文档内容
期末模拟测试(基础卷)
(时间:75分钟 满分:100分)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Cl 35.5 Br 80 I 127
一、选择题(本题包括10个小题,每小题只有一个选项符合题意。每小题2分,共20分)
1.(2023秋·河北邢台·高二邢台市第二中学校考期末)下列有关说法错误的是
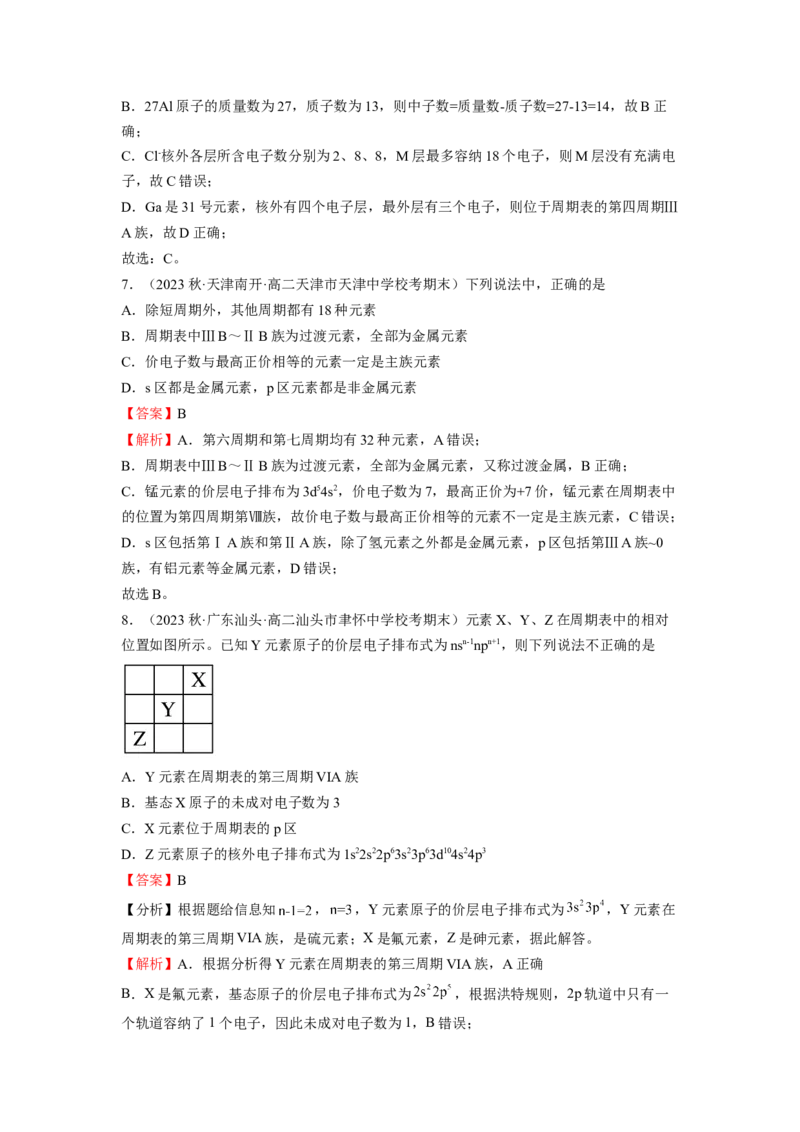
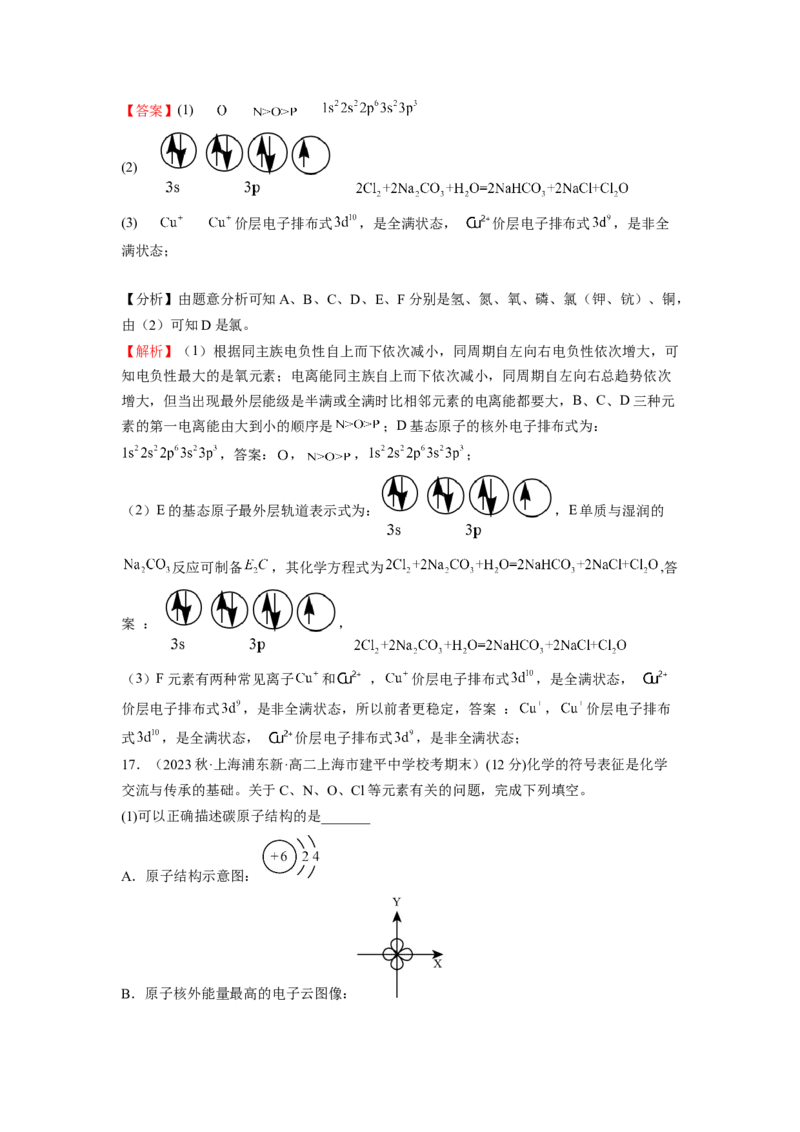
图1 图2 图3 图4
A.氢原子的电子云图如图1:表示离核越近电子出现的几率越大
B.处于最低能量状态的原子叫基态原子,1s22s22p43s1→1s22s22p5过程中形成的是发射光谱:
如图2
C.钙的某氧化物的晶胞结构如图3所示:其中黑球为Ca2+,则该晶体化学式为CaO
2
D.四氨合铜离子的球棍模型如图4所示
【答案】B
【解析】A.电子云中的小黑点表示电子出现的几率,氢原子的电子云图如图1:表示离核
越近电子出现的几率越大,故A正确;
B.处于最低能量状态的原子叫基态原子,1s22s22p43s1→1s22s22p5过程中3s能级上的电子跃
迁到2p能级,形成1条吸收谱线,故B错误;
C.根据均摊原则,Ca2+数为 、 数为 ,则该晶体化学式为
CaO,故C正确;
2
D.四氨合铜离子是平面结构,故D正确;
选B。
2.(2023秋·河北唐山·高二唐山市第二中学校考期末)下列说法中正确的是
A.元素第一电离能:
B.键角:
C. 比 稳定的原因是 分子间存在氢键
D. 熔化和干冰升华克服的作用力相同
【答案】B
【解析】A.同一周期元素,元素第一电离能随着原子序数增大而呈增大趋势,但第IIA族、
第VA族元素第一电离能大于其相邻元素,所以第一电离能F>N>O,选项A错误;
B.BeCl 价层电子对数目为2,无孤电子对,故为直线型结构,键角为180º;NH 价层电
2 3子对数为4,有一个孤电子对,排斥力较小,故为三角锥形结构,键角为107.3º;HO价层
2
电子对数为4,有2个孤电子对,排斥力较大,故为V形结构,键角为104.5º;CCl 价层电
4
子对数为4,无孤电子对,故结构为正四面体,键角为109º28′;所以键角的大小顺序为:
,选项B正确;
C.水的稳定性是化学性质,因而不是由氢键决定的,是由在分子内部氢氧键的稳定性决
定的,选项C错误;
D.干冰水分子晶体,干冰升华克服的是分子间作用力,SiO 是原子晶体,SiO 融化克服
2 2
的是极性键,选项D错误;
答案选B。
3.(2023秋·山东济宁·高二济宁一中校考期末)N 为阿伏加德罗常数的值。下列说法正
A
确的是
A.一定条件下,0.1mol H 和0.1mol I 充分反应后转移电子总数为0.2N
2 2 A
B.标准状况下,11.2L CH Cl 中含有的原子总数为2.5N
2 2 A
C.常温下,0.5 Na S溶液中S2-数目小于0.5N
2 A
D.1mol甲苯中σ键总数为15N
A
【答案】D
【解析】A.氢气与碘反应生成碘化氢,该反应为可逆反应,不能进行到底,一定条件下,
0.1mol H 和0.1mol I 于密闭容器中充分反应后生成碘化氢小于0.2mol,转移电子总数小于
2 2
0.2N ,故A错误;
A
B.由于标准状况下,二氯甲烷不是气体,无法求算其物质的量,故B错误;
C.溶液体积未知,无法计算NaS溶液中S2-数目,故C错误;
2
D.单键由1个σ键形成,1mol甲苯含有15molσ键,甲苯中σ键总数为15N ,故D正确;
A
故选:D。
4.(2023秋·山东菏泽·高二统考期末) 、 和 均可作为燃料电池的燃料。下
列说法错误的是
A. 、 和 中C、N杂化方式均相同
B. 和 的空间结构分别为正四面体形、三角锥形
C. 、 和 均为极性分子
D.沸点:
【答案】C
【解析】A.CH、NH 和NH 中C、N价层电子对数都是4,所以这三种分子中C、N都
4 3 2 4
采用sp3杂化,A正确;
B.CH 中C价层电子对数= 且不含有孤电子对,NH 中N价层电子对数为
4 3且含有1个孤电子对,空间结构分别为正四面体形、三角锥形,B正确;
C.CH 结构对称,正负电荷中心重合,为非极性分子,NH 为三角锥形,正负电荷中心不
4 3
重合,为极性分子,NH,正负电荷中心重合,为极性分子,C错误;
2 4
D.NH、NH 都能形成分子间氢键,且形成分子间氢键个数:NH> NH ,CH 不能形成
2 4 3 2 4 3 4
分子间氢键,所以沸点: NH > NH > CH,D正确;
2 4 3 4
故选C。
5.(2023秋·天津南开·高二天津市天津中学校考期末)下列分子的中心原子轨道杂化的类
型相同的是
A. 与 B. 与 C. 与 D. 与
【答案】A
【解析】A.SO 中S原子的价电子对数为3+ (6-3×2)=3,采取sp2杂化方式,SO 中S原
3 2
子的价电子对数为2+ (6-2×2)=3,采取 sp2杂化方式,两者分子的中心原子的杂化方式相
同,故A选;
B.BF 中B原子的价电子对数为3+ (3-3×1)=3,采取sp2杂化方式,NH 中N原子的价电
3 3
子对数为3+ (5-3×1)=4,采取sp3杂化方式,二者杂化方式不同,故B不选;
C.BeCl 中Be原子的价电子对数为2+ (2-2×1)=2,采取sp杂化方式,SCl 中S原子的
2 2
价电子对数为2+ (6-2×1)=4,采取sp3杂化方式,二者杂化方式不同,故C不选;
D.HO中O原子的价电子对数为2+ (6-2×1)=4,采取sp3杂化方式,CS 中C原子的价电
2 2
子对数为2+ (4-2×2)=2,采取sp杂化方式,二者杂化方式不同,故D不选;
答案选A。
6.(2023秋·重庆南岸·高二重庆市第十一中学校校考期末)三甲基镓[(CH )Ga]是应用最
3 3
广泛的一种金属有机化合物,可通过如下反应制备:GaCl +(CH )Al (CH)Ga+AlCl (已
3 3 3 3 3 3.
知:GaCl 中Ga为最高价)下列说法错误的是
3
A.Al原子核外有13种运动状态不同的电子
B.27Al原子的中子数为14
C.Cl-的核外三个电子能层均充满电子
D.Ga位于周期表中第四周期ⅢA族
【答案】C
【解析】A.铝原子的核外电子排布式为:1s22s22p63s23p1,有1+1+3+1+1=7个原子轨道,
则核外电子有7种空间运动状态,故A正确;B.27Al原子的质量数为27,质子数为13,则中子数=质量数-质子数=27-13=14,故B正
确;
C.Cl-核外各层所含电子数分别为2、8、8,M层最多容纳18个电子,则M层没有充满电
子,故C错误;
D.Ga是31号元素,核外有四个电子层,最外层有三个电子,则位于周期表的第四周期Ⅲ
A族,故D正确;
故选:C。
7.(2023秋·天津南开·高二天津市天津中学校考期末)下列说法中,正确的是
A.除短周期外,其他周期都有18种元素
B.周期表中ⅢB~ⅡB族为过渡元素,全部为金属元素
C.价电子数与最高正价相等的元素一定是主族元素
D.s区都是金属元素,p区元素都是非金属元素
【答案】B
【解析】A.第六周期和第七周期均有32种元素,A错误;
B.周期表中ⅢB~ⅡB族为过渡元素,全部为金属元素,又称过渡金属,B正确;
C.锰元素的价层电子排布为3d54s2,价电子数为7,最高正价为+7价,锰元素在周期表中
的位置为第四周期第Ⅷ族,故价电子数与最高正价相等的元素不一定是主族元素,C错误;
D.s区包括第ⅠA族和第ⅡA族,除了氢元素之外都是金属元素,p区包括第ⅢA族~0
族,有铝元素等金属元素,D错误;
故选B。
8.(2023秋·广东汕头·高二汕头市聿怀中学校考期末)元素X、Y、Z在周期表中的相对
位置如图所示。已知Y元素原子的价层电子排布式为nsn-1npn+1,则下列说法不正确的是
A.Y元素在周期表的第三周期VIA族
B.基态X原子的未成对电子数为3
C.X元素位于周期表的p区
D.Z元素原子的核外电子排布式为1s22s22p63s23p63d104s24p3
【答案】B
【分析】根据题给信息知 , ,Y元素原子的价层电子排布式为 ,Y元素在
周期表的第三周期VIA族,是硫元素;X是氟元素,Z是砷元素,据此解答。
【解析】A.根据分析得Y元素在周期表的第三周期VIA族,A正确
B.X是氟元素,基态原子的价层电子排布式为 ,根据洪特规则,2p轨道中只有一
个轨道容纳了1个电子,因此未成对电子数为1,B错误;C.X基态原子的价层电子排布式为 ,位于周期表的p区,C正确;
D.Z是砷元素,位于周期表第四周期第ⅤA族,原子的核外电子排布式为
1s22s22p63s23p63d104s24p3,D正确;
故选B。
9.(2023秋·河北唐山·高二唐山一中校考期末)下列有关物质性质、结构的表述均正确,
且存在因果关系的是
选
表述Ⅰ 表述Ⅱ
项
在水中,NaCl的溶解度比I 的 NaCl晶体中Cl-与Na+间的作用力大于碘晶体中分
2
A
溶解度大 子间的作用力
B SO 的键角小于120° 二氧化硫中心原子存在孤电子对
2
C NaCl的熔点比MgO的熔点高 NaCl的晶格能比MgO的晶格能大
D HO比HS稳定 HO分子间作用力大
2 2 2
A.A B.B C.C D.D
【答案】B
【解析】A.氯化钠为离子晶体,易溶于极性的水分子,而碘单质为非极性分子,不易溶
于水,与分子间作用力无关,A项错误;
B.SO 中心原子价层电子对数= ,1对孤电子对,是V型,由于存在孤电子
2
对,根据孤对电子间的排斥作用>孤对电子与成键电子间的排斥作用>成键电子对之间的排
斥作用,所以键角小于120°,B正确;
C.离子半径Mg2+<Na+、O2-<Cl-,故晶格能MgO>NaCl,熔点MgO高于NaCl,C项错
误;
D.非金属性越强,气态氢化物的稳定性越大,非金属性O>S,HO比HS稳定,与分子
2 2
间作用力无关,D项错误;
故选B。
10.(2023秋·吉林通化·高二梅河口市第五中学校考期末)LiO是离子晶体,其晶格能可
2
通过图的Born-Haber循环计算得到。下列说法错误的是A.Li原子的第一电离能为520kJ/mol
B.O=O键的键能为249kJ/mol
C.LiO的晶格能为2908kJ/mol
2
D.1molLi(s)转变成Li(g)需要吸收的能量为159kJ
【答案】B
【解析】A. 原子的第一电离能是由气态原子失去1个电子形成气态离子所需要的能量,
应为 ,故A正确;
B. 键的键能为1molO (g)分解为2molO(g)所吸收的能量,即
2
,故B错误;
C.晶格能是指气态离子形成1mol离子晶体释放的能量,即 的晶格能为 ,
故C正确;
D. 转变成 需要吸收的能量为 ,故D正确;
故选:B。
二、选择题(本题包括5个小题,每小题有1~2个选项符合题意。每小题4分,共20分)
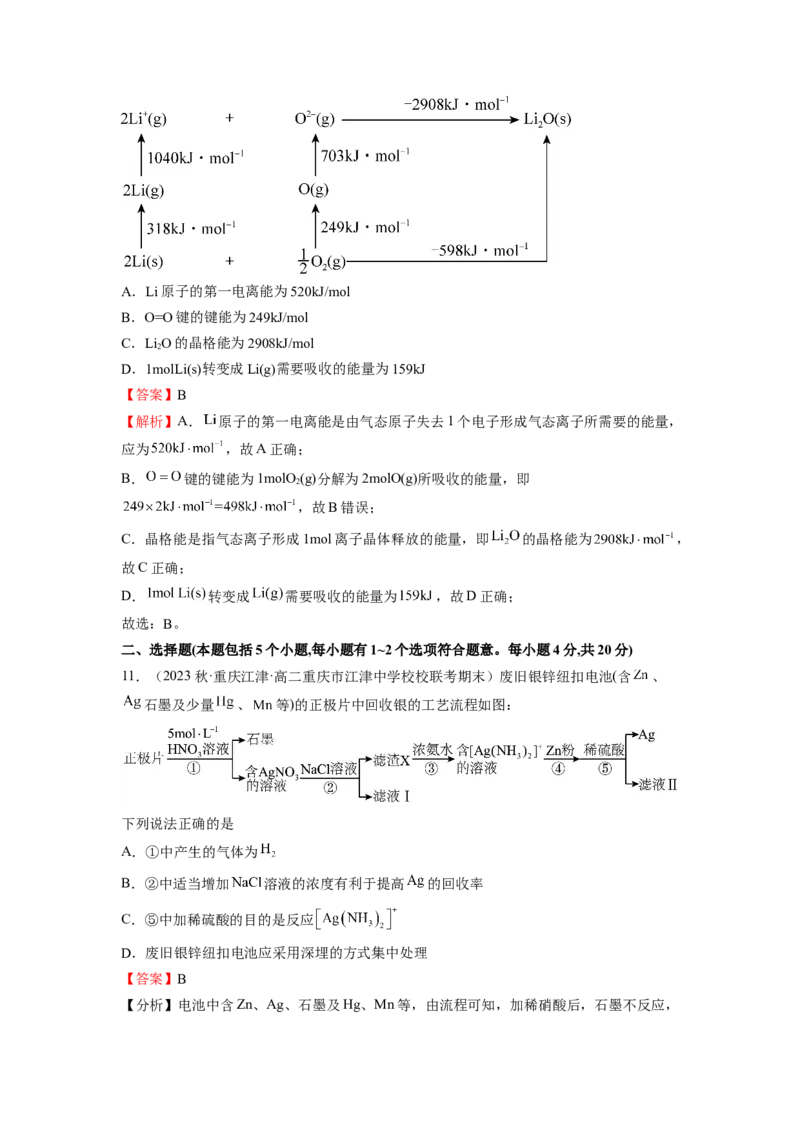
11.(2023秋·重庆江津·高二重庆市江津中学校校联考期末)废旧银锌纽扣电池(含 、
石墨及少量 、 等)的正极片中回收银的工艺流程如图:
下列说法正确的是
A.①中产生的气体为
B.②中适当增加 溶液的浓度有利于提高 的回收率
C.⑤中加稀硫酸的目的是反应
D.废旧银锌纽扣电池应采用深埋的方式集中处理
【答案】B
【分析】电池中含Zn、Ag、石墨及Hg、Mn等,由流程可知,加稀硝酸后,石墨不反应,Zn、Ag、Hg、Mn和硝酸反应生成硝酸锌,硝酸银,硝酸汞,硝酸锰,再加氯化钠溶液会
发生Ag++Cl-=AgCl↓,在含AgCl的滤渣中加入氨水会发反应生成 ,在银氨络
合物中加入Zn生成银,过量的锌可以溶解于稀硫酸溶液中,以此来解答。
【解析】A.金属和硝酸反应生成氮氧化物,不是氢气,故A错误;
B.③的离子方程式为AgCl+2NH•H O= +Cl-+2H O,因此②中适当增加
3 2 2
溶液的浓度有利于提高 的回收率,故B正确;
C.锌可以溶解于稀硫酸溶液中,故⑤中加稀硫酸的目的是除去银粉中的锌,转化为
Zn2+,故C错误;
D.废旧电池中含有重金属离子,污染环境,所以废旧银锌纽扣电池不应采用深埋的方式
集中处理,故D错误;
故选B。
12.(2023秋·重庆沙坪坝·高二重庆一中校考期末)下列说法不正确的是
A.激光、焰火都与电子跃迁释放能量有关
B.可燃冰( )中甲烷与水分子间存在氢键
C.冠醚利用不同大小的空穴适配不同大小的碱金属离子进行“分子识别”
D.晶体的自范性是晶体在微观空间呈周期性有序排列的宏观表象
【答案】B
【解析】A.光辐射是电子释放能量的重要形式之一,激光、焰火都与原子核外电子发生
跃迁释放能量有关,A正确;
B.甲烷与水之间为分子间作用力,不是氢键,B错误;
C.同主族从上往下碱金属元素的离子半径逐渐增大,冠醚利用不同大小的空穴适配不同
大小的碱金属离子进行“分子识别”,C正确;
D.晶体自范性的本质:晶体中粒子微观空间里呈现周期性的有序排列的宏观表象,D正
确;
故选B。
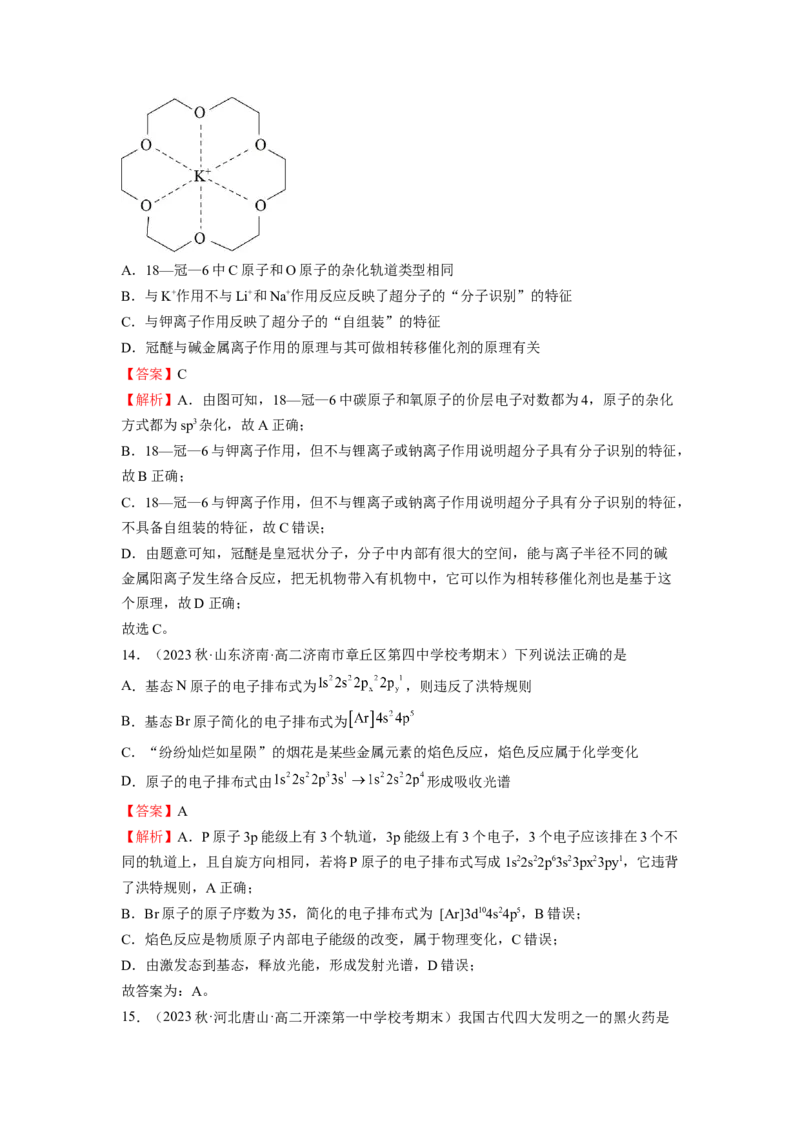
13.(2023秋·吉林通化·高二梅河口市第五中学校考期末)冠醚能与阳离子尤其是与碱金
属离子作用,并随环的大小不同而与不同碱金属离子作用,12—冠—4与锂离子作用而不
与钠离子、钾离子作用,18—冠—6与钾离子作用如图,但不与锂离子或钠离子作用,下
列说法不正确的是A.18—冠—6中C原子和O原子的杂化轨道类型相同
B.与K+作用不与Li+和Na+作用反应反映了超分子的“分子识别”的特征
C.与钾离子作用反映了超分子的“自组装”的特征
D.冠醚与碱金属离子作用的原理与其可做相转移催化剂的原理有关
【答案】C
【解析】A.由图可知,18—冠—6中碳原子和氧原子的价层电子对数都为4,原子的杂化
方式都为sp3杂化,故A正确;
B.18—冠—6与钾离子作用,但不与锂离子或钠离子作用说明超分子具有分子识别的特征,
故B正确;
C.18—冠—6与钾离子作用,但不与锂离子或钠离子作用说明超分子具有分子识别的特征,
不具备自组装的特征,故C错误;
D.由题意可知,冠醚是皇冠状分子,分子中内部有很大的空间,能与离子半径不同的碱
金属阳离子发生络合反应,把无机物带入有机物中,它可以作为相转移催化剂也是基于这
个原理,故D正确;
故选C。
14.(2023秋·山东济南·高二济南市章丘区第四中学校考期末)下列说法正确的是
A.基态N原子的电子排布式为 ,则违反了洪特规则
B.基态Br原子简化的电子排布式为
C.“纷纷灿烂如星陨”的烟花是某些金属元素的焰色反应,焰色反应属于化学变化
D.原子的电子排布式由 形成吸收光谱
【答案】A
【解析】A.P原子3p能级上有3个轨道,3p能级上有3个电子,3个电子应该排在3个不
同的轨道上,且自旋方向相同,若将P原子的电子排布式写成1s22s22p63s23px23py1,它违背
了洪特规则,A正确;
B.Br原子的原子序数为35,简化的电子排布式为 [Ar]3d104s24p5,B错误;
C.焰色反应是物质原子内部电子能级的改变,属于物理变化,C错误;
D.由激发态到基态,释放光能,形成发射光谱,D错误;
故答案为:A。
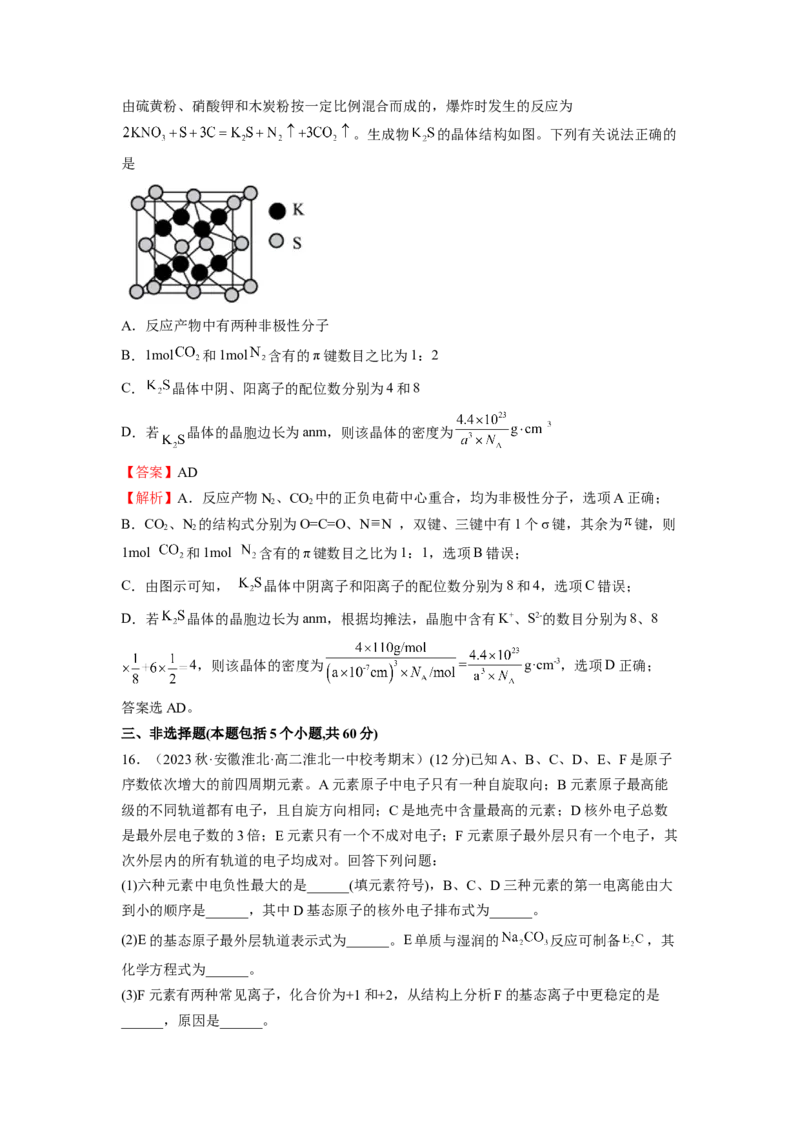
15.(2023秋·河北唐山·高二开滦第一中学校考期末)我国古代四大发明之一的黑火药是由硫黄粉、硝酸钾和木炭粉按一定比例混合而成的,爆炸时发生的反应为
。生成物 的晶体结构如图。下列有关说法正确的
是
A.反应产物中有两种非极性分子
B.1mol 和1mol 含有的π键数目之比为1:2
C. 晶体中阴、阳离子的配位数分别为4和8
D.若 晶体的晶胞边长为anm,则该晶体的密度为
【答案】AD
【解析】A.反应产物N、CO 中的正负电荷中心重合,均为非极性分子,选项A正确;
2 2
B.CO、N 的结构式分别为O=C=O、N N ,双键、三键中有1个σ键,其余为 键,则
2 2
1mol 和1mol 含有的 键数目之比为1:1,选项B错误;
C.由图示可知, 晶体中阴离子和阳离子的配位数分别为8和4,选项C错误;
D.若 晶体的晶胞边长为anm,根据均摊法,晶胞中含有K+、S2-的数目分别为8、8
4,则该晶体的密度为 = g·cm-3,选项D正确;
答案选AD。
三、非选择题(本题包括5个小题,共60分)
16.(2023秋·安徽淮北·高二淮北一中校考期末)(12分)已知A、B、C、D、E、F是原子
序数依次增大的前四周期元素。A元素原子中电子只有一种自旋取向;B元素原子最高能
级的不同轨道都有电子,且自旋方向相同;C是地壳中含量最高的元素;D核外电子总数
是最外层电子数的3倍;E元素只有一个不成对电子;F元素原子最外层只有一个电子,其
次外层内的所有轨道的电子均成对。回答下列问题:
(1)六种元素中电负性最大的是______(填元素符号),B、C、D三种元素的第一电离能由大
到小的顺序是______,其中D基态原子的核外电子排布式为______。
(2)E的基态原子最外层轨道表示式为______。E单质与湿润的 反应可制备 ,其
化学方程式为______。
(3)F元素有两种常见离子,化合价为+1和+2,从结构上分析F的基态离子中更稳定的是
______,原因是______。【答案】(1)
(2)
(3) 价层电子排布式 ,是全满状态, 价层电子排布式 ,是非全
满状态;
【分析】由题意分析可知A、B、C、D、E、F分别是氢、氮、氧、磷、氯(钾、钪)、铜,
由(2)可知D是氯。
【解析】(1)根据同主族电负性自上而下依次减小,同周期自左向右电负性依次增大,可
知电负性最大的是氧元素;电离能同主族自上而下依次减小,同周期自左向右总趋势依次
增大,但当出现最外层能级是半满或全满时比相邻元素的电离能都要大,B、C、D三种元
素的第一电离能由大到小的顺序是 ;D基态原子的核外电子排布式为:
,答案: , , ;
(2)E的基态原子最外层轨道表示式为: ,E单质与湿润的
反应可制备 ,其化学方程式为 ,答
案 : ,
(3)F元素有两种常见离子 和 , 价层电子排布式 ,是全满状态,
价层电子排布式 ,是非全满状态,所以前者更稳定,答案 : , 价层电子排布
式 ,是全满状态, 价层电子排布式 ,是非全满状态;
17.(2023秋·上海浦东新·高二上海市建平中学校考期末)(12分)化学的符号表征是化学
交流与传承的基础。关于C、N、O、Cl等元素有关的问题,完成下列填空。
(1)可以正确描述碳原子结构的是_______
A.原子结构示意图:
B.原子核外能量最高的电子云图像:C.碳-12原子:
D.原子的轨道表示式:
(2)下列有关微粒的描述正确的是_______
A.羟基的电子式: B.乙炔的分子式:
C. 的球棍模型: D.乙烯的结构简式:
(3)写出N、Cl元素的气态氢化物常温下相互反应的化学方程式_______,其生成物的电子
式为_______。
(4)Cl元素基态原子的电子排布式为_______,其最高能级是_______。
(5)在第四周期元素中,基态原子的未成对电子数最多的是_______(填元素符号),其价电子
轨道表示式为_______。
【答案】(1)AB
(2)D
(3) NH +HCl=
3
(4) 1s22s22p63s23p5 3p
(5) Cr
【解析】(1)A.C原子是6号元素,电子结构示意图为 ,A正确;
B.原子核外能量最高的电子为2p轨道电子,p轨道上排布了2个电子,电子云呈哑铃型,
其电子云图形为 ,B正确;
C.碳-12原子的质子数为6,质量数为12,该原子的正确表示为 ,C错误;
D.2p轨道上的两个电子应该优先占据2个轨道,碳原子正确的轨道表示式为
,D错误;
故答案为:AB;(2)A.羟基中氧原子上有一个未成对电子,故其电子式为 ,A错误;
B.乙炔的分子式为C H,B错误 ;
2 4
C. 的比例模型为 ,C错误;
D.乙烯的结构简式: ,D正确;
故答案为:D;
(3)N、Cl元素的气态氢化物分别为NH 和HCl,常温下相互反应的化学方程式为
3
NH +HCl= ; 为离子化合物,其电子式为 ;
3
(4)Cl元素是17号元素,其基态原子的电子排布式为1s22s22p63s23p5,其最高能级是3p;
(5)在第四周期元素中,基态原子的未成对电子数最多的原子的外围电子排布式为
3d54s1,该元素是Cr,其价电子轨道表示式为 。
18.(2023秋·山东菏泽·高二菏泽一中统考期末)(12分)Zn、V、Cu、In、S和Se等原子
是生物医药、太阳能电池等领域的理想荧光材料。回答下列问题:
(1) In的价层电子排布式为_______。
49
(2)Zn、O、S和Se的电负性由大到小的顺序为_______。制备荧光材料过程中会产生少量
SO 、VO ,其中V原子采用_______杂化,VO 空间结构为_______,SO 的空间构型
为_______。
(3)C、N、S分别与H形成的简单氢化物中键角最小的是_______,其原因是_______。
(4)H、C、N、S四种元素可形成硫氰酸( )和异硫氰酸(H-N=C=S),异硫氰酸分子
中σ键与π键的数目比为_______,异硫氰酸沸点较高,原因是_______。
(5)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+ 表示,与之相反的用−
表示,称为电子的自旋量子数。对于基态Cu原子,其价电子自旋磁量子数的代数和为
_______。
【答案】(1)5s25p1
(2) O>S>Se>Zn sp3 正四面体 三角锥
(3) HS 三种氢化物中心原子均采取sp3杂化,HS中心原子S上孤对电子多,对成键
2 2
电子对排斥力大
(4) 3:2 异硫氰酸分子间形成氢键
(5)+ (或− )【解析】(1)铟元素核外电子数为49,位于第五周期第 A族,根据构造原理,核外电
子排布为[Kr] ,其价层电子排布式为 ,答案为: ;
(2)同一周期从左到右,元素的电负性依次增大,同一主族从上到下,元素的电负性依次
减小,四种元素的电负性由大到小的顺序为:O>S>Se> Zn。 中钒硫原子形了4个σ
键,孤电子对数为 ,价层电子对数为4,因此钒原子的杂化方式为 ,
的空间构型为正四面体形。 中硫原子形成了3个σ键,孤电子对数为
,价层电子对数为4,硫原子的杂化类型为 , 的空间构型为三角
锥形;答案为: O>S>Se>Zn; ;正四面体;三角锥;
(3)CH 的价层电子对数为 ,NH 的价层电子对数为 ,HS的
4 3 2
价层电子对数为 ,中心原子均采取 杂化,碳原子没有孤电子对,氮原子
有一对孤电子,硫原子有两对孤电子对,因此硫原子的孤电子对σ键电子对的排斥力大,
HS的键角最小,答案为:HS;三种氢化物中心原子均采取sp3杂化,HS中心原子S上孤
2 2 2
对电子多,对成键电子对排斥力大;
(4)一个异硫氰酸分子中含有一个单键和两个双键,单键为σ键,双键中有一个o键和一
个π键,因此异硫氰酸中σ键与π键数之比为 ;硫氰酸分子中的氢原子连在硫原子上,
分子间不能形成氢键,异硫氰酸分子的氢原子与氮原子相连,由于N元素电负性大,分子
间能形成氢键,因此异硫氰酸的沸点较高;答案为:3:2;异硫氰酸分子间形成氢键;
(5)基态铜原子的价电子排布式为 ,3d轨道价电子自旋磁量子数的代数和为0,
4s价电子自旋磁量子数的代数和为 或 ;答案为:+ (或− )。
19.(2023秋·广东东莞·高二东莞市东莞中学校考阶段练习)(12分)钛被称为继铁、铝之
后的“第三金属”,一种制备金属钛的工艺流程如下所示。
(1)Ti在元素周期表的位置为_______;下列基态或激发态Ti原子价电子排布图中,能量最
高的是_______。
A.
B.C.
(2)已知 在通常情况下是无色液体,熔点为 ,沸点为 ,结构与 相似,
的晶体类型是_______。 稳定性比 差,试从化学键角度分析原因_______。
(3)纳米 是一种应用广泛的催化剂,其催化作用的一个实例如下所示:
化合物甲中采取 杂化的原子有_______(填元素符号)。化合物乙的沸点明显高于化合物
甲,主要原因是_______。
(4)硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示。该阳离子的化学式为
_______。
【答案】(1) 第四周期第ⅣB族 C
(2) 分子晶体 钛原子半径比碳大,Ti-Cl键比C-Cl键的键长大、键能低,易断
裂
(3) C和O 化合乙分子间存在氢键
(4)TiO2+
【解析】(1)Ti 的原子序数为22,在元素周期表的位置是第四周期第ⅣB族;由洪特规
则可知,在等价轨道(相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不
同的轨道,3d电子应占据不同轨道,3d轨道能级比4s高,C中4s电子激发到3d轨道中,
故能量最高的是C;
(2)TiCl 和CCl 都是正四面体结构,熔沸点较低,为分子晶体;钛原子半径比碳原子半
4 4
径大,Ti-Cl键比C-Cl键的键长长,键能低,易断裂,所以TiCl 稳定性比CCl 差,故答案
4 4
为:分子晶体;钛原子半径比碳大,Ti-Cl键比C-Cl键的键长大、键能低,易断裂;
(3)采取sp3杂化的原子价层电子对数是4,价层电子对个数是4的原子有形成甲基和亚
甲基的3个碳原子和形成醚键的氧原子,即原子有C和O;化合物乙因分子间存在氢键,
则化合物乙的沸点比化合物甲高
(4)该阳离子中每个Ti原子连接2个O原子、每个O原子连接2个Ti原子,则O、Ti原
子个数之比为1:1,该离子中Ti为+4价,所以该阳离子为TiO2+。
20.(2022秋·山东菏泽·高二菏泽一中校考阶段练习)(12分)硒化物(如KCu Se )可用于太
4 8阳能电池、光传感器、热电发电与制冷等。回答下列问题:
(1)K与Cu位于同周期,金属钾的熔点比铜的低,这是因为___________。
(2)O、S、Se均位于元素周期表第ⅥA族,它们的氢化物HO、HS及HSe分子的键角从
2 2 2
大到小顺序为___________。
(3)配合物[Cu(CHCN) ]BF 中,阴离子的空间构型为___________,配合离子中与Cu(Ⅱ)形
3 4 4
成配位键的原子是___________,配体中碳原子的杂化方式是___________。
(4)TMTSF( )中共价键的类型是___________。
【答案】(1)钾的原子半径比铜的大,价电子数比铜少,钾的金属键比铜的弱
(2)H O>HS>HSe
2 2 2
(3) 正四面体 N sp和sp3
(4)σ键和π键
【解析】(1)金属晶体的熔点与金属键强度有关,金属键强度与原子半径以及原子的价电
子有关,同周期元素从左至右半径逐渐减小(稀有气体除外),钾的原子半径比铜的大,价
电子数比铜少,钾的金属键比铜的弱,使得金属钾的熔点比铜的低;
(2)HO、HS及HSe分子互为等电子体,空间结构都是V型,O、S、Se均位于元素周
2 2 2
期表第ⅥA族,从上到下电负性依次减小,电负性越大,对孤对电子的吸引力越强,键角
越大,因此HO、HS及HSe分子的键角从大到小顺序为HO>HS>HSe;
2 2 2 2 2 2
(3)[Cu(CHCN) ]BF 中阴离子为 ,B原子的价层电子对数=4+ =4,分子中
3 4 4
无孤对电子对,因此 的空间构型为正四面体;[Cu(CHCN) ]BF 中,Cu2+提供空轨道,
3 4 4
配体CHCN中能提供孤电子对的是N;配体CHCN 中,甲基上的碳是sp3杂化,-CN中含
3 3
有三键,碳原子是sp杂化,故答案为:正四面体;N;sp和sp3;
(4)依据结构简式 可知,该分子中既含有单键又
含有双键,所以含有共价键类型为σ键和π键。