文档内容
1.2.2 离子反应 练习(解析版)
1.下列反应属于离子反应的是( )
A.氢气还原氧化铜 B.胆矾失去结晶水
C.酸碱中和反应 D.二氧化硫与氧化钙的反应
【答案】C
【解析】A中氢气还原氧化铜属于氧化还原反应,但不属于离子反应;B中胆矾失去结晶水属于分解
反应,不属于离子反应;D中二氧化硫与氧化钙的反应仅属于化合反应,不属于离子反应,所以只有C符
合题意。
2.关于离子方程式Cu2++2OH-===Cu(OH) ↓的说法正确的是( )
2
A.可表示所有铜盐和强碱的反应
B.可表示某一个具体的反应,也可以表示一类反应
C.离子方程式中的OH-可代表弱碱或强碱
D.该反应可看到Cu(OH) 白色沉淀
2
【答案】B
【解析】该离子方程式不能表示如 CuSO 和Ba(OH) 的反应,A错;OH-只能代表强碱,C错;
4 2
Cu(OH) 为蓝色沉淀,D错。
2
3.下列实验设计及其对应的离子方程式均正确的是( )
A.把铁片插入CuSO 溶液中,验证古代湿法冶铜:2Fe+3Cu2+===2Fe3++3Cu
4
B.某气体使澄清石灰水先变浑浊后变澄清,验证该气体是CO:
2
Ca2++2OH-+CO===CaCO ↓+HO CaCO +CO+HO===Ca2++2HCO
2 3 2 3 2 2
C.在小苏打溶液中加入醋酸,验证醋酸比碳酸的酸性强:HCO+H+===CO ↑+HO
2 2
D.若要求用两种单质和一种溶液来测定Zn、Cu、Ag三种金属的活动性顺序,可用Zn、Cu和AgNO
3
溶液:Zn+2Ag+===Zn2++2Ag
【答案】B
【解析】A项反应中生成的应是Fe2+,而不是Fe3+,A错;能够拆为离子的只有强酸强碱和可溶盐,
醋酸不是强酸,所以不能拆成离子,C错;D项的设计方案中无法比较Zn与Cu的活动性,应改为Zn、
Cu(NO ) 溶液、Ag,D错。
3 2
4.某同学在实验室中进行如下实验:
编号 Ⅰ Ⅱ Ⅲ实验
没有明显变化,溶 有白色沉淀生成,
现象 有无色气体放出
液仍为无色 溶液为蓝色
以下结论正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为CuCl
2
C.Ⅲ中的离子方程式为2H++Zn===Zn2++H↑
2
D.Ⅲ中发生的反应不是离子反应
【答案】C
【解析】Ⅰ中虽无明显现象,但发生了离子反应:H++OH-===H O,A错误;Ⅱ中发生反应为:Ba2
2
++SO===BaSO ↓,白色沉淀为BaSO ,B错误;Ⅲ中的反应是离子反应,离子方程式为Zn+2H+===Zn2+
4 4
+H↑,C正确,D错误。
2
5.下列各选项中的反应①与反应②不能用同一离子方程式表示的是( )
序号 反应① 反应②
A 向AgNO 溶液中滴加稀盐酸 AgNO 溶液与食盐水混合
3 3
B 过量CO 通入NaOH溶液中 过量CO 通入澄清石灰水中
2 2
C 向烧碱溶液中滴加稀盐酸 向HSO 溶液中滴加KOH溶液
2 4
D 向BaCl 溶液中滴加稀HSO 向Ba(OH) 溶液中滴加CuSO 溶液
2 2 4 2 4
【答案】D
【解析】A项:Ag++Cl-===AgCl↓;B项:CO +OH-===HCO;C项:H++OH-===H O;D项:反
2 2
应①SO+Ba2+===BaSO ↓;反应②Cu2++SO+Ba2++2OH-===Cu(OH) ↓+BaSO↓。
4 2 4
6.实验室有三缸废液,分别含有NaCO、Ca(OH) 和HCl。且它们的物质的量之比为1∶1∶2。要让三缸
2 3 2
废液混合后,所得溶液的溶质只有NaCl,应选择的混合顺序是( )
A.先将NaCO 废液和Ca(OH) 废液混合,再与HCl废液混合
2 3 2
B.先将NaCO 废液和HCl废液混合,再与Ca(OH) 废液混合
2 3 2
C.先将Ca(OH) 废液和HCl废液混合,再与NaCO 废液混合
2 2 3
D.将NaCO 废液和Ca(OH) 废液同时慢慢倒入HCl废液中
2 3 2
【答案】C
【解析】三种废液NaCO 、Ca(OH) 和HCl物质的量之比为1∶1∶2,任何两种物质混合均恰好完全反应。
2 3 2
A中形成的CaCO 沉淀和NaOH溶液混合物再与HCl废液混合必然又有部分CaCO 溶解,形成Ca2+进入溶
3 3液,A错误;B中形成NaCl溶液与Ca(OH) 不反应,溶液中含有Ca(OH) ,B错误;D中同时生成NaCl和
2 2
CaCl 溶液,HCl消耗完全后,NaCO 与Ca(OH) 反应生成的NaOH也存在于溶液中,D错误。
2 2 3 2
7.能正确表示下列化学反应的离子方程式是( )
A.氢氧化钡溶液与硝酸的反应OH-+H+ HO
2
B.澄清的石灰水与稀盐酸反应Ca(OH) +2H+ Ca2++2H O
2 2
C.铜片插入硝酸银溶液中Cu+Ag+ Cu2++Ag
D.碳酸钡溶于稀盐酸中C +2H+ HO+CO↑
O2- 2 2
3
【答案】A
【解析】氢氧化钡溶液与硝酸的反应:OH-+H+===H O,故A正确;澄清的石灰水与稀盐酸反应:OH-
2
+H+===H O,故B错误;铜片插入硝酸银溶液中:Cu+2Ag+===Cu2++2Ag,故C错误;碳酸钡溶于稀盐酸
2
中:BaCO +2H+===Ba2++H O+CO↑,故D错误。
3 2 2
8.下列各组中的离子,能在溶液中大量共存的是( )
A.Mg2+、H+、Cl-、OH-
B.Na+、Ba2+、C 、N
O2- O-
3 3
C.Na+、H+、Cl-、C
O2-
3
D.K+、Cu2+、N 、S
O- O2-
3 4
【答案】D
【解析】A项中Mg2+、H+与OH-不能会反应生成Mg(OH) 沉淀和HO,A错;B项中Ba2+与C 可反
2 2 O2-
3
应生成BaCO 沉淀,B错;H+与C 可反应生成CO 气体和HO,C错;D项中各离子间均不发生反应,
3 O2- 2 2
3
可大量共存。
9.在某无色溶液中含有大量的Ba2+、H+、Cl-,该溶液中还可能大量存在的离子是( )
A.N B.OH- C.S D.Cu2+
H+ O2-
4 4
【答案】A
【解析】含Cu2+的溶液呈蓝色,在无色溶液中不能大量存在,Ba2+和S 反应生成白色沉淀不能大量
O2-
4
共存,OH-与H+反应生成HO不能大量共存,综上所述,答案选A。
210.已知NaHSO 在溶液中完全电离为金属阳离子、H+和酸根离子:
4
(1)写出NaHSO 在水溶液中电离的方程式:________________。
4
(2)NaHSO 属于“酸”“碱”“盐”中的________,你的选择理由是__________________________。
4
(3)① 若将 NaHSO 与 Ba(OH) 在溶液中按物质的量比为 2∶1 混合,反应的离子方程式是
4 2
_______________________________________________________________________________。
②若将 NaHSO 与 Ba(OH) 在溶液中按物质的量比 1∶1 混合,反应的离子方程式是:
4 2
____________________________________________________________________________________。
【答案】(1)NaHSO===Na++H++SO (2)盐 NaHSO 在水溶液中电离出的离子,既有金属阳离子又
4 4
有酸根阴离子 (3)①2H++SO+2OH-+Ba2+===BaSO ↓+2HO ②H++SO+OH-+Ba2+===H O+
4 2 2
BaSO↓
4
【解析】在书写NaHSO 与Ba(OH) 反应的离子方程式时,要注意两点:一是 H+与OH-反应生成
4 2
HO,同时SO与Ba2+反应生成BaSO 沉淀,二是NaHSO 与Ba(OH) 的物质的量之比。
2 4 4 2
11.有一固体混合物,可能由NaCO 、NaSO 、CuSO 、CaCl 、NaCl等混合而成,为检验它们,做
2 3 2 4 4 2
了以下实验:
①将固体混合物溶于水中,搅拌后得无色透明溶液;
②往此溶液中滴加硝酸钡溶液,有白色沉淀产生;
③过滤,将沉淀物置于稀硝酸中,发现沉淀全部溶解。
根据上述实验事实,回答下列问题:
(1)原固体混合物中一定含有的物质是________,一定不含有的物质是________,可能含有的物质是
________( 以 上 空 格 均 填 写 化 学 式 ) 。 对 可 能 含 有 的 物 质 , 可 采 用 向 滤 液 中 滴 加
________________________________________________________________________
溶液的方法来检验。
(2)写出步骤③中的离子方程式
________________________________________________________________________。
【答案】(1)Na CO NaSO 、CuSO 、CaCl NaCl 硝酸酸化的硝酸银
2 3 2 4 4 2
(2)BaCO+2H+===Ba2++CO↑+HO
3 2 2
【解析】根据①“无色透明”知原固体无CuSO ,根据②和③知该白色沉淀是碳酸钡,故原固体一定
4
有碳酸钠,且固体溶解的离子方程式是BaCO +2H+===Ba2++CO↑+HO,则一定无硫酸钠和氯化钙。无
3 2 2
法判断NaCl是否含有,若进一步确认,可向溶液中滴加硝酸酸化的硝酸银,若产生白色沉淀,则原溶液
中有氯化钠。
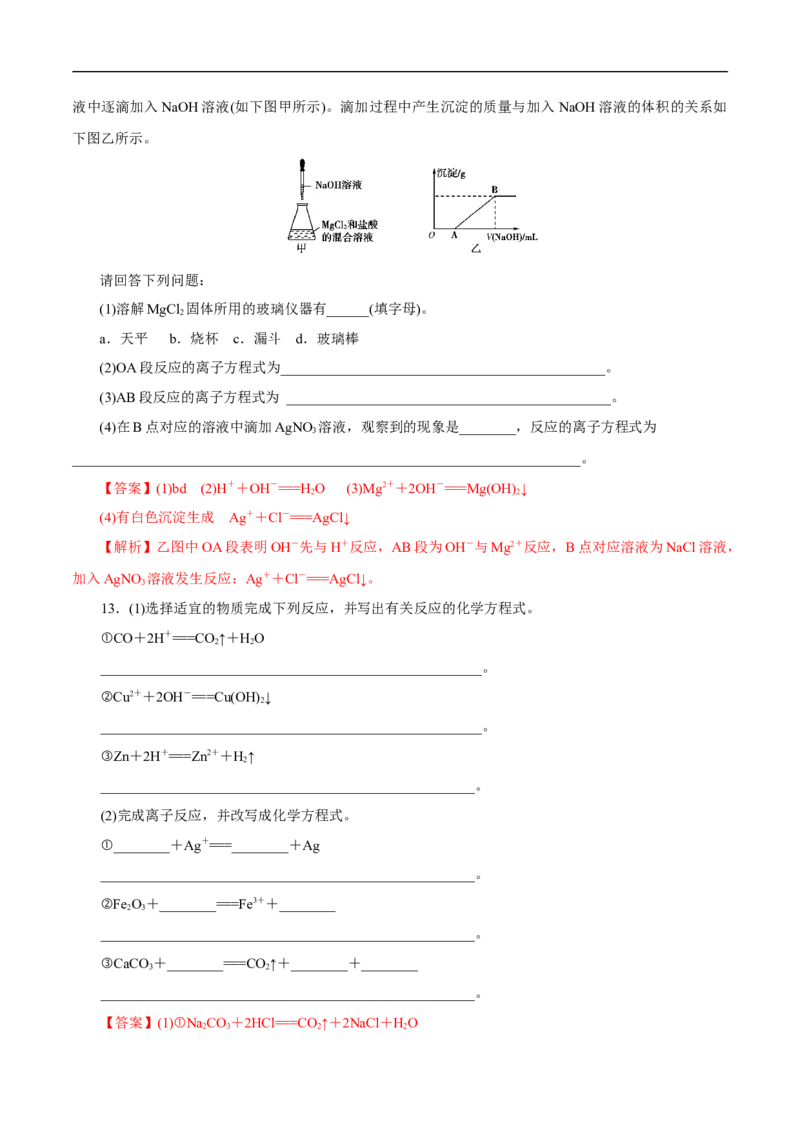
12.某同学称取一定质量的MgCl 固体配成溶液,在该溶液中加入一定量的稀盐酸,然后向此混合溶
2液中逐滴加入NaOH溶液(如下图甲所示)。滴加过程中产生沉淀的质量与加入 NaOH溶液的体积的关系如
下图乙所示。
请回答下列问题:
(1)溶解MgCl 固体所用的玻璃仪器有______(填字母)。
2
a.天平 b.烧杯 c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______________________________________________。
(3)AB段反应的离子方程式为 ______________________________________________。
(4)在B点对应的溶液中滴加AgNO 溶液,观察到的现象是________,反应的离子方程式为
3
________________________________________________________________________。
【答案】(1)bd (2)H++OH-===H O (3)Mg2++2OH-===Mg(OH) ↓
2 2
(4)有白色沉淀生成 Ag++Cl-===AgCl↓
【解析】乙图中OA段表明OH-先与H+反应,AB段为OH-与Mg2+反应,B点对应溶液为NaCl溶液,
加入AgNO 溶液发生反应:Ag++Cl-===AgCl↓。
3
13.(1)选择适宜的物质完成下列反应,并写出有关反应的化学方程式。
①CO+2H+===CO ↑+HO
2 2
______________________________________________________。
②Cu2++2OH-===Cu(OH) ↓
2
______________________________________________________。
③Zn+2H+===Zn2++H↑
2
_____________________________________________________。
(2)完成离子反应,并改写成化学方程式。
①________+Ag+===________+Ag
_____________________________________________________。
②Fe O+________===Fe3++________
2 3
_____________________________________________________。
③CaCO +________===CO ↑+________+________
3 2
_____________________________________________________。
【答案】(1)①NaCO+2HCl===CO ↑+2NaCl+HO
2 3 2 2②CuSO
4
+2NaOH===Cu(OH)
2
↓+Na
2
SO
4
③Zn+2HCl===ZnCl
2
+H
2
↑
(2)①Cu+2Ag+===Cu2++2Ag Cu+2AgNO===2Ag+Cu(NO )
3 3 2
②Fe O+6H+===2Fe3++3HO Fe O+3HSO ===Fe (SO )+3HO
2 3 2 2 3 2 4 2 4 3 2
③CaCO +2H+===CO ↑+Ca2++HO CaCO +2HCl===CaCl +CO↑+HO
3 2 2 3 2 2 2
【解析】(1)①CO代表易溶碳酸盐,如KCO 、NaCO 、(NH )CO ,但不能是CaCO 、BaCO 等;H+
2 3 2 3 4 2 3 3 3
代表强酸,主要有三种,是HNO、HSO 、HCl。
3 2 4
②Cu2+代表易溶的铜盐,如CuSO 、Cu(NO ) 、CuCl 等,OH-代表强碱,如NaOH、Ba(OH) 等,但
4 3 2 2 2
注意Ca(OH) 、Ba(OH) 与CuSO 反应不符合题意要求,因其反应的离子方程式为:Ba2++Cu2++SO+
2 2 4
2OH-===BaSO ↓+Cu(OH) ↓
4 2
③H+代表稀硫酸、盐酸,不能用浓硫酸和HNO,因其与Zn反应不放出H。
3 2
(2)①能置换Ag的金属可以在金属活动性顺序表中Mg~Hg之间找即可。
②能将Fe O 变为自由移动的Fe3+的只有酸,如HSO 、HNO、HCl。
2 3 2 4 3
③由CaCO 制CO 需要酸,可用盐酸,硝酸,但不能用HSO 。
3 2 2 4