文档内容
江西省重点中学协作体 2023~2024 学年度高一期末联考
化学
本试卷共100分,考试用时75分钟.
可能用到的相对原子质量:
一、选择题:本题共14小题,每小题3分,共42分.每小题只有一个选项符合题目要求.
1.腊八节吃腊八粥,以庆祝丰收.腊八粥的主要食材为大米、青菜、花生、豆腐等.下列有关说法错误的是
( )
A.大米所含的淀粉属于多糖 B.青菜所含膳食纤维属于纯净物
C.花生所含油脂可用于制肥皂 D.豆腐所含蛋白质为天然高分子化合物
2.下列说法正确的是( )
A.因为 具有漂白性,所以它能使品红溶液、 溶液、石蕊溶液褪色
B.等物质的量的 和 通入溶液中可增强漂白性
C. 、漂白粉、活性炭、 都能使红墨水褪色,其原理相同
D.能使品红溶液褪色的气体不一定是
3.能量以各种不同的形式呈现在人们面前,通过物理变化或化学变化可以实现不同形式的能量间的转化.下
列说法错误的是( )
A.沼气属于可再生能源
B.光伏发电系统能将太阳能直接转化为机械能
C.物质燃烧的过程将化学能转化为热能
D.原电池放电的过程将化学能转化为电能
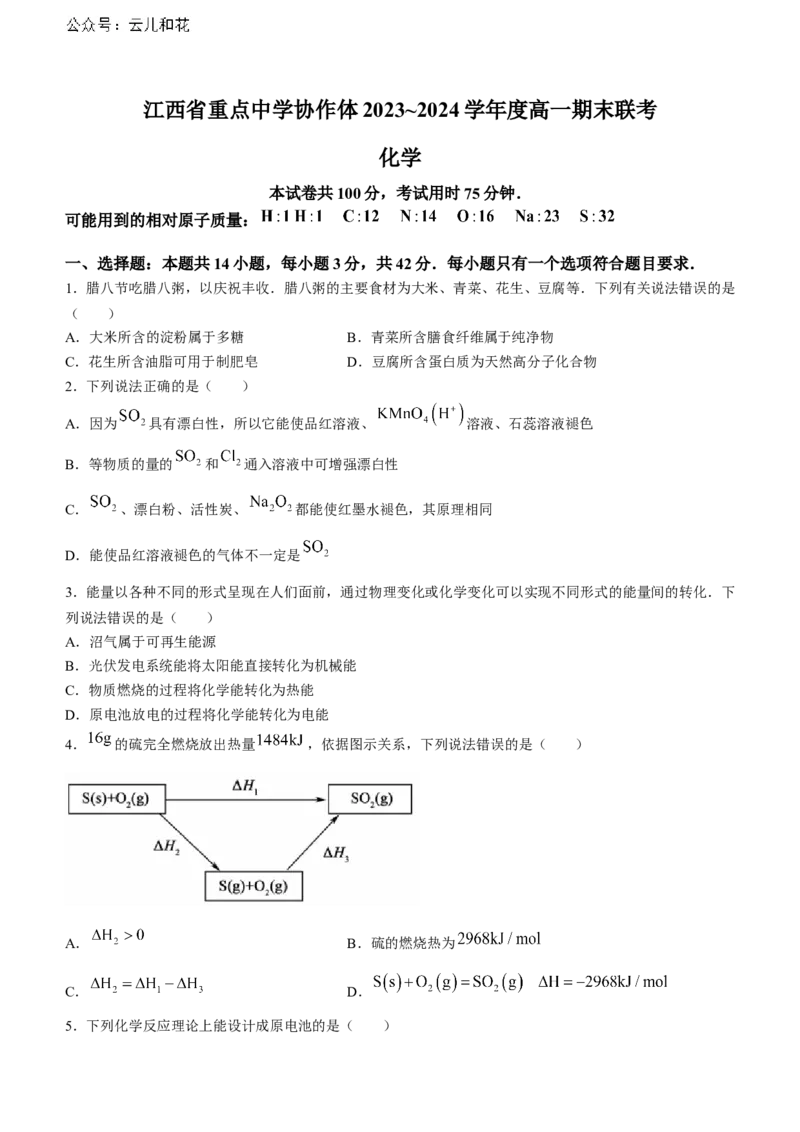
4. 的硫完全燃烧放出热量 ,依据图示关系,下列说法错误的是( )
A. B.硫的燃烧热为
C. D.
5.下列化学反应理论上能设计成原电池的是( )A. B.
C. D.
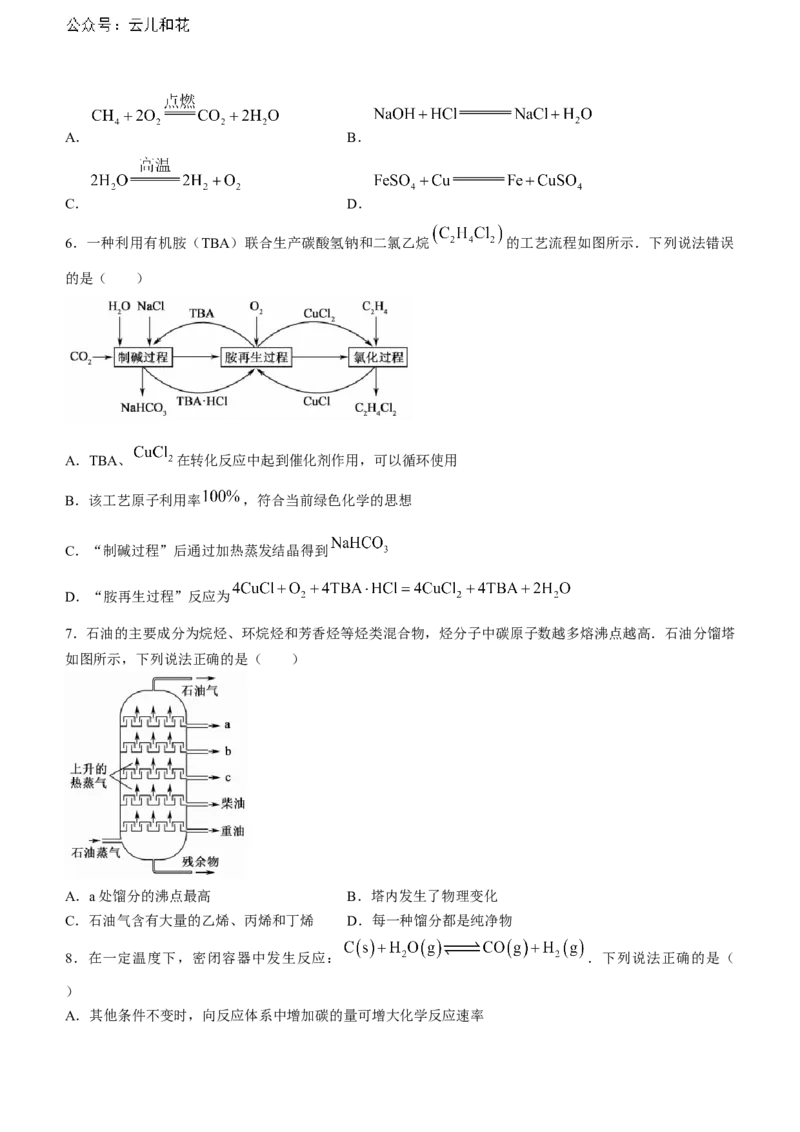
6.一种利用有机胺(TBA)联合生产碳酸氢钠和二氯乙烷 的工艺流程如图所示.下列说法错误
的是( )
A.TBA、 在转化反应中起到催化剂作用,可以循环使用
B.该工艺原子利用率 ,符合当前绿色化学的思想
C.“制碱过程”后通过加热蒸发结晶得到
D.“胺再生过程”反应为
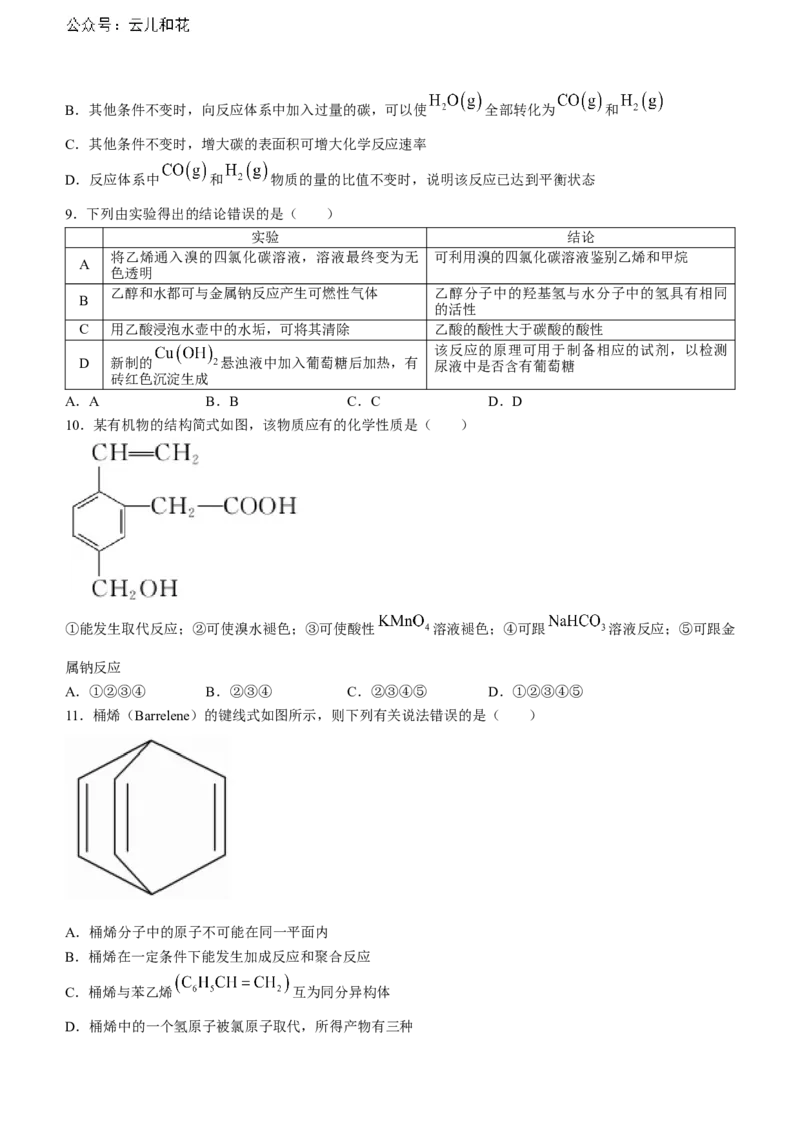
7.石油的主要成分为烷烃、环烷烃和芳香烃等烃类混合物,烃分子中碳原子数越多熔沸点越高.石油分馏塔
如图所示,下列说法正确的是( )
A.a处馏分的沸点最高 B.塔内发生了物理变化
C.石油气含有大量的乙烯、丙烯和丁烯 D.每一种馏分都是纯净物
8.在一定温度下,密闭容器中发生反应: .下列说法正确的是(
)
A.其他条件不变时,向反应体系中增加碳的量可增大化学反应速率B.其他条件不变时,向反应体系中加入过量的碳,可以使 全部转化为 和
C.其他条件不变时,增大碳的表面积可增大化学反应速率
D.反应体系中 和 物质的量的比值不变时,说明该反应已达到平衡状态
9.下列由实验得出的结论错误的是( )
实验 结论
将乙烯通入溴的四氯化碳溶液,溶液最终变为无 可利用溴的四氯化碳溶液鉴别乙烯和甲烷
A
色透明
乙醇和水都可与金属钠反应产生可燃性气体 乙醇分子中的羟基氢与水分子中的氢具有相同
B
的活性
C 用乙酸浸泡水壶中的水垢,可将其清除 乙酸的酸性大于碳酸的酸性
该反应的原理可用于制备相应的试剂,以检测
D 新制的 悬浊液中加入葡萄糖后加热,有 尿液中是否含有葡萄糖
砖红色沉淀生成
A.A B.B C.C D.D
10.某有机物的结构简式如图,该物质应有的化学性质是( )
①能发生取代反应;②可使溴水褪色;③可使酸性 溶液褪色;④可跟 溶液反应;⑤可跟金
属钠反应
A.①②③④ B.②③④ C.②③④⑤ D.①②③④⑤
11.桶烯(Barrelene)的键线式如图所示,则下列有关说法错误的是( )
A.桶烯分子中的原子不可能在同一平面内
B.桶烯在一定条件下能发生加成反应和聚合反应
C.桶烯与苯乙烯 互为同分异构体
D.桶烯中的一个氢原子被氯原子取代,所得产物有三种12.利用甲烷可消除 的污染: .在 密闭容器中,控制不同温
度,分别加入 和 ,测得 随时间变化的有关实验数据见表.
组别 温度 时间 0 10 20 40 50
① 0.50 0.35 0.25 0.10 0.10
② 0.50 0.30 0.18 0.15
下列说法正确的是( )
A.组别①中, 内, 的降解速率为
B.由实验数据可知实验控制的温度:
C. 时,表格中 对应的数据为0.17
D. 内,组别②中 的转化率:
13.过氧化氢浓度差电池是一种新型原电池,其工作原理如图所示,其中电极材料均为石墨,阴离子交换膜
只允许 通过,工作时两极室均无气体生成.下列说法错误的是( )
A.电极a为负极 B.工作时乙室溶液 减小
C.过氧化氢浓度:乙室>甲室 D.每转移 时甲室质量增加
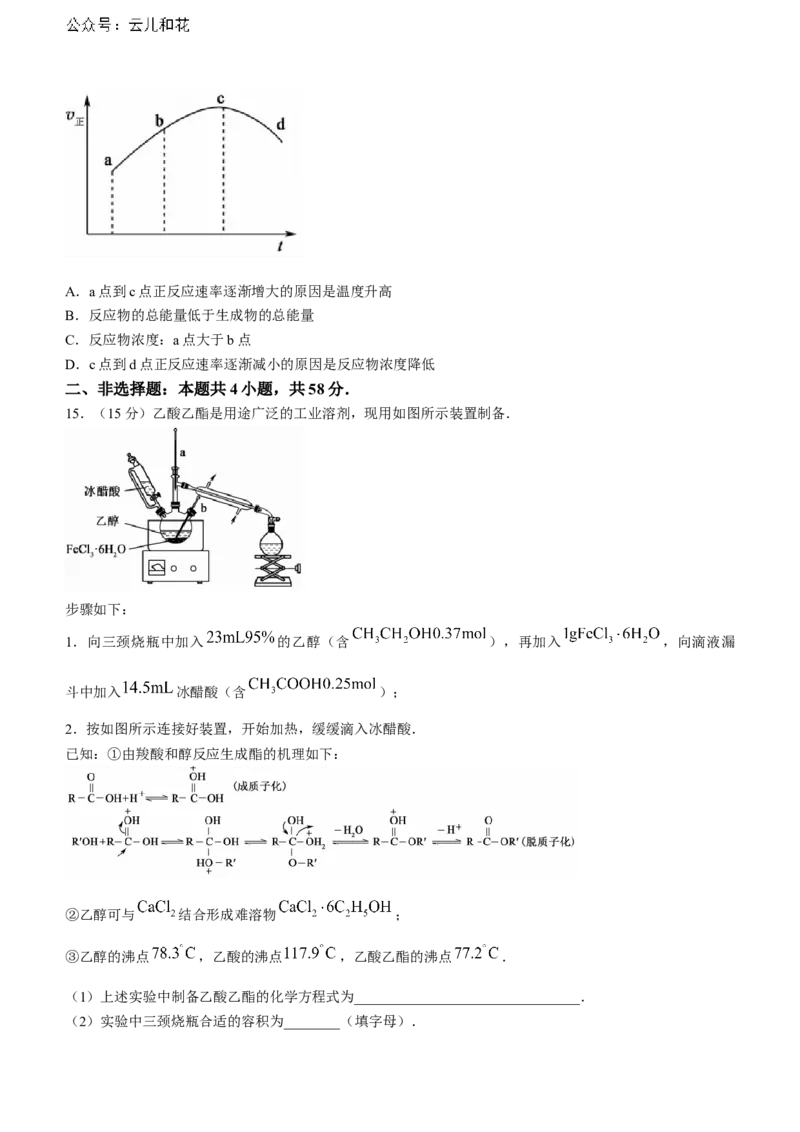
14 . 一 定 条 件 下 , 向 绝 热 恒 容 密 闭 容 器 中 通 入 一 定 量 的 和 , 使 反 应
,达到平衡,正反应速率随时间变化如图所示.下列说法
错误的是( )A.a点到c点正反应速率逐渐增大的原因是温度升高
B.反应物的总能量低于生成物的总能量
C.反应物浓度:a点大于b点
D.c点到d点正反应速率逐渐减小的原因是反应物浓度降低
二、非选择题:本题共4小题,共58分.
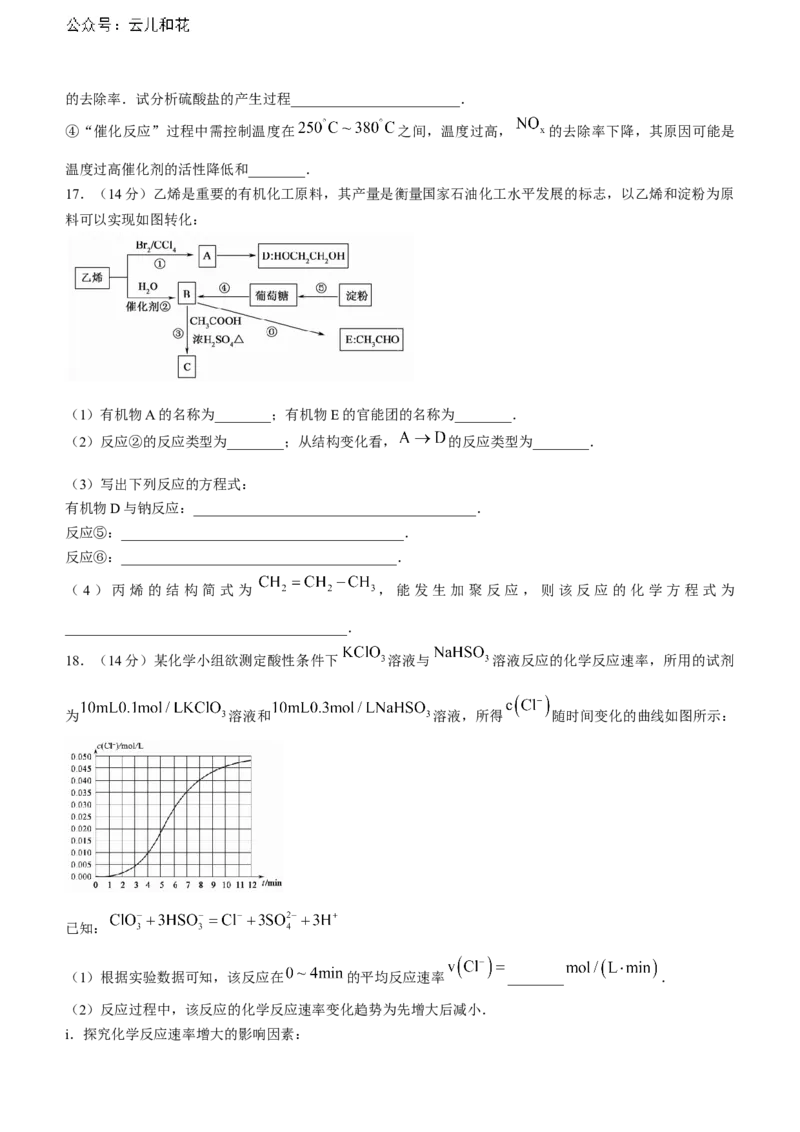
15.(15分)乙酸乙酯是用途广泛的工业溶剂,现用如图所示装置制备.
步骤如下:
1.向三颈烧瓶中加入 的乙醇(含 ),再加入 ,向滴液漏
斗中加入 冰醋酸(含 );
2.按如图所示连接好装置,开始加热,缓缓滴入冰醋酸.
已知:①由羧酸和醇反应生成酯的机理如下:
②乙醇可与 结合形成难溶物 ;
③乙醇的沸点 ,乙酸的沸点 ,乙酸乙酯的沸点 .
(1)上述实验中制备乙酸乙酯的化学方程式为________________________________.
(2)实验中三颈烧瓶合适的容积为________(填字母).A. B. C. D.
( 3 ) 实 验 测 得 温 度 为 时 产 率 最 高 , 温 度 过 高 造 成 产 率 下 降 , 可 能 的 原 因 是
________________________________.
(4)与采用浓硫酸相比,选用 作为催化剂的优点为________________(写出一点即可);根
据羧酸和醇生成酯的反应机理推测,下列物质中可用作制备乙酸乙酯催化剂的是________(填字母).
A. B. C.浓 D.
(5)对得到的粗产品分离提纯:
①向粗产品先加入碳酸钠粉末.
② 再 其 中 加 入 饱 和 氯 化 钙 溶 液 , 振 荡 、 静 置 、 分 液 , ① ② 两 步 操 作 的 目 的 是
________________________________.
③向所得有机层中加入无水硫酸钠,过滤.加入无水硫酸钠的作用是________________________________.
(6)最终得到乙酸乙酯 (乙酸乙酯的密度 ).则该实验中乙酸乙酯的产率为________
(保留两位有效数字).
16.(15分)工业或机动车尾气中的 会造成环境问题,可用多种方法脱除.
(1)碱液吸收: 溶液可吸收硝酸工业尾气(含 、 ),获得副产品.
① 等 物 质 的 量 和 被 溶 液 吸 收 , 产 物 只 有 一 种 盐 , 反 应 的 离 子 方 程 式 为
________________________.
②若吸收时 与 比例控制不当,则吸收液经浓缩结晶、过滤得到 晶体中最有可能混有的杂质
是________(填化学式).排放的尾气中含量较高的氮氧化物是________(填化学式).
(2)还原法:尿素水溶液热解产生的 可去除尾气中的 ,流程如下:
①尿素 中氮元素的化合价为________.
②写出“催化反应”过程中 还原 的化学方程式________________________.
③若氧化处理后的尾气中混有 ,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低的去除率.试分析硫酸盐的产生过程________________________.
④“催化反应”过程中需控制温度在 之间,温度过高, 的去除率下降,其原因可能是
温度过高催化剂的活性降低和________.
17.(14分)乙烯是重要的有机化工原料,其产量是衡量国家石油化工水平发展的标志,以乙烯和淀粉为原
料可以实现如图转化:
(1)有机物A的名称为________;有机物E的官能团的名称为________.
(2)反应②的反应类型为________;从结构变化看, 的反应类型为________.
(3)写出下列反应的方程式:
有机物D与钠反应:________________________________________.
反应⑤:________________________________________.
反应⑥:_______________________________________.
(4)丙烯的结构简式为 ,能发生加聚反应,则该反应的化学方程式为
________________________________________.
18.(14分)某化学小组欲测定酸性条件下 溶液与 溶液反应的化学反应速率,所用的试剂
为 溶液和 溶液,所得 随时间变化的曲线如图所示:
已知:
(1)根据实验数据可知,该反应在 的平均反应速率 ________ .
(2)反应过程中,该反应的化学反应速率变化趋势为先增大后减小.
i.探究化学反应速率增大的影响因素:方案 假设 具体实验操作
该反应放热,使溶液温度升
向 烧 杯 中 依 次 加 入 溶 液 和
Ⅰ 高,反应速率加快
溶液,________.
反应产物 对反应有催化作 取 溶液于烧杯中,先加入________固体
Ⅱ
用
(填化学式),再加入 溶液.
反应中溶液酸性增强,加快了
1.分别向编号为①②的2个烧杯中加入 溶
化学反应速率
液;
Ⅲ
2.烧杯①中加入 水,烧杯②中加入 盐酸;
3.再分别向2个烧杯中加入 溶液.
【问题与思考】
①在III烧杯①中加入 水的作用是_______________________________.
②在证明方案I假设不成立的情况下,从控制变量角度思考,方案 III实验操作设计不严谨,改进措施为
_______________________________.
③除方案I、II、III外,请再提出一个可能使化学反应速率增大的假设_______________________________.
ii.反应后期,化学反应速率降低的主要原因是_______________________________.高一・化学(江西)・大联考・参考答案
1.B大米成分为淀粉,分子式为 ,属于多糖,A正确;纤维素的分子式均为 ,但n
值不同,结构不同,纤维素属于混合物,B错误;油脂在碱性条件下的水解反应称为㿝化反应,可以制甘油
和肥皂,C正确;蛋白质属于天然高分子化合物,D正确.
2.D 能使品红溶液褪色是因为二氧化硫具有漂白性, 能使 溶液褪色是因为二氧化硫
具有还原性, 能使石芯溶液褪色是因为二氧化硫是酸性氧化物,A错误;等物质的量的 和 通入
溶液中生成硫酸和盐酸,没有漂白能力,B错误; 能使红墨水褪色体现二氧化硫的漂白性,漂白粉、
使红墨水褪色体现强氧化性,活性炭使红墨水褪色体现其吸附性,C错误; 、氯气都能使品红溶
液褪色,能使品红溶液褪色的不一定是 ,D正确.
3.B沼气可以通过纤维素发酵生成,属于自然界中的可再生能源,A正确;光伏发电系统为光电转换装置,
该系统能将太阳能直接转化为电能,B错误;物质燃烧的过程中化学能转化为热能,C正确;原电池放电的
过程实现了化学能转化为电能,D正确.
4.B 为吸热过程,则 ,A正确; 完全燃烧释放的能量等于 ,不是
, B 错 误 ; 根 据 盖 斯 定 律 : , 则 , C 正 确 ;
,D正确.
5.A 的反应属于自发的氧化还原反应,能设计成原电池,A 正确;
的反应属于自发非氧化还原反应,不能设计成原电池,B 错误;
的反应属于非自发的氧化还原反应,不能设计成原电池, C 错误;
的反应属于非自发的氧化还原反应,不能设计成原电池,D错误.
6.C根据物质转化关系可知,TBA在胺再生过程中为生成物,在制碱过程中为反应物,则TBA为催化剂,在胺再生过程为生成物,再氯化过程为反应物,则 为催化剂,A正确;从生成工艺流程图可以
看出, ,反应物全部转化成产物,该工
艺原子利用率 ,B正确; 热稳定性差,加热易分解,应通过降温结晶得到 ,C错
误 ; 结 合 图 示 物 质 及 转 化 关 系 , 可 得 “ 胺 再 生 过 程 ” 反 应 为
,D正确.
7.B石油分馏得到的每一种馏分都是混合物,沸点最低的最先蒸出,则 a馏分的沸点最低,A错误;石油的
分馏是物理变化,B正确;石油的分馏是物理变化,没有分解生成新的物质,C错误;石油分馏得到的每一
种馏分都是混合物,石油气主要成分为甲烷、乙烷、丙烷和丁烷,D错误.
8.C碳为固体,反应体系中增加碳的量不影响化学反应速率,A错误;该反应为可逆反应,反应物不可能完
全转化为生成物, 不可能全部转化为 和 ,B错误;其他条件不变时,增加碳的表面
积可增大化学反应速率,C正确;无论反应是否达到平衡状态,反应体系中 和 物质的量的比
值都是 ,无法判断是否达到平衡状态,D错误.
9.B乙烯与溴发生加成反应,能使溴的四氯化碳溶液褪色,而甲烷不能,因此可用于鉴别乙烯和甲烷,A正
确;乙醇和水均能与 反应生成 ,但 与水反应更剧烈,故水分子中氢的活性强于乙醇分子中氢的活
性,B错误;乙酸能除去水垢,说明酸性:乙酸>碳酸,C正确;新制的 悬浊液中加入葡萄糖后加
热,有砖红色沉淀生成,这是葡萄糖的特征反应,D正确.
10.D①羟基的氢和苯环的氢都能被取代,故①具有;②有机物含有碳碳双键,因此可跟溴发生加成反应,
故②具有;③有机物含有碳碳双键、含有羟基,都能使酸性 溶液褪色,故③具有;④有机物含有羧
基,可跟 溶液反应,故④具有;⑤有机物含有羧基、羟基,可跟金属钠反应,故⑤具有;因此
①②③④⑤都具有的化学性质,综上所述,D正确.
11.D饱和碳原子具有甲烷中碳原子结构,是四面体结构,所以该分子中所有原子不可能处于同一平面上,
A正确;桶烯分子中含有碳碳双键,具有烯烃的性质,在一定条件下能发生加成反应和加聚反应,B正确;
桶烯与苯乙烯 的分子式都为 ,结构不同,二者互为同分异构体,C正确;桶烯中的
一个氢原子被氯原子取代,所得产物有2种,D错误.12.B组别①中 内, 的降解速率为 ,化学反
应速率之比等于化学计量数之比,则 的降解速率为 ,A错
误;开始时 和 物质的量相同, 后, 温度时甲烷物质的量更小,说明反应速率快,温度越
高反应越快, ,B正确; 组别①中甲烷的物质的量不再改变,说明反应达到平衡,组别②反
应速率比组别①更快,所以 时组别②也已经达到平衡,所以表格中 对应的数据为0.15,C错误;
内,组别②中 ,转化率为 ,
D错误.
13.B阴离子 向负极移动,电a为负极,A正确;工作时乙室: ,消耗氢
离 子 , 溶 液 增 大 , B 错 误 ; a 极 : , 甲 室 浓 度 增 大 , b 极 :
,乙室 浓度减小,当 浓度:乙室=甲室,原电池反应停止,C正确;
每转移 时,有 通过阴离子交换膜进入甲室,甲室质量增加 ,D正确.
14.B如果在恒温恒容条件下,随着反应的正向进行,反应物浓度减小则正反应速率减小,实际上在绝热恒
容条件下,随着反应的正向进行,正反应速率增大,说明该反应的正反应为放热反应,从开始到c点,温度
对化学反应速率的影响大于浓度对化学反应速率的影响,表现为正反应速率逐渐增大,c点后温度对化学反
应速率的影响小于浓度对化学反应速率的影响,表现为正反应速率逐渐下降.a点到c点正反应速率逐渐增大
的原因是温度升高,A正确;该反应为放热反应 ,反应物的总能量高于生成物的总能量,B错误;反
应正向进行,反应物浓度逐渐减小,反应物浓度:a点大于b点,C正确;c点到d点正反应速率逐渐减小的
原因是反应物浓度降低,D正确.
15.(1) (2分,条件错误扣1分)
(2)B(1分)
(3)温度 时, 会与水反应生成氢氧化铁胶体,失去催化效果(或温度 以上,乙醇挥
发)(2分)
(4)添加步骤简单;不用加入沸石(2分) CD(2分)(5)②除去乙酸、乙醇,得到乙酸乙酯(2分)
③除去乙酸乙酯中的水(或干燥乙酸乙酯)(2分)
(6) (2分)
解 析 : ( 1 ) 实 验 中 制 备 乙 酸 乙 酯 的 化 学 方 程 式 为
;
(2)加热溶液时,三颈烧瓶内液体的体积不低于其容积的 ,不超过其容积的 ,本实验中液体的总体积
约为 ,故三颈烧瓶适合的容积为 ;
(3)温度过高造成产率下降的原因可能是 会与水反应生成氢氧化铁[答案灵感来自于 胶体制
备],失去催化效果;或乙醇的沸点 ,温度 以上,乙醇挥发;
(4)浓硫酸具有强腐蚀性,使用 添加步骤简单,可减小实验危险或减少副反应,不用加入沸
石;分析羧酸和醇生成酯的反应机理可知,能提供质子 的物质可作为该反应的催化剂, 水解生成
,浓 、 电离出 ,故可用作制备乙酸乙酯的催化剂,故答案为CD;
(5)向粗产品中加入碳酸钠粉末,除去冰醋酸;向其中加入饱和氯化钙溶液,除去粗产品中的碳酸钠和乙醇;
两步操作的目的是除去乙酸、乙醇,得到乙酸乙酯;向有机层中加入无水硫酸钠,作用是除去乙酸乙酯中的
水;
(6)最终得到 乙酸乙酯,质量为 ,物质的量为 ,
由题中数据可知,乙醇过量,则理论上生成乙酸乙酯的物质的量为 ,故该实验中乙酸乙酯的产率为
.
16.(1)① (2分)
② (2分) (2分)
(2)① (2分)② (2分)
③ 与 、 反应生成 , 与 反应生成 或者 (3分)
④温度升高, 催化氧化生成 (2分)
解析:(1)① 与 中氮元素化合价分别为 、 ,等物质的量 与 被 溶液吸收,
则生成 和水,反应的离子方程式为 ;
②若吸收时 与 比例控制不当, 过量不影响生成物, 过量则和氢氧化钠生成亚硝酸钠和硝
酸钠,故得到 晶体中最有可能混有的杂质是 ; 和氢氧化钠不反应,故排放的尾气中含量
较高的氮氧化物是 ;
(2)① 中碳元素 价,氧元素 价,氢元素 价,设氮元素化合价为 x,则
,解得 ;
② 依 据 题 意 可 知 反 应 物 为 和 , 产 物 为 和 . 于 是 , 方 程 式 为
;
③硫酸盐形成需要 ,而题目中混合气体含有的是 ,因此可以推导形成 的过程中存在将
氧化成 的过程.尿素水溶液热解和催化生成 过程中均有 ,可以将 转化成 .生成的
与 反应生成 或 ;
④尾气中还含有氧气,温度升高, 和氧气有可能发生催化氧化反应生成 .
17.(1)1, 二溴乙烷(2分) 醛基(2分)
(2)加成反应(1分) 取代反应(1分)
(3) (2分)(2分)
(无淀粉、葡萄糖扣1分,无淀粉酶扣1分)
(2分)
(无 、 扣1分)
(4) (2分)
解析:(1)乙烯与溴的四氯化碳溶液发生加成反应生成 A的名称为1, 二溴乙烷;E是 ,其
官能团是 ,名称为醛基;
( 2 ) 反 应 ② 是 乙 烯 和 水 发 生 加 成 反 应 生 成 乙 醇 , 故 反 应 类 型 为 加 成 反 应 ; 是
,从结构上看,属于取代反应;
( 3 ) 和 钠 反 应 的 方 程 式 类 似 于 乙 醇 和 钠 的 反 应 , 故 方 程 式 为
;淀粉为多糖,水解最终产物是葡萄糖,反应方程式:
; 乙 醇 催 化 氧 化 生 成 乙 醛 , 反 应 方 程 式 :
;
(4)丙烯加聚的化学方程式: .
18.(1) (2分)
(2)ⅰ.方案I:插入温度计(2分)
方案Ⅱ: (或者 )(2分)
①空白试验,消除由于体积改变带来的实验影响(2分)
②将 水改为 溶液(或 溶液)(2分)
③反应产物硫酸根对反应有催化作用(或生成了硫酸根加快了化学反应速率)(2分)ii.随着反应进行,反应物浓度降低,反应速率减慢(2分)
解 析 : ( 1 ) 内 从 0 升 高 到 , 所 以
;
(2)ⅰ.欲判断反应的热效应,可以通过反应液反应前后溶液温度的变化实现,所以实验方案I中具体操作
为向烧杯中依次加入 溶液和 溶液,插入温度计;方案II中
具体操作为取 溶液于烧杯中,先加入 (或者 )固体,再加入
溶液.
【问题与思考】
①方案III烧杯①中加入 水的作用是空白试验,消除由于体积改变带来的实验影响;
②方案III中实验操作设计不严谨,改进的方法是将 水改为 溶液(或 溶液);
③根据题目信息结合反应可知,可能使化学反应速率增大的假设为反应产物硫酸根对反应有催化作用(或生
成了硫酸根加快了化学反应速率;
ⅱ.后期化学反应速率变慢的主要原因是反应物浓度降低,反应速率减慢.