文档内容
【冲刺期末】高二化学期末单元复习测试
第一单元 化学反应的热效应
(时间:90分钟 满分:100分)
一、选择题(本题共15小题,每小题3分,共45分。每小题只有一个选项符合题意)
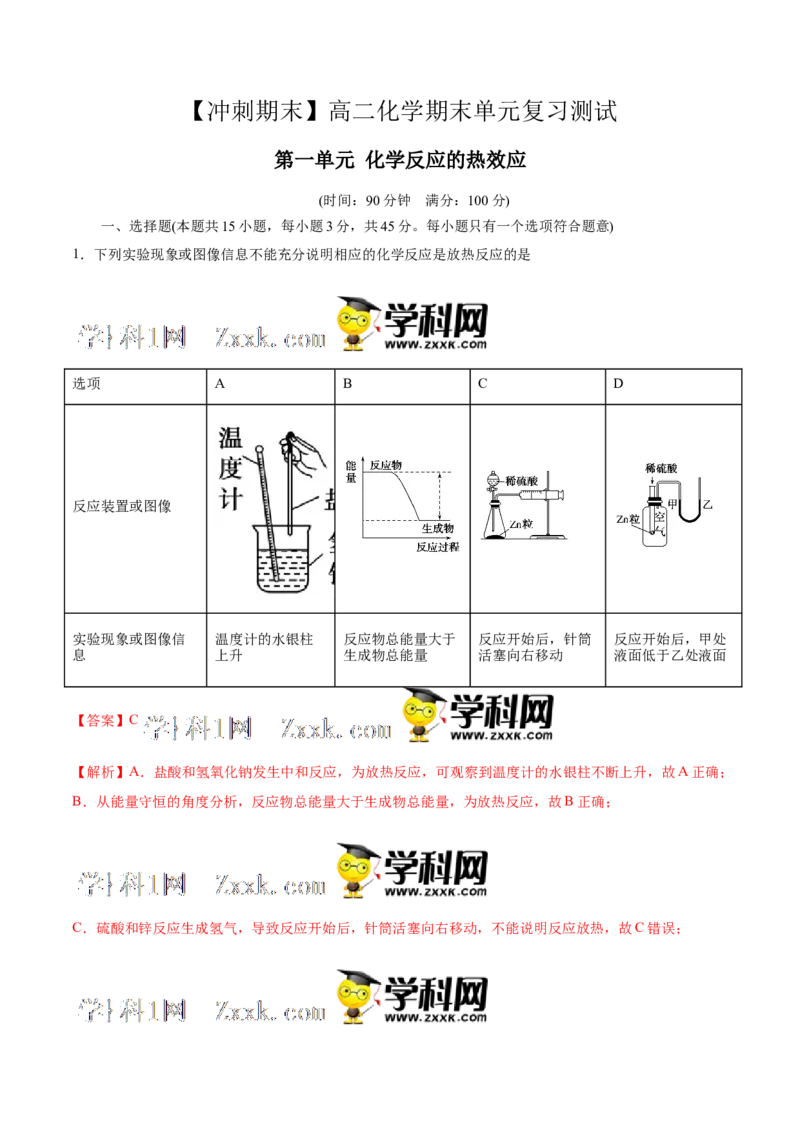
1.下列实验现象或图像信息不能充分说明相应的化学反应是放热反应的是
选项 A B C D
反应装置或图像
实验现象或图像信 温度计的水银柱 反应物总能量大于 反应开始后,针筒 反应开始后,甲处
息 上升 生成物总能量 活塞向右移动 液面低于乙处液面
【答案】C
【解析】A.盐酸和氢氧化钠发生中和反应,为放热反应,可观察到温度计的水银柱不断上升,故A正确;
B.从能量守恒的角度分析,反应物总能量大于生成物总能量,为放热反应,故B正确;
C.硫酸和锌反应生成氢气,导致反应开始后,针筒活塞向右移动,不能说明反应放热,故C错误;D.反应开始后,甲处液面低于乙处液面,说明装置内压强增大,反应为放热反应,温度升高,压强增大,
故D正确。
故选C。
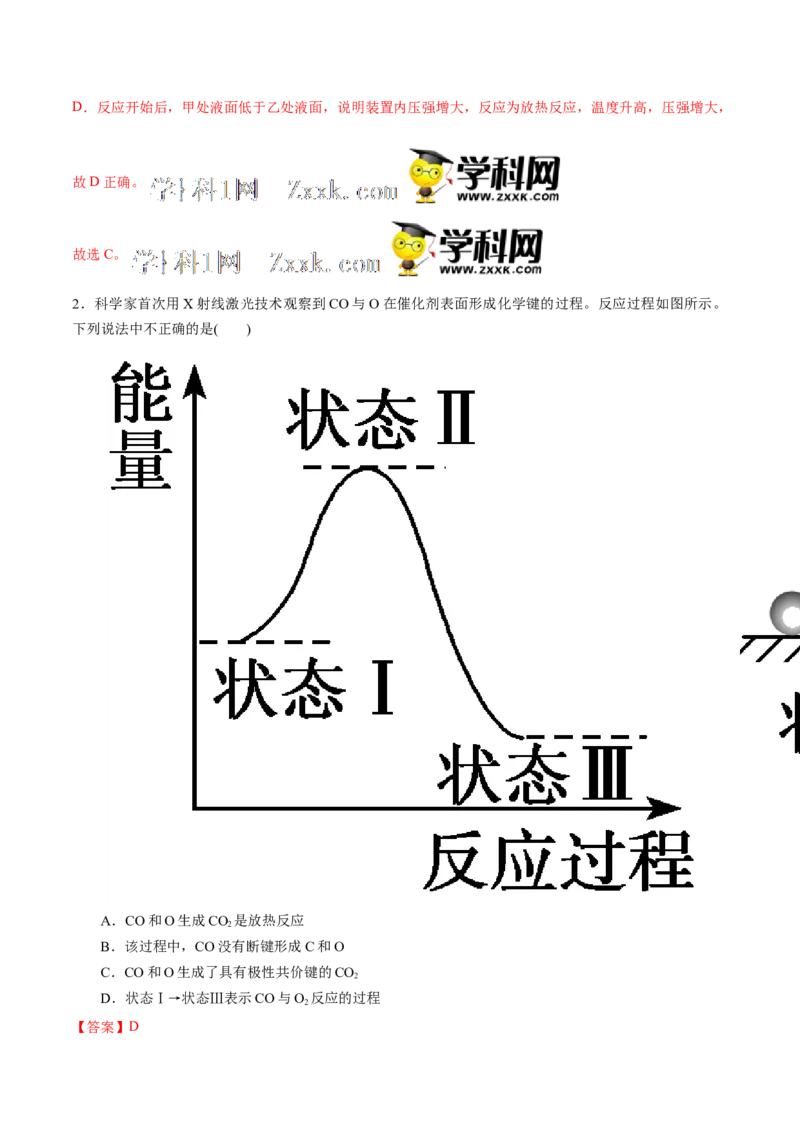
2.科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程如图所示。
下列说法中不正确的是( )
A.CO和O生成CO 是放热反应
2
B.该过程中,CO没有断键形成C和O
C.CO和O生成了具有极性共价键的CO
2
D.状态Ⅰ→状态Ⅲ表示CO与O 反应的过程
2
【答案】D【解析】 状态Ⅰ的能量大于状态Ⅲ,所以状态Ⅰ→状态Ⅲ的过程即 CO和O生成CO 的过程,是放热过
2
程,A正确;由图可知不存在CO断键的过程,B正确;CO与O在催化剂表面形成CO ,形成了C===O
2
极性
3.单质或化合物必须是完全燃烧,如反应物中C→CO,H→HO(液),S→SO (气)等。
2 2 2 2
已知1 mol燃料完全燃烧的数据分别为:
燃料 一氧化碳 甲烷 异辛烷(C H ) 乙醇
8 18
ΔH -283.0 kJ·mol−1 -891.0 kJ·mol−1 -5461.0 kJ·mol−1 -1366.8 kJ·mol−1
使用上述燃料最能体现“低碳经济”理念的是
A.一氧化碳 B.甲烷 C.异辛烷 D.乙醇
【答案】B
【解析】通过所给的数据计算出题给物质生成1 mol CO 放出的热量分别为:283.0 kJ、891.0 kJ,682.6
2
kJ、683.4 kJ,所以要得到相同的热量,甲烷释放出CO 最少,最能体现“低碳经济”理念。
24.下列表述中正确的是( )
A.根据图甲可知合成甲醇的热化学方程式为CO(g)+2H(g)===CH OH(g) ΔH=(b-a)kJ·mol-1
2 3 1
B.图乙表示2 mol H (g)所具有的能量比2 mol气态水所具有的能量多483.6 kJ
2
C.1 mol NaOH分别和1 mol CH COOH、1 mol HNO 反应,后者比前者ΔH小
3 3
D.汽油燃烧时化学能全部转化为热能
【答案】C
【解析】由题图甲可知,合成甲醇的反应是放热反应,ΔH =(a-b)kJ·mol-1,A项错误;由题图乙知,2
1
mol H(g)和1 mol O (g)的总能量比2 mol气态水的能量多483.6 kJ,B项错误;CHCOOH为弱酸,电离吸
2 2 3
收热量,所以 NaOH 与 CHCOOH 反应放出的热量少,但中和反应 ΔH<0,故 1 mol NaOH 与 1 mol
3
CHCOOH反应的ΔH更大,C项正确;汽油燃烧时化学能除转化为热能外还转化为光能等,D项错误。
3
5.已知:①2H(g)+O(g)===2H O(g) ΔH
2 2 2 1
②3H (g)+Fe O(s)===2Fe(s)+3HO(g) ΔH ③2Fe(s)+O(g)===Fe O(s) ΔH
2 2 3 2 2 2 2 3 3
④2Al(s)+O(g)===AlO(s) ΔH
2 2 3 4
⑤2Al(s)+Fe O(s)===AlO(s)+2Fe(s) ΔH
2 3 2 3 5
下列关于上述反应焓变的判断正确的是( )
A.ΔH<0,ΔH>0 B.ΔH<0,ΔH<ΔH
1 3 5 4 3
C.ΔH=ΔH+ΔH D.ΔH=ΔH+ΔH
1 2 3 3 4 5
【答案】B
【解析】反应③为放热反应,故ΔH<0,A错误;反应⑤为放热反应,ΔH<0,根据盖斯定律得④-③=
3 5
⑤,故ΔH =ΔH -ΔH<0,则ΔH<ΔH ,B正确,D错误;根据盖斯定律得①=(②+③)×,故ΔH =(ΔH
5 4 3 4 3 1 2
+ΔH)×,C错误。
3
6.下列有关反应热的说法正确的是( )
A.在化学反应过程中,吸热反应需不断从外界获得能量,放热反应不需从外界获得能量
B.甲烷的燃烧热ΔH=-890 kJ·mol-1,则甲烷燃烧的热化学方程式为CH(g)+2O(g)===CO (g)+2HO(g)
4 2 2 2
ΔH=-890 kJ·mol-1
C.已知:S(s)+O(g)===SO(g) ΔH =-Q kJ·mol-1,S(g)+O(g)===SO(g) ΔH =-Q kJ·mol-1,则Q
2 2 1 1 2 2 2 2 1
<Q
2
D.已知常温常压下:HCl(aq)+NaOH(aq)===NaCl(aq)+HO(l) ΔH=-57.3 kJ·mol-1,则有:HSO (aq)
2 2 4+Ba(OH) (aq)===BaSO (s)+2HO(l) ΔH=-114.6 kJ·mol-1
2 4 2
【答案】C
【解析】无论放热反应还是吸热反应在化学键断裂时都要从外界吸收一部分能量达到反应的活化状态,对
于放热反应来说是放出的热量大于吸收的热量,对于吸热反应来说是吸收的热量大于放出的热量,吸热反
应不一定需要不断从外界获得能量,放热反应未必不需要从外界获得能量,A项错误;燃烧热是指101 kPa
时,1 mol纯物质完全燃烧生成指定产物时所放出的热量,其中生成指定产物是指燃烧产物不能再燃烧且
状态稳定,如HO为液态而不是气态,故正确的甲烷燃烧的热化学方程式为CH(g)+2O(g)===CO (g)+
2 4 2 2
2HO(l) ΔH=-890 kJ·mol-1,B项错误;产物相同时,同种气态物质燃烧放出的热量比等量的固态物质
2
放出的热量多,故Q <Q ,C项正确;中和热不包括离子在水溶液中的反应热, HSO 溶液和Ba(OH) 溶
1 2 2 4 2
液反应的焓变值中不仅包含中和热,还有生成BaSO 固体的反应热,D项错误。
4
7.已知几种离子反应如下:
①NH ·H O(aq)+H+(aq)===NH(aq)+HO(l) ΔH ②Ba2+(aq)+SO(aq)===BaSO (s) ΔH
3 2 2 1 4 2
③Ba2+(aq)+2H+(aq)+2OH-(aq)+SO(aq)===BaSO (s)+2HO(l) ΔH
4 2 3
④H+(aq)+OH-(aq)===H O(l) ΔH
2 4
下列推断正确的是( )
A.ΔH>0,ΔH<0 B.ΔH<ΔH
1 2 2 3
C.ΔH=ΔH+2ΔH D.ΔH<ΔH
3 2 4 1 4
【答案】C
【解析】酸碱中和反应都是放热反应,即 ΔH<0,A项错误;沉淀反应由不稳定的离子生成稳定的化合物,
1
属于放热反应,放出热量越多,焓变越小,ΔH>ΔH ,B项错误;根据盖斯定律,③=②+④×2,即ΔH
2 3 3
=ΔH+2ΔH,C项正确;一水合氨电离时要吸收热量,ΔH>ΔH,D项错误。
2 4 1 4
8.下列说法正确的是
A.1molH 完全燃烧生成HO(g)放出的热量叫H 的燃烧热
2 2 2
B.25℃、101kPa时,1molS和2molS的燃烧热相等C.已知S(s)+ O(g)=SO(g) ∆H=-269.8kJ/mol,则硫生成SO 的反应热为
2 3 3
269.8kJ/mol
D.25℃、101kPa时,碳的燃烧热为-393.5kJ/mol
【答案】B
【解析】
A.燃烧热对产物的要求是稳定状态,对水来说应为HO(l),A不正确;
2
B.燃烧热是指1mol可燃物完全燃烧放出的热量,与实验时反应物的用量无关,所以25℃、101kPa时,
1molS和2molS的燃烧热相等,B正确;
C.从热化学方程式S(s)+ O(g)=SO(g) ∆H=-269.8kJ/mol可以看出,燃烧为放
2 3
热反应,∆H小于0,所以硫生成SO 的反应热为-269.8kJ/mol,C不正确;
3D.燃烧热都为正值,所以25℃、101kPa时,碳的燃烧热为393.5kJ/mol,D不正确;
故选B。
9.已知:① CHOH(g)+O(g)===CO (g)+2H(g) ΔH=-192.9 kJ·mol-1
3 2 2 2
②H (g)+O(g)===H O(l)ΔH=-285.8 kJ·mol-1
2 2 2
则CHOH(g)+O(g)===CO (g)+2HO(l) ΔH为( )
3 2 2 2
A.+478.7 kJ·mol-1 B.-764.5 kJ·mol-1 C.-478.7 kJ·mol-1 D.+764.5 kJ·mol-1
【答案】B
【解析】 已知热化学方程式:① CHOH(g)+O(g)===CO (g)+2H(g) ΔH=-192.9 kJ·mol-1;②H(g)
3 2 2 2 2
+O(g)===H O(l) ΔH=-285.8 kJ·mol-1;根据盖斯定律可知,将①+②×2可得目标方程式CHOH(g)+
2 2 3
O(g)===CO (g)+2HO(l) ΔH=(-192.9 kJ·mol-1)+(-285.8 kJ·mol-1)×2=-764.5 kJ·mol-1,故B正确。
2 2 2
10.下列依据热化学方程式得出的结论正确的是( )
选项 热化学方程式 结论
2H(g)+O(g)===2H O(g) H 的燃烧热为 241.8
2 2 2 2
A
ΔH=-483.6 kJ·mol-1 kJ·mol-1
含 1 mol NaOH 的稀
溶液与浓 HSO 完全
B OH-(aq)+H+(aq)===H O(l) ΔH=-57.3 kJ·mol-1 2 4
2
中和,放出热量小于
57.3 kJ
2C(s)+2O(g)===2CO (g) ΔH=-a kJ·mol-1
2 2
C b<a
2C(s)+O(g)===2CO(g) ΔH=-b kJ·mol-1
2
D C(石墨,s)===C(金刚石,s) ΔH=+1.5 kJ·mol-1 金刚石比石墨稳定
【答案】B
【解析】燃烧热是指1 mol可燃物完全燃烧生成指定物质时放出的热量,气态水转化为液态水吸收热量,
H 的燃烧热应小于241.8 kJ·mol-1,故A错误;浓硫酸溶解于水的过程放热,则用浓硫酸与NaOH溶液反
2应生成1 mol水,放出的热量大于57.3 kJ,故B错误;2 mol 碳单质,完全燃烧时放出热量更多,故有
a>b,故C正确;石墨转化为金刚石吸热,说明石墨的能量低于金刚石,而物质能量越低越稳定,故石墨
比金刚石更稳定,故D错误。
11.已知:2HO(l)===2H (g)+O(g) ΔH=+571.6 kJ·mol-1。以太阳能为热源分解Fe O ,经热化学铁氧
2 2 2 3 4
化合物循环分解水制H 的图示与过程如下:
2
过程Ⅰ:……
过程Ⅱ:3FeO(s)+HO(l)===H (g)+Fe O(s) ΔH=+129.2 kJ·mol-1
2 2 3 4
下列说法不正确的是( )
A.该过程能量转化形式是太阳能→化学能→热能
B.过程Ⅰ的热化学方程式为Fe O(s)===3FeO(s)+O(g) ΔH=+156.6 kJ·mol-1
3 4 2
C.氢气的燃烧热为ΔH=-285.8 kJ·mol-1
D.铁氧化合物循环制H 具有成本低、产物易分离等优点
2
【答案】A
【解析】过程Ⅰ中Fe O 分解变为FeO、O ,该反应为吸热反应,过程Ⅱ发生的反应也是吸热反应,因此
3 4 2
不存在化学能→热能的过程,A错误;已知反应①2HO(l)===2H (g)+O(g) ΔH=+571.6 kJ·mol-1和反应
2 2 2
② 3FeO(s)+HO(l)===H (g)+Fe O(s) ΔH=+129.2 kJ·mol-1,根据盖斯定律,将①×-②得:
2 2 3 4
Fe O(s)===3FeO(s)+O(g) ΔH=+156.6 kJ·mol-1,B正确;由2HO(l)===2H (g)+O(g) ΔH=+571.6
3 4 2 2 2 2
kJ·mol-1可知2 mol H 完全燃烧产生2 mol液态水,放出571.6 kJ的热量,则1 mol H 完全燃烧产生1 mol
2 2
液态水,放出285.8 kJ的热量,故氢气的燃烧热为ΔH=-285.8 kJ·mol-1,C正确;过程Ⅱ为3FeO(s)+
HO(l)===H (g)+Fe O(s),产物中,氢气为气体,而Fe O 为固体,故铁氧化合物循环制H 的产物易分离,
2 2 3 4 3 4 2
且由于利用太阳能,故成本低,D正确。
12.一定条件下,氢气与氧气反应的能量变化如图所示,下列说法中正确的是A.该反应的反应热
B.该反应为吸热反应
C.断裂2molH-H和1mol 放出(b-a)KJ的能量
D. 燃烧热的热化学方程式为:
【答案】A
【解析】
A. 由图知:热化学方程式为:
,该反应的反应热 ,
A正确;
B.反应物具有的总能量大于生成物具有的总能量,该反应为放热反应,B错误;C. 断裂化学键要吸收能量,断裂2molH-H和1mol 吸收bKJ的能量,C
错误;
D.燃烧热是101kP时,1mol可燃物完全燃烧生成稳定产物时的反应热,常见元素的稳定产物:
C→CO(g)、H→H O(l),图中水呈气态而不是液态,则热化学方程式
2 2
不能表示 的燃烧热,D错误;
答案选A。
13.通过以下反应可获得新型能源二甲醚(CHOCH )。下列说法不正确的是( )
3 3
①C(s)+HO(g)===CO(g)+H(g) ΔH=a kJ·mol-1
2 2 1
②CO(g)+HO(g)===CO (g)+H(g) ΔH=b kJ·mol-1
2 2 2 2
③CO (g)+3H(g)===CH OH(g)+HO(g) ΔH=c kJ·mol-1
2 2 3 2 3
④2CH OH(g)===CH OCH (g)+HO(g) ΔH=d kJ·mol-1
3 3 3 2 4
A.反应①、②为反应③提供原料气 B.反应③也是CO 资源化利用的方法之一
2
C.反应CHOH(g)===CH OCH (g)+HO(l)的ΔH= kJ·mol-1
3 3 3 2
D.反应2CO(g)+4H(g)===CH OCH (g)+HO(g)的ΔH=(2b+2c+d)kJ·mol-1
2 3 3 2
【答案】C
【解析】反应①的产物为CO和H,反应②的产物为CO 和H,反应③的原料为CO 和H,A项正确;反
2 2 2 2 2
应③将温室气体CO 转化为燃料CHOH,B项正确;反应④中生成物HO为气态,C项中生成物HO为液
2 3 2 2
态,故C项中反应的焓变不等于 kJ·mol-1,C项错误;依据盖斯定律,由②×2+③×2+④,可得所求反
应的焓变,D项正确。
14.NO和CO是环境污染性气体,可在Pt O+表面转化为无害气体,其反应为NO(g)+CO(g)===CO (g)+
2 2 2 2
N(g) ΔH,有关化学反应的物质变化过程如图1所示,能量变化过程如图2所示,下列说法正确的是( )
2A.由图1、2可知ΔH=ΔH+ΔH=ΔE-ΔE
1 2 1 2
B.加入Pt O+作为反应物,可使反应的焓变减小
2
C.由图2可知ΔE 大于ΔE
1 2
D.物质的量相等的NO、CO的键能总和大于CO、N 的键能总和
2 2 2
【答案】A
【解析】 ①NO+Pt O+===Pt O+N ΔH ,②Pt O+CO===Pt O++CO ΔH ,结合盖斯定律计算①
2 2 2 2 1 2 2 2 2
+②得到NO(g)+CO(g)===CO (g)+N(g) ΔH=ΔH +ΔH ,焓变=正反应活化能-逆反应活化能,图中
2 2 2 1 2
ΔE 为正反应活化能,ΔE 为逆反应活化能,所以ΔH=ΔE -ΔE ,故A正确;据图可知Pt O+为催化剂,
1 2 1 2 2
不影响反应的焓变,故B错误;由图可知ΔE<ΔE,故C错误;该反应的反应物能量高于生成物,为放热
1 2
反应,所以物质的量相等的NO、CO的键能总和小于CO、N 的键能总和,故D错误。
2 2 2
15.已知:①2C(s)+O(g)===2CO(g) ΔH=-220 kJ·mol-1
2
②氢气燃烧的能量变化示意图:
下列说法正确的是( )
A.1 mol C(s)完全燃烧放出110 kJ的热量
B.H(g)+O(g)===H O(g) ΔH=-240 kJ·mol-1
2 2 2
C.C(s)+HO(g)===CO(g)+H(g) ΔH=-130 kJ·mol-1
2 2
D.欲分解2 mol H O(l),至少需要提供4×462 kJ的热量
2
【答案】B
【解析】1 mol C(s)燃烧生成CO时放出110 kJ热量,此时不是完全燃烧,A项错误;根据氢气燃烧的能量
变化示意图,可得热化学方程式②2H(g)+O(g)===2H O(g) ΔH=2×436 kJ·mol-1+496 kJ·mol-1-4×462
2 2 2
kJ·mol-1=-480 kJ·mol-1,故H(g)+O(g)===H O(g) ΔH=-240 kJ·mol-1,B项正确;根据盖斯定律由
2 2 2可得目标热化学方程式,即C(s)+HO(g)===CO(g)+H(g) ΔH=+130 kJ·mol-1,C项错误;由图中信息
2 2
可知,分解2 mol H O(g)至少需要提供4×462 kJ的热量,而分解2 mol H O(l)需要提供的热量更多,故D项
2 2
错误。
二、非选择题(本题共5小题,共55分)
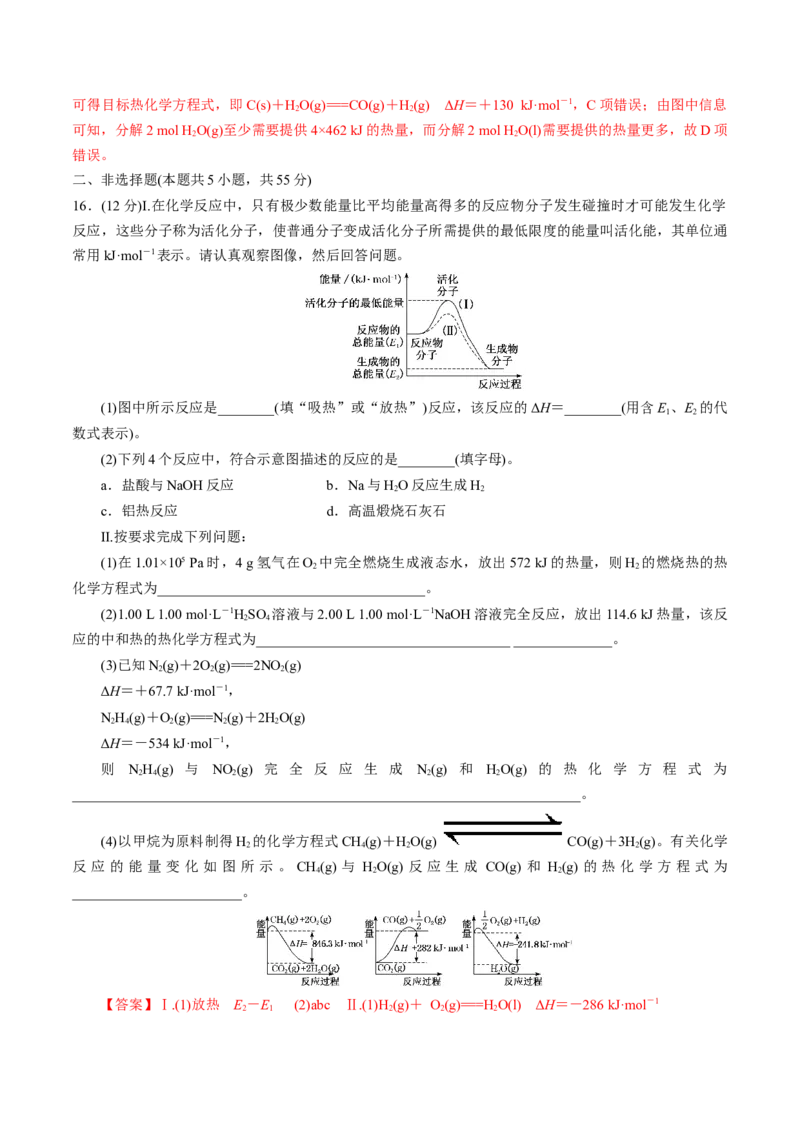
16.(12分)Ⅰ.在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学
反应,这些分子称为活化分子,使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通
常用kJ·mol-1表示。请认真观察图像,然后回答问题。
(1)图中所示反应是________(填“吸热”或“放热”)反应,该反应的ΔH=________(用含E 、E 的代
1 2
数式表示)。
(2)下列4个反应中,符合示意图描述的反应的是________(填字母)。
a.盐酸与NaOH反应 b.Na与HO反应生成H
2 2
c.铝热反应 d.高温煅烧石灰石
Ⅱ.按要求完成下列问题:
(1)在1.01×105 Pa时,4 g氢气在O 中完全燃烧生成液态水,放出572 kJ的热量,则H 的燃烧热的热
2 2
化学方程式为______________________________________。
(2)1.00 L 1.00 mol·L-1HSO 溶液与2.00 L 1.00 mol·L-1NaOH溶液完全反应,放出114.6 kJ热量,该反
2 4
应的中和热的热化学方程式为____________________________________ ______________。
(3)已知N(g)+2O(g)===2NO(g)
2 2 2
ΔH=+67.7 kJ·mol-1,
NH(g)+O(g)===N (g)+2HO(g)
2 4 2 2 2
ΔH=-534 kJ·mol-1,
则 NH(g) 与 NO (g) 完 全 反 应 生 成 N(g) 和 HO(g) 的 热 化 学 方 程 式 为
2 4 2 2 2
________________________________________________________________________。
(4)以甲烷为原料制得H 的化学方程式CH(g)+HO(g) CO(g)+3H(g)。有关化学
2 4 2 2
反 应 的 能 量 变 化 如 图 所 示 。 CH(g) 与 HO(g) 反 应 生 成 CO(g) 和 H(g) 的 热 化 学 方 程 式 为
4 2 2
________________________。
【答案】Ⅰ.(1)放热 E-E (2)abc Ⅱ.(1)H (g)+ O(g)===H O(l) ΔH=-286 kJ·mol-1
2 1 2 2 2(2)H SO (aq)+NaOH(aq)===Na SO (aq)+HO(l) ΔH=-57.3 kJ·mol-1
2 4 2 4 2
(3)2N H(g) + 2NO (g)===3N (g) + 4HO(g) ΔH = - 1 135.7 kJ·mol - 1 (4)CH (g) + HO(g)
2 4 2 2 2 4 2
CO(g)+3H(g) ΔH=+161.1 kJ·mol-1
2
【解析】Ⅰ.(1)图中所示反应反应物的总能量大于生成物的总能量,是放热反应,该反应的 ΔH=E -
2
E。
1
(2)常见的放热反应为燃烧反应,铝热反应,金属与水或酸的反应,中和反应等,所以 4个反应中,符
合示意图描述的反应的是a、b、c。
Ⅱ.(1)在1.01×105 Pa时,4 g氢气在O 中完全燃烧生成液态水,放出572 kJ的热量,则1 mol氢气即2 g
2
氢气完全燃烧放出的热量为286 kJ,故H 的燃烧热的热化学方程式为H(g)+ O(g)===H O(l) ΔH=-286
2 2 2 2
kJ·mol-1。
(2)中和热是指稀的酸碱中和生成 1 mol 水放出的热量,则中和热的热化学方程式为 HSO (aq)+
2 4
NaOH(aq)===Na SO (aq)+HO(l) ΔH=-57.3 kJ·mol-1。
2 4 2
(3)已知①N(g)+2O(g)===2NO(g) ΔH=+67.7 kJ·mol-1,②NH(g)+O(g)===N (g)+2HO(g) ΔH
2 2 2 2 4 2 2 2
=-534 kJ·mol-1,则根据盖斯定律分析,将②×2-①得NH(g)与NO (g)完全反应生成N(g)和HO(g)的热
2 4 2 2 2
化学方程式:2NH(g)+2NO (g)===3N (g)+4HO(g) ΔH=-534 kJ·mol-1×2-67.7 kJ·mol-1=-1 135.7
2 4 2 2 2
kJ·mol-1。
(4)由图可知热化学方程式为① CH(g)+2O(g)===CO (g)+2HO(g) ΔH=-846.3 kJ·mol-1;
4 2 2 2
②CO(g)===CO(g)+ O(g) ΔH=+282 kJ·mol-1;③H(g)+O(g)===H O(g) ΔH=-241.8 kJ·mol-1; 根
2 2 2 2 2
据盖斯定律分析,①+②-③×3可得CH(g)与HO(g)反应生成CO(g)和H(g)的热化学方程式:CH(g)+
4 2 2 4
HO(g) CO(g)+3H(g) ΔH=-846.3 kJ·mol-1+282 kJ·mol-1+241.8 kJ·mol-1×3=+
2 2
161.1 kJ·mol-1。
17.(8分)实验室用50mL0.50mol/L盐酸、50mL0.55mol/LNaOH溶液和如图所示装置,进行测定中和热的
实验,得到表中的数据:完成下列问题:起始温度t/℃
1
实验次数 终止温度t/℃
2
盐酸 NaOH溶液
1 20.2 20.3 23.7
2 20.3 20.5 23.8
3 21.5 21.6 24.9
(1)实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是_________________________________。
(2)在操作正确的前提下,提高中和热测定准确性的关键是_________________________________。
(3)根据表中所测数据进行计算,则该实验测得的中和热ΔH=_________________ [盐酸和NaOH溶液的
密度(ρ)按1g/cm3计算,反应后混合溶液的比热容(с)按4.18J/(g·℃)计算]。如果用0.5mol/L的醋酸与
0.55mol/LNaOH溶液进行实验,则实验中测得的“中和热”将____________(填“偏大”、“偏小”或“不变”)。(4)若某同学利用上述装置做实验,有些操作不规范,造成测得中和热偏大,请你分析可能的原因是
_____________。
A.测量盐酸的温度后,温度计没有用水冲洗干净
B.把量筒中的氢氧化钠溶液倒入小烧杯时动作迟缓
C.做本实验的当天室温较高
D.在量取盐酸时仰视读数
E.大烧杯的盖板中间小孔太大
【答案】(1)Cu传热快,热量损失大 (2)提高装置的保温效果,尽可能减少热量损失
(3) 偏大 (4)ABE【解析】
(1)铜是金属,是热的良导体,传热快,热量损失大,因此实验时不能用铜丝搅拌棒代替环形玻璃搅拌
棒。
(2)在操作正确的前提下,提高中和热测定准确性的关键是提高装置的保温效果,尽可能减少热量损失。
(3)根据表中数据可知三次实验中温度差分别是23.7℃- =3.45℃、23.8℃-
=3.4℃、24.9℃-
=3.35℃,所以三次实验的平均值是3.4℃,则反应中放出的热量=100g×4.18
J·(g∙℃)-1×3.4℃=1421.2J=1.4212kJ。又因为反应中生成水的物质的量是0.025mol,则该反应的中和热
。由于醋酸是弱酸,电离吸收热量,则如果用0.5mol/L的醋酸与
0.55mol/LNaOH溶液进行实验,放出的热量减少,则实验中测得的“中和热”将偏大。
(4)A.测量盐酸的温度后,温度计没有用水冲洗干净,则称量氢氧化钠溶液的温度时起始温度偏高,经
过计算放出的热量偏少,则造成测得的中和热将偏大,故A符合;B.把量筒中的氢氧化钠溶液倒入小烧
杯时动作迟缓会导致热量损失,则造成测得的中和热将偏大,故B符合;C.做本实验的当天室温较高对
实验没有影响,故C不符合;D.在量取盐酸时仰视读数,则量取的盐酸体积偏大,则放出热量增加,则造成测得的中和热将偏小,故D不符合;E.大烧杯的盖板中间小孔太大会导致热量损失,则造成测得的
中和热将偏大,故E符合;故选ABE。
18.(11分)(1)目前NH 和(NH )CO 已经被用作工业捕碳剂,它们与CO 可发生如下可逆反应:
3 4 2 3 2
反应Ⅰ.2NH(l)+HO(l)+CO(g)(NH)CO(aq) ΔH
3 2 2 4 2 3 1
反应Ⅱ.NH(l)+HO(l)+CO(g)NHHCO (aq) ΔH
3 2 2 4 3 2
反应Ⅲ.(NH)CO(aq)+HO(l)+CO(g)2NHHCO (aq) ΔH
4 2 3 2 2 4 3 3
则 ΔH 与 ΔH 、 ΔH 之 间 的 关 系 : ΔH = ________________________________________
3 1 2 3
________________________________。
(2)白磷(P )可由Ca (PO )、焦炭和SiO 在一定条件下反应获得。相关热化学方程式如下:
4 3 4 2 2
①2Ca (PO )(s)+10C(s)===6CaO(s)+P(s)+10CO(g)
3 4 2 4
ΔH=+3 359.26 kJ·mol-1
1
②CaO(s)+SiO(s)===CaSiO (s)
2 3
ΔH=-89.61 kJ·mol-1
2
③2Ca (PO )(s)+6SiO(s)+10C(s)===6CaSiO (s)+P(s)+10CO(g) ΔH
3 4 2 2 3 4 3
则ΔH=________ kJ·mol-1。
3
(3)真空碳还原—氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al O(s)+AlCl (g)+3C(s)===3AlCl(g)+3CO(g)
2 3 3
ΔH=a kJ·mol-1
3AlCl(g)===2Al(l)+AlCl (g) ΔH=b kJ·mol-1
3
则反应Al O(s)+3C(s)===2Al(l)+3CO(g)的ΔH=________ kJ·mol-1(用含a、b的代数式表示)。
2 3
【答案】(1)2ΔH-ΔH (2)+2 821.6 (3)a+b
2 1
【解析】(1)根据盖斯定律,将Ⅱ式×2-Ⅰ式即可得到Ⅲ式,则ΔH =2ΔH -ΔH 。(2)根据盖斯定律可
3 2 1
得①+②×6=③,所以ΔH=+3 359.26 kJ·mol-1-89.61 kJ·mol-1×6=+2 821.6 kJ·mol-1。(3)根据盖斯定
3
律,将题中所给的两个热化学方程式相加可得所求的热化学方程式,该反应的ΔH=(a+b) kJ·mol-1。
19.(12分)完成下列反应的热化学方程式。(1)沼气是一种能源,它的主要成分是CH,常温下,0.5 mol CH 完全燃烧生成CO(g)和液态水时,放
4 4 2
出445 kJ热量,则热化学方程式为_____________。
(2)已知HS完全燃烧生成SO (g)和HO(l),HS的燃烧热为a kJ·mol-1,写出HS的燃烧热的热化学方
2 2 2 2 2
程式_________________________ 。
(3)已知: N(g)+ H(g)=N(g)
2 2
+3H(g) ΔH=+a kJ·mol-1
1
N(g)+3H(g)=NH (g) ΔH=-b kJ·mol-1
3 2
NH (g)=NH (l) ΔH=-c kJ·mol-1
3 3 3
写出N(g)和H(g)反应生成液氨的热化学方程式______________________________。
2 2
(4)已知:①HF(aq)+OH-(aq)=F-(aq)+HO(l) ΔH=-67.7 kJ·mol-1
2
②H+(aq)+OH-(aq)=H O(l) ΔH=-57.3 kJ·mol-1
2试写出HF电离的热化学方程式_____________________________________________。
(5)SF 是一种优良的绝缘气体,分子结构中,只存在S—F键,已知1 mol S(s)转化为气态硫原子吸收能
6
量280 kJ,F—F键能为160 kJ·mol-1,S—F键能为330 kJ·mol-1,试写出S(s)和F(g)反应生成SF (g)的热化
2 6
学方程式___________________________________________。
【答案】(1)CH(g)+2O(g)=CO (g)+2HO(l) △H=-890kJ/mol (2)HS(g)+
4 2 2 2 2
O(g)===SO (g)+HO(l) ΔH=-a kJ/mol (3)N(g)
2 2 2 2
+3H (g)===2NH (l) ΔH=-2(b+c-a) kJ/mol. (4)HF(aq) H+(aq)+F-(aq) ΔH=-10.4 kJ/mol (5)
2 3
S(s)+3F (g)═SF6(g) ΔH=-1 220 kJ/mol.
2
【解析】
(1)0.5mol CH 完全燃烧生成CO 和液态HO时,放出445kJ热量,1mol甲烷燃烧生成二氧化碳和液态水放
4 2 2
热890kJ,反应的热化学方程式为:CH(g)+2O(g)=CO (g)+2HO(l) △H=-890kJ/mol,
4 2 2 2
故答案为:CH(g)+2O(g)=CO (g)+2HO(l) △H=-890kJ/mol,
4 2 2 2(2) 已知HS完全燃烧生成SO (g)和HO(l),HS的燃烧热为a kJ·mol-1,则HS的燃烧热的热化学方程式为:
2 2 2 2 2
HS(g)+ O(g)===SO (g)+HO(l) ΔH=-a kJ/mol,
2 2 2 2
故答案为:HS(g)+ O(g)===SO (g)+HO(l) ΔH=-a kJ/mol;
2 2 2 2
(3) 已知: N(g)+ H(g)=N(g)+
2 2
3H(g) ΔH=+a kJ·mol-1
1
N(g)+3H(g)=NH (g) ΔH=-b kJ·mol-1
3 2
NH (g)=NH (l) ΔH=-c kJ·mol-1
3 3 3
根据盖斯定律,将以上三个热化学方程式相加即可得到
N(g)+ H(g)=== NH(l) ΔH=- (b+c-a) kJ/mol.,即得到N(g)
2 2 3 2
+3H (g)===2NH (l) ΔH=-2(b+c-a) kJ/mol.
2 3故答案为:N(g)+3H(g)===2NH (l) ΔH=-2(b+c-a) kJ/mol.
2 2 3
(4) 已知:①HF(aq)+OH-(aq)=F-(aq)+HO(l) ΔH=-67.7 kJ·mol-1,②H+(aq)+OH-(aq)=H O(l) ΔH=
2 2
-57.3 kJ·mol-1根据盖斯定律,①-②得:HF(aq) H+(aq)+F-(aq) ΔH=(-
67.7+57.3)kJ·mol-1=-10.4 kJ/mol,
故答案为:HF(aq) H+(aq)+F-(aq) ΔH=-10.4 kJ/mol
(5) 已知1 mol S(s)转化为气态硫原子吸收能量280 kJ,F—F键能为160 kJ·mol-1,S—F键能为330 kJ·mol-
1,ΔH=生成物的总能量-反应物的总能量=反应物的键能-生成物的键能=280 kJ·mol-1+3×160 kJ·mol-1-
6×330 kJ·mol-1= -1 220 kJ/mol, 所以 S(s)+3F (g)═SF6(g) ΔH=-1 220 kJ/mol.,
2
故答案为:S(s)+3F (g)═SF6(g) ΔH=-1 220 kJ/mol.;
2
20.(12分)热力学标准状况(298.15K、101kPa)下,由稳定单质发生反应生成1mol化合物的反应热叫该化
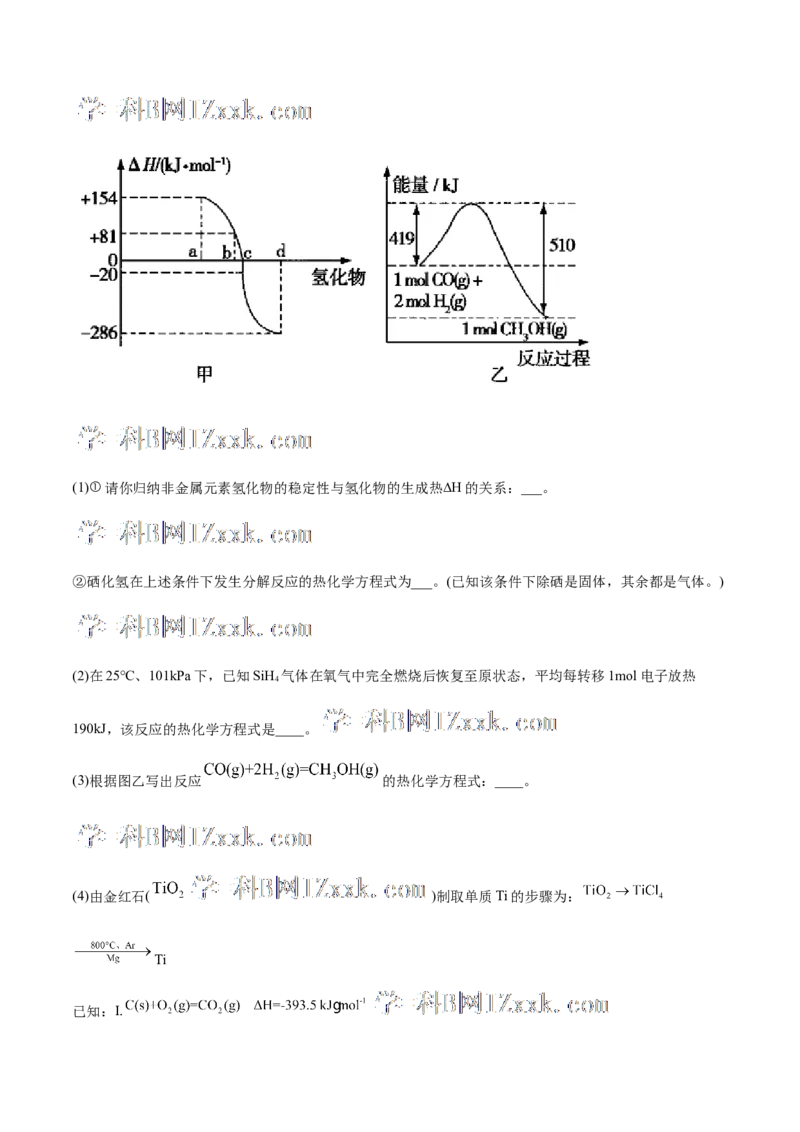
合物的生成热(∆H)。图甲为ⅥA族元素氢化物a、b、c、d的生成热数据示意图。试完成下列问题。(1)①请你归纳非金属元素氢化物的稳定性与氢化物的生成热∆H的关系:___。
②硒化氢在上述条件下发生分解反应的热化学方程式为___。(已知该条件下除硒是固体,其余都是气体。)
(2)在25℃、101kPa下,已知SiH 气体在氧气中完全燃烧后恢复至原状态,平均每转移1mol电子放热
4
190kJ,该反应的热化学方程式是____。
(3)根据图乙写出反应 的热化学方程式:____。
(4)由金红石( )制取单质Ti的步骤为:
Ti
已知:I.II.
III.
① 的∆H=____。
②反应 在Ar气氛中进行的理由是
_____。
【答案】非金属元素氢化物越稳定,∆H越小
防止高温下Mg、Ti与空气中的 (或 、
)作用
【解析】
(1)①非金属元素氢化物的稳定性与生成1mol氢化物时的 H的关系为:根据元素周期律,同一主族元素
非金属性越强,生成气态氢化物越容易,气态氢化物越稳△定;而根据热力学,能量越低越稳定.a、b、c、
d依次为HTe、HSe、HS、HO,故答案为:非金属元素氢化物越稳定, H越小,反之亦然;
2 2 2 2
②由①可知,b为HSe的生成热数据,则HSe分解吸热,且 H=-81kJ/mo△l,所以HSe发生分解反应的热
2 2 2
化学反应方程式为HSe(g)═Se(s)+H (g)△H= -81 kJ•mol-1,故答△案为:HSe(g)═Se(s)+H (g)△H= -81
2 2 2 2
kJ•mol-1;
(2)SiH 气体在氧气中完全燃烧的化学方程式为:SiH+2O SiO+2H O,由方程式可知,1 mol SiH 完
4 4 2 2 2 4
全燃烧转移8 mol电子,故热化学方程式为:SiH(g)+2O(g)═SiO (s)+2HO(l)△H= -1520.0 kJ•mol-1,故答案
4 2 2 2
为:SiH(g)+2O(g)═SiO (s)+2HO(l)△H= -1520.0 kJ•mol-1;
4 2 2 2
(3)△H=反应物总能量-生成物总能量=419 kJ•mol-1-510 kJ•mol-1= -91 kJ•mol-1,故该反应的热化学方程式为
CO(g)+2H(g)═CH OH(g)△H= -91 kJ•mol-1;故答案为:CO(g)+2H(g)═CH OH(g)△H= -91 kJ•mol-1;
2 3 2 3(4)①已知①C(s)+O(g)=CO (g)△H= -393.5kJ/mol
2 2
②2CO(g)+O(g)=2CO (g)△H= -566kJ/L
2 2
③TiO(s)+2Cl (g)=TiCl (s)+O(g)△H= +141kJ/mol;
2 2 4 2
由盖斯定律①×2-②+③得到:TiO(s)+2Cl (g)+2C(s)=TiCl (s)+2CO(g)的 H= -80 kJ•mol-1,故答案为:-80
2 2 4
kJ•mol-1; △
②反应TiCl +2Mg═2MgCl +Ti在Ar气氛中进行的理由是防止高温下Mg或Ti与空气中的O(或CO、N)反
4 2 2 2 2
应化学反应,对TiCl +2Mg═2MgCl +Ti造成干扰,故答案为:防止高温下Mg(Ti)与空气中的O(或CO、
4 2 2 2
N)作用。
2