文档内容
第四章 第2节 元素周期律课时作业2022-2023学年高中化
学人教版(2019)必修第一册
学校:___________姓名:___________班级:___________考号:___________
一、单选题
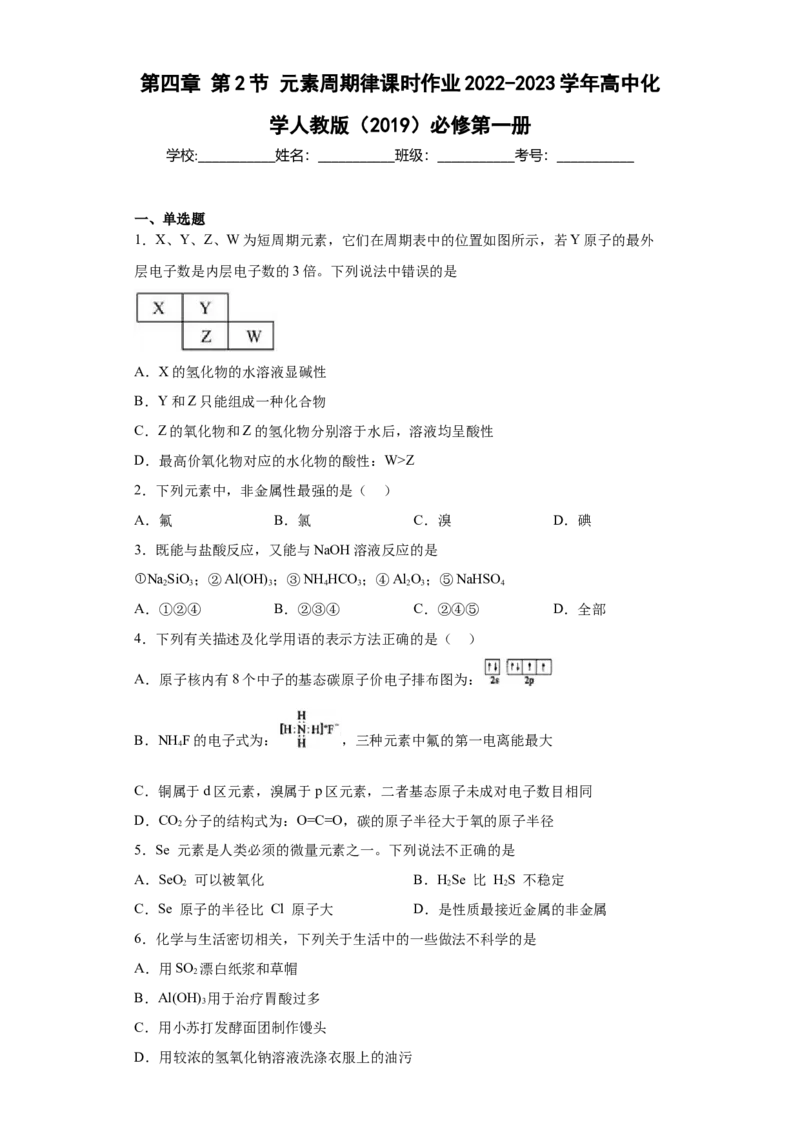
1.X、Y、Z、W为短周期元素,它们在周期表中的位置如图所示,若Y原子的最外
层电子数是内层电子数的3倍。下列说法中错误的是
A.X的氢化物的水溶液显碱性
B.Y和Z只能组成一种化合物
C.Z的氧化物和Z的氢化物分别溶于水后,溶液均呈酸性
D.最高价氧化物对应的水化物的酸性:W>Z
2.下列元素中,非金属性最强的是( )
A.氟 B.氯 C.溴 D.碘
3.既能与盐酸反应,又能与NaOH溶液反应的是
①Na SiO;②Al(OH) ;③NH HCO ;④Al O;⑤NaHSO
2 3 3 4 3 2 3 4
A.①②④ B.②③④ C.②④⑤ D.全部
4.下列有关描述及化学用语的表示方法正确的是( )
A.原子核内有8个中子的基态碳原子价电子排布图为:
B.NH F的电子式为: ,三种元素中氟的第一电离能最大
4
C.铜属于d区元素,溴属于p区元素,二者基态原子未成对电子数目相同
D.CO 分子的结构式为:O=C=O,碳的原子半径大于氧的原子半径
2
5.Se 元素是人类必须的微量元素之一。下列说法不正确的是
A.SeO 可以被氧化 B.HSe 比 HS 不稳定
2 2 2
C.Se 原子的半径比 Cl 原子大 D.是性质最接近金属的非金属
6.化学与生活密切相关,下列关于生活中的一些做法不科学的是
A.用SO 漂白纸浆和草帽
2
B.Al(OH) 用于治疗胃酸过多
3
C.用小苏打发酵面团制作馒头
D.用较浓的氢氧化钠溶液洗涤衣服上的油污7.元素X、Y、Q和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素
的原子最外层电子数之和为24。下列说法正确的是
X Y
Q Z
A.原子半径(r):r(Y)>r(Q)
B.氧化物对应的水化物酸性:Z>Q
C.形成气态氢化物的稳定性:Y>X
D.与Z同一主族的元素,最高正价均为+7
8.第二、三周期七种主族元素T、U、V、W、X、Y、Z它们的原子序数依次增大,
其中T、U、V为同一周期,T与X,V与Y分别为同一主族,U、V、W三种元素的
原子序数之和为28,W的原子序数比V多5,V的最外层电子数是W最外层电子数的
2倍,下列说法正确的是
A.简单离子半径:U>V>W>Y
B.X的单质用于制作光导纤维
C.氧化物对应的水化物的酸性:Z>Y
D.T和V形成的某种二元化合物既不能和盐酸反应又不能和氢氧化钠反应
9.几种短周期元素的原子半径及主要化合价如下表:
元素代号 X Y Z W
原子半径/pm 160 143 70 66
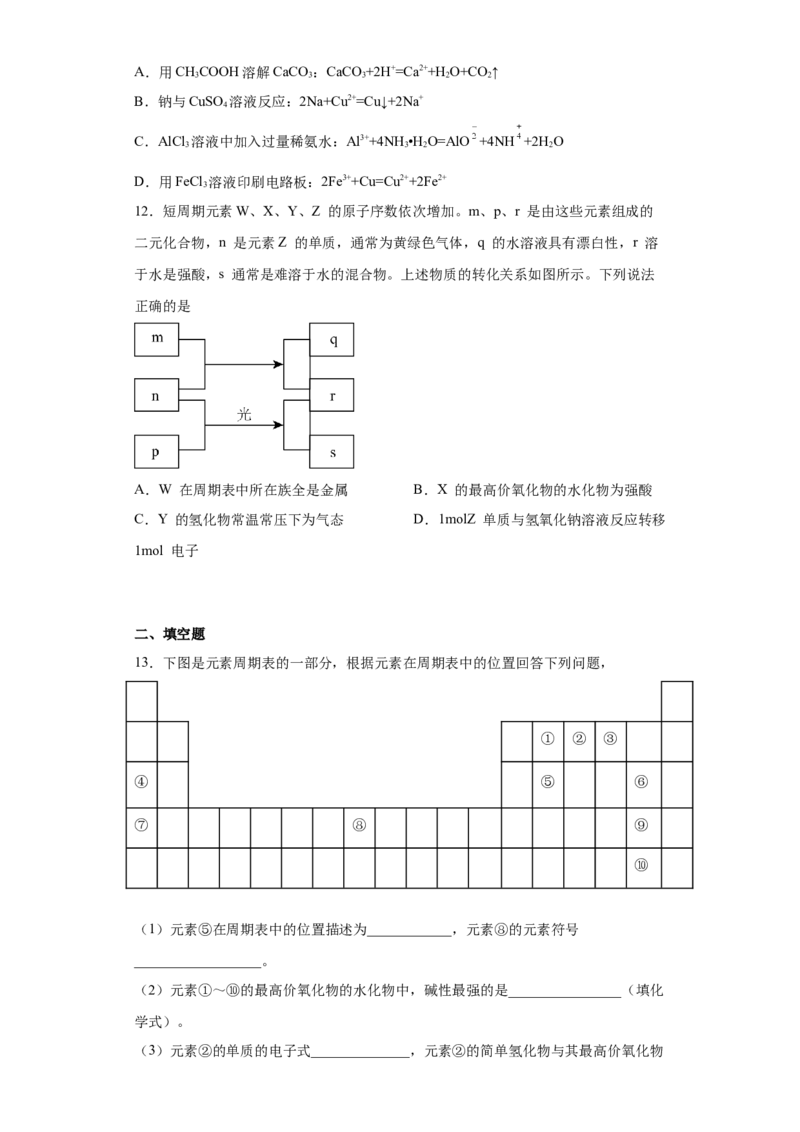
主要化合价 +2 +3 +5、+3、—3 —2
下列叙述正确的是A.X、Y元素的金属性X⑨>⑩。
14.元素周期表的第三周期元素,从左到右,原子半径逐渐___________;元素的金属
性逐渐___________;非金属性逐渐___________。
三、实验题
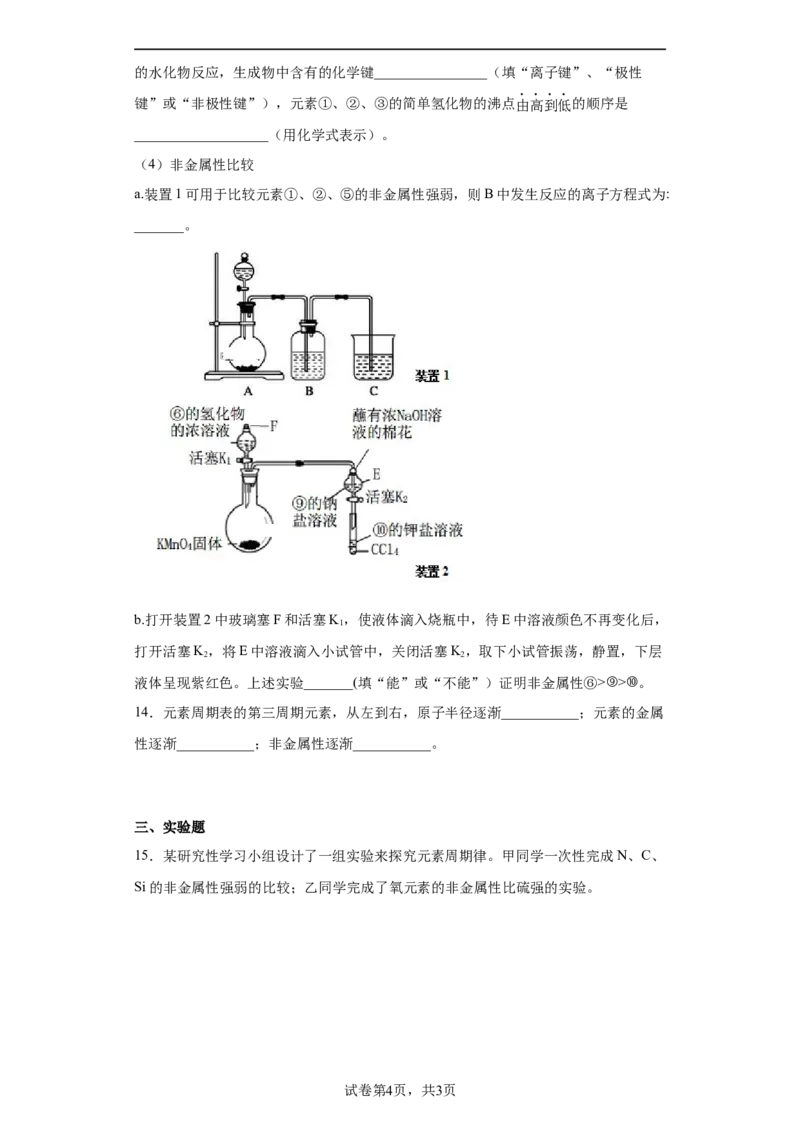
15.某研究性学习小组设计了一组实验来探究元素周期律。甲同学一次性完成N、C、
Si的非金属性强弱的比较;乙同学完成了氧元素的非金属性比硫强的实验。
试卷第4页,共3页(1)从以下所给物质中选出甲同学设计的实验所用到物质:
①稀HNO 溶液②稀盐酸③碳酸钙④NaSiO 溶液⑤SiO
3 2 3 2
试剂A为_________;试剂C为_________(填序号)。
(2)乙同学设计的实验所用到试剂A为________;装置C中反应的化学方程式为
___________________________。
(3)丙同学认为甲设计的实验方案不够严谨并做出改进,他在装置B、D之间加装了一
个盛有某溶液的洗气瓶,则该溶液的溶质为________________(填化学式)。
四、有机推断题
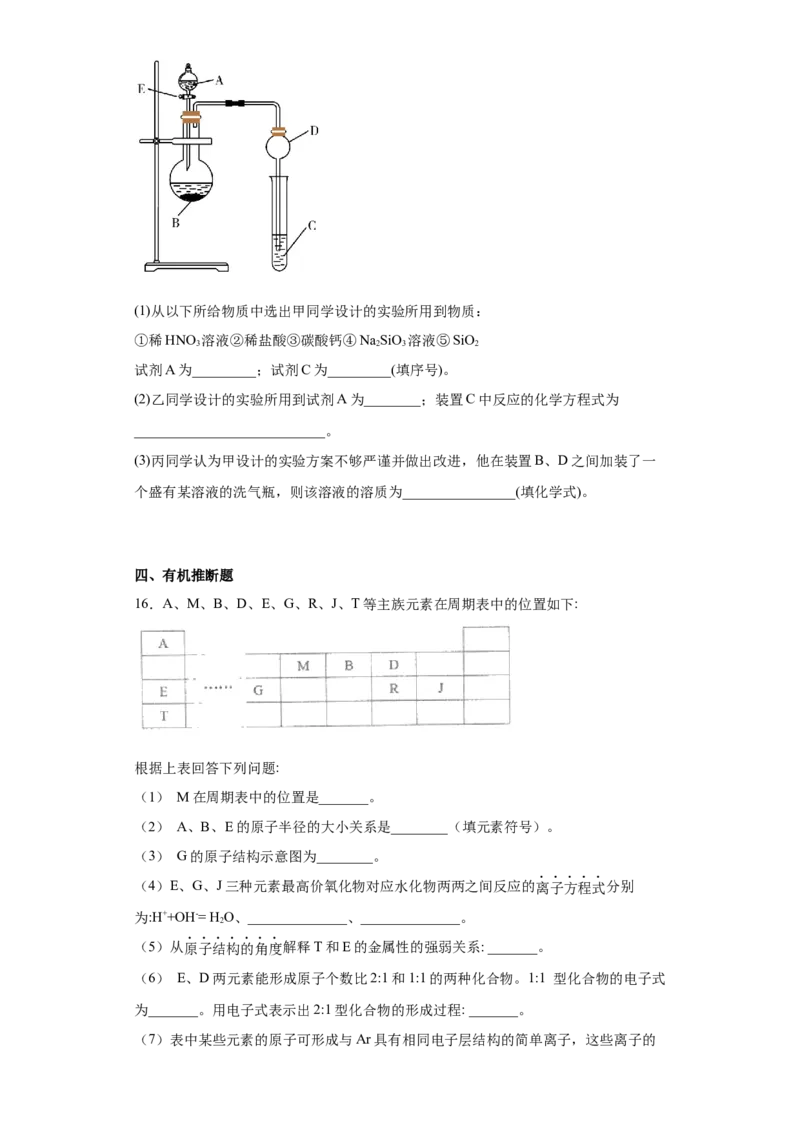
16.A、M、B、D、E、G、R、J、T等主族元素在周期表中的位置如下:
根据上表回答下列问题:
(1) M在周期表中的位置是_______。
(2) A、B、E的原子半径的大小关系是________(填元素符号)。
(3) G的原子结构示意图为________。
(4)E、G、J三种元素最高价氧化物对应水化物两两之间反应的离子方程式分别
为:H++OH-= H O、______________、______________。
2
(5)从原子结构的角度解释T和E的金属性的强弱关系: _______。
(6) E、D两元素能形成原子个数比2:1和1:1的两种化合物。1:1 型化合物的电子式
为_______。用电子式表示出2:1型化合物的形成过程: _______。
(7)表中某些元素的原子可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是________(用离子符号表示)。
(8) J非金属性强于R,下列选项中能证明这一事实的是________(填字母序号)
a 常温下J的单质溶沸点比R的单质高
b J的氢化物比R的氢化物更稳定
c 一定条件下J和R的单质都能与NaOH溶液反应
d 最高价氧化物的水化物的酸性强弱: J>R
试卷第6页,共3页参考答案:
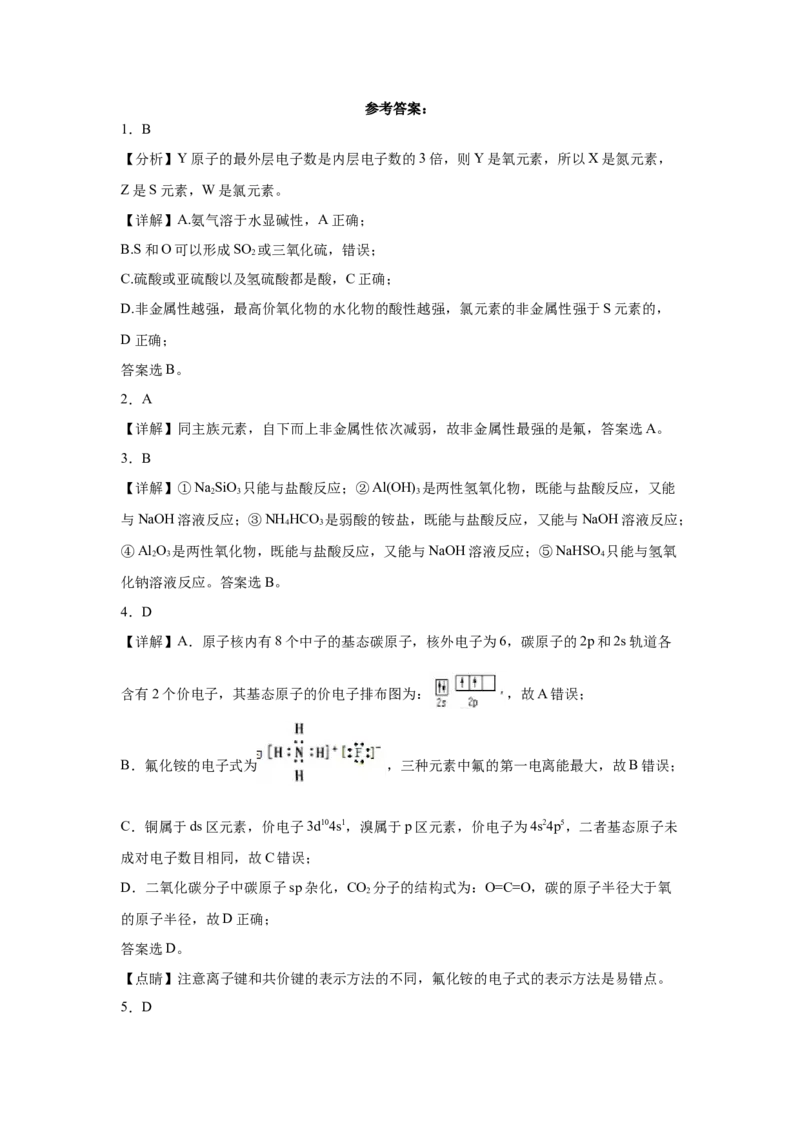
1.B
【分析】Y原子的最外层电子数是内层电子数的3倍,则Y是氧元素,所以X是氮元素,
Z是S元素,W是氯元素。
【详解】A.氨气溶于水显碱性,A正确;
B.S和O可以形成SO 或三氧化硫,错误;
2
C.硫酸或亚硫酸以及氢硫酸都是酸,C正确;
D.非金属性越强,最高价氧化物的水化物的酸性越强,氯元素的非金属性强于S元素的,
D正确;
答案选B。
2.A
【详解】同主族元素,自下而上非金属性依次减弱,故非金属性最强的是氟,答案选A。
3.B
【详解】①NaSiO 只能与盐酸反应;②Al(OH) 是两性氢氧化物,既能与盐酸反应,又能
2 3 3
与NaOH溶液反应;③NH HCO 是弱酸的铵盐,既能与盐酸反应,又能与NaOH溶液反应;
4 3
④Al O 是两性氧化物,既能与盐酸反应,又能与NaOH溶液反应;⑤NaHSO 只能与氢氧
2 3 4
化钠溶液反应。答案选B。
4.D
【详解】A.原子核内有8个中子的基态碳原子,核外电子为6,碳原子的2p和2s轨道各
含有2个价电子,其基态原子的价电子排布图为: ,故A错误;
B.氟化铵的电子式为 ,三种元素中氟的第一电离能最大,故B错误;
C.铜属于ds区元素,价电子3d104s1,溴属于p区元素,价电子为4s24p5,二者基态原子未
成对电子数目相同,故C错误;
D.二氧化碳分子中碳原子sp杂化,CO 分子的结构式为:O=C=O,碳的原子半径大于氧
2
的原子半径,故D正确;
答案选D。
【点睛】注意离子键和共价键的表示方法的不同,氟化铵的电子式的表示方法是易错点。
5.D【详解】A. Se最高价是+6,SeO 中Se化合价为+4,所以SeO 可以被氧化,故A正确;
2 2
B. Se 非金属性比S弱,所以HSe 比 HS 不稳定,故B正确;
2 2
C. 同主族元素从上到下半径依次增大,Se 原子的半径比 S原子大,同周期元素从左到右
半径减小,S原子半径大于Cl,所以Se 原子的半径比 Cl 原子大,故C正确;
D. Se并没有在金属、非金属的分界线,Se不是性质最接近金属的非金属,故D错误;
选D。
6.D
【详解】A.SO 具有漂白性,常用来漂白纸浆和草帽,故A正确;
2
B.氢氧化铝可以和盐酸发生反应,也能够消耗盐酸,同时不会产生有害物质,所以可以
治疗胃酸过多,故B正确;
C.小苏打发酵时能产生二氧化碳气体,则可用小苏打发酵面团制作馒头,故C正确;
D.氢氧化钠有腐蚀性,会腐蚀手,故D错误;
故选D。
7.C
【分析】元素X、Y、Q和Z为短周期元素,这4种元素的原子最外层电子数之和为24,
设Y的最外层子数为y,则y-1+y+y+y+1=24,y=6,则X为N,Y为O,Q为S,Z为Cl。
【详解】A. 周期表中同主族从上到下,原子半径增大,原子半径(r):r(Y)<r(Q),故A
错误;
B. 周期表中同主族从下到上,同周期从左到右,元素的非金属性增强,最高价氧化物对
应的水化物的酸性增强,最高价氧化物对应的水化物酸性:Z>Q,故B错误;
C. 周期表中同主族从下到上,同周期从左到右,元素的非金属性增强,形成气态氢化物
的稳定性增强,气态氢化物的稳定性:Y>X,故C正确;
D. 与Z同一主族的元素有F元素,但F没有最高正价,故D错误;
故选C。
8.D
【分析】T、U、V、W、X、Y、Z为原子序数依次增大的第二、三周期元素,U、V、W
三种元素的原子序数之和为28,W的原子序数比V多5,V的最外层电子数是W最外层电
子数的2倍,则V是O元素,W是Al元素,U是N元素,又T、U、V为同一周期,T与
X,V与Y分别为同一主族,则T为C元素,X为Si元素,Y为S元素,Z为Cl元素,据
此分析解答。
【详解】A.离子核外电子层数越多,半径越大,核电荷数越小,半径越大,则简单离子
答案第2页,共2页半径:S2->N3->O2->Al3+,A选项错误;
B.Si的单质常用作制造芯片和太阳能电池,其氧化物SiO 用于制作光导纤维,B选项错
2
误;
C.非金属性越强,最高价氧化物对应的水化物酸性越强,选项中描述的氧化物对应水化
物的酸性与非金属性无直接联系,无法判断,如次氯酸的酸性弱于硫酸,C选项错误;
D.C和O形成的二元化合物CO既不能和盐酸反应又不能和氢氧化钠反应,D选项正确;
答案选D。
9.D
【分析】由W的化合价只有—2价可知,W为O元素;由Z的化合价有—3、+5价,原子
半径大于氧原子且相差不大可知,Z为N元素;由X的化合价只有+2价和Y的化合价只有
+3价,X、Y原子半径相差不大,原子半径较氮元素、氧元素大很多可知,X为Mg元素、
Y为Al元素。
【详解】A.同周期元素,从左到右元素的金属性依次减弱,则镁元素的金属性强于铝元
素,故A错误;
B.氮气和氧气在放电条件下发生化合反应只能生成一氧化氮,不能生成二氧化氮,故B
错误;
C.氢氧化铝是两性氢氧化物,能溶于强酸、强碱,不能溶于弱酸、弱碱,则氢氧化铝不
溶于稀氨水,故C错误;
D.在催化剂作用下,氧气和氨气共热发生催化氧化反应生成一氧化氮和水,故D正确;
故选D。
10.B
【详解】A. IA族元素除了H元素以外都是金属元素,选项A错误;
B. 同周期从左到右原子半径依次减小,故在第三周期主族元素中Na的原子半径最大,选
项B正确;
C. 焰色反应焰色反应只是高温激发原子核内层电子至激发态,没有生成新物质,是物理变
化,选项C错误;
D. 碱金属元素的化合物焰色反应不全是黄色,钠的焰色反应为黄色,钾的焰色反应为紫色,
选项D错误;
答案选B。
11.D【详解】A.醋酸是弱酸,离子方程式中不能拆写成离子,用CHCOOH溶解CaCO :
3 3
CaCO +2CH COOH=Ca2++2CH COO- +H O+CO↑,故A错误;
3 3 3 2 2
B.钠与CuSO 溶液反应,离子方程式是2Na+2HO +Cu2+=Cu(OH) ↓+2Na++H ↑,故B错误;
4 2 2 2
C.AlCl 溶液中加入过量稀氨水生成氢氧化铝沉淀和氯化铵,离子方程式是Al3+
3
+3NH•H O=Al(OH) ↓+3NH ,故C错误;
3 2 3
D.用FeCl 溶液印刷电路板,氯化铁和铜反应生成氯化亚铁和氯化铜,离子方程式是2Fe3+
3
+Cu=Cu2++2Fe2+,故D正确;
选D。
12.D
【分析】n 是元素Z 的单质,通常为黄绿色气体,为氯气,则Z为氯元素;q 的水溶液具
有漂白性,则q为次氯酸;r 溶于水是强酸,可推知为盐酸; 由框图和对应的条件,可推
知p为甲烷,m为水,则W、X、Y、Z 分别为H、C、O、Cl。
【详解】A.氢元素在第IA族,氢为非金属元素,故A错误;
B.X的最高价氧化物的水化物碳酸,碳酸为弱酸,故B错误;
C.Y为氧元素,其气态氢化物为水、双氧水,常温常压下均为液态,故C错误;
D.氯气与氢氧化钠发生歧化反应生成氯化钠和次氯酸钠,根据化合价变化可知,1mol氯气
参加反应转移 1mol电子,故D正确;
综上所述,答案为D。
13. 第三周期第ⅣA族 KOH Fe 离子键、极
性键 HO>NH >CH H++HCO-=CO ↑+H O 不能
2 3 4 3 2 2
【分析】根据元素在周期表中的相对位置,元素①~⑩分别是C、N、O、Na、Si、Cl、K
Fe、Br、I,据此分析可得结论。
【详解】(1)元素⑤为硅元素,在周期表中的位置第三周期第ⅣA族;元素⑧为铁元素,符
号为Fe;(2) 元素①~⑩的最高价氧化物的水化物中,碱性最强的是氢氧化钾,化学式为
KOH;(3) 元素②的单质为氮气,其电子式为 ,元素②的简单氢化物与其最高价
氧化物的水化物反应的生成物为NH NO ,其中含有的化学键有离子键、极性键,元素①、
4 3
②、③的简单氢化物中由于水分子、氨分子间存在氢键,沸点较高,其沸点由高到低的排
列为HO>NH >CH ;(4)a.由装置1的实验目的为比较元素①、②、⑤的非金属性强弱,
2 3 4
答案第4页,共2页可设计实验来体现酸性HNO>H CO>H SiO,则B中发生反应的离子方程式为: H++HCO-
3 2 3 2 3 3
=CO ↑+H O;b.因为在反应中氯气可能过量,所以该实验能证明非金属性Cl大于I,Cl大
2 2
于Br,但不能够证明Br大于I,故答案为不能。
【点睛】本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元
素推断知识和灵活运用知识的能力,也有利于培养学生规范严谨的实验设计能力。
14. 减小 减弱 增强
【详解】元素周期表的第三周期元素,电子层数相同,从左到右,质子数增多,原子核对
电子吸引力增大,原子半径逐渐减小;从左到右,最外层电子数增多,元素的金属性逐渐
减弱,非金属性逐渐增强。
15. ① ④ HO O+2H S=2S↓+2H O NaHCO
2 2 2 2 2 3
【分析】探究元素非金属性,由图可知应是利用最高价含氧酸的酸性强弱比较,烧瓶中是
碳酸钠与硝酸反应生成二氧化碳,C中是二氧化碳与硅酸钠反应;完成O元素的非金属性
比S强的实验研究,通过比较单质的氧化性来判断非金属性,所以用二氧化锰作催化剂使
双氧水分解生成氧气,氧气通过氢硫酸或硫化钠溶液会生成硫单质。硝酸具有挥发性,用
NaHCO 除去,以防止其与硅酸钠反应。
3
【详解】(1)探究元素非金属性,由图可知应是利用最高价含氧酸的酸性强弱比较,所以A
中试剂为稀硝酸,B中为碳酸钙,C中为NaSiO 溶液;试剂A为①;试剂C为④,故答案
2 3
为:①;④;
(2)完成O元素的非金属性比S强的实验研究,通过比较单质的氧化性来判断非金属性,所
以用二氧化锰作催化剂使双氧水分解生成氧气,氧气通过氢硫酸或硫化钠溶液会生成硫单
质;乙同学设计的实验所用到试剂A为HO;装置C中反应的化学方程式为
2 2
O+2H S=2S↓+2H O。故答案为:HO;O+2H S=2S↓+2H O;
2 2 2 2 2 2 2 2
(3)硝酸具有挥发性,丙同学在装置B、D之间加装了一个盛有某溶液的洗气瓶,则该溶液
的溶质为NaHCO ,可除去挥发的硝酸,同时又不与二氧化碳反应,故答案为:NaHCO 。
3 3
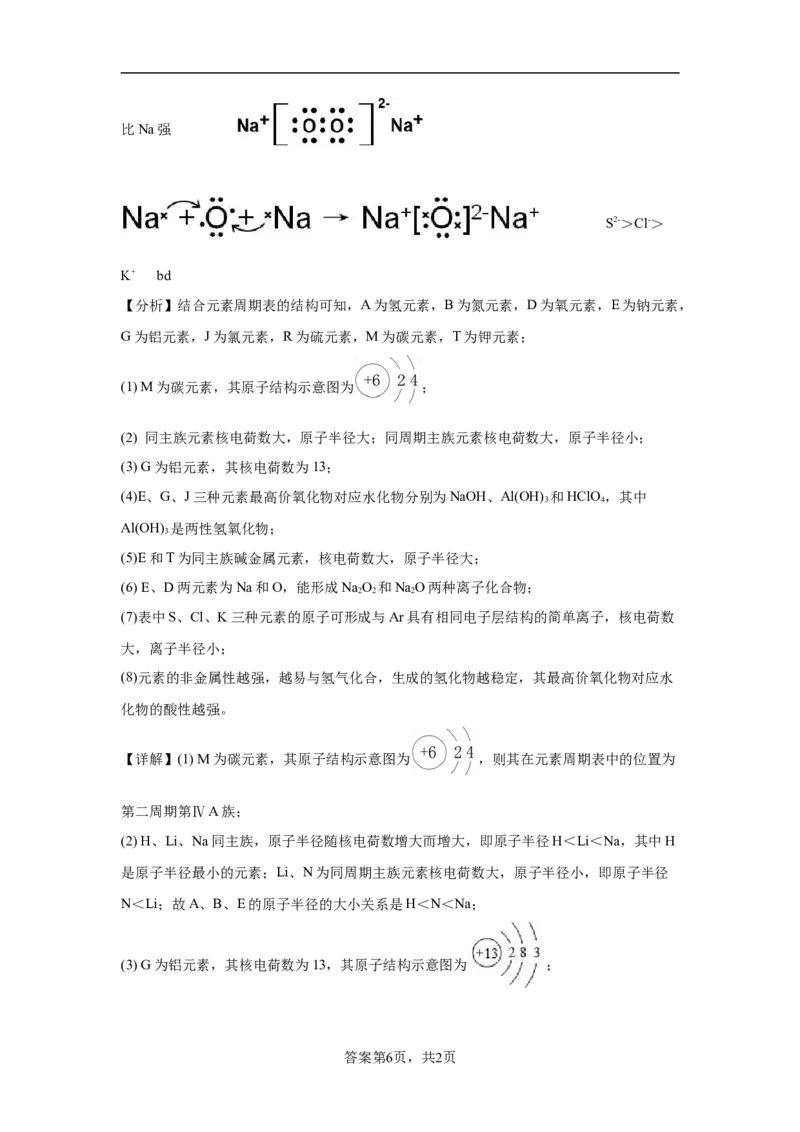
16. 第二周期第ⅣA族 H<N<Na Al(OH) +OH-=2
3
HO+AlO- 3H++Al(OH) =3 H O+Al3+ Na和K属于同主族,电子层数:K>Na,原子半
2 2 3 2
径:K>Na,原子核对外层电子的吸引力:K<Na,失电子能力:K>Na,故K的金属性比Na强
S2->Cl->
K+ bd
【分析】结合元素周期表的结构可知,A为氢元素,B为氮元素,D为氧元素,E为钠元素,
G为铝元素,J为氯元素,R为硫元素,M为碳元素,T为钾元素;
(1) M为碳元素,其原子结构示意图为 ;
(2) 同主族元素核电荷数大,原子半径大;同周期主族元素核电荷数大,原子半径小;
(3) G为铝元素,其核电荷数为13;
(4)E、G、J三种元素最高价氧化物对应水化物分别为NaOH、Al(OH) 和HClO,其中
3 4
Al(OH) 是两性氢氧化物;
3
(5)E和T为同主族碱金属元素,核电荷数大,原子半径大;
(6) E、D两元素为Na和O,能形成NaO 和NaO两种离子化合物;
2 2 2
(7)表中S、Cl、K三种元素的原子可形成与Ar具有相同电子层结构的简单离子,核电荷数
大,离子半径小;
(8)元素的非金属性越强,越易与氢气化合,生成的氢化物越稳定,其最高价氧化物对应水
化物的酸性越强。
【详解】(1) M为碳元素,其原子结构示意图为 ,则其在元素周期表中的位置为
第二周期第ⅣA族;
(2) H、Li、Na同主族,原子半径随核电荷数增大而增大,即原子半径H<Li<Na,其中H
是原子半径最小的元素;Li、N为同周期主族元素核电荷数大,原子半径小,即原子半径
N<Li;故A、B、E的原子半径的大小关系是H<N<Na;
(3) G为铝元素,其核电荷数为13,其原子结构示意图为 ;
答案第6页,共2页(4)E、G、J三种元素最高价氧化物对应水化物分别为NaOH、Al(OH) 和HClO,其中
3 4
Al(OH) 是两性氢氧化物、NaOH是强碱、HClO 是强酸,两两之间反应的离子方程式分别
3 4
为H++OH-= H O、Al(OH) +OH-=2H O+AlO-、3H++Al(OH) =3 H O+Al3+;
2 3 2 2 3 2
(5)Na和K为同主族碱金属元素,电子层数:K>Na,核电荷数大,原子半径:K>Na,原
子核对外层电子的吸引力Na>K,失电子能力:K>Na,故K的金属性比Na强;
(6) E、D两元素为Na和O,能形成NaO 和NaO两种离子化合物,其中1:1型的NaO 的
2 2 2 2 2
电子式为 ,2:1型的NaO的电子式形成过程为
2
;
(7)S2-、Cl-、K+的离子结构与Ar具有相同电子层结构,核电荷数大,离子半径小,则离子
半径的大小关系是S2->Cl->K+;
(8)元素的非金属性越强,越易与氢气化合,生成的氢化物越稳定,其最高价氧化物对应水
化物的酸性越强;
a.常温下J的单质熔沸点比R的单质高,与元素的非金属性强弱无必然联系,故a错误;
b.J的氢化物比R的氢化物更稳定,说明J的非金属性比R强,故b正确;
c.非金属元素的单质与NaOH溶液反应,无法比较J和R的非金属性强弱,故c错误;
d.最高价氧化物的水化物的酸性强弱J>R,说明J的非金属性比R强,故d正确;
故答案为bd。
【点睛】元素非金属性强弱的判断依据:①非金属单质跟氢气化合的难易程度(或生成的氢
化物的稳定性),非金属单质跟氢气化合越容易(或生成的氢化物越稳定),元素的非金属性
越强,反之越弱;②最高价氧化物对应的水化物(即最高价含氧酸)的酸性强弱.最高价含
氧酸的酸性越强,对应的非金属元素的非金属性越强,反之越弱;③氧化性越强的非金属
元素单质,对应的非金属元素的非金属性越强,反之越弱。答案第8页,共2页