文档内容
第四章 第一节 第2课时 化学电源 测试题
榆次一中 李金虎
一、选择题(本题共有15小题,每小题4分,共60分,每小题只有一个正确选项)
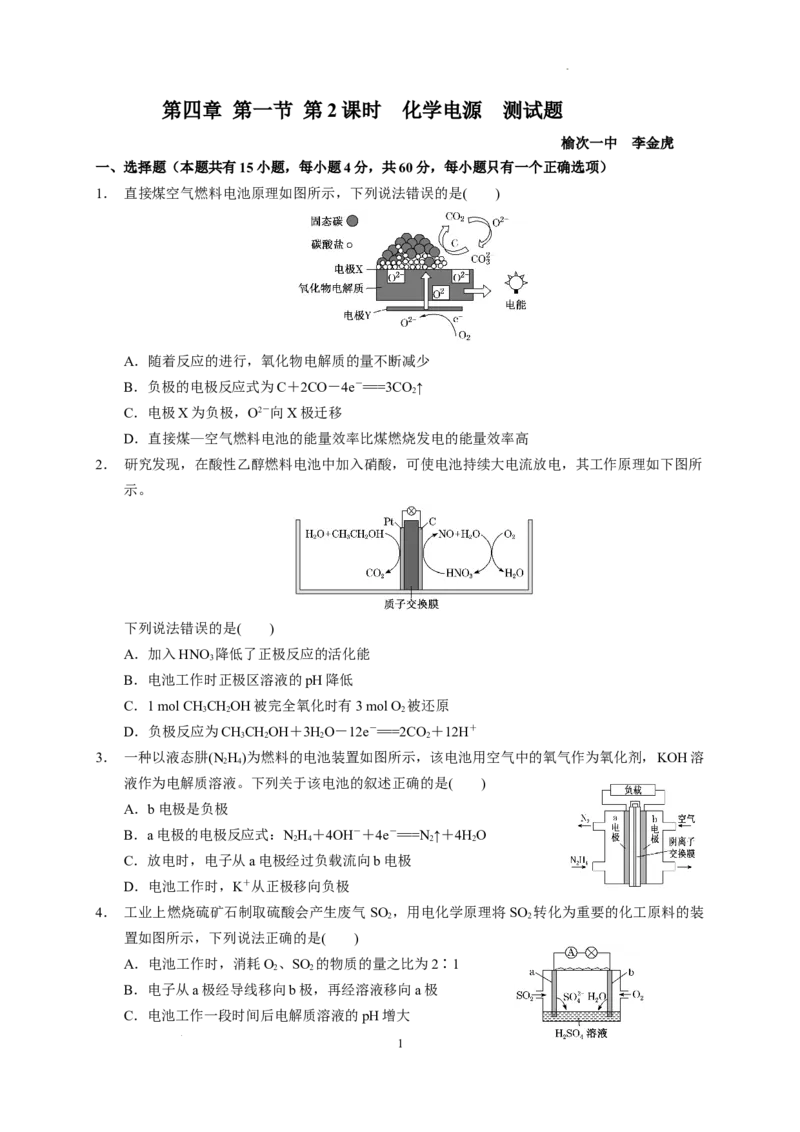
1. 直接煤空气燃料电池原理如图所示,下列说法错误的是( )
A.随着反应的进行,氧化物电解质的量不断减少
B.负极的电极反应式为C+2CO-4e-===3CO ↑
2
C.电极X为负极,O2-向X极迁移
D.直接煤—空气燃料电池的能量效率比煤燃烧发电的能量效率高
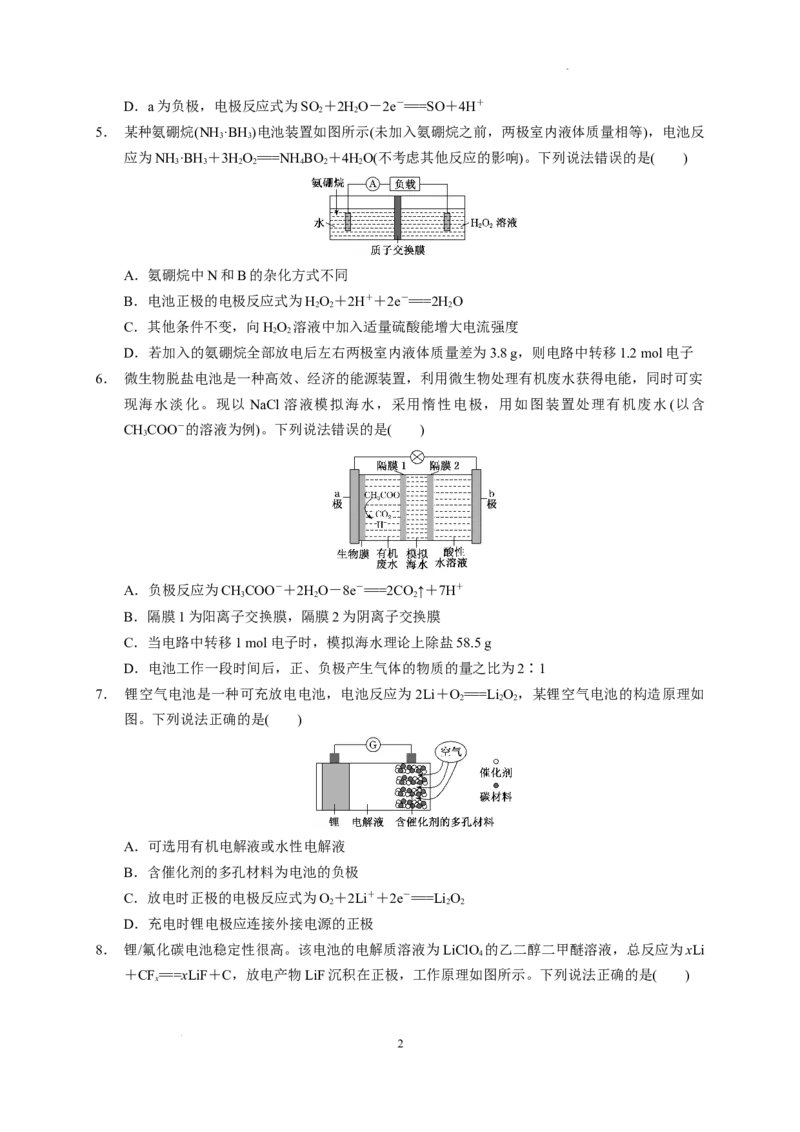
2. 研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如下图所
示。
下列说法错误的是( )
A.加入HNO 降低了正极反应的活化能
3
B.电池工作时正极区溶液的pH降低
C.1 mol CH CHOH被完全氧化时有3 mol O 被还原
3 2 2
D.负极反应为CHCHOH+3HO-12e-===2CO +12H+
3 2 2 2
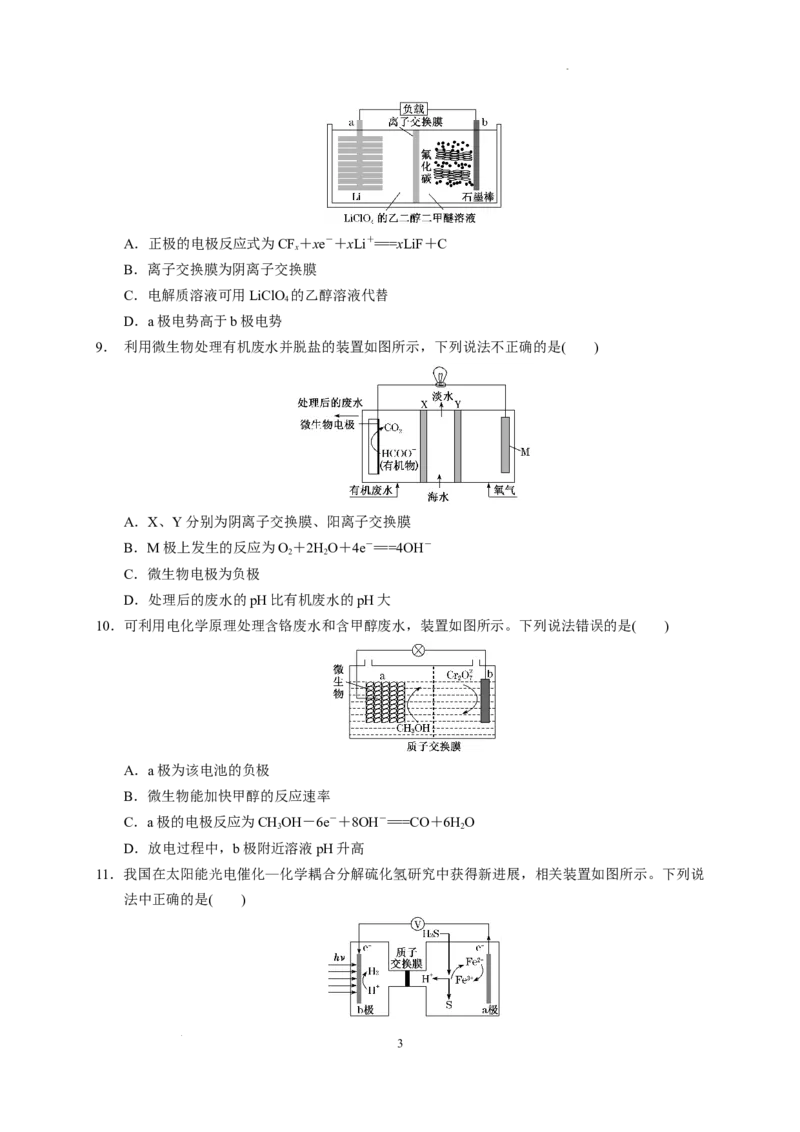
3. 一种以液态肼(N H)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶
2 4
液作为电解质溶液。下列关于该电池的叙述正确的是( )
A.b电极是负极
B.a电极的电极反应式:NH+4OH-+4e-===N ↑+4HO
2 4 2 2
C.放电时,电子从a电极经过负载流向b电极
D.电池工作时,K+从正极移向负极
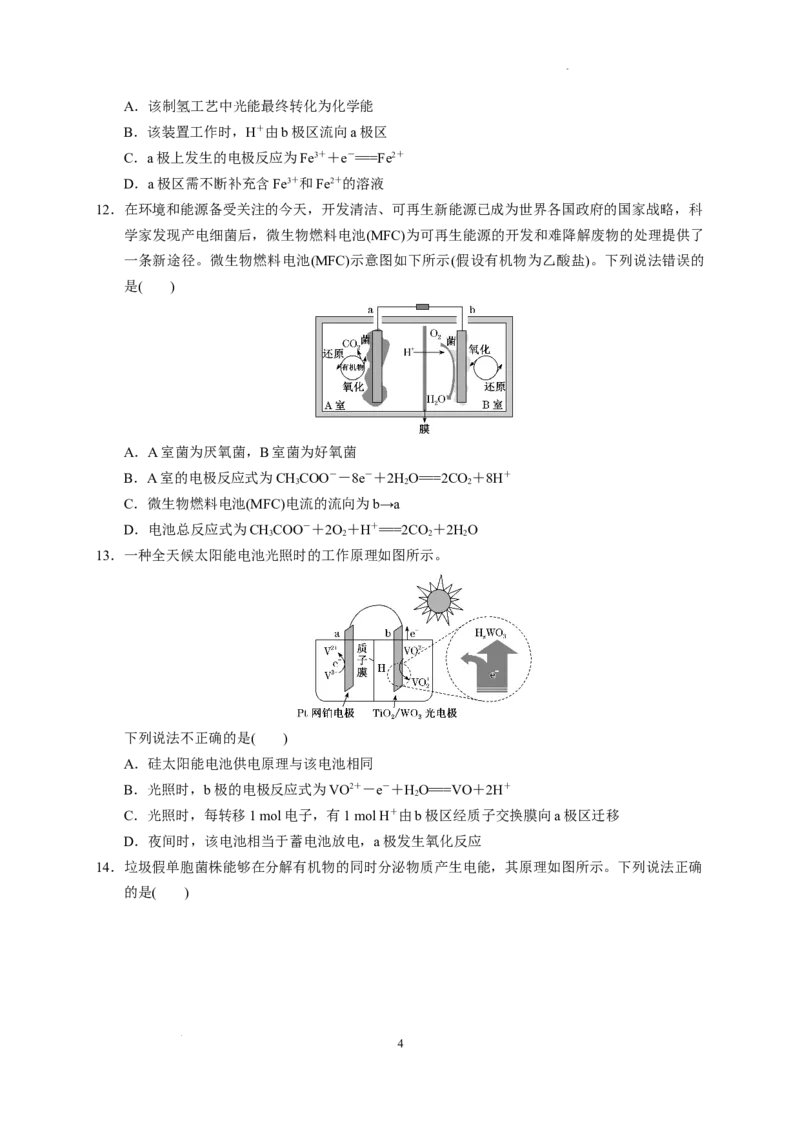
4. 工业上燃烧硫矿石制取硫酸会产生废气SO ,用电化学原理将SO 转化为重要的化工原料的装
2 2
置如图所示,下列说法正确的是( )
A.电池工作时,消耗O、SO 的物质的量之比为2∶1
2 2
B.电子从a极经导线移向b极,再经溶液移向a极
C.电池工作一段时间后电解质溶液的pH增大
1
学科网(北京)股份有限公司D.a为负极,电极反应式为SO +2HO-2e-===SO+4H+
2 2
5. 某种氨硼烷(NH ·BH)电池装置如图所示(未加入氨硼烷之前,两极室内液体质量相等),电池反
3 3
应为NH ·BH+3HO===NHBO+4HO(不考虑其他反应的影响)。下列说法错误的是( )
3 3 2 2 4 2 2
A.氨硼烷中N和B的杂化方式不同
B.电池正极的电极反应式为HO+2H++2e-===2H O
2 2 2
C.其他条件不变,向HO 溶液中加入适量硫酸能增大电流强度
2 2
D.若加入的氨硼烷全部放电后左右两极室内液体质量差为3.8 g,则电路中转移1.2 mol电子
6. 微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实
现海水淡化。现以 NaCl 溶液模拟海水,采用惰性电极,用如图装置处理有机废水(以含
CHCOO-的溶液为例)。下列说法错误的是( )
3
A.负极反应为CHCOO-+2HO-8e-===2CO ↑+7H+
3 2 2
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1
7. 锂空气电池是一种可充放电电池,电池反应为2Li+O===Li O ,某锂空气电池的构造原理如
2 2 2
图。下列说法正确的是( )
A.可选用有机电解液或水性电解液
B.含催化剂的多孔材料为电池的负极
C.放电时正极的电极反应式为O+2Li++2e-===Li O
2 2 2
D.充电时锂电极应连接外接电源的正极
8. 锂/氟化碳电池稳定性很高。该电池的电解质溶液为LiClO 的乙二醇二甲醚溶液,总反应为xLi
4
+CF===xLiF+C,放电产物LiF沉积在正极,工作原理如图所示。下列说法正确的是( )
x
2
学科网(北京)股份有限公司A.正极的电极反应式为CF+xe-+xLi+===xLiF+C
x
B.离子交换膜为阴离子交换膜
C.电解质溶液可用LiClO 的乙醇溶液代替
4
D.a极电势高于b极电势
9. 利用微生物处理有机废水并脱盐的装置如图所示,下列说法不正确的是( )
A.X、Y分别为阴离子交换膜、阳离子交换膜
B.M极上发生的反应为O+2HO+4e-===4OH-
2 2
C.微生物电极为负极
D.处理后的废水的pH比有机废水的pH大
10.可利用电化学原理处理含铬废水和含甲醇废水,装置如图所示。下列说法错误的是( )
A.a极为该电池的负极
B.微生物能加快甲醇的反应速率
C.a极的电极反应为CHOH-6e-+8OH-===CO+6HO
3 2
D.放电过程中,b极附近溶液pH升高
11.我国在太阳能光电催化—化学耦合分解硫化氢研究中获得新进展,相关装置如图所示。下列说
法中正确的是( )
3
学科网(北京)股份有限公司A.该制氢工艺中光能最终转化为化学能
B.该装置工作时,H+由b极区流向a极区
C.a极上发生的电极反应为Fe3++e-===Fe2+
D.a极区需不断补充含Fe3+和Fe2+的溶液
12.在环境和能源备受关注的今天,开发清洁、可再生新能源已成为世界各国政府的国家战略,科
学家发现产电细菌后,微生物燃料电池(MFC)为可再生能源的开发和难降解废物的处理提供了
一条新途径。微生物燃料电池(MFC)示意图如下所示(假设有机物为乙酸盐)。下列说法错误的
是( )
A.A室菌为厌氧菌,B室菌为好氧菌
B.A室的电极反应式为CHCOO--8e-+2HO===2CO +8H+
3 2 2
C.微生物燃料电池(MFC)电流的流向为b→a
D.电池总反应式为CHCOO-+2O+H+===2CO +2HO
3 2 2 2
13.一种全天候太阳能电池光照时的工作原理如图所示。
下列说法不正确的是( )
A.硅太阳能电池供电原理与该电池相同
B.光照时,b极的电极反应式为VO2+-e-+HO===VO+2H+
2
C.光照时,每转移1 mol电子,有1 mol H+由b极区经质子交换膜向a极区迁移
D.夜间时,该电池相当于蓄电池放电,a极发生氧化反应
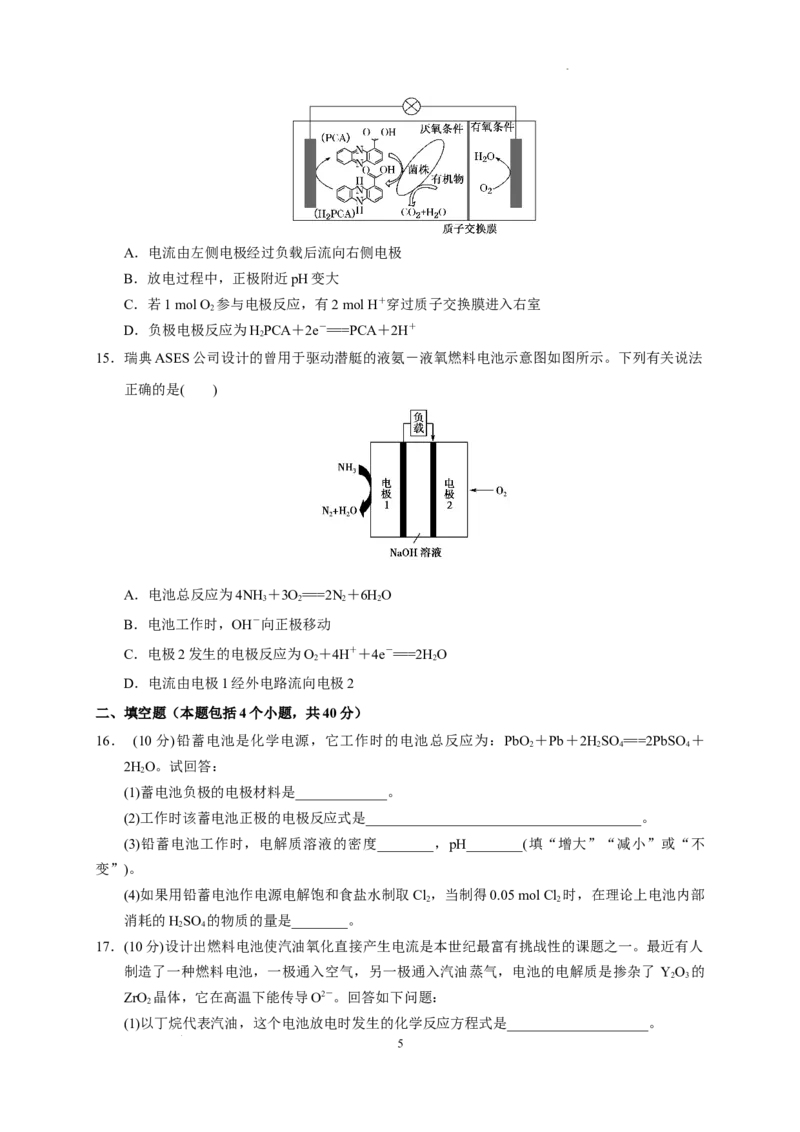
14.垃圾假单胞菌株能够在分解有机物的同时分泌物质产生电能,其原理如图所示。下列说法正确
的是( )
4
学科网(北京)股份有限公司A.电流由左侧电极经过负载后流向右侧电极
B.放电过程中,正极附近pH变大
C.若1 mol O 参与电极反应,有2 mol H+穿过质子交换膜进入右室
2
D.负极电极反应为HPCA+2e-===PCA+2H+
2
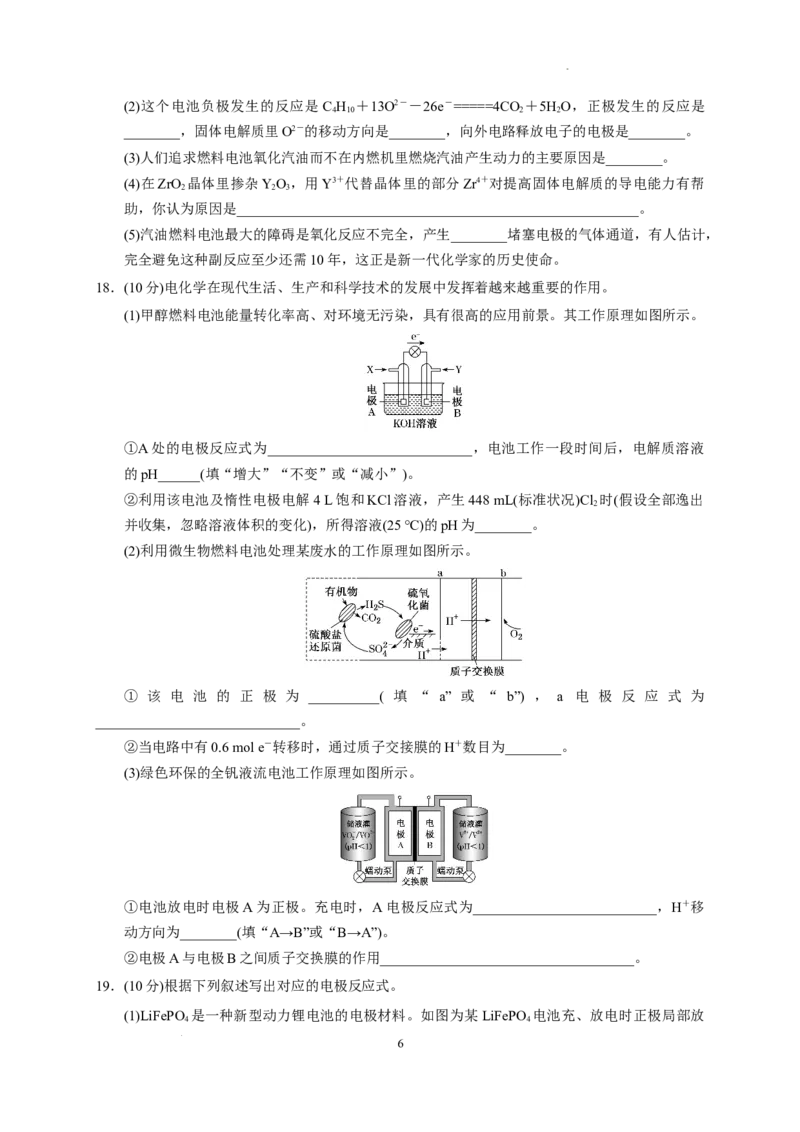
15.瑞典ASES公司设计的曾用于驱动潜艇的液氨-液氧燃料电池示意图如图所示。下列有关说法
正确的是( )
A.电池总反应为4NH +3O===2N +6HO
3 2 2 2
B.电池工作时,OH-向正极移动
C.电极2发生的电极反应为O+4H++4e-===2H O
2 2
D.电流由电极1经外电路流向电极2
二、填空题(本题包括4个小题,共40分)
16. (10分)铅蓄电池是化学电源,它工作时的电池总反应为:PbO +Pb+2HSO ===2PbSO +
2 2 4 4
2HO。试回答:
2
(1)蓄电池负极的电极材料是_____________。
(2)工作时该蓄电池正极的电极反应式是_______________________________________。
(3)铅蓄电池工作时,电解质溶液的密度________,pH________(填“增大”“减小”或“不
变”)。
(4)如果用铅蓄电池作电源电解饱和食盐水制取Cl ,当制得0.05 mol Cl 时,在理论上电池内部
2 2
消耗的HSO 的物质的量是________。
2 4
17.(10分)设计出燃料电池使汽油氧化直接产生电流是本世纪最富有挑战性的课题之一。最近有人
制造了一种燃料电池,一极通入空气,另一极通入汽油蒸气,电池的电解质是掺杂了 YO 的
2 3
ZrO 晶体,它在高温下能传导O2-。回答如下问题:
2
(1)以丁烷代表汽油,这个电池放电时发生的化学反应方程式是____________________。
5
学科网(北京)股份有限公司(2)这个电池负极发生的反应是C H +13O2--26e-=====4CO +5HO,正极发生的反应是
4 10 2 2
________,固体电解质里O2-的移动方向是________,向外电路释放电子的电极是________。
(3)人们追求燃料电池氧化汽油而不在内燃机里燃烧汽油产生动力的主要原因是________。
(4)在ZrO 晶体里掺杂YO ,用Y3+代替晶体里的部分Zr4+对提高固体电解质的导电能力有帮
2 2 3
助,你认为原因是_________________________________________________________。
(5)汽油燃料电池最大的障碍是氧化反应不完全,产生________堵塞电极的气体通道,有人估计,
完全避免这种副反应至少还需10年,这正是新一代化学家的历史使命。
18.(10分)电化学在现代生活、生产和科学技术的发展中发挥着越来越重要的作用。
(1)甲醇燃料电池能量转化率高、对环境无污染,具有很高的应用前景。其工作原理如图所示。
①A处的电极反应式为_____________________________,电池工作一段时间后,电解质溶液
的pH______(填“增大”“不变”或“减小”)。
②利用该电池及惰性电极电解4 L饱和KCl溶液,产生448 mL(标准状况)Cl 时(假设全部逸出
2
并收集,忽略溶液体积的变化),所得溶液(25 ℃)的pH为________。
(2)利用微生物燃料电池处理某废水的工作原理如图所示。
① 该 电 池 的 正 极 为 __________( 填 “ a” 或 “ b”) , a 电 极 反 应 式 为
_____________________________。
②当电路中有0.6 mol e-转移时,通过质子交接膜的H+数目为________。
(3)绿色环保的全钒液流电池工作原理如图所示。
①电池放电时电极A为正极。充电时,A电极反应式为__________________________,H+移
动方向为________(填“A→B”或“B→A”)。
②电极A与电极B之间质子交换膜的作用____________________________________。
19.(10分)根据下列叙述写出对应的电极反应式。
(1)LiFePO 是一种新型动力锂电池的电极材料。如图为某LiFePO 电池充、放电时正极局部放
4 4
6
学科网(北京)股份有限公司大示意图,则电池放电时正极反应式为 。
(2)以NO 、O 、熔融NaNO 组成的燃料电池装置如图,在使用过程中石墨Ⅰ电极反应生成一
2 2 3
种氧化物Y,则该电极反应式为_____________________________________________。
(3)AlAg O 电池可用作水下动力电源,其原理如图所示。该电池的负极反应式为
2 2
_________________________________________________________。
1.答案:A
解析:该燃料电池,Y 为正极,反应为 O +4e-===2O2-;X 是负极,反应为 C+2CO-4e-
2
===3CO ↑,CO +O2-===CO。A项,由题图可知,电极X反应消耗O2-,电极Y上O 得电子生成
2 2 2
O2-不断补充,氧化物电解质的量不会减少,错误;B项,由原理图分析可知,其负极反应式为C
+2CO-4e-===3CO ↑,正确;C项,X为负极,原电池内部的阴离子向负极移动,正确;D项,
2
该燃料电池是把化学能直接转化为电能,而煤燃烧发电是把化学能转化为热能,再转化为电能,正
确。
2.答案:B
解析:由分析知,HNO 在正极起催化作用,作催化剂,则加入 HNO 降低了正极反应的活化能,
3 3
故A正确;电池工作时正极区的总反应为O +4e-+4H+===2H O,则溶液中氢离子浓度减小,pH
2 2
增大,故B错误;根据得失电子守恒可知,1 mol CH CHOH被完全氧化时,转移12 mol电子,则
3 2
有3 mol O 被还原,故C正确;由分析知,负极反应为CHCHOH+3HO-12e-===2CO +12H
2 3 2 2 2
+,故D正确。
7
学科网(北京)股份有限公司3.答案:C
解析:燃料为NH ,a为负极,失电子氧化反应,电子从负极流出,流向正极,溶液中K+移向正
2 4
极。
4.答案:D
解析:SO 在a电极被氧化生成 SO,O 在b电极反应生成 HO,电池总反应式为 2SO +O +
2 2 2 2 2
2HO===2H SO ,则消耗O 、SO 的物质的量之比为1∶2,A错误;结合电极反应可知,a电极是
2 2 4 2 2
负极,b电极是正极,则电子从a极经导线移向b极,但不能进入电解质溶液,B错误;电池工作
过程中反应消耗HO,生成HSO ,溶液的酸性增强,pH减小,C错误;a电极是负极,SO 被氧
2 2 4 2
化生成SO,电极反应式为SO +2HO-2e-===SO+4H+,D正确。
2 2
5.答案:A
解析:NH ·BH 中N与B间共用1对电子形成配位键,使得N、B周围均有4对电子,则氨硼烷中
3 3
的N、B均为sp3杂化,A项错误;电池正极为氧化剂得电子的反应,即HO 得电子转化为HO的
2 2 2
反应,B项正确;向HO 溶液中加入适量硫酸,可增大离子浓度,增大电流强度,C项正确;负极
2 2
反应:NH ·BH +2HO-6e-===NHBO +6H+,若左极室加入1 mol氨硼烷(31 g),则电极产物
3 3 2 4 2
NH BO 留在左极室,H+穿过质子交换膜进入右极室,故左极室增加的质量为31 g-6 g=25 g,右
4 2
极室增加的是6 mol H+,其质量为6 g,则左右两极室液体质量差为25 g-6 g=19 g,此时转移6
mol电子,若左右两极室液体质量差为3.8 g,则转移1.2 mol电子,D项正确。
6.答案:B
解析:根据题意可知,A项正确;该电池工作时,Cl-向a极移动,Na+向b极移动,即隔膜1为阴
离子交换膜,隔膜2为阳离子交换膜,B项错误;电路中转移1 mol电子时,向a极和b极分别移
动1 mol Cl-和1 mol Na+,则模拟海水理论上可除盐 58.5 g,C项正确;电池工作时负极产生
CO ,正极产生H ,结合正、负极的电极反应知,一段时间后,正极和负极产生气体的物质的量之
2 2
比为2∶1,D项正确。
7.答案:C
解析:在锂空气电池中,锂失电子作负极,反应式为Li-e-===Li+,以空气中的氧气作为正极反应
物,氧气得电子生成LiO ,正极反应为O +2Li++2e-===Li O ,总反应为2Li+O===Li O 。选
2 2 2 2 2 2 2 2
项A,可选用有机电解液,水性电解液会与Li直接反应,错误;选项B,含催化剂的多孔材料为电
池的正极,错误;选项C,放电时正极的电极反应式为O +2Li++2e-===Li O ,正确;选项D,
2 2 2
充电时锂电极应连接外接电源的负极,电极反应式为Li++e-===Li,错误。
8.答案:A
解析:根据总反应可知,Li为负极,石墨棒为正极,正极上CF 转化为C,电极反应式为CF+xe-
x x
+xLi+===xLiF+C,A项正确;根据正极的电极反应式可知,负极区的 Li+通过离子交换膜进入正
极区,则离子交换膜为阳离子交换膜,B项错误;Li能与乙醇发生反应,因此电解质溶液不能用
LiClO 的乙醇溶液代替,C项错误;b极为正极,a极为负极,故b极电势高于a极电势,D项错误。
4
9.答案:D
解析:HCOO-在微生物电极上发生氧化反应生成CO ,微生物电极为原电池的负极,原电池中阳
2
离子向正极移动,阴离子向负极移动,要达到脱盐的目的,Cl-向负极(微生物电极)移动,Na+向正
8
学科网(北京)股份有限公司极(M极)移动,所以X为阴离子交换膜,Y为阳离子交换膜,A、C正确;M极上发生的反应为O
2
+2HO+4e-===4OH-,B正确;负极区反应后氢离子浓度增大,pH变小,D不正确。
2
10.答案:C
解析:a极为该电池的负极,A项正确;在微生物作用下,甲醇的反应速率加快,B项正确;a极发
生氧化反应,其电极反应式为CHOH-6e-+HO===CO ↑+6H+,C项错误;放电过程中,正极反
3 2 2
应消耗H+,则b极附近溶液pH升高,D项正确。
11.答案:A
解析:该制氢工艺中光能转化为电能,最终转化为化学能,A项正确;该装置工作时,H+由a极区
流向b极区,B项错误;a极上发生氧化反应,失电子,所以a极上发生的电极反应为Fe2+-e-
===Fe3+,C项错误;由题图可知a极区Fe2+和Fe3+可相互转化,故不需补充含Fe3+和Fe2+的溶液,
D项错误。
12.答案:B
解析:根据装置图可知B室中氧气参与反应,应为好氧菌,选项A正确;方程式中电荷和氢原子不
守恒,选项B错误;MFC电池中氢离子向得电子的正极移动,即向b极移动,b为正极,电流方向
是由正极流向负极,即b→a,选项C正确;电池的总反应是醋酸根离子在酸性条件下被氧化成
CO、HO,即CHCOO-+2O+H+===2CO +2HO,选项D正确。
2 2 3 2 2 2
13.答案:A
解析:硅太阳能电池是用半导体原理将光能转化为电能,是物理变化,而该电池是化学能转化为电
能,两者原理不同,故A错误。
14.答案:B
解析:右侧氧气得电子产生水,作为正极,故电流由右侧正极经过负载后流向左侧负极,选项A错
误;放电过程中,正极氧气得电子与氢离子结合产生水,氢离子浓度减小,pH变大,选项B正确;
若1 mol O 参与电极反应,有4 mol H+穿过质子交换膜进入右室,生成2 mol水,选项C错误;原
2
电池负极失电子,选项D错误。
15.答案:A
解析:由题图可知,NH 在电极1上发生氧化反应生成N 和HO,则电极1是负极,电极反应式为
3 2 2
2NH +6OH--6e-===N +6HO;O 通入电极2,则电极2是正极,发生还原反应,电解质溶液是
3 2 2 2
NaOH溶液,故正极反应式为O +2HO+4e-===4OH-;根据正、负极反应式,结合得失电子守恒
2 2
可得电池总反应为4NH +3O===2N +6HO,A正确。电池工作时,阴离子向负极移动,则OH-
3 2 2 2
向负极移动,B错误。由上述分析可知,C错误。电流由正极经外电路流向负极,则电流由电极 2
经外电路流向电极1,D错误。
16.答案:(1)Pb (2)PbO +4H++SO+2e-===PbSO+2HO (3)减小 增大 (4)0.10 mol
2 4 2
解析:(1)由电池总反应可知,Pb 发生氧化反应,所以 Pb 是负极。(2)正极上的反应是
PbO →PbSO ,则必然有HSO 参加:PbO +4H++SO+2e-===PbSO +2HO(负极反应为Pb-2e-
2 4 2 4 2 4 2
+SO===PbSO ,将正、负极反应合并,与题给总反应相符)。(3)在蓄电池的工作过程中,Pb被氧
4
9
学科网(北京)股份有限公司化,HSO 被消耗,所以溶液的密度减小,pH增大。(4)用铅蓄电池作电源,电解饱和食盐水制
2 4
0.05 mol Cl ,需提供0.10 mol e-(2Cl--2e-===Cl↑),每消耗2 mol H SO 时转移2 mol e-,故至少
2 2 2 4
消耗0.10 mol HSO 。
2 4
17.答案:(1)2C H +13O=====8CO+10HO
4 10 2 2 2
(2)O +4e-=====2O2- 向负极移动 负极
2
(3)燃料电池具有较高的能量利用率
(4)为维持电荷平衡,晶体中的O2-将减少,从而使O2-得以在电场作用下向负极移动
(5)碳粒
18.答案:(1)①CHOH+8OH--6e-===CO+6HO 减小 ②12
3 2
(2)①b HS+4HO-8e-===SO+10H+ ②0.6N 或3.612×1023
2 2 A
(3)①VO2++HO-e-===VO+2H+ A→B
2
②避免氧化剂与还原剂直接接触(其他合理答案也可)
19.答案:(1)Li++FePO +e-===LiFePO
4 4
(2)NO +NO-e-===N O
2 2 5
(3)Al-3e-+4OH-===AlO+2HO
2
解析:(1)原电池放电时,正极上 FePO 得电子生成 LiFePO ,电极反应式为 Li++FePO +e-
4 4 4
===LiFePO 。(2)因为石墨Ⅱ电极上通入的O 得电子,故在石墨Ⅰ电极上NO 失电子,与迁移过来
4 2 2
的NO结合生成+5价氮的氧化物NO ,电极反应式为NO +NO-e-===N O 。(3)该电池中铝为负
2 5 2 2 5
极,失去电子,结合溶液中的OH-,最终生成AlO。
10
学科网(北京)股份有限公司11
学科网(北京)股份有限公司