文档内容
第四章 第一节 第3课时 原子结构与元素性质 测试题
榆次一中 李金虎
一、选择题(每小题只有一个正确选项,每小题4分,共60分)
1. 下列关于碱金属元素的说法正确的是( )
①原子结构的相同点是最外层电子数相同,都为1 ②原子结构的不同点是随核电荷数的增加,
电子层数增多,原子半径增大 ③具有相似的化学性质,都是活泼金属 ④都具有强还原性,
在化合物中显+1价 ⑤化学性质有差别,从Li到Cs,失电子能力逐渐增强
A.①③④ B.①③⑤
C.②④⑤ D.全部
2. 下列有关碱金属元素的说法正确的是()
A.单质的沸点随原子序数的递增而升高
B.元素周期表第一列是第ⅠA族元素,又称碱金属元素
C.金属锂在空气中燃烧,产物是LiO
2 2
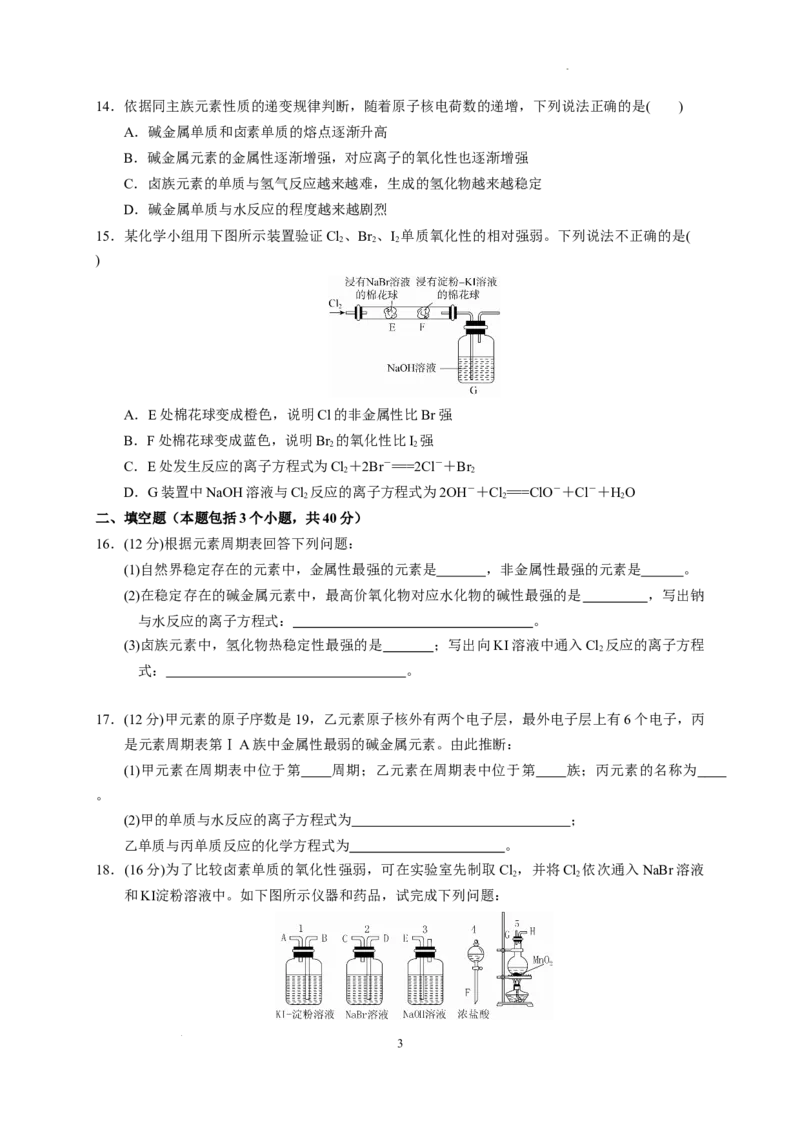
D.金属锂常用于制造锂电池,这跟它还原性强、密度小有关
3. 下列关于Li、Na、K、Rb、Cs的叙述均正确的一组是( D )
①金属性最强的是锂 ②氧化性最强的是锂离子 ③在自然界中均以化合态形式存在
④Li的密度最大 ⑤铯与水反应十分剧烈,甚至会发生爆炸
⑥粒子半径:Rb+>K+>Na+,Cs>Cs+
A.①②③ B.④⑤⑥
C.②④⑥ D.②③⑤⑥
4. 卤素按F、Cl、Br、I的顺序,其非金属性逐渐减弱的原因是( )
A.原子核内质子数增多起主要作用
B.相对原子质量逐渐增大起主要作用
C.其单质的密度增大起主要作用
D.随着核电荷数增加电子层数增多起主要作用
5. 下列关于卤素(用X表示)的叙述正确的是( )
A.HF、HCl、HBr、HI的稳定性依次增强
B.卤素单质与水反应都生成HX和HXO
C.其单质都有颜色,都有毒
D.卤素单质与其他物质化合时,均表现为还原性
6.如图表示碱金属的某些性质与核电荷数的变化关系。则下列各性质中不符合图示关系的是( )
A.还原性 B.与水反应的剧烈程度
1
学科网(北京)股份有限公司C.熔点 D.原子半径
7. 下列对碱金属性质的叙述中,正确的是( )
A.都是银白色的柔软金属,密度都比较小
B.单质在空气中燃烧生成的都是过氧化物
C.碱金属单质都能与水反应生成碱和氢气
D.单质的熔、沸点随着原子序数的增加而升高
8. 借助碱金属元素和卤族元素性质的递变性分析下面的推断,其中正确的是( )
A.已知Ca是第四周期第ⅡA族元素,故Ca(OH) 的碱性比Mg(OH) 的碱性弱
2 2
B.已知As是第四周期第ⅤA族元素,故AsH 的稳定性比NH 的稳定性强
3 3
C.已知Cs的原子半径比Na的原子半径大,故Cs与水反应不如Na与水反应剧烈
D.已知Cl的核电荷数比F的核电荷数多,故Cl的原子半径比F的原子半径大
9. 下列不能证明K比Na金属性强的事实是( )
A.Na的熔点比钾的高
B.K与HO的反应比Na剧烈
2
C.K在O 中燃烧的产物更为复杂
2
D.KOH的碱性比NaOH强
10.下列关于碱金属的原子结构和性质的叙述不正确的是( )
A.碱金属元素的原子在化学反应中容易失去电子
B.碱金属单质都可以作还原剂
C.碱金属单质都能在O 中燃烧生成过氧化物
2
D.碱金属单质都能与水反应生成碱
11.下列四种演示金属钾与水反应的实验装置,正确的是( )
12.关于铯及其化合物的以下说法不正确的是( )
A.氢氧化铯是一种强碱,比KOH的碱性强
B.铯与水或酸溶液反应剧烈,生成氢气
C.Cs的还原性比Na强,故Na+的氧化性大于Cs+
D.Cs的金属性小于K
13.卤素是最活泼的一族非金属元素。下列关于卤族元素的说法正确的是( )
A.卤素单质只具有氧化性
B.从上到下,卤素原子的电子层数依次增多,半径依次减小
C.从F到I,原子核对最外层电子的吸引能力依次减弱,原子的得电子能力依次减弱
D.卤素单质与H 化合的难易程度为FK+>Na+,Cs>Cs+,故⑥
正确。
4.答案:D
解析:F、Cl、Br、I元素非金属性逐渐减弱的原因主要是随着核外电子层数增多,原子核对最外层
电子的吸引能力减弱。
5.答案:C
解析:从F到I,元素的非金属性逐渐减弱,相应氢化物的稳定性逐渐减弱,A项错误;要注意F
2
及氟的化合物的特殊性:F 与水反应置换HO中的氧生成O,不像其他卤素单质,B项错误;卤素
2 2 2
单质与其他物质化合时,多表现为氧化性,D项错误。
6.答案:C
解析:由图可知,随碱金属的核电荷数的增大,碱金属的性质呈增强的趋势。随核电荷数的增大,
碱金属的还原性增强,碱金属与水反应的剧烈程度增大,原子半径增大,A、B、D三项正确;随
核电荷数的增大,碱金属单质的熔点逐渐降低,C项与图示关系不符,故选C项。
7.答案:C
4
学科网(北京)股份有限公司解析:A项,碱金属中除Cs略带金色光泽外,其余都是银白色的柔软金属,Rb和Cs的密度大于水,
其余密度都比较小,错误;B项,单质在空气中燃烧生成的不一定都是过氧化物,例如Li只能生成
氧化锂,错误;C项,碱金属单质都能与水反应生成碱和氢气,正确;D项,单质的熔、沸点随着
原子序数的增加而降低,错误。
8.答案:D
解析:A 项,元素金属性越强,对应最高价氧化物的水化物碱性越强,故 Ca(OH) 的碱性比
2
Mg(OH) 的碱性强,错误;B项,元素非金属性越强,对应简单气态氢化物越稳定,故 AsH 的稳
2 3
定性比NH 的稳定性弱,错误;C项,元素金属性越强,单质与水反应越剧烈,故Cs与水反应比
3
Na与水反应剧烈,错误;D项,同族元素,原子序数大的电子层数多,原子半径大,已知 Cl的核
电荷数比F的核电荷数多,故Cl的原子半径比F的原子半径大,正确。
9.答案:A
解析:熔点高低是物理性质,与金属性强弱无关。
10.答案:C
解析:碱金属元素原子的最外电子层上只有一个电子,同时原子半径又比较大,故在化学反应中易
失去电子表现出强还原性,A、B两项正确;锂与氧气反应生成的是LiO,C项错误;碱金属单质
2
都能与水反应生成碱,D项正确。
11.答案:B
解析:钾与水反应剧烈,从安全角度来看,用B装置反应空间大且加有玻璃片,能防止液体溅出来,
C空间太小可能会爆炸,D钾与水反应太剧烈,不易操作。
12.答案:D
解析:Cs的最外层电子数是1,电子层数比K的多,故Cs的金属性比K强,CsOH的碱性比KOH
强,A项正确,D项错误;铯与钠化学性质相似,铯与水或酸反应更剧烈,生成H ,B项正确;Cs
2
的还原性比Na强,所以Na+的得电子能力比Cs+强,C项正确。
13.答案:C
解析:卤素单质(Cl 、Br 、I)在氧化还原反应中,化合价既可以升高也可以降低,所以既具有氧化
2 2 2
性,也具有还原性,A项错误;卤素原子从F到I,电子层数依次增多,原子半径依次增大,原子
核对最外层电子的吸引能力依次减弱,原子得电子能力依次减弱,故B项错误,C项正确;卤素单
质与H 化合的难易程度为F>Cl>Br >I,D项错误。
2 2 2 2 2
14.答案:D
解析:A项,随着原子核电荷数的递增,碱金属单质的熔点逐渐降低,错误;B项,随着原子核电
荷数的递增,碱金属元素的原子失电子的能力逐渐增强, 则碱金属元素的阳离子氧化性逐渐减弱,
错误;C项,随着原子核电荷数的递增,卤族元素形成的氢化物的稳定性越来越弱,错误;D项,
随着原子核电荷数的递增,碱金属元素的金属性越来越强,其单质与水反应的程度越来越剧烈,正
确。
15.答案:B
解析:E处棉花球变成橙色,说明Cl 置换出了Br ,即Cl的非金属性强于Br,其离子方程式为:
2 2
Cl +2Br-===2Cl-+Br ,A、C 正确;由 NaOH 溶液与 Cl 反应的化学方程式 2NaOH+
2 2 2
5
学科网(北京)股份有限公司Cl===NaClO+NaCl+HO知D正确;F处棉花球变成蓝色也可能是未反应完的Cl 与I-反应,B错
2 2 2
误。
16.答案:(1) Cs F (2) 2Na + 2H O == =2Na + + 2OH - + H ↑
2 2
(3) HF Cl+2I-===2Cl-+I
2 2
解析:根据同主族、同周期元素金属性、非金属性递变规律可知,在自然界稳定存在的元素中,金
属性最强的元素是第ⅠA族的Cs,非金属性最强的元素是F,所以碱性最强的是CsOH,氢化物热
稳定性最强的是HF。
17.答案:(1) 四 ⅥA 锂
(2) 2K+2HO===2K++2OH-+H↑
2 2
4Li+O=====2LiO。
2 2
解析:甲的原子序数是19,甲是钾元素,乙是氧元素,丙是锂元素。
18.答案:(1) F G H D C B A E
(2) MnO+4HCl(浓)=====MnCl +Cl↑+2HO。
2 2 2 2
(3)吸收未反应完的Cl,防止污染空气, Cl+2OH-===Cl-+ClO-+HO。
2 2 2
(4)溶液显蓝色 Cl+2KI===2KCl+I。
2 2
解析: 首先弄清实验原理及目的:通过卤素单质之间的置换反应证明它们之间氧化性强弱。为此
通过装置4和装置5来制取Cl ,再通过Cl 与NaBr和KI淀粉溶液反应,并通过现象来证明反应情
2 2
况。实验过程中要注意尾气处理,以防止污染空气。
6
学科网(北京)股份有限公司7
学科网(北京)股份有限公司