必修第一册 第四章 第二节 元素周期律 测试题
榆次一中 李金虎
一、选择题(每小题只有一个正确选项,每小题4分,共40分)
1. 我国嫦娥五号探测器带回1.731 kg的月球土壤,经分析发现其构成与地球土壤类似,土壤中含
有的短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为 15。X、Y、Z为同
周期相邻元素,且均不与W同族。下列结论正确的是( )
A.原子半径大小顺序为W>X>Y>Z
B.化合物XW中的化学键为离子键
C.Y单质的导电性能弱于Z单质的
D.Z的氧化物的水化物的酸性强于碳酸
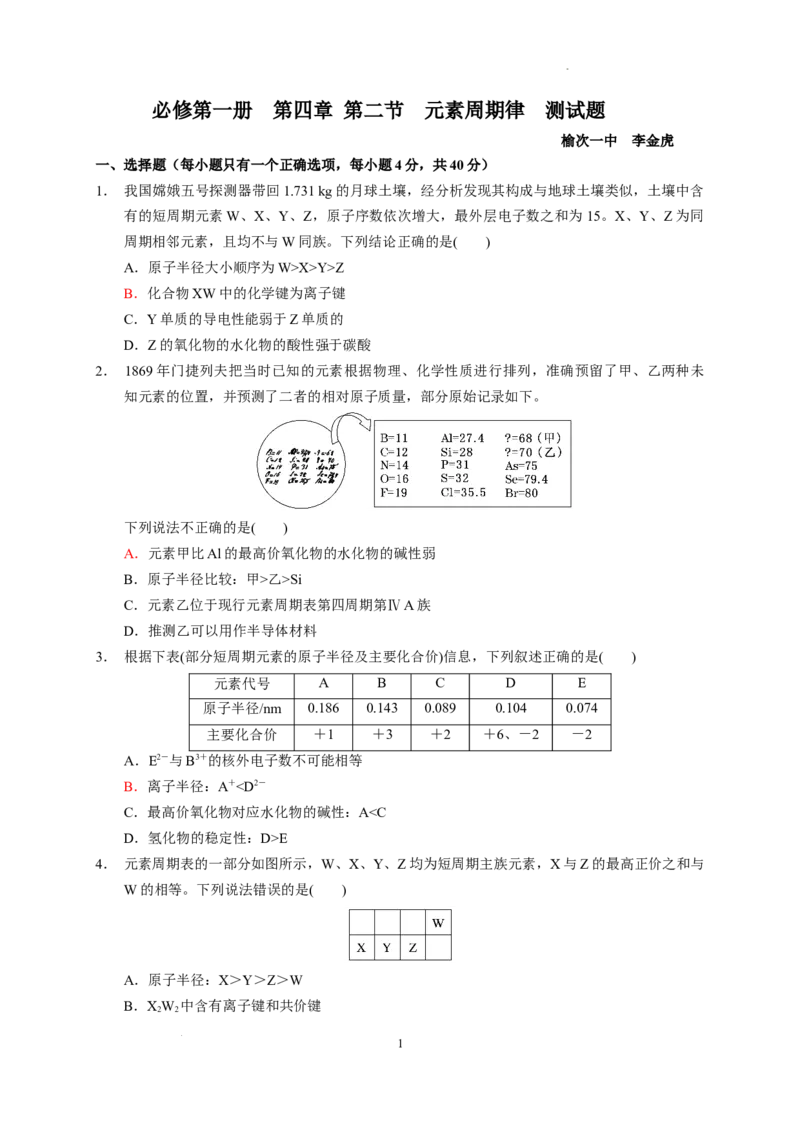
2. 1869年门捷列夫把当时已知的元素根据物理、化学性质进行排列,准确预留了甲、乙两种未
知元素的位置,并预测了二者的相对原子质量,部分原始记录如下。
下列说法不正确的是( )
A.元素甲比Al的最高价氧化物的水化物的碱性弱
B.原子半径比较:甲>乙>Si
C.元素乙位于现行元素周期表第四周期第ⅣA族
D.推测乙可以用作半导体材料
3. 根据下表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是( )
元素代号 A B C D E
原子半径/nm 0.186 0.143 0.089 0.104 0.074
主要化合价 +1 +3 +2 +6、-2 -2
A.E2-与B3+的核外电子数不可能相等
B.离子半径:A+
E
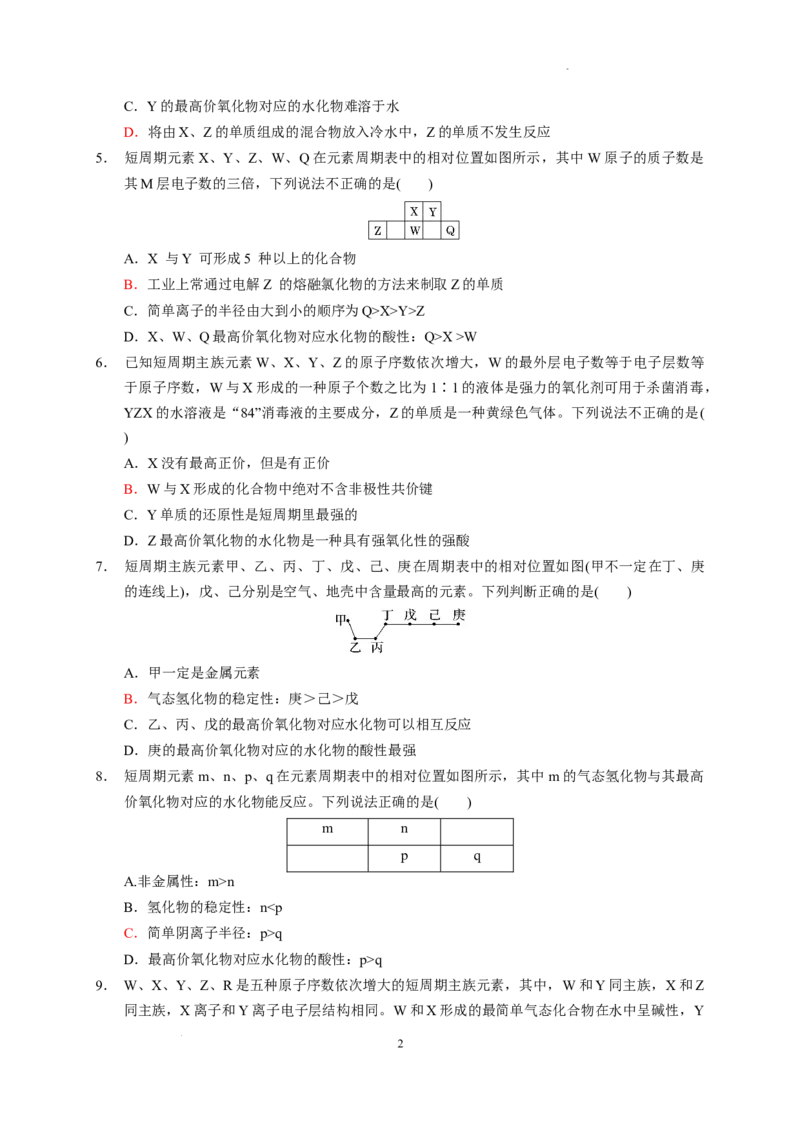
4. 元素周期表的一部分如图所示,W、X、Y、Z均为短周期主族元素,X与Z的最高正价之和与
W的相等。下列说法错误的是( )
A.原子半径:X>Y>Z>W
B.XW 中含有离子键和共价键
2 2
1
学科网(北京)股份有限公司C.Y的最高价氧化物对应的水化物难溶于水
D.将由X、Z的单质组成的混合物放入冷水中,Z的单质不发生反应
5. 短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示,其中 W原子的质子数是
其M层电子数的三倍,下列说法不正确的是( )
A.X 与Y 可形成5 种以上的化合物
B.工业上常通过电解Z 的熔融氯化物的方法来制取Z的单质
C.简单离子的半径由大到小的顺序为Q>X>Y>Z
D.X、W、Q最高价氧化物对应水化物的酸性:Q>X >W
6. 已知短周期主族元素W、X、Y、Z的原子序数依次增大,W的最外层电子数等于电子层数等
于原子序数,W与X形成的一种原子个数之比为1∶1的液体是强力的氧化剂可用于杀菌消毒,
YZX的水溶液是“84”消毒液的主要成分,Z的单质是一种黄绿色气体。下列说法不正确的是(
)
A.X没有最高正价,但是有正价
B.W与X形成的化合物中绝对不含非极性共价键
C.Y单质的还原性是短周期里最强的
D.Z最高价氧化物的水化物是一种具有强氧化性的强酸
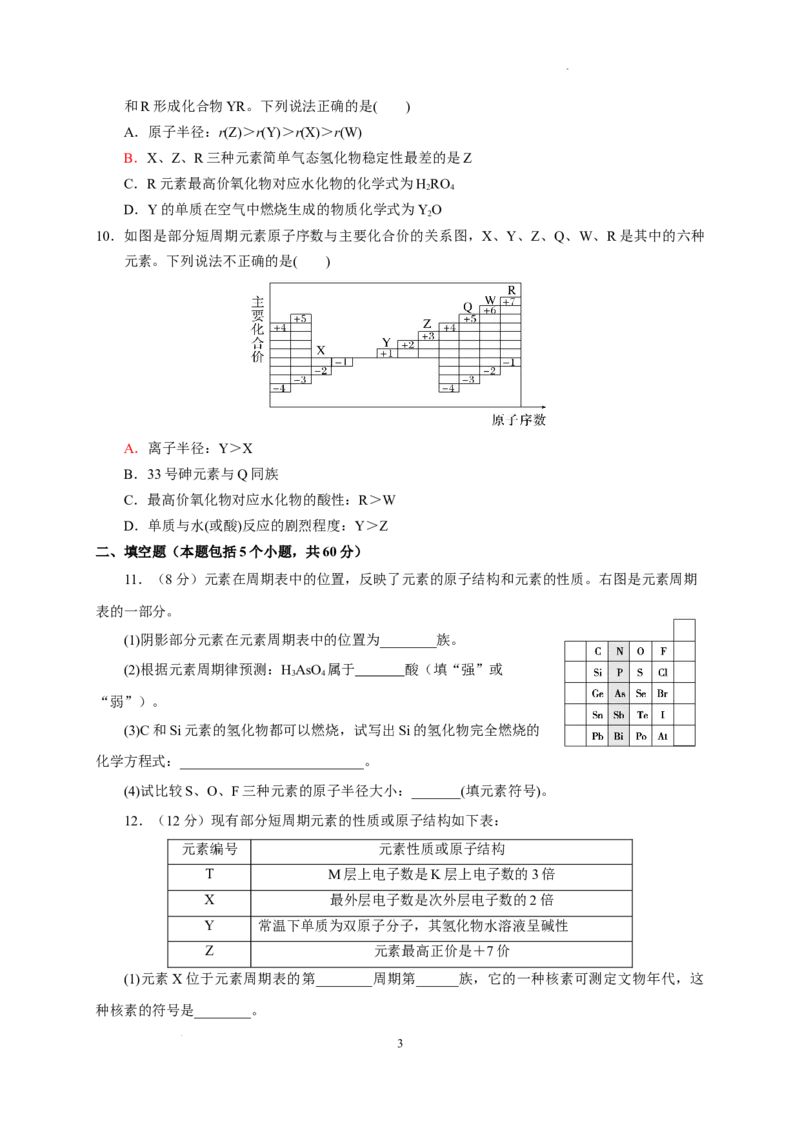
7. 短周期主族元素甲、乙、丙、丁、戊、己、庚在周期表中的相对位置如图(甲不一定在丁、庚
的连线上),戊、己分别是空气、地壳中含量最高的元素。下列判断正确的是( )
A.甲一定是金属元素
B.气态氢化物的稳定性:庚>己>戊
C.乙、丙、戊的最高价氧化物对应水化物可以相互反应
D.庚的最高价氧化物对应的水化物的酸性最强
8. 短周期元素m、n、p、q在元素周期表中的相对位置如图所示,其中m的气态氢化物与其最高
价氧化物对应的水化物能反应。下列说法正确的是( )
m n
p q
A.非金属性:m>n
B.氢化物的稳定性:nq
D.最高价氧化物对应水化物的酸性:p>q
9. W、X、Y、Z、R是五种原子序数依次增大的短周期主族元素,其中,W和Y同主族,X和Z
同主族,X离子和Y离子电子层结构相同。W和X形成的最简单气态化合物在水中呈碱性,Y
2
学科网(北京)股份有限公司和R形成化合物YR。下列说法正确的是( )
A.原子半径:r(Z)>r(Y)>r(X)>r(W)
B.X、Z、R三种元素简单气态氢化物稳定性最差的是Z
C.R元素最高价氧化物对应水化物的化学式为HRO
2 4
D.Y的单质在空气中燃烧生成的物质化学式为YO
2
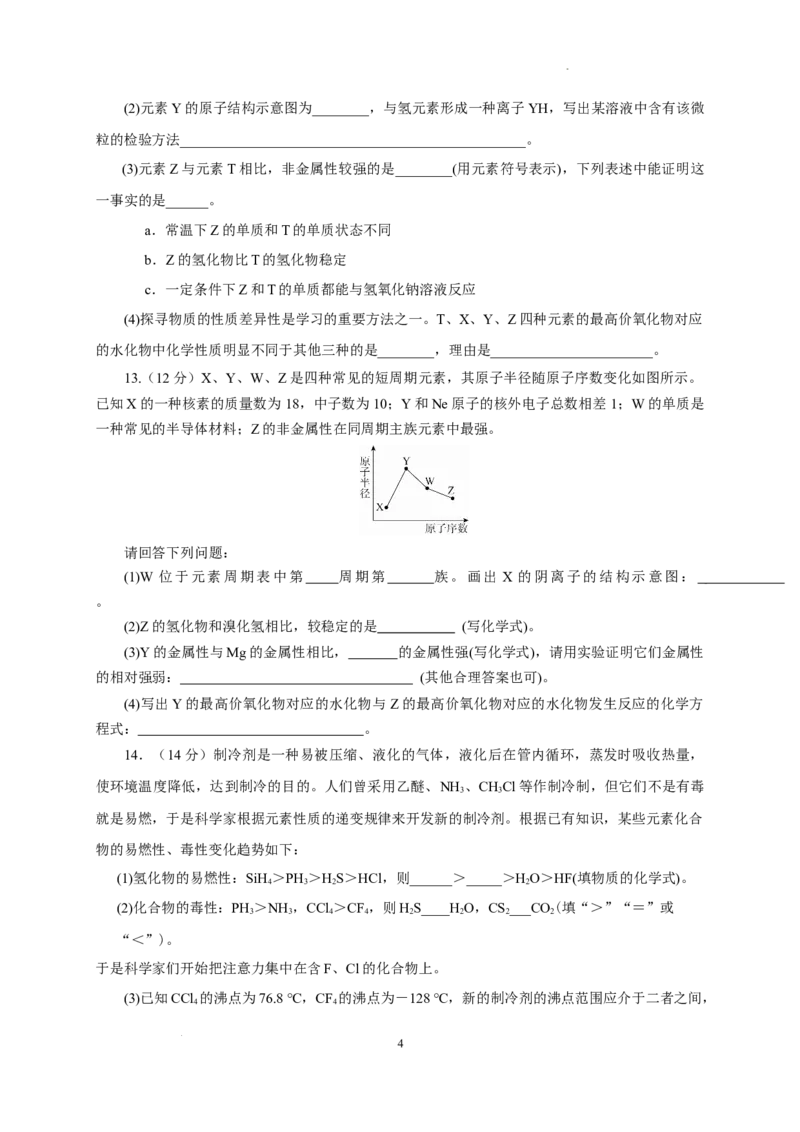
10.如图是部分短周期元素原子序数与主要化合价的关系图,X、Y、Z、Q、W、R是其中的六种
元素。下列说法不正确的是( )
A.离子半径:Y>X
B.33号砷元素与Q同族
C.最高价氧化物对应水化物的酸性:R>W
D.单质与水(或酸)反应的剧烈程度:Y>Z
二、填空题(本题包括5个小题,共60分)
11.(8分)元素在周期表中的位置,反映了元素的原子结构和元素的性质。右图是元素周期
表的一部分。
(1)阴影部分元素在元素周期表中的位置为________族。
(2)根据元素周期律预测:HAsO 属于 酸(填“强”或
3 4
“弱”)。
(3)C和Si元素的氢化物都可以燃烧,试写出Si的氢化物完全燃烧的
化学方程式:__________________________。
(4)试比较S、O、F三种元素的原子半径大小:_______(填元素符号)。
12.(12分)现有部分短周期元素的性质或原子结构如下表:
元素编号 元素性质或原子结构
T M层上电子数是K层上电子数的3倍
X 最外层电子数是次外层电子数的2倍
Y 常温下单质为双原子分子,其氢化物水溶液呈碱性
Z 元素最高正价是+7价
(1)元素X位于元素周期表的第________周期第______族,它的一种核素可测定文物年代,这
种核素的符号是________。
3
学科网(北京)股份有限公司(2)元素Y的原子结构示意图为________,与氢元素形成一种离子YH,写出某溶液中含有该微
粒的检验方法_________________________________________________。
(3)元素Z与元素T相比,非金属性较强的是________(用元素符号表示),下列表述中能证明这
一事实的是______。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物对应
的水化物中化学性质明显不同于其他三种的是________,理由是_______________________。
13.(12分)X、Y、W、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示。
已知X的一种核素的质量数为18,中子数为10;Y和Ne原子的核外电子总数相差1;W的单质是
一种常见的半导体材料;Z的非金属性在同周期主族元素中最强。
请回答下列问题:
(1)W 位于元素周期表中第 周期第 族。画出 X 的阴离子的结构示意图:
。
(2)Z的氢化物和溴化氢相比,较稳定的是 (写化学式)。
(3)Y的金属性与Mg的金属性相比, 的金属性强(写化学式),请用实验证明它们金属性
的相对强弱: (其他合理答案也可)。
(4)写出Y的最高价氧化物对应的水化物与 Z的最高价氧化物对应的水化物发生反应的化学方
程式: 。
14.(14分)制冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,
使环境温度降低,达到制冷的目的。人们曾采用乙醚、NH 、CHCl等作制冷制,但它们不是有毒
3 3
就是易燃,于是科学家根据元素性质的递变规律来开发新的制冷剂。根据已有知识,某些元素化合
物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:SiH>PH >HS>HCl,则______>_____>HO>HF(填物质的化学式)。
4 3 2 2
(2)化合物的毒性:PH >NH ,CCl >CF,则HS____H O,CS___CO(填“>”“=”或
3 3 4 4 2 2 2 2
“<”)。
于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl 的沸点为76.8 ℃,CF 的沸点为-128 ℃,新的制冷剂的沸点范围应介于二者之间,
4 4
4
学科网(北京)股份有限公司经过较长时间的反复实验,发现了制冷剂CFCl(氟利昂),其他类似的制冷剂可以是________。
2 2
(4)然而这种制冷剂造成的当今某一环境问题是 。
但求助于周期表中元素及其化合物的 (填写下列选项的编号)变化趋势开发制冷剂的科学思
维方法是值得借鉴的。
①毒性; ②沸点; ③易燃性; ④水溶性; ⑤颜色
A.①②③ B.②④⑤ C.②③④ D.①②④⑤
15.(14分)某同学在研究元素性质递变规律实验时,自己设计了一套实验方案,并记录了
有关实验现象(见下表,表中的“实验方案”与“实验现象”前后不一定是对应关系)。
实验步骤 实验现象
①将镁条用砂纸打磨后,放入试管中,
A.浮在水面上,熔成小球,四处游动,发出
加入少量水后,加热至水沸腾;再向溶
“嘶嘶”声,随之消失,溶液变成红色
液中滴加酚酞溶液
②向新制的NaS溶液中滴加新制的氯水 B.有气体产生,溶液变成浅红色
2
③将一小块金属钠放入滴有酚酞溶液的
C.剧烈反应,迅速产生大量无色气体
冷水中
④将镁条投入稀盐酸中 D.反应不十分剧烈,产生无色气体
⑤将铝条投入稀盐酸中 E.生成白色胶状沉淀,继而沉淀消失
⑥向AlCl 溶液中滴加NaOH溶液至过量 F.生成淡黄色沉淀
3
请你帮助该同学整理并完成实验报告。
(1)实验目的:研究________元素性质递变规律。
(2)实验用品:试剂:金属钠、镁条、铝条、稀盐酸、新制氯水、新制NaS溶液、AlCl 溶液、
2 3
NaOH溶液、酚酞溶液等。
仪器:_______、_______、_______、试管夹、胶头滴管、镊子、小刀、玻璃片、砂纸、火柴等。
(3)实验内容:(填写与实验步骤对应的实验现象的编号和①②的化学方程式及此实验的结论)
实验内容 ① ② ③ ④ ⑤ ⑥
实验现象
(填A~F)
①_______________________________________________________________;
②_______________________________________________________________;
此实验的结论:___________________________________________________。
(4)请用原子结构的知识简单解释上述实验结论: 。
1.答案 B
解析 O原子有两层,Mg、Al、Si均有三层且原子序数依次增大,故原子半径大小顺序为Mg>Al
>Si>O,即X>Y>Z>W,A错误;化合物XW即MgO为离子化合物,其中的化学键为离子键,B
正确;Y单质为铝单质,铝属于导体,导电性很强,Z单质为硅,为半导体,半导体导电性介于导
5
学科网(北京)股份有限公司体和绝缘体之间,故Y单质的导电性能强于Z单质的,C错误;Z的氧化物的水化物为硅酸,硅酸
酸性弱于碳酸,D错误。
2.答案 A
解析: 由元素的相对原子质量可知,甲、乙的相对原子质量均比As小,As位于第四周期第ⅤA
族,则C、Si、乙位于第ⅣA族,乙为Ge,B、Al、甲位于第ⅢA族,甲为Ga。A项,甲为Ga,
位于现行元素周期表第四周期第ⅢA族,最高价氧化物的水化物的碱性比铝的强,故A错误;B项,
电子层数越多,原子半径越大,同周期从左向右原子半径减小,则原子半径:甲>乙>Si,故B正确;
C项,乙为Ge,位于现行元素周期表第四周期第ⅣA族,故C正确;D项,乙为Ge,位于金属元
素与非金属元素的分界处,可用作半导体材料,故D正确。
3.答案 B
解析:由表中数据可知,A为钠,B为铝,C为铍,D为硫,E为氧。E2-与B3+的核外电子数都为
10,相等,A错误;离子半径:Na+HS,D错误。
2 2
4.答案 D
解析 设X的最外层电子数为x,则Z和W的最外层电子数为(x+2)、(x+3),由X与Z的最高正
价之和与W的相等可得x+(x+2)=x+3,解得x=1,由此可知X为Na元素、Y为Mg元素、Z为
Al元素、W为C元素。同周期元素,从左到右原子半径依次减小,同主族元素,从上到下原子半
径依次增大,则原子半径:X>Y>Z>W,A项正确;XW 为NaC ,NaC 中含有离子键和共价
2 2 2 2 2 2
键,B项正确;Y为Mg元素,氢氧化镁为难溶于水的氢氧化物,C项正确;将由Na、Al的单质组
成的混合物放入冷水中,钠首先和水反应生成氢氧化钠和氢气,反应生成的氢氧化钠和铝单质反应
生成偏铝酸钠和氢气,D项错误。
5.答案 B
解析: 这几种元素都是短周期元素,根据元素在周期表中的位置知,X、Y位于第二周期,Z、
W、Q位于第三周期,W原子的质子数是其M层电子数的三倍,设其M层电子为x,则W原子质
子数=2+8+x,2+8+x=3x,所以x=5,则W为P元素,则X是N元素、Y是O元素、Z是Al元
素、Q是Cl元素。X、Y分别是N、O元素,二者能形成多种氮氧化物,如NO、NO、NO 、
2 2
NO 、NO ,所以X与Y可形成的化合物在5种以上,故A正确;Z是Al元素,熔融状态下氯化
2 4 2 5
铝不导电,所以工业上采用电解熔融氧化铝的方法冶炼 Al,故B错误;电子层数越多其离子半径
越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径:Q>X>Y>Z,
故C正确;元素的非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:Q>X >W,则
最高价氧化物对应水化物的酸性:Q>X >W,故D正确。
6.答案 B
解析: 已知短周期主族元素W、X、Y、Z的原子序数依次增大,W的最外层电子数等于电子层
数等于原子序数,说明W为H,YZX的水溶液是“84”消毒液的主要成分,说明Y为钠元素,Z为
氯元素,X为氧元素,W与X形成的一种原子个数之比为1∶1的液体是强力的氧化剂可用于杀菌
消毒,即HO ,Z的单质是一种黄绿色气体,即氯气。X为氧元素,氧没有最高正价,但是与氟形
2 2
6
学科网(北京)股份有限公司成化合物时,氧为正价,A正确;W与X形成的化合物HO 中含非极性共价键,B错误;Y单质
2 2
为钠单质,钠元素在短周期中非金属性最强,故单质的还原性是短周期里最强的,C正确;Z最高
价氧化物的水化物是高氯酸,是一种具有强氧化性的强酸,D正确。
7.答案 B
解析 由戊、己的位置及二者分别是空气、地壳中含量最高的元素,可判断出戊是 N元素,己是O
元素,则庚是F元素,丁是C元素,丙是Ar元素,乙是Mg元素。A项,甲可能是H或Li元素,
错误;B项,同周期主族元素,从左到右非金属性逐渐增强,气态氢化物的稳定性也增强,正确;
C项,Mg(OH) 和Ar(OH) 不能发生反应,错误;D项,F没有正价,错误。
2 3
8.答案 C
解析 m的气态氢化物与其最高价氧化物对应的水化物能反应,说明m 为氮元素,则n为氧元素,
p为硫元素,q为氯元素。同周期元素从左到右,非金属性逐渐增强,则氮和氧比较,氧的非金属
性强,故A错误;同主族元素从上到下,非金属性逐渐减弱,非金属性越强,其气态氢化物越稳定,
则水的稳定性强于硫化氢,故B错误;硫离子和氯离子电子层结构相同,核电荷数越大,半径越小,
所以硫离子半径大,故C正确;元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,非
金属性:Cl>S,则高氯酸的酸性强于硫酸,故D错误。
9.答案 B
解析 根据W和X形成的最简单气态化合物在水中呈碱性,可知该化合物为 NH ,即W、X分别
3
为H、N元素;根据W和Y同主族、X和Z同主族,可知Y为Na元素,Z为P元素;根据Y和R
形成化合物YR,可知R为Cl元素。原子半径的大小顺序:Na>P>N>H,A项错误;N、P、Cl
中非金属性最弱的是P,即PH 的稳定性最差,B项正确;Cl元素最高价为+7价,其最高价氧化
3
物对应的水化物为HClO,C项错误;单质Na在空气中燃烧生成NaO,D项错误。
4 2 2
10.答案 A
解析 根据X元素只有-2价,可知X为O元素;根据Y为+1价,可知Y为Na元素,同理结合
最高正价和最低负价可知Z、Q、W、R分别为Al、P、S、Cl元素。
11.答案 (1)第ⅤA (2)弱酸 (3) SiH+2O=====SiO+2HO (4)S>O>F
4 2 2 2
解析 (1)图中阴影部分为氮族元素,即第ⅤA族。
(2)在周期表中,砷元素的非金属性比磷元素弱,磷酸属于中强酸,故HAsO 属于弱酸。
3 4
(3)甲烷(CH)燃烧产生二氧化碳和水,硅烷(SiH)的性质与甲烷相似,它在空气中燃烧的产物应
4 4
该是水和硅的氧化物,即:SiH+2O=====SiO+2HO。
4 2 2 2
(4)S与O同主族,原子序数S>O,故原子半径S>O;O与F同周期,原子序数O<F,故原子
半径O>F,所以原子半径:S>O>F。
12.答案 (1)二 ⅣA C
(2) 取适量溶液放入试管,然后加入浓NaOH溶液,加热,若产生能使湿润的红色石蕊试
7
学科网(北京)股份有限公司纸变蓝的气体,可以证明该溶液中含有NH(答案合理即可)
(3)Cl b (4)H CO HCO 是弱酸(或非氧化性酸)
2 3 2 3
13.答案:(1) 三 ⅣA
(2) HCl
(3) Na Na与冷水剧烈反应,而Mg与冷水反应较慢(其他合理答案也可)。
(4) NaOH+HClO===NaClO +HO。
4 4 2
解析 X、Y、W、Z是四种常见的短周期元素,已知X的一种核素的质量数为18,中子数为10,
则X元素原子的质子数为18-10=8,故X为O元素;Y和Ne原子的核外电子数相差1,Y为Na
或F元素,由题图可知,Y原子半径大于氧原子,故Y为Na元素;W的单质是一种常见的半导体
材料,原子序数大于Na元素,故W为Si元素;Z的非金属性在同周期主族元素中最强,故Z为Cl
元素。
(1)W为Si元素,原子核外电子数为14,有3个电子层,最外层电子数为4,处于周期表中第
三周期第ⅣA族。(2)Z为Cl元素,由于元素的非金属性:Cl>Br,故氢化物稳定性:HCl>HBr,即
较稳定的是HCl。(3)同周期元素随原子序数增大原子半径减小,原子失去电子的能力逐渐减弱,元
素的金属性逐渐减弱,所以金属性:Na>Mg;元素的金属性越强,其单质与水或酸反应置换出氢气
就越容易,所以可以通过 Na与冷水剧烈反应,而Mg与冷水反应较慢证明元素的金属性强弱。
(4)Y的最高价氧化物对应的水化物NaOH是强碱,Z的最高价氧化物对应的水化物HClO 是一元强
4
酸,二者发生酸碱中和反应,生成 NaClO 和 HO,发生反应的化学方程式是 NaOH+
4 2
HClO===NaClO +HO。
4 4 2
14.答案 (1)CH NH (2)> > (3)CFCl 或CFCl (4)使大气臭氧层出现空洞 A
4 3 3 3
解析 (1)根据元素周期律,氢化物越稳定的元素,非金属性越强,从题中所给出的信息可知,氢化
物的易燃性顺序为SiH >PH >HS>HCl,因此得出氢化物越不稳定的越易燃烧,很容易得出氢化
4 3 2
物的易燃性顺序:CH>NH >HO>HF。
4 3 2
(2)根据已知化合物的毒性PH >NH ,CCl >CF,总结规律得出结论;同类型的化合物,非金
3 3 4 4
属性越弱的元素形成的化合物毒性越强,因此毒性:HS>HO,CS>CO。
2 2 2 2
(3)根据题中信息CCl 的沸点76.8 ℃、CF 的沸点-128 ℃,说明只含碳与氯元素的化合物沸点
4 4
高,而只含碳与氟元素的化合物沸点低,因此组成中含C、Cl、F元素的化合物的沸点将会介于
76.8 ℃和-128 ℃之间,故其他类似的制冷剂可以是CFCl 或CFCl。
3 3
15.答案 (1)同周期 (2)试管 酒精灯 滤纸
(3)B F A C D E
①Mg+2HO=====Mg(OH) +H↑ ②Cl+NaS===S↓+2NaCl
2 2 2 2 2
随着原子序数的递增,同周期元素从左到右金属性逐渐减弱,非金属性逐渐增强
(4)同周期元素从左到右,随着核电荷数的逐渐增加,原子半径逐渐减小,原子核对最外层电子
8
学科网(北京)股份有限公司吸引能力减弱,失电子能力增强,得电子能力减弱。
9
学科网(北京)股份有限公司10
学科网(北京)股份有限公司