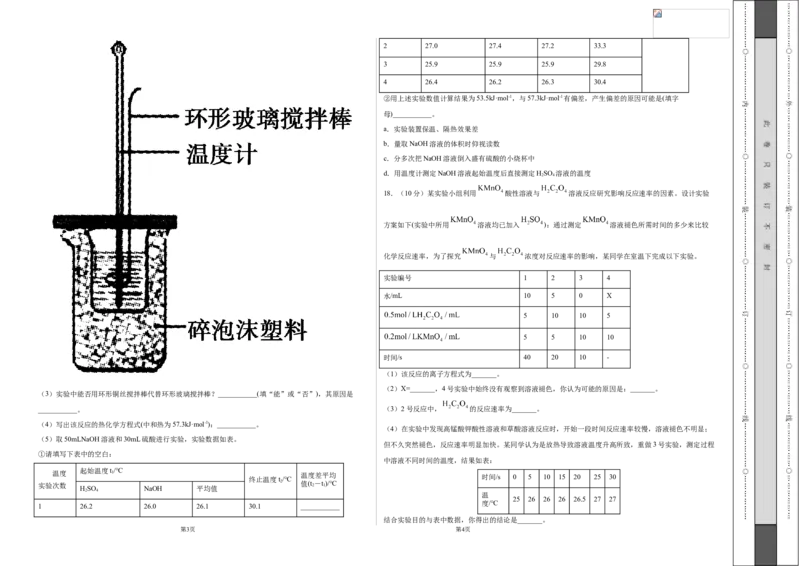
文档内容
………………○………………线………………○………………订………………○………………装………………○………………外………………○………………
______________________:号考_______________:级班_____________:名姓______________:校学
…
………………○………………线………………○………………订………………○………………装………………○………………内………………○………………
D.生成物的总能量大于反应物的总能量时,反应吸热,ΔH>0
上学期期中测试卷 03
3.对于化学反应3W(g)+2X(g)===4Y(g)+3Z(g),下列反应速率关系中,正确的是( )
高二化学 A.v(W)=3v(Z) B.2v(X)=3v(Z) C.2v(X)=v(Y) D.3v(W)=2v(X)
4.下列说法不正确的是( )
(考试时间:90分钟 试卷满分:100分) A.ΔH<0、ΔS>0的反应在任何温度下都能自发进行
注意事项: B.NHHCO (s)===NH(g)+HO(g)+CO(g) ΔH=+185.57 kJ·mol-1能自发进行,原因是体系有自发地
4 3 3 2 2
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考
向混乱度增加的方向转变的倾向
证号填写在答题卡上。 C.因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据
2.回答第Ⅰ卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,
D.在其他外界条件不变的情况下,使用催化剂可以改变化学反应进行的速率
用橡皮擦干净后,再选涂其他答案标号。写在本试卷上无效。 5.已知25 ℃、101 kPa下,1 mol水蒸发为水蒸气需要吸热44.01 kJ
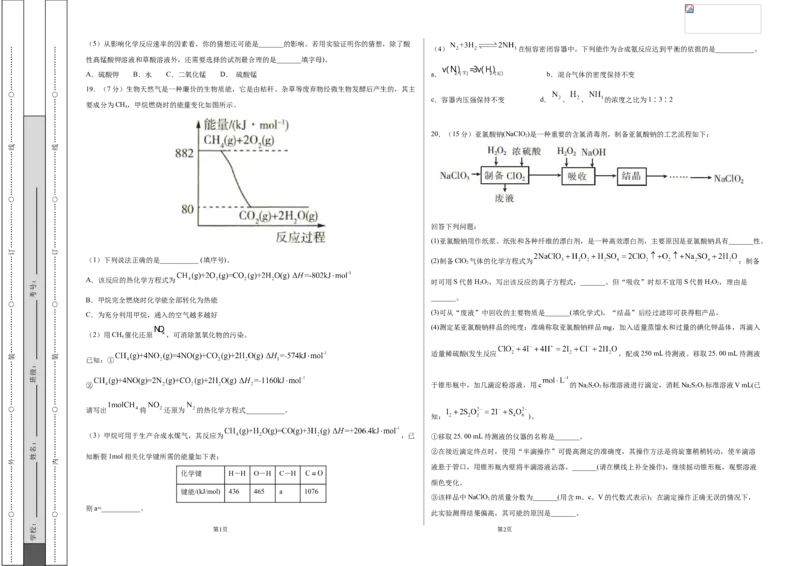
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。 2HO(l) 2H(g)+O(g) ΔH=+571.66 kJ·mol-1
2 2 2
4.测试范围:人教版2019选择性必修1第一章至第三章第二节 C(s)+HO(g) CO(g)+H(g) ΔH=+131.29 kJ·mol-1
2 2
5.考试结束后,将本试卷和答题卡一并交回。
则反应C(s)+ O (g) CO(g)的反应热为 ( )
2
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5
A.ΔH=-396.36 kJ·mol-1 B.ΔH=-198.55 kJ·mol-1
第Ⅰ卷(选择题 共 44 分)
C.ΔH=-154.54 kJ·mol-1 D.ΔH=-110.53 kJ·mol-1
6.化学反应放出或吸收的能量称为反应热。反应热(ΔH)又因化学反应的分类给予不同的名称。如我们学过
一、本题共10小题,每小题2分,共20分。在每小题给出的四个选项中,只有一项是符合题目要求的。
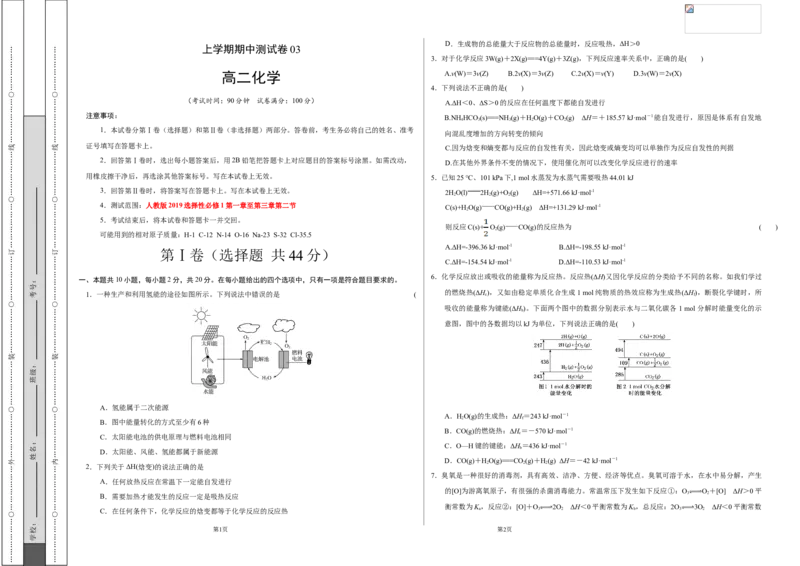
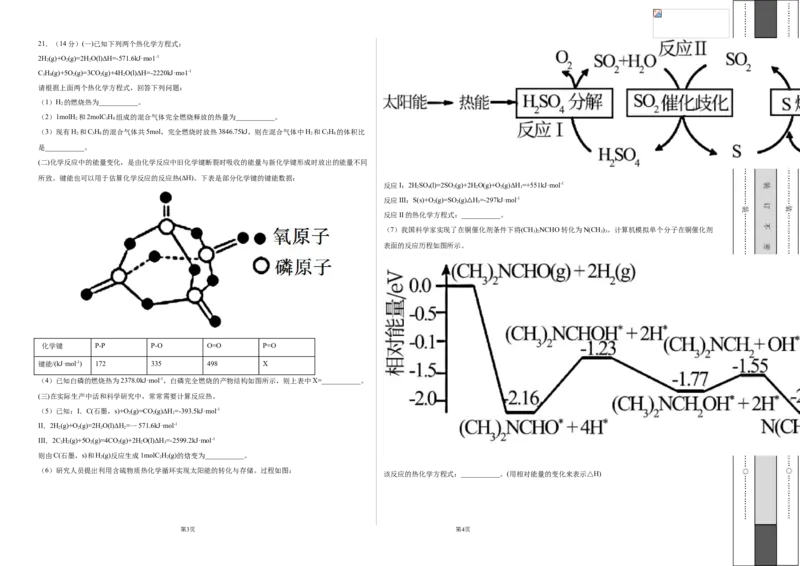
1.一种生产和利用氢能的途径如图所示。下列说法中错误的是 ( 的燃烧热(ΔH c ),又如由稳定单质化合生成1 mol纯物质的热效应称为生成热(ΔH f ),断裂化学键时,所
吸收的能量称为键能(ΔH)。下面两个图中的数据分别表示水与二氧化碳各 1 mol 分解时能量变化的示
b
意图,图中的各数据均以kJ为单位,下列说法正确的是( )
A.氢能属于二次能源
A.HO(g)的生成热:ΔH=243 kJ·mol-1
2 f
B.图中能量转化的方式至少有6种
B.CO(g)的燃烧热:ΔH=-570 kJ·mol-1
c
C.太阳能电池的供电原理与燃料电池相同
C.O—H键的键能:ΔH=436 kJ·mol-1
b
D.太阳能、风能、氢能都属于新能源
D.CO(g)+HO(g)===CO (g)+H(g) ΔH=-42 kJ·mol-1
2 2 2
2.下列关于ΔH(焓变)的说法正确的是
7.臭氧是一种很好的消毒剂,具有高效、洁净、方便、经济等优点。臭氧可溶于水,在水中易分解,产生
A.任何放热反应在常温下一定能自发进行
的[O]为游离氧原子,有很强的杀菌消毒能力。常温常压下发生如下反应①:O O +[O] ΔH>0平
3 2
B.需要加热才能发生的反应一定是吸热反应
衡常数为K,反应②:[O]+O 2O ΔH<0平衡常数为K ,总反应:2O 3O ΔH<0平衡常数
C.在任何条件下,化学反应的焓变都等于化学反应的反应热 a 3 2 b 3 2
第1页 第2页………………○………………内………………○………………装………………○………………订………………○………………线………………○………………
此
卷
只
装
订
不
密
封
………………○………………外………………○………………装………………○………………订………………○………………线………………○………………
为K。下列说法错误的是( ) 11.设N 为阿伏加德罗常数的值。下列说法正确的是
A
A.降低温度,K减小 B.K=K·K A.1mol·L-1 CuCl 溶液中含有的Cl- 数目为2N
a b 2 A
C.适当升温,可提高消毒效率 D.压强增大,K 不变
b
B. 溶液中含有的 离子数为
8.把晶体NO 放入一固定容积的密闭容器中气化并建立NO(g) 2NO (g)平衡后,保持温度不变,再通
2 4 2 4 2
C.标准状况下,4.48L SO 中含有的氧原子数为0.6N
入与起始时等量的NO 气体,反应再次达到平衡,则新平衡NO 的转化率与原平衡比( ) 3 A
2 4 2 4
D.3mol NO 与足量的HO反应,转移的电子数为2N
A.变大 B.变小 C.不变 D.无法确定 2 2 A
12.一定温度下,10 mL 0.40 mol·L-1 H O 溶液发生催化分解。不同时刻测得生成O 的体积(已折算为标准
9.根据表中的信息判断下列说法错误的是( ) 2 2 2
状况)如下表:
物质 外观 熔点 燃烧热/(kJ·mol-1)
t/min 0 2 4 6 8 10
金刚石 无色,透明固体 ? 395.4
V(O )/mL 0.0 9.9 17.2 22.4 26.5 29.9
石墨 灰黑,不透明固体 ? 393.5 2
下列叙述不正确的是(溶液体积变化忽略不计)( )
A.0~6 min的平均反应速率:v(H O)≈3.3×10-2 mol·(L·min)-1
2 2
B.6~10 min的平均反应速率:v(H O)<3.3×10-2 mol·(L·min)-1
2 2
C.反应至6 min时,c(H O)=0.30 mol·L-1
2 2
D.反应至6 min时,HO 分解了50%
2 2
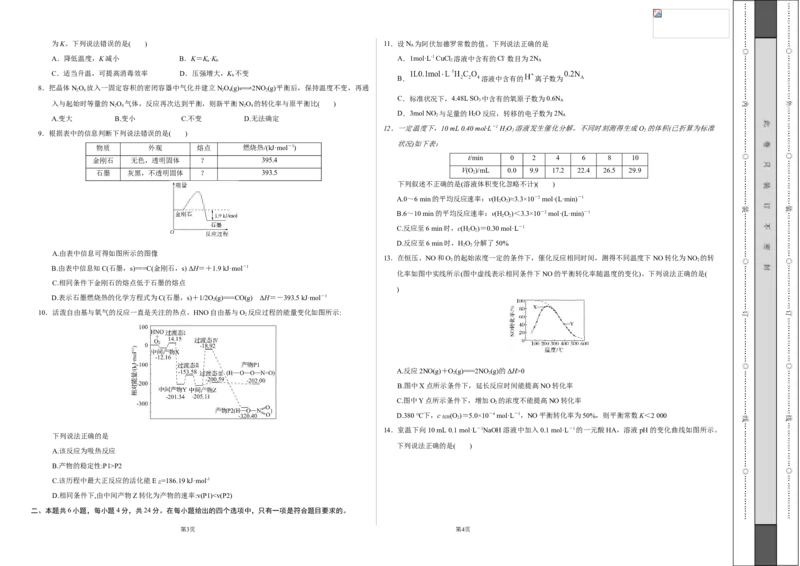
A.由表中信息可得如图所示的图像
13.在恒压、NO和O 的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO 的转
2 2
B.由表中信息知C(石墨,s)===C(金刚石,s) ΔH=+1.9 kJ·mol-1
化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是(
C.相同条件下金刚石的熔点低于石墨的熔点
)
D.表示石墨燃烧热的化学方程式为C(石墨,s)+1/2O (g)===CO(g) ΔH=-393.5 kJ·mol-1
2
10.活泼自由基与氧气的反应一直是关注的热点。HNO自由基与O 反应过程的能量变化如图所示:
2
A.反应2NO(g)+O(g)===2NO(g)的ΔH>0
2 2
B.图中X点所示条件下,延长反应时间能提高NO转化率
C.图中Y点所示条件下,增加O 的浓度不能提高NO转化率
2
D.380 ℃下,c (O )=5.0×10-4 mol·L-1,NO平衡转化率为50%,则平衡常数K<2 000
起始 2
14.室温下向10 mL 0.1 mol·L-1NaOH溶液中加入0.1 mol·L-1的一元酸HA,溶液pH的变化曲线如图所示。
下列说法正确的是
下列说法正确的是( )
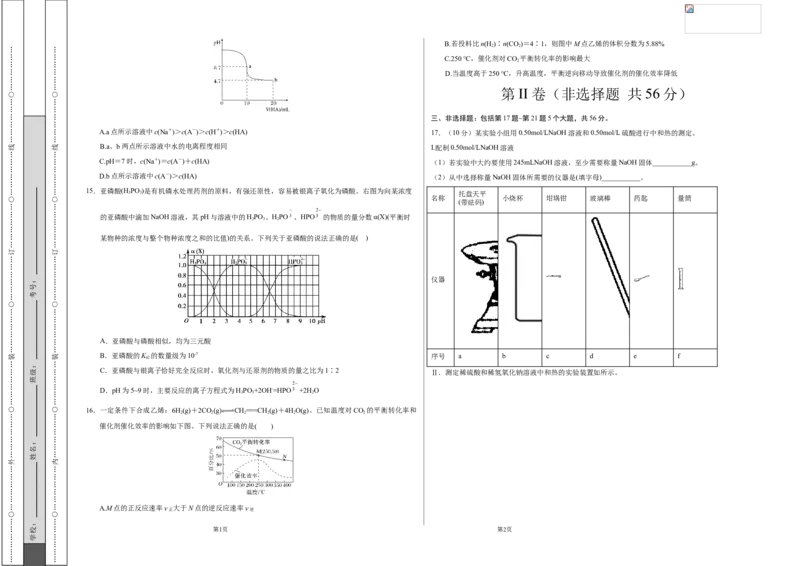
A.该反应为吸热反应
B.产物的稳定性:P1>P2
C.该历程中最大正反应的活化能E =186.19 kJ·mol-1
正
D.相同条件下,由中间产物Z转化为产物的速率:v(P1)