文档内容
………………○………………线………………○………………订………………○………………装………………○………………外………………○………………
______________________:号考_______________:级班_____________:名姓______________:校学
…
………………○………………线………………○………………订………………○………………装………………○………………内………………○………………
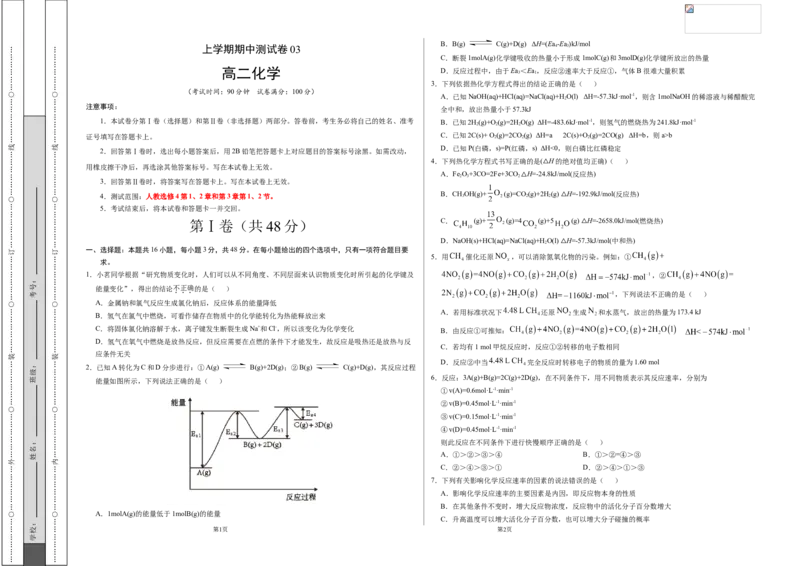
B.B(g) C(g)+D(g) ΔH=(Ea-Ea)kJ/mol
上学期期中测试卷 03 4 3
C.断裂1molA(g)化学键吸收的热量小于形成1molC(g)和3molD(g)化学键所放出的热量
高二化学 D.反应过程中,由于Ea<Ea,反应②速率大于反应①,气体B很难大量积累
3 1
3.下列依据热化学方程式得出的结论正确的是( )
(考试时间:90分钟 试卷满分:100分)
A.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H O(l) ΔH=-57.3kJ·mol-1,则含1molNaOH的稀溶液与稀醋酸完
2
注意事项:
全中和,放出热量小于57.3kJ
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考 B.已知2H(g)+O(g)=2HO(g) ΔH=-483.6kJ·mol-1,则氢气的燃烧热为241.8kJ·mol-1
2 2 2
证号填写在答题卡上。 C.已知2C(s)+ O 2 (g)=2CO 2 (g) ΔH=a 2C(s)+O 2 (g)=2CO(g) ΔH=b,则a>b
D.已知P(白磷,s)=P(红磷,s) ΔH<0,则白磷比红磷稳定
2.回答第Ⅰ卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,
4.下列热化学方程式书写正确的是( H的绝对值均正确)( )
用橡皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
A.Fe O+3CO=2Fe+3CO H=-24.8kJ/mol(反应热)
2 3 2 △
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。
△
B.CHOH(g)+ (g)=CO (g)+2H(g) H=-192.9kJ/mol(反应热)
4.测试范围:人教选修4第1、2章和第3章第1、2节。 3 2 2
5.考试结束后,将本试卷和答题卡一并交回。 △
第Ⅰ卷(共 48 分) C. (g)+ (g)=4 (g)+5 (g) H=-2658.0kJ/mol(燃烧热)
△
D.NaOH(s)+HCl(aq)=NaCl(aq)+H O(l) H=-57.3kJ/mol(中和热)
2
一、选择题:本题共16小题,每小题3分,共48分。在每小题给出的四个选项中,只有一项符合题目要
5.用 催化还原 ,可以消除氮氧△化物的污染。例如:①
求。
1.小茗同学根据“研究物质变化时,人们可以从不同角度、不同层面来认识物质变化时所引起的化学键及 ,②
能量变化”,得出的结论不正确的是( )
,下列说法不正确的是( )
A.金属钠和氯气反应生成氯化钠后,反应体系的能量降低
A.若用标准状况下 还原 生成 和水蒸气,放出的热量为173.4 kJ
B.氢气在氯气中燃烧,可看作储存在物质中的化学能转化为热能释放出来
C.将固体氯化钠溶解于水,离子键发生断裂生成Na+和Cl-,所以该变化为化学变化
B.由反应①可推知:
D.氢气在氧气中燃烧是放热反应,但反应需要在点燃的条件下才能发生,故反应是吸热还是放热与反
C.若均有1 mol甲烷反应时,反应①②转移的电子数相同
应条件无关
D.反应②中当 完全反应时转移电子的物质的量为1.60 mol
2.已知A转化为C和D分步进行:①A(g) B(g)+2D(g);②B(g) C(g)+D(g),其反应过程
6.反应:3A(g)+B(g)=2C(g)+2D(g),在不同条件下,用不同物质表示其反应速率,分别为
能量如图所示,下列说法正确的是( )
①v(A)=0.6mol·L-1·min-1
②v(B)=0.45mol·L-1·min-1
③v(C)=0.15mol·L-1·min-1
④v(D)=0.45mol·L-1·min-1
则此反应在不同条件下进行快慢顺序正确的是( )
A.①>②>③>④ B.①>②=④>③
C.②>④>③>① D.②>④>①>③
7.下列有关影响化学反应速率的因素的说法错误的是( )
A.影响化学反应速率的主要因素是内因,即反应物本身的性质
B.在其他条件不变时,增大反应物浓度,反应物中的活化分子百分数增大
A.1molA(g)的能量低于1molB(g)的能量
C.升高温度可以增大活化分子百分数,也可以增大分子碰撞的概率
第1页 第2页………………○………………内………………○………………装………………○………………订………………○………………线………………○………………
此
卷
只
装
订
不
密
封
………………○………………外………………○………………装………………○………………订………………○………………线………………○………………
D.使用催化剂,活化分子百分数增大,化学反应速率加快 、 ,当平衡时,下列数据肯定不正确的是( )
8.NO催化O 分解的反应机理如下:
3
A. 的物质的量为 , 的物质的量为
第一步:
B. 的物质的量为
第二步:
C. 的物质的量为 , 的物质的量为
第三步:
D. 的物质的量为
总反应:
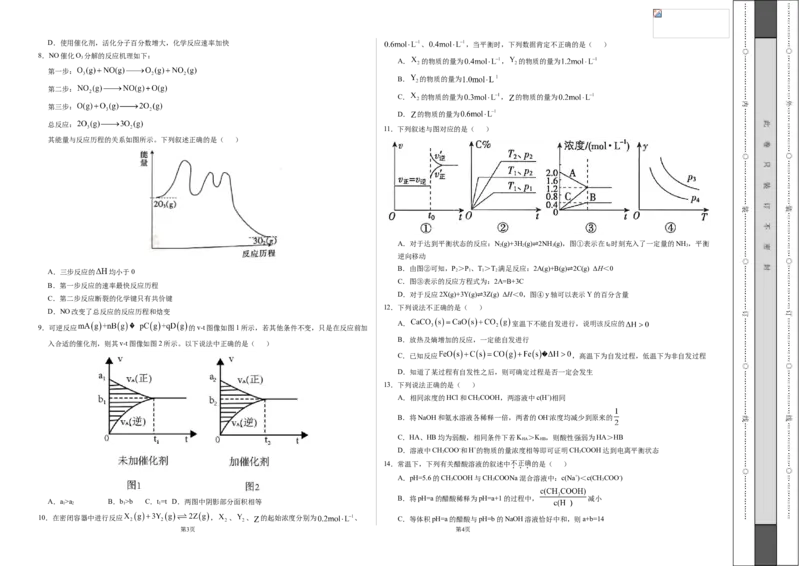
11.下列叙述与图对应的是( )
其能量与反应历程的关系如图所示。下列叙述正确的是( )
A.对于达到平衡状态的反应:N(g)+3H(g) 2NH (g),图①表示在t 时刻充入了一定量的NH ,平衡
2 2 3 0 3
逆向移动
⇌
B.由图②可知,P>P、T>T 满足反应:2A(g)+B(g) 2C(g) ΔH<0
A.三步反应的 均小于0 2 1 1 2
C.图③表示的反应方程式为:2A=B+3C
B.第一步反应的速率最快反应历程 ⇌
D.对于反应2X(g)+3Y(g) 3Z(g) ΔH<0,图④y轴可以表示Y的百分含量
C.第二步反应断裂的化学键只有共价键
12.下列说法不正确的是( )
D.NO改变了总反应的反应历程和焓变 ⇌
A. 室温下不能自发进行,说明该反应的
9.可逆反应 的v-t图像如图1所示,若其他条件不变,只是在反应前加
B.放热及熵增加的反应,一定能自发进行
入合适的催化剂,则其v-t图像如图2所示。以下说法中正确的是( )
C.已知反应 ,高温下为自发过程,低温下为非自发过程
D.知道了某过程有自发性之后,则可确定过程是否一定会发生
13.下列说法正确的是( )
A.相同浓度的HCl和CHCOOH,两溶液中c(H+)相同
3
B.将NaOH和氨水溶液各稀释一倍,两者的OH-浓度均减少到原来的
C.HA、HB均为弱酸,相同条件下若K >K ,则酸性强弱为HA>HB
HA HB
D.溶液中CHCOO-和H+的物质的量浓度相等即可证明CHCOOH达到电离平衡状态
3 3
14.常温下,下列有关醋酸溶液的叙述中不正确的是( )
A.pH=5.6的CHCOOH与CHCOONa混合溶液中:c(Na+)<c(CHCOO-)
3 3 3
B.将pH=a的醋酸稀释为pH=a+1的过程中, 减小
A.a>a B.b>b C.t=t D.两图中阴影部分面积相等
1 2 1 1
10.在密闭容器中进行反应 , 、 、 的起始浓度分别为 、 C.等体积pH=a的醋酸与pH=b的NaOH溶液恰好中和,则a+b=14
第3页 第4页………………○………………线………………○………………订………………○………………装………………○………………外………………○………………
______________________:号考_______________:级班_____________:名姓______________:校学
…
………………○………………线………………○………………订………………○………………装………………○………………内………………○………………
D.向等体积pH均为2的醋酸和硫酸中分别加入足量锌粒,产生气体的量前者大于后者 18.(9分)下表是不同温度下水的离子积数据:
15.一定温度下,用水稀释 的一元弱酸 ,随着稀释的进行,下列数值一定增大的是( 表 温度/℃ 25 t t
1 2
示水的离子积, 表示 的电离常数)( ) 水的离子积 1×10-14 a 1×10-12
试回答以下问题:
A. B. C. D.
(1)若25<t<t,则a____1×10-14(填“>”、“<”或“=”)。
1 2
(2)在t℃下,pH=2的稀硫酸溶液中,水电离产生的H+浓度为c(H+)=____。
2
16.NaOH标准溶液的配制和标定,需经过NaOH溶液配制、基准物质HC O•2H O的称量以及用NaOH溶
2 2 4 2
(3)t℃下,将pH=11的苛性钠溶液V L与pH=1的稀硫酸V L混合(体积为原两溶液体积之和),所得混
2 1 2
液滴定等操作。下列有关说法正确的是( )
合溶液的pH=2,则V:V=_____。
1 2
(4)t℃下,取相同体积、相同pH的醋酸和盐酸,各稀释100倍后其pH大小关系为:pH(醋酸)___pH(盐
2
酸)(填“大于”、“小于”或“等于”。下同);稀释后溶液分别用等浓度的NaOH稀溶液中和至pH=7,则
消耗的NaOH溶液的体积大小关系为:V(醋酸)_____V(盐酸)。
(5)t℃时,HF的K=6.4×10-4,则此温度下0.1mol·L-1HF溶液的c(H+)=______mol·L-1。
2 a
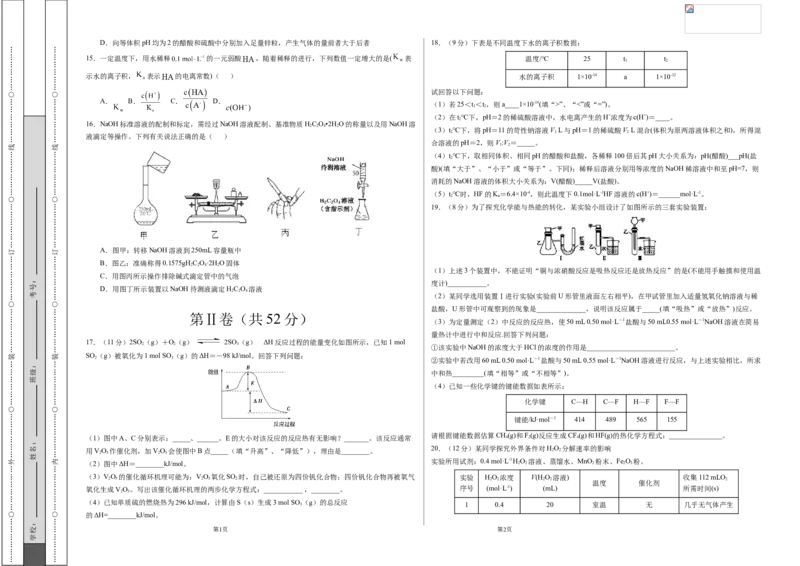
19.(8分)为了探究化学能与热能的转化,某实验小组设计了如图所示的三套实验装置:
A.图甲:转移NaOH溶液到250mL容量瓶中
B.图乙:准确称得0.1575gH C O·2H O固体
2 2 4 2
(1)上述3个装置中,不能证明“铜与浓硝酸反应是吸热反应还是放热反应”的是(不能用手触摸和使用温
C.用图丙所示操作排除碱式滴定管中的气泡
度计)___________。
D.用图丁所示装置以NaOH待测液滴定HC O 溶液
2 2 4
(2)某同学选用装置Ⅰ进行实验(实验前U形管里液面左右相平),在甲试管里加入适量氢氧化钠溶液与稀
盐酸,U形管中可观察到的现象是______________,说明该反应属于_____(填“吸热”或“放热”)反应。
第Ⅱ卷(共 52 分)
(3)为定量测定(2)中反应的反应热,使50 mL 0.50 mol·L-1盐酸与50 mL0.55 mol·L-1NaOH溶液在简易
量热计中进行中和反应.回答下列问题:
17.(11分)2SO (g)+O(g) 2SO (g) ΔH反应过程的能量变化如图所示,已知1 mol
2 2 3
①该实验中NaOH的浓度大于HCl的浓度的作用是_________________________。
SO (g)被氧化为1 mol SO (g)的ΔH=-98 kJ/mol。回答下列问题:
2 3 ②实验中若改用60 mL 0.50 mol·L-1盐酸与50 mL 0.55 mol·L-1NaOH溶液进行反应,与上述实验相比,所求
中和热_________(填“相等”或“不相等”)。
(4)已知一些化学键的键能数据如表所示:
化学键 C—H C—F H—F F—F
键能/kJ·mol-1 414 489 565 155
请根据键能数据估算CH(g)和F(g)反应生成CF(g)和HF(g)的热化学方程式:_______________。
(1)图中A、C分别表示:_____、______。E的大小对该反应的反应热有无影响?_______。该反应通常 4 2 4
20.(12分)某同学探究外界条件对HO 分解速率的影响
用VO 作催化剂,加VO 会使图中B点_____(填“升高”、“降低”),理由是________。 2 2
2 5 2 5
实验所用试剂:0.4 mol·L-1 HO 溶液、蒸馏水、MnO 粉末、Fe O 粉。
(2)图中ΔH=________kJ/mol。 2 2 2 2 3
(3)VO 的催化循环机理可能为:VO 氧化SO 时,自己被还原为四价钒化合物;四价钒化合物再被氧气 实验 HO 浓度 V(H O 溶液) 收集112 mLO
2 5 2 5 2 2 2 2 2 2
温度 催化剂
氧化生成VO。写出该催化循环机理的两步化学方程式:___________ ,________。 序号 (mol·L-1) (mL) 所需时间(s)
2 5
(4)已知单质硫的燃烧热为296 kJ/mol,计算由S(s)生成3 mol SO (g)的总反应
3 1 0.4 20 室温 无 几乎无气体产生
的ΔH=________kJ/mol。
第1页 第2页………………○………………内………………○………………装………………○………………订………………○………………线………………○………………
此
卷
只
装
订
不
密
封
………………○………………外………………○………………装………………○………………订………………○………………线………………○………………
2 0.4 20 50℃水浴 无 296
3 0.4 20 室温 0.5 g a 45
4 0.4 20 室温 0.5 g MnO 粉末 100
2
5 0.4 b 室温 a >45
(1)实验1、2的目的是其他条件相同时,研究____对HO 分解速率的影响。
2 2
(2)表中a处所用试剂为______。对比实验3、4可得出的结论是_____________________。
(3)写出实验③中HO 分解的化学方程式:______________________________;
2 2
(3)实验3、5是其他条件相同时,探究浓度对该化学反应速率的影响。b处取用10 mL 0.4 mol·L-1 HO 溶
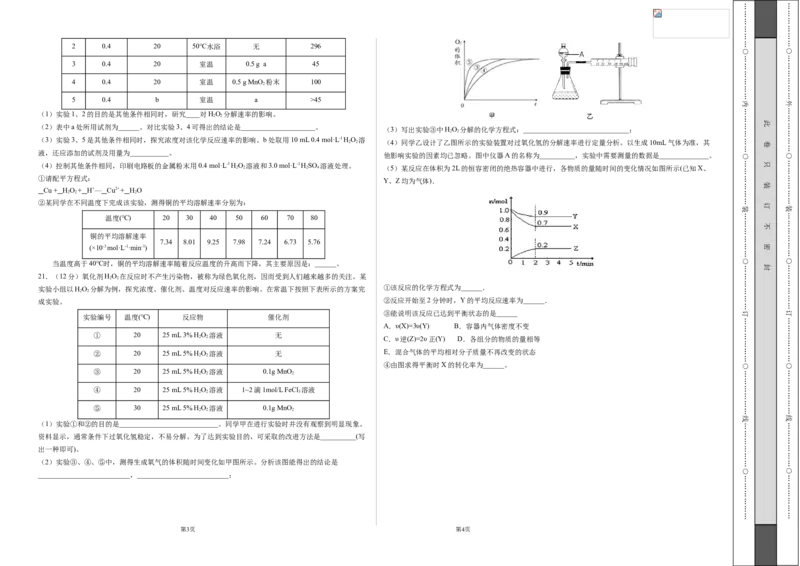
2 2 (4)同学乙设计了乙图所示的实验装置对过氧化氢的分解速率进行定量分析。以生成10mL气体为准,其
液,还应添加的试剂及用量为___________。
他影响实验的因素均已忽略。图中仪器A的名称为__________,实验中需要测量的数据是______________。
(4)控制其他条件相同,印刷电路板的金属粉末用0.4 mol·L-1 HO 溶液和3.0 mol·L-1 HSO 溶液处理。
2 2 2 4 (5)某反应在体积为2L的恒容密闭的绝热容器中进行,各物质的量随时间的变化情况如图所示(已知X、
①请配平方程式:
Y、Z均为气体).
Cu + HO + H+— Cu2+ + HO
2 2 2
②某同学在不同温度下完成该实验,测得铜的平均溶解速率分别为:
温度(℃) 20 30 40 50 60 70 80
铜的平均溶解速率
7.34 8.01 9.25 7.98 7.24 6.73 5.76
(×10-3 mol·L-1·min-1)
当温度高于40℃时,铜的平均溶解速率随着反应温度的升高而下降,其主要原因是:______。
21.(12分)氧化剂HO 在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。某
2 2
实验小组以HO 分解为例,探究浓度、催化剂、温度对反应速率的影响。在常温下按照下表所示的方案完 ①该反应的化学方程式为______.
2 2
成实验。 ②反应开始至2分钟时,Y的平均反应速率为______.
③能说明该反应已达到平衡状态的是______
实验编号 温度(℃) 反应物 催化剂
A.υ(X)=3υ(Y) B.容器内气体密度不变
① 20 25 mL 3% HO 溶液 无
2 2 C.υ逆(Z)=2υ正(Y) D.各组分的物质的量相等
② 20 25 mL 5% HO 溶液 无 E.混合气体的平均相对分子质量不再改变的状态
2 2
④由图求得平衡时X的转化率为______。
③ 20 25 mL 5% HO 溶液 0.1g MnO
2 2 2
④ 20 25 mL 5% HO 溶液 1~2滴1mol/L FeCl 溶液
2 2 3
⑤ 30 25 mL 5% HO 溶液 0.1g MnO
2 2 2
(1)实验①和②的目的是____________________________。同学甲在进行实验时并没有观察到明显现象。
资料显示,通常条件下过氧化氢稳定,不易分解。为了达到实验目的,可采取的改进方法是__________(写
出一种即可)。
(2)实验③、④、⑤中,测得生成氧气的体积随时间变化如甲图所示。分析该图能得出的结论是
__________________________,__________________________;
第3页 第4页………………○………………线………………○………………订………………○………………装………………○………………外………………○………………
______________________:号考_______________:级班_____________:名姓______________:校学
…
………………○………………线………………○………………订………………○………………装………………○………………内………………○………………
第1页 第2页