文档内容
绝密★启用前|学科网考试研究中心命制
上学期期末测试卷 02
高二化学
(考试时间:90分钟 试卷满分:100分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Cu-64
第Ⅰ卷(选择题 共 48 分)
一、选择题:本题共16个小题,每小题3分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.关于化学反应热效应的叙述中,正确的是( )
A.化学反应中只伴随热量的变化
B.放热反应在常温下就一定很容易发生
C.铝热反应属于放热反应
D.在测定中和热的实验中,测定和记录反应前后温度时,只记录一次数据即可
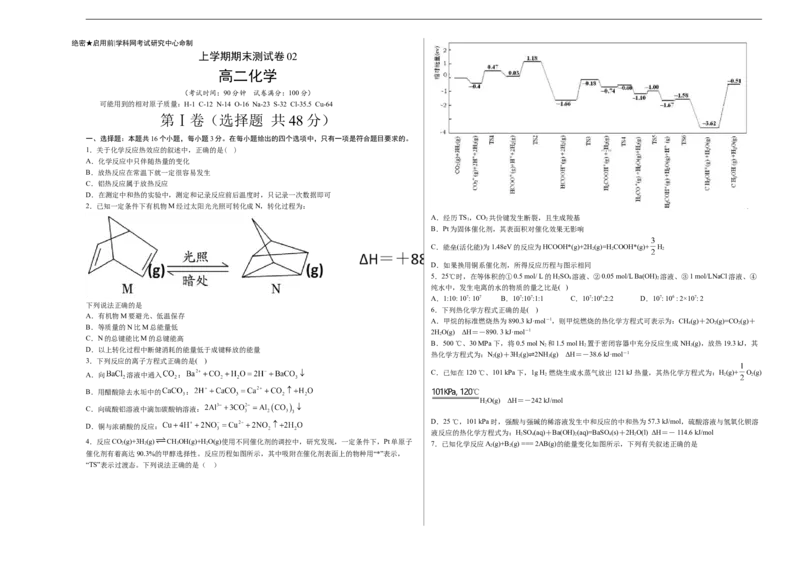
2.已知一定条件下有机物M经过太阳光光照可转化成N,转化过程为:
A.经历TS ,CO 共价键发生断裂,且生成羧基
1 2
B.Pt为固体催化剂,其表面积对催化效果无影响
C.能垒(活化能)为1.48eV的反应为HCOOH*(g)+2H (g)=HCOOH*(g)+ H
2 2 2
D.如果换用铜系催化剂,所得反应历程与图示相同
5.25℃时,在等体积的①0.5 mol/ L的HSO 溶液、②0.05 mol/L Ba(OH) 溶液、③1 mol/LNaCl溶液、④
2 4 2
纯水中,发生电离的水的物质的量之比是( )
A.1:10: 107: 107 B.107:107:1:1 C.107:106:2:2 D.107: 106 : 2×107: 2
下列说法正确的是
6.下列热化学方程式正确的是( )
A.有机物M要避光、低温保存
A.甲烷的标准燃烧热为 890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH(g)+2O(g)=CO (g)+
4 2 2
B.等质量的N比M总能量低
2HO(g) ΔH=-890. 3 kJ·mol-1
2
C.N的总键能比M的总键能高
B.500 ℃、30 MPa 下,将 0.5 mol N 和1.5 mol H 置于密闭容器中充分反应生成 NH (g),放热19.3 kJ,其
2 2 3
D.以上转化过程中断健消耗的能量低于成键释放的能量
热化学方程式为:N(g)+3H(g) 2NH (g) ΔH=-38.6 kJ·mol-1
2 2 3
3.下列反应的离子方程式正确的是( )
⇌
C.已知在 120 ℃、101 kPa 下,1g H 燃烧生成水蒸气放出 121 kJ 热量,其热化学方程式为:H(g)+ O(g)
A.向 溶液中通入 : 2 2 2
B.用醋酸除去水垢中的 :
HO(g) ΔH=-242 kJ/mol
2
C.向硫酸铝溶液中滴加碳酸钠溶液:
D.25 ℃,101 kPa 时,强酸与强碱的稀溶液发生中和反应的中和热为 57.3 kJ/mol,硫酸溶液与氢氧化钡溶
D.铜与浓硝酸的反应:
液反应的热化学方程式为:HSO (aq)+Ba(OH) (aq)=BaSO (s)+2HO(l) ΔH=- 114.6 kJ/mol
2 4 2 4 2
4.反应CO(g)+3H(g) CHOH(g)+H O(g)使用不同催化剂的调控中,研究发现,一定条件下,Pt单原子
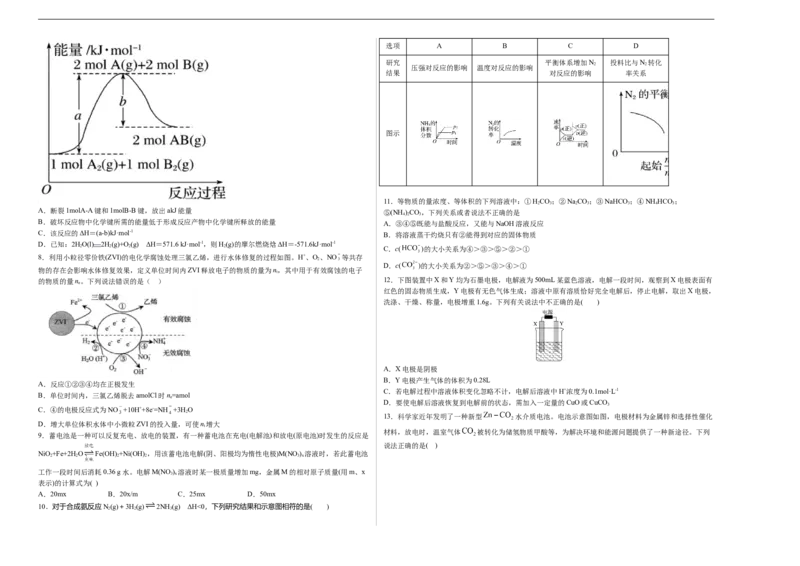
2 2 3 2 7.已知化学反应A(g)+B (g) === 2AB(g)的能量变化如图所示,下列有关叙述正确的是
2 2
催化剂有着高达90.3%的甲醇选择性。反应历程如图所示,其中吸附在催化剂表面上的物种用“*”表示,
“TS”表示过渡态。下列说法正确的是( )选项 A B C D
研究 平衡体系增加N 投料比与N 转化
2 2
压强对反应的影响 温度对反应的影响
结果 对反应的影响 率关系
图示
11.等物质的量浓度、等体积的下列溶液中:①HCO;②NaCO;③NaHCO ;④NH HCO ;
2 3 2 3 3 4 3
A.断裂1molA-A键和1molB-B键,放出akJ能量 ⑤(NH )CO,下列关系或者说法不正确的是
4 2 3
B.破坏反应物中化学键所需的能量低于形成反应产物中化学键所释放的能量 A.③④⑤既能与盐酸反应,又能与NaOH溶液反应
C.该反应的ΔH=(a-b)kJ·mol-1
B.将溶液蒸干灼烧只有②能得到对应的固体物质
D.已知:2HO(l) 2H(g)+O(g) ΔH=571.6 kJ·mol-1,则H(g)的摩尔燃烧焓ΔH=-571.6kJ·mol-1
2 2 2 2 C.c( )的大小关系为④>③>⑤>②>①
8.利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图。H+、O、NO 等共存
2
D.c( )的大小关系为②>⑤>③>④>①
物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为n,其中用于有效腐蚀的电子
t
的物质的量n。下列说法错误的是( ) 12.下图装置中X和Y均为石墨电极,电解液为500mL某蓝色溶液,电解一段时间,观察到X电极表面有
e
红色的固态物质生成,Y电极有无色气体生成;溶液中原有溶质恰好完全电解后,停止电解,取出X电极,
洗涤、干燥、称量,电极增重1.6g。下列有关说法中不正确的是( )
A.X电极是阴极
B.Y电极产生气体的体积为0.28L
A.反应①②③④均在正极发生
C.若电解过程中溶液体积变化忽略不计,电解后溶液中H+浓度为0.1mol·L-1
B.单位时间内,三氯乙烯脱去amolCl时n=amol
e
D.要使电解后溶液恢复到电解前的状态,需加入一定量的CuO或CuCO
3
C.④的电极反应式为NO +10H++8e-=NH +3H O
2
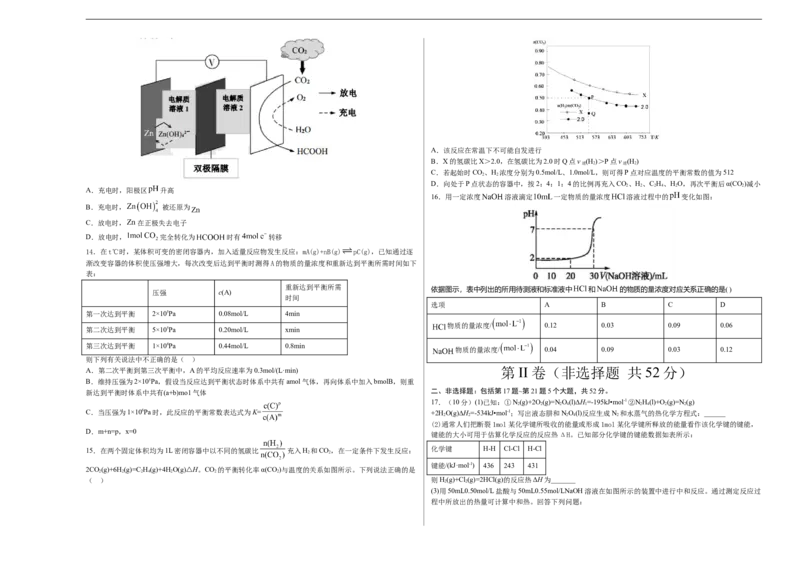
13.科学家近年发明了一种新型 水介质电池。电池示意图如图,电极材料为金属锌和选择性催化
D.增大单位体积水体中小微粒ZVI的投入量,可使n增大
t
材料,放电时,温室气体 被转化为储氢物质甲酸等,为解决环境和能源问题提供了一种新途径。下列
9.蓄电池是一种可以反复充电、放电的装置,有一种蓄电池在充电(电解池)和放电(原电池)时发生的反应是
说法正确的是( )
NiO+Fe+2H O Fe(OH) +Ni(OH) ,用该蓄电池电解(阴、阳极均为惰性电极)M(NO) 溶液时,若此蓄电池
2 2 2 2 3 x
工作一段时间后消耗0.36 g水。电解M(NO) 溶液时某一极质量增加mg,金属M的相对原子质量(用m、x
3 x
表示)的计算式为( )
A.20mx B.20x/m C.25mx D.50mx
10.对于合成氨反应N(g)+3H(g) 2NH (g) ΔH<0,下列研究结果和示意图相符的是( )
2 2 3A.该反应在常温下不可能自发进行
B.X的氢碳比X>2.0,在氢碳比为2.0时Q点v (H )>P点v (H )
逆 2 逆 2
C.若起始时CO、H 浓度分别为0.5mol/L、1.0mol/L,则可得P点对应温度的平衡常数的值为512
2 2
D.向处于P点状态的容器中,按2:4:1:4的比例再充入CO、H、C H、HO,再次平衡后α(CO)减小
2 2 2 4 2 2
A.充电时,阳极区 升高
16.用一定浓度 溶液滴定 一定物质的量浓度 溶液过程中的 变化如图:
B.充电时, 被还原为
C.放电时, 在正极失去电子
D.放电时, 完全转化为 时有 转移
14.在t℃时,某体积可变的密闭容器内,加入适量反应物发生反应:mA(g)+nB(g) pC(g),已知通过逐
渐改变容器的体积使压强增大,每次改变后达到平衡时测得A的物质的量浓度和重新达到平衡所需时间如下
表:
重新达到平衡所需
依据图示,表中列出的所用待测液和标准液中 和 的物质的量浓度对应关系正确的是( )
压强 c(A)
时间
选项 A B C D
第一次达到平衡 2×105Pa 0.08mol/L 4min
物质的量浓度/ 0.12 0.03 0.09 0.06
第二次达到平衡 5×105Pa 0.20mol/L xmin
第三次达到平衡 1×106Pa 0.44mol/L 0.8min
物质的量浓度/ 0.04 0.09 0.03 0.12
则下列有关说法中不正确的是( )
A.第二次平衡到第三次平衡中,A的平均反应速率为0.3mol/(L·min) 第 II 卷(非选择题 共 52 分)
B.维持压强为2×105Pa,假设当反应达到平衡状态时体系中共有amol气体,再向体系中加入bmolB,则重
新达到平衡时体系中共有(a+b)mo1气体
二、非选择题:包括第17题~第21题5个大题,共52分。
17.(10分)(1)已知:①N(g)+2O(g)=NO(l)∆H=-195kJ•mol-1 ②NH(l)+O (g)=N(g)
2 2 2 4 1 2 4 2 2
C.当压强为1×106Pa时,此反应的平衡常数表达式为K= +2H O(g)∆H=-534kJ•mol-1;写出液态肼和NO(l)反应生成N 和水蒸气的热化学方程式:______
2 2 2 4 2
(2)通常人们把断裂1mol某化学键所吸收的能量或形成1mol某化学键所释放的能量看作该化学键的键能,
D.m+n=p,x=0
键能的大小可用于估算化学反应的反应热ΔH。已知部分化学键的键能数据如表所示:
15.在两个固定体积均为1L密闭容器中以不同的氢碳比 充入H 和CO,在一定条件下发生反应: 化学键 H-H Cl-Cl H-Cl
2 2
键能/(kJ·mol-1) 436 243 431
2CO(g)+6H(g)=C H(g)+4HO(g)△H。CO 的平衡转化率α(CO)与温度的关系如图所示。下列说法正确的是
2 2 2 4 2 2 2
( ) 则H(g)+Cl (g)=2HCl(g)的反应热ΔH为_______
2 2
(3)用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应。通过测定反应过
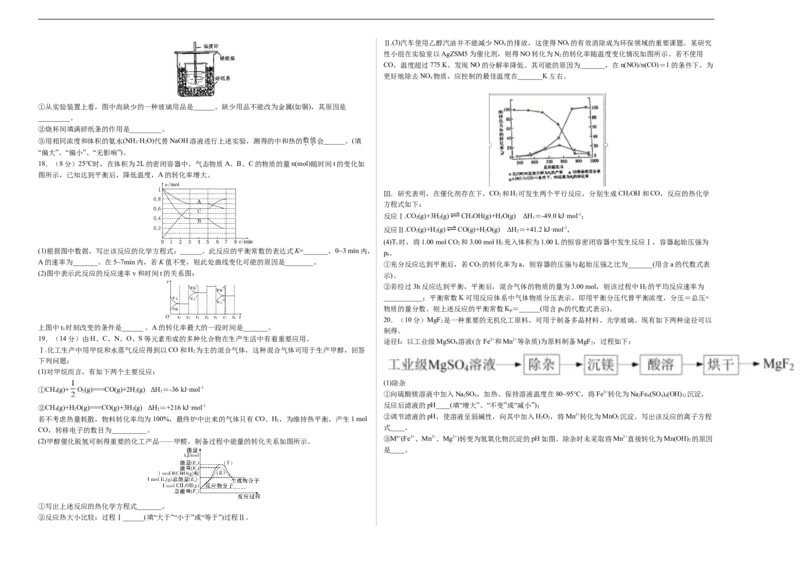
程中所放出的热量可计算中和热。回答下列问题:Ⅱ.(3)汽车使用乙醇汽油并不能减少NO 的排放,这使得NO 的有效消除成为环保领域的重要课题。某研究
x x
性小组在实验室以AgZSM5为催化剂,则得NO转化为N 的转化率随温度变化情况如图所示。若不使用
2
CO,温度超过775 K,发现NO的分解率降低。其可能的原因为_______,在n(NO)/n(CO)=1的条件下,为
更好地除去NO 物质,应控制的最佳温度在_______K左右。
x
①从实验装置上看,图中尚缺少的一种玻璃用品是______。缺少用品不能改为金属(如铜),其原因是
_________。
②烧杯间填满碎纸条的作用是_________。
③用相同浓度和体积的氨水(NH ·H O)代替NaOH溶液进行上述实验,测得的中和热的数值会______。(填
3 2
“偏大”、“偏小”、“无影响”)。
18.(8分)25℃时,在体积为2L的密闭容器中,气态物质A、B、C的物质的量n(mol)随时间t的变化如
图所示,已知达到平衡后,降低温度,A的转化率增大。
Ⅲ.研究表明,在催化剂存在下,CO 和H 可发生两个平行反应,分别生成CHOH和CO,反应的热化学
2 2 3
方程式如下:
反应Ⅰ.CO (g)+3H(g) CHOH(g)+H O(g) ΔH=-49.0 kJ·mol-1;
2 2 3 2 1
反应Ⅱ.CO (g)+H(g) CO(g)+HO(g) ΔH=+41.2 kJ·mol-1,
2 2 2 2
(4)T 时,将1.00 mol CO 和3.00 mol H 充入体积为1.00 L的恒容密闭容器中发生反应Ⅰ,容器起始压强为
1 2 2
(1)根据图中数据,写出该反应的化学方程式:______。此反应的平衡常数的表达式K=_______,0~3 min内,
p。
0
A的速率为_______。在5~7min内,若K值不变,则此处曲线变化可能的原因是________。
①充分反应达到平衡后,若CO 的转化率为a,则容器的压强与起始压强之比为_______(用含a的代数式表
2
(2)图中表示此反应的反应速率v和时间t的关系图:
示)。
②若经过3h反应达到平衡,平衡后,混合气体的物质的量为3.00 mol,则该过程中H 的平均反应速率为
2
___________;平衡常数K可用反应体系中气体物质分压表示,即用平衡分压代替平衡浓度,分压=总压×
物质的量分数。则上述反应的平衡常数K=______(用含p 的代数式表示)。
p 0
20.(10分)MgF 是一种重要的无机化工原料,可用于制备多晶材料、光学玻璃。现有如下两种途径可以
2
上图中t 时刻改变的条件是______ 。A的转化率最大的一段时间是_______。
3 制得。
19.(14分)由H、C、N、O、S等元素形成的多种化合物在生产生活中有着重要应用。
途径Ⅰ:以工业级MgSO 溶液(含Fe3+和Mn2+等杂质)为原料制备MgF ,过程如下:
4 2
Ⅰ.化工生产中用甲烷和水蒸气反应得到以CO和H 为主的混合气体,这种混合气体可用于生产甲醇,回答
2
下列问题:
(1)对甲烷而言,有如下两个主要反应:
(1)除杂
①CH(g)+ O(g)===CO(g)+2H (g) ΔH =-36 kJ·mol-1
4 2 2 1 ①向硫酸镁溶液中加入NaSO ,加热、保持溶液温度在80~95℃,将Fe3+转化为NaFe (SO )(OH) 沉淀,
2 4 2 6 4 4 12
反应后滤液的pH____(填“增大”、“不变”或“减小”);
②CH(g)+HO(g)===CO(g)+3H (g) ΔH =+216 kJ·mol-1
4 2 2 2
②调节滤液的pH,使溶液呈弱碱性,向其中加入HO,将Mn2+转化为MnO 沉淀,写出该反应的离子方程
若不考虑热量耗散,物料转化率均为100%,最终炉中出来的气体只有CO、H,为维持热平衡,产生1 mol 2 2 2
2
式____。
CO,转移电子的数目为__________。
③Mn+(Fe3+、Mn2+、Mg2+)转变为氢氧化物沉淀的pH如图。除杂时未采取将Mn2+直接转化为Mn(OH) 的原因
(2)甲醇催化脱氢可制得重要的化工产品——甲醛,制备过程中能量的转化关系如图所示。 2
是____。
①写出上述反应的热化学方程式_______。
②反应热大小比较:过程Ⅰ______(填“大于”“小于”或“等于”)过程Ⅱ。(2)沉镁
向“除杂”后滤液中加入NaCO,同时产生气体,写出生成Mg(OH) CO 的化学方程式____。
2 3 2 2 3
(3)酸溶
将所得Mg(OH) CO 置于____(填“玻璃”、“聚丙烯”或“石英”)烧杯中,加入适量的HF,搅拌溶解。
2 2 3
途径Ⅱ:以磷肥副产物HSiF 溶解MgO,充分反应后过滤、得MgSiF 溶液,浓缩得MgSiF ·6H O,300℃条
2 6 6 6 2
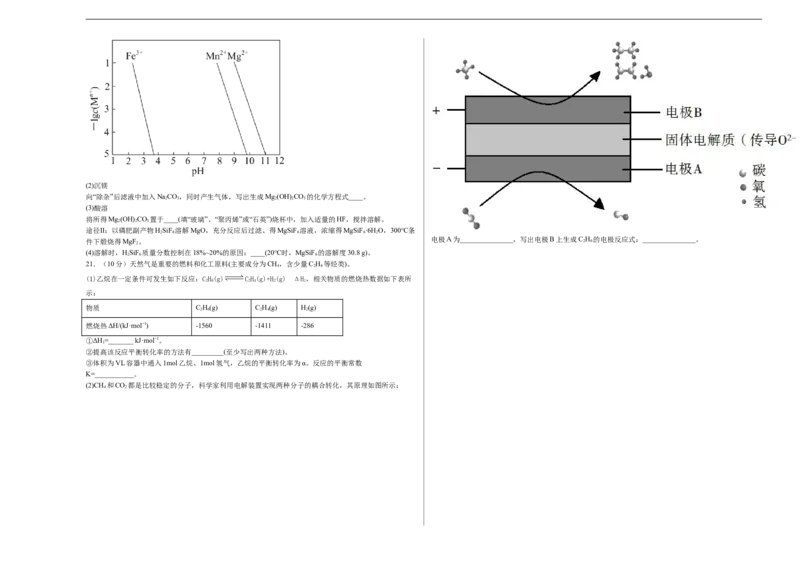
电极A为_______________,写出电极B上生成C H 的电极反应式:_______________。
件下煅烧得MgF 。 2 6
2
(4)溶解时,HSiF 质量分数控制在18%~20%的原因:____(20℃时,MgSiF 的溶解度30.8 g)。
2 6 6
21.(10分)天然气是重要的燃料和化工原料(主要成分为CH,含少量C H 等烃类)。
4 2 6
(1)乙烷在一定条件可发生如下反应:CH(g) CH(g)+H(g) ΔH,相关物质的燃烧热数据如下表所
2 6 2 4 2 1
示:
物质 C H(g) C H(g) H(g)
2 6 2 4 2
燃烧热ΔH/(kJ·mol−1) -1560 -1411 -286
①ΔH=_______ kJ·mol−1。
1
②提高该反应平衡转化率的方法有_________(至少写出两种方法)。
③体积为VL容器中通入1mol乙烷、1mol氢气,乙烷的平衡转化率为α。反应的平衡常数
K=___________。
(2)CH 和CO 都是比较稳定的分子,科学家利用电解装置实现两种分子的耦合转化,其原理如图所示:
4 2