文档内容
绝密★启用前|学科网考试研究中心命制 C.原电池的两极一定是由活动性不同的两种金属组成
上学期期末测试卷 03 D.从理论上讲,任何能自发进行的释放能量的氧化还原反应都可设计成原电池
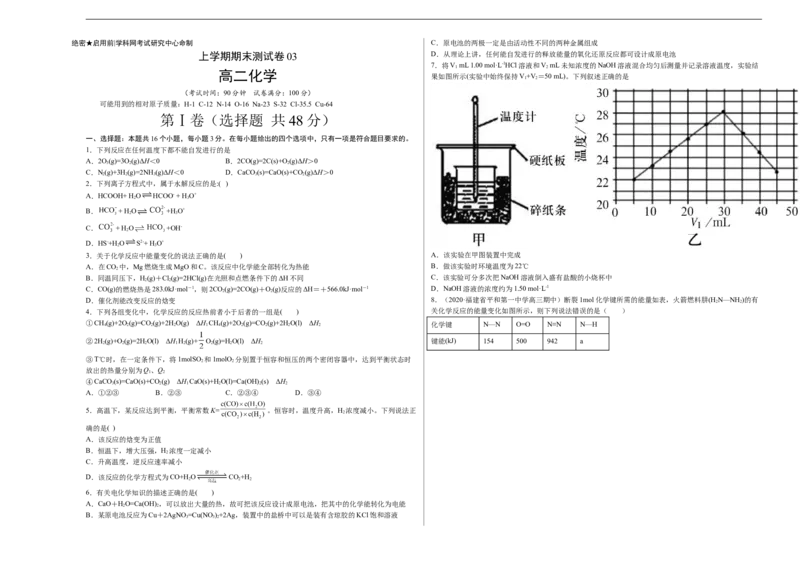
7.将V mL 1.00 mol·L-1HCl溶液和V mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结
1 2
高二化学
果如图所示(实验中始终保持V+V=50 mL)。下列叙述正确的是
1 2
(考试时间:90分钟 试卷满分:100分)
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 S-32 Cl-35.5 Cu-64
第Ⅰ卷(选择题 共 48 分)
一、选择题:本题共16个小题,每小题3分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列反应在任何温度下都不能自发进行的是
A.2O(g)=3O(g)ΔH<0 B.2CO(g)=2C(s)+O (g)ΔH>0
3 2 2
C.N(g)+3H(g)=2NH (g)ΔH<0 D.CaCO (s)=CaO(s)+CO (g)ΔH>0
2 2 3 3 2
2.下列离子方程式中,属于水解反应的是:( )
A.HCOOH+ H O HCOO- + H O+
2 3
B. + H O +H O+
2 3
C. + H O +OH-
2
D.HS-+H O S2-+ H O+
2 3
3.关于化学反应中能量变化的说法正确的是( ) A.该实验在甲图装置中完成
A.在CO 中,Mg燃烧生成MgO和C。该反应中化学能全部转化为热能 B.做该实验时环境温度为22℃
2
B.同温同压下,H(g)+Cl(g)=2HCl(g)在光照和点燃条件下的ΔH不同 C.该实验可分多次把NaOH溶液倒入盛有盐酸的小烧杯中
2 2
C.CO(g)的燃烧热是283.0kJ·mol-1,则2CO(g)=2CO(g)+O(g)反应的ΔH=+566.0kJ·mol-1 D.NaOH溶液的浓度约为1.50 mol·L-1
2 2
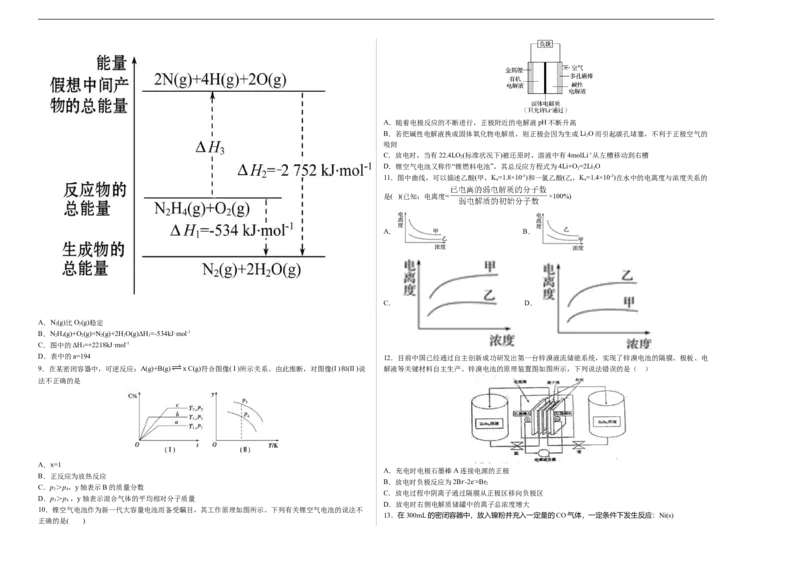
D.催化剂能改变反应的焓变 8.(2020·福建省平和第一中学高三期中)断裂1mol化学键所需的能量如表,火箭燃料肼(H N—NH)的有
2 2
4.下列各组变化中,化学反应的反应热前者小于后者的一组是( ) 关化学反应的能量变化如图所示,则下列说法错误的是( )
①CH 4 (g)+2O 2 (g)=CO 2 (g)+2H 2 O(g) ΔH 1 CH 4 (g)+2O 2 (g)=CO 2 (g)+2H 2 O(l) ΔH 2 化学键 N—N O=O N≡N N—H
②2H(g)+O(g)=2HO(l) ΔH H(g)+ O(g)=HO(l) ΔH 键能(kJ) 154 500 942 a
2 2 2 1 2 2 2 2
③T℃时,在一定条件下,将1molSO 和1molO 分别置于恒容和恒压的两个密闭容器中,达到平衡状态时
2 2
放出的热量分别为Q、Q
1 2
④CaCO (s)=CaO(s)+CO (g) ΔH CaO(s)+H O(l)=Ca(OH) (s) ΔH
3 2 1 2 2 2
A.①②③ B.②③ C.②③④ D.③④
5.高温下,某反应达到平衡,平衡常数K= 。恒容时,温度升高,H 浓度减小。下列说法正
2
确的是( )
A.该反应的焓变为正值
B.恒温下,增大压强,H 浓度一定减小
2
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+HO CO+H
2 2 2
6.有关电化学知识的描述正确的是( )
A.CaO+HO=Ca(OH) ,可以放出大量的热,故可把该反应设计成原电池,把其中的化学能转化为电能
2 2
B.某原电池反应为Cu+2AgNO=Cu(NO)+2Ag,装置中的盐桥中可以是装有含琼胶的KCl饱和溶液
3 3 2A.随着电极反应的不断进行,正极附近的电解液pH不断升高
B.若把碱性电解液换成固体氧化物电解质,则正极会因为生成LiO而引起碳孔堵塞,不利于正极空气的
2
吸附
C.放电时,当有22.4LO (标准状况下)被还原时,溶液中有4molLi+从左槽移动到右槽
2
D.锂空气电池又称作“锂燃料电池”,其总反应方程式为4Li+O=2Li O
2 2
11.图中曲线,可以描述乙酸(甲,K=1.8×10-5)和一氯乙酸(乙,K=1.4×10-3)在水中的电离度与浓度关系的
a a
是( )(已知:电离度= ×100%)
A. B.
C. D.
A.N(g)比O(g)稳定
2 2
B.NH(g)+O(g)=N(g)+2HO(g)ΔH =-534kJ·mol-1
2 4 2 2 2 1
C.图中的ΔH=+2218kJ·mol-1
3
D.表中的a=194 12.目前中国已经通过自主创新成功研发出第一台锌溴液流储能系统,实现了锌溴电池的隔膜、极板、电
9.在某密闭容器中,可逆反应:A(g)+B(g) x C(g)符合图像( I )所示关系。由此推断,对图像(I )和(II )说 解液等关键材料自主生产。锌溴电池的原理装置图如图所示,下列说法错误的是( )
法不正确的是
A.x=1
A.充电时电极石墨棒A连接电源的正极
B.正反应为放热反应
B.放电时负极反应为2Br--2e-=Br
2
C.p>p,y轴表示B的质量分数
3 4
C.放电过程中阴离子通过隔膜从正极区移向负极区
D.p>p ,y轴表示混合气体的平均相对分子质量
3 4
D.放电时右侧电解质储罐中的离子总浓度增大
10.锂空气电池作为新一代大容量电池而备受瞩目,其工作原理如图所示。下列有关锂空气电池的说法不
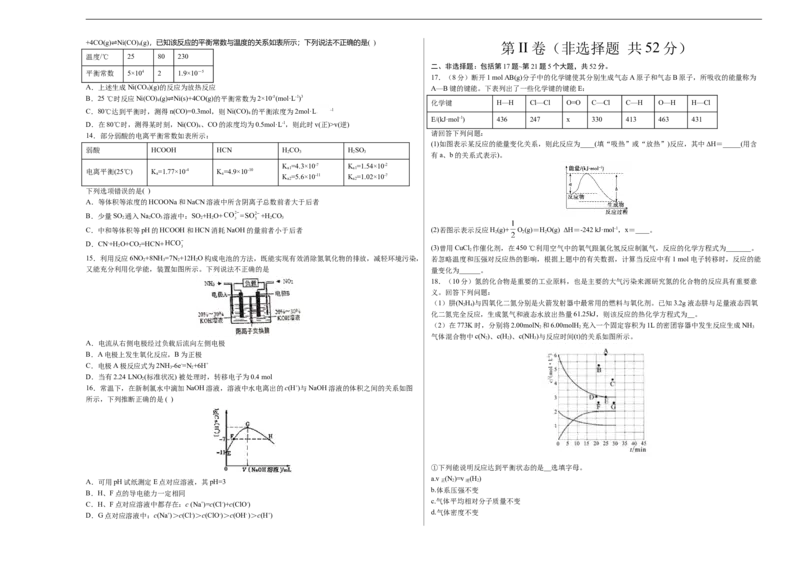
13.在300mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)
正确的是( )+4CO(g) Ni(CO) 4 (g),已知该反应的平衡常数与温度的关系如表所示;下列说法不正确的是( ) 第 II 卷(非选择题 共 52 分)
温度/℃ ⇌ 25 80 230
二、非选择题:包括第17题~第21题5个大题,共52分。
平衡常数 5×104 2 1.9×10-5
17.(8分)断开1 mol AB(g)分子中的化学键使其分别生成气态A原子和气态B原子,所吸收的能量称为
A.上述生成Ni(CO 4 )(g)的反应为放热反应 A—B键的键能。下表列出了一些化学键的键能E:
B.25 ℃时反应Ni(CO) (g) Ni(s)+4CO(g)的平衡常数为2×10-5(mol·L-1)3
4 化学键 H—H Cl—Cl O=O C—Cl C—H O—H H—Cl
C.80℃达到平衡时,测得n(CO)=0.3mol,则Ni(CO) 的平衡浓度为2mol·L -1
⇌ 4
E/(kJ·mol-1) 436 247 x 330 413 463 431
D.在80℃时,测得某时刻,Ni(CO) 、CO的浓度均为0.5mol·L-1,则此时v(正)>v(逆)
4
请回答下列问题:
14.部分弱酸的电离平衡常数如表所示:
(1)如图表示某反应的能量变化关系,则此反应为____(填“吸热”或“放热”)反应,其中ΔH=_____(用含
弱酸 HCOOH HCN HCO HSO
2 3 2 3 有a、b的关系式表示)。
K =4.3×10-7 K =1.54×10-2
电离平衡(25℃) K=1.77×10-4 K=4.9×10-10 a1 a1
a a K =5.6×10-11 K =1.02×10-7
a2 a2
下列选项错误的是( )
A.等体积等浓度的HCOONa和NaCN溶液中所含阴离子总数前者大于后者
B.少量SO 通入NaCO 溶液中:SO +H O+ = +H CO
2 2 3 2 2 2 3
C.中和等体积等pH的HCOOH和HCN消耗NaOH的量前者小于后者 (2)若图示表示反应H(g)+ O(g)=HO(g) ΔH=-242 kJ·mol-1,x=____。
2 2 2
D.CN-+H O+CO=HCN+
2 2 (3)曾用CuCl 作催化剂,在450 ℃利用空气中的氧气跟氯化氢反应制氯气,反应的化学方程式为_______。
2
15.利用反应6NO +8NH=7N +12H O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染, 若忽略温度和压强对反应热的影响,根据上题中的有关数据,计算当反应中有1 mol 电子转移时,反应的能
2 3 2 2
又能充分利用化学能,装置如图所示。下列说法不正确的是 量变化为______。
18.(10分)氮的化合物是重要的工业原料,也是主要的大气污染来源研究氮的化合物的反应具有重要意
义。回答下列问题:
(1)肼(N H)与四氧化二氮分别是火箭发射器中最常用的燃料与氧化剂。已知3.2g液态肼与足量液态四氧
2 4
化二氮完全反应,生成氮气和液态水放出热量61.25kJ,则该反应的热化学方程式为__。
(2)在773K时,分别将2.00molN 和6.00molH 充入一个固定容积为1L的密团容器中发生反应生成NH
2 2 3
气体混合物中c(N)、c(H)、c(NH )与反应时间(t)的关系如图所示。
2 2 3
A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.电极A极反应式为2NH -6e-=N +6H+
3 2
D.当有2.24 LNO (标准状况) 被处理时,转移电子为0.4 mol
2
16.常温下,在新制氯水中滴加NaOH溶液,溶液中水电离出的c(H+)与NaOH溶液的体积之间的关系如图
所示,下列推断正确的是 ( )
①下列能说明反应达到平衡状态的是__选填字母。
a.v (N )=v (H )
A.可用pH试纸测定E点对应溶液,其pH=3 正 2 逆 2
b.体系压强不变
B.H、F点的导电能力一定相同
c.气体平均相对分子质量不变
C.H、F点对应溶液中都存在:c (Na+)=c(Cl-)+c(ClO-)
d.气体密度不变
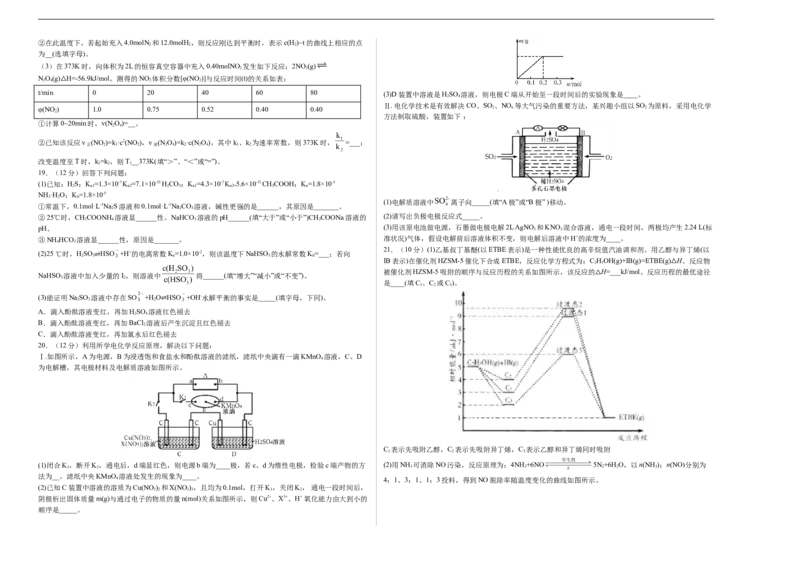
D.G点对应溶液中:c(Na+)>c(Cl-)>c(ClO-)>c(OH- )>c(H+)②在此温度下,若起始充入4.0molN 和12.0molH,则反应刚达到平衡时,表示c(H)~t的曲线上相应的点
2 2 2
为__(选填字母)。
(3)在373K时,向体积为2L的恒容真空容器中充入0.40molNO 发生如下反应:2NO (g)
2 2
NO(g) H=-56.9kJ/mol。测得的NO 体积分数[φ(NO )]与反应时间(t)的关系如表:
2 4 2 2
t/min △ 0 20 40 60 80 (3)D装置中溶液是HSO 溶液,则电极C端从开始至一段时间后的实验现象是____。
2 4
Ⅱ. 电化学技术是有效解决 CO、SO 、NO 等大气污染的重要方法,某兴趣小组以SO 为原料,采用电化学
φ(NO ) 1.0 0.75 0.52 0.40 0.40 2 x 2
2
方法制取硫酸,装置如下 :
①计算0~20min时,v(N O)=__。
2 4
②已知该反应v (NO )=k ·c2(NO ),v (N O)=k ·c(NO),其中k、k 为速率常数,则373K时, =___;
正 2 1 2 逆 2 4 2 2 4 1 2
改变温度至T时,k=k,则T__373K(填“>”、“<”或“=”)。
1 2 1
19.(12分)回答下列问题:
(1)已知:HS:K =1.3×10-7 K =7.1×10-15 HCO:K =4.3×10-7 K 5.6×10-11 CHCOOH:K=1.8×10-5
2 a1 a2 2 3 a1 a2= 3 a
NH ·H O:K=1.8×10-5
3 2 b
(1)电解质溶液中 离子向_____(填“A极”或“B极” )移动。
①常温下,0.1mol·L-1NaS溶液和0.1mol·L-1NaCO 溶液,碱性更强的是______,其原因是_______。
2 2 3
②25℃时,CHCOONH 溶液显______性。NaHCO 溶液的pH______(填“大于”或“小于”)CHCOONa溶液的 (2)请写出负极电极反应式_____。
3 4 3 3
pH。 (3)用该原电池做电源,石墨做电极电解2L AgNO 3 和KNO 3 混合溶液,通电一段时间,两极均产生2.24 L(标
③NH HCO 溶液显______性,原因是_______。 准状况)气体,假设电解前后溶液体积不变,则电解后溶液中H+的浓度为____。
4 3
21.(10分)(1)乙基叔丁基醚(以ETBE表示)是一种性能优良的高辛烷值汽油调和剂。用乙醇与异丁烯(以
(2)25 ℃时,HSO HSO +H+的电离常数K=1.0×10-2,则该温度下NaHSO 的水解常数K=___;若向
2 3 a 3 h
IB表示)在催化剂HZSM-5催化下合成ETBE,反应化学方程式为:C HOH(g)+IB(g)=ETBE(g) H。反应物
2 5
⇌
被催化剂HZSM-5吸附的顺序与反应历程的关系如图所示,该反应的 H=___kJ/mol。反应历程的最优途径
NaHSO 3 溶液中加入少量的I 2 ,则溶液中 将______(填“增大”“减小”或“不变”)。 △
是____(填C 、C 或C )。
1 2 3 △
(3)能证明NaSO 溶液中存在SO +H O HSO +OH-水解平衡的事实是_____(填字母,下同)。
2 3 2
A.滴入酚酞溶液变红,再加H
2
SO
4
溶液⇌红色褪去
B.滴入酚酞溶液变红,再加BaCl 溶液后产生沉淀且红色褪去
2
C.滴入酚酞溶液变红,再加氯水后红色褪去
20.(12分)利用所学电化学反应原理,解决以下问题:
Ⅰ.如图所示,A为电源,B为浸透饱和食盐水和酚酞溶液的滤纸,滤纸中央滴有一滴KMnO 溶液,C、D
4
为电解槽,其电极材料及电解质溶液如图所示。
C 表示先吸附乙醇,C 表示先吸附异丁烯,C 表示乙醇和异丁烯同时吸附
1 2 3
(1)闭合K,断开K,通电后,d端显红色,则电源b端为____极,若c、d为惰性电极,检验c端产物的方 (2)用NH 可消除NO污染,反应原理为:4NH +6NO 5N+6H O,以n(NH ):n(NO)分别为
1 2 3 3 2 2 3
法为__。滤纸中央KMnO 溶液处发生的现象为____。
4 4:1、3:1、1:3投料,得到NO脱除率随温度变化的曲线如图所示。
(2)已知C装置中溶液的溶质为Cu(NO ) 和X(NO),且均为0.1mol,打开K,关闭K, 通电一段时间后,
3 2 3 3 1 2
阴极析出固体质量m(g)与通过电子的物质的量n(mol)关系如图所示,则Cu2+、X3+、H+ 氧化能力由大到小的
顺序是_____。①曲线a对应的n(NH ):n(NO)=___。
3
②曲线c中NO的起始浓度为4×10-4mg/m3,从A点到B点经过0.8s,该时间段内NO的脱除速率为____。
③由图可知,无论以何种比例反应,在温度超过900℃时NO脱除率都会骤然下降,可能的原因是____(至少
写两条)。
(3)二氧化硫的催化氧化是工业上生产硫酸的主要反应O(g)+2SO(g) 2SO (g)。
2 2 3
已知:标准平衡常数Kθ= ,其中pθ为标准压强(1×105Pa),p(SO )、p(O )和p(SO )为各组
3 2 2
分的平衡分压,如p(SO )=x(SO)p,p为平衡总压,x(SO )为平衡系统中SO 的物质的量分数。SO 和O 起
3 3 3 3 2 2
始物质的量之比为2:1,反应在恒定温度和标准压强下进行,SO 的平衡产率为ω,则Kθ=____(用含ω的最
3
简式表示)。