文档内容
下学期期末原创卷03
高二化学 选择性必修2·全解全析
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
C A D A D C C C C D C A C C B B
1.C
【详解】
A.氢原子光谱的精细结构是在有外磁场的条件下出现的,在引入了角量子数后才得以解释,A错误;
B.非金属越强,元素电负性越强,F>S>As,B错误;
C. M g原子3s轨道为全充满稳定状态,半径又较小,第一电离能高于Na的,它们失去1个电子后,
Na+的最外层排布为2s2p6,Mg2+的最外层排布为3s1,Na+是稳定结构,第二电离能远高于Mg的,C正确;
D.水分子间存在氢键,故HO的熔沸点大于HS,稳定性由共价键决定的,D错误;
2 2
答案选C。
2.A
【详解】
A.X是碳,Y是硅,它们属于同主族元素,彼此化学性质一定相似,A符合题意;
B.原子核外M层上仅有两个电子的X原子为Mg、原子核外N层上仅有两个电子的Y原子可能是Ca、
Fe、Zn等,如果X是Mg、Y是Fe、Zn等,二者化学性质不相似,B不符合题意;
C.原子核外电子排布式为1s2的X原子为He,处于稳定结构,原子核外电子排布式为1s22s2的Y原子为
Be,前者是0族元素、后者是第IIA族元素,两者化学性质不相似,C不符合题意;
D.最外层只有一个电子的原子,可能是H、碱金属原子或第ⅠB族元素原子,化学性质不一定相似,D
不符合题意;
故选A。
3.D
【详解】
A.根据题意:在电场作用下,水分子瞬间凝固成“暖冰”,水分子间更易形成氢键,不存在离子键,不
是离子晶体,而NaO晶体属于离子晶体,A不正确;
2
B.“暖冰”是由水分子构成,是分子晶体,SiO 晶体是原子晶体,两者晶体类型不同,B不正确;
2
C.水分子中含有O-H键,是极性键;而HS中的H-S键也是极性键,两者的化学键类型相同,C不正
2
确;
D.“暖冰”是由水分子构成的,和普通冰相同;组成的物质没有变,其化学性质相同,D正确;
答案选D。
4.A
【详解】
A.熔融态能够导电的晶体不一定是离子晶体,可能是金属晶体,A错误;
B.不同族元素氧化物可形成同类晶体,例如氧化钠、氧化镁等均是离子晶体,B正确;
C.同族元素氧化物可形成不同类型晶体,例如二氧化硅是共价晶体,二氧化碳是分子晶体,C正确;D.氯化铵是离子化合物,氯化铵固体属于离子晶体,氯化铵中存在离子键和共价键,加热使其分解时生
成氨气和氯化氢,破坏了离子键和共价键,D正确;
答案选A。
5.D
【详解】
A.Na+核电荷数为11,核外电子数为10,钠离子核外电子排布式为:1s22s22p6,排布图为:
,A错误;
B.硫离子的核外电子数为18,其电子排布式为:1s22s22p63s23p6,B错误;
C.碘化铵为离子化合物,其电子式为 ,C错误;
D.HO为共价化合物,其电子式为 ,D正确;
2
故选D。
6.C
【详解】
由于轨道中的电子处于半充满或全充满状态能量最低、稳定性强,且遵循洪特规则,单独电子占据一个轨
道,电子自旋方向相同,所以选项C正确,答案选C。
7.C
【详解】
A.B原子位于顶点,个数为 =1,A原子位于内部,个数为1,所以化学式为AB,A错误;
B.E、F分别占据4个顶点,个数相同,化学式为EF,B错误;
C.Z原子位于顶点,个数为 =1,X原子位于内部,个数为1,Y原子位于面心,个数为 =3,所
以化学式为XY Z,C正确;
3
D.A原子位于顶点和面心,个数为 + =4,B原子位于棱心和内部,个数为1+ =4,所以化
学式为AB,D错误;
综上所述答案为C。
8.C
【详解】
X、Y、Z、W为四种短周期主族元素, Y与Z同周期,W是短周期主族元素中原子半径最大的,则W为
Na,X原子最外层电子数是核外电子层数的3倍,则X为O,X与Z同族,则Z为S,Y的最高正价与最
低负价的代数和为6,则Y为Cl。
A. Y的最高价氧化物对应的水化物HClO 是一元强酸,选项A错误;
4
B. 原子半径:X(O) Z(S),故气态氢化物的热稳定性:HCl
>H S,选项D错误;
2
答案选C。
9.C
【分析】
同周期元素W、X、Y、Z中,Y的最外层电子数等于X的核外电子总数,说明这四种元素位于第二周期;
根据图示可知,Y可形成2个共价键,应为O元素;X为6号C元素;Z只能形成1个共价键,则Z为F
元素;四种元素最外层电子数之和为20,W的最外层电子数为20-4-6-7=3,为B元素,所以W、X、Y、Z
分别为:B、C、O、F,据此解答。
【详解】
A.四种元素最简单氢化物分别为BH、CH、HO、HF,由于水和氟化氢均含有氢键,所以其沸点较前两
3 4 2
者高,但由于相同物质的量的水中含所有的氢键数比氟化氢中的氢键数多,所以水的沸点比氟化氢高,选
项A错误;
B.W、Z可以形成化合物BF,该物质中B原子最外层只有6个电子,选项B错误;
3
C.按电子云重叠方式考虑,X与Y形成的二元化合物CO、CO 均含有2种类型的共价键,π键、σ键,选
2
项C正确;
D.四种元素均为非金属元素,所以没有金属晶体,选项D错误;
答案选C。
10.D
【详解】
A.晶格能越大,物质的熔点越高,由表可知,熔点:Al O>AlF,所以晶格能:Al O>AlF,故A正确;
2 3 3 2 3 3
B.C和Si同主族,但氧化物的晶体类型不同,分别属于分子晶体和原子晶体,故B正确;
C.汞的熔点比AlCl 低,所以金属晶体的熔点不一定比分子晶体的高,故C正确;
3
D.活泼金属Al与活泼非金属Cl形成的AlCl 熔点较低属于共价化合物,所以活泼金属元素与活泼非金属
3
元素能形成共价化合物,故D错误;
故选:D。
11.C
【分析】
X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气获得其单质,则X是N或O。Y元
素原子最外电子层上s、p电子数相等,Y是C或Si。Z元素+2价阳离子的核外电子排布与氖原子相同,Z
是Mg。W元素原子的M层有1个未成对的p电子,W是Al或Cl。
【详解】
A.X元素的氢化物的水溶液显碱性(NH )或中性(H O),A不正确;
3 2
B.若W是氯元素,则氯离子电子层数比镁离子多,所以离子半径大于镁离子半径,B不正确;
C.镁既能和氮气反应生成氮化镁,也能和氧气反应生成氧化镁,C正确;
D.若Y是碳元素,则CO 形成的是分子晶体,熔沸点低,D不正确;
2
答案选C。12.A
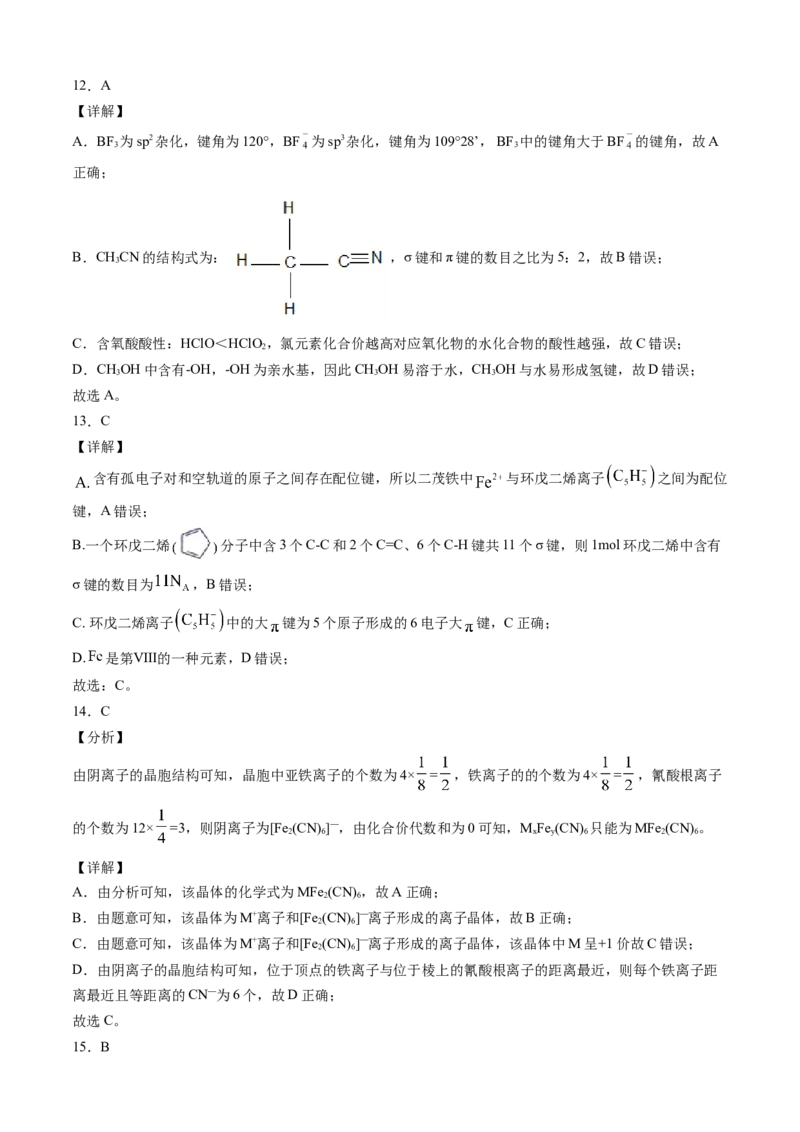
【详解】
A.BF 为sp2杂化,键角为120°,BF 为sp3杂化,键角为109°28’, BF 中的键角大于BF 的键角,故A
3 3
正确;
B.CHCN的结构式为: ,σ键和π键的数目之比为5:2,故B错误;
3
C.含氧酸酸性:HClO<HClO,氯元素化合价越高对应氧化物的水化合物的酸性越强,故C错误;
2
D.CHOH中含有-OH,-OH为亲水基,因此CHOH易溶于水,CHOH与水易形成氢键,故D错误;
3 3 3
故选A。
13.C
【详解】
含有孤电子对和空轨道的原子之间存在配位键,所以二茂铁中 与环戊二烯离子 之间为配位
键,A错误;
B.一个环戊二烯 分子中含3个C-C和2个C=C、6个C-H键共11个σ键,则1mol环戊二烯中含有
σ键的数目为 ,B错误;
C. 环戊二烯离子 中的大 键为5个原子形成的6电子大 键,C正确;
D. 是第Ⅷ的一种元素,D错误;
故选:C。
14.C
【分析】
由阴离子的晶胞结构可知,晶胞中亚铁离子的个数为4× = ,铁离子的的个数为4× = ,氰酸根离子
的个数为12× =3,则阴离子为[Fe (CN) ]—,由化合价代数和为0可知,MFe (CN) 只能为MFe (CN) 。
2 6 x y 6 2 6
【详解】
A.由分析可知,该晶体的化学式为MFe (CN) ,故A正确;
2 6
B.由题意可知,该晶体为M+离子和[Fe (CN) ]—离子形成的离子晶体,故B正确;
2 6
C.由题意可知,该晶体为M+离子和[Fe (CN) ]—离子形成的离子晶体,该晶体中M呈+1 价故C错误;
2 6
D.由阴离子的晶胞结构可知,位于顶点的铁离子与位于棱上的氰酸根离子的距离最近,则每个铁离子距
离最近且等距离的CN—为6个,故D正确;
故选C。
15.B【详解】
A.晶胞内含有4个Cu原子,O原子处于晶胞的8个顶角和体心,则一个晶胞含有O原子个数为
,Cu、O原子个数比为4:2=2:1,该晶体的化学式为Cu O,故铜离子的电荷数为+1,故A正
2
确;
B.根据均摊法可知,在C 晶胞中含有C 分子的个数为 ,故B错误;
60 60
C.C 分子中含有30个C=C双键,能与30个F 分子发生加成反应,生成C F ,故C正确;
60 2 60 60
D.根据结构可知,每一个碳原子形成3个δ键,但每个δ键被两个六边形共用,所以每个碳原子形成δ键
的个数: ,1molC 分子中含有60个碳原子,所以含有的δ键数目约为
60
,故D正确;
故选B。
16.B
【详解】
A.由晶体结构可知,立方相氮化硼为空间网状结构与金刚石类似,所以硬度大,立方相氮化硼中不存在π
键,故A错误;
B.晶体中存在可以自由移动的电子能导电,六方相氮化硼晶体中没有可以自由移动的电子,所以不导电,
故B正确;
C.立方氮化硼晶体中每个硼原子形成4个σ键,所以硼原子的杂化轨道类型为sp3,而六方相氮化硼中硼
原子的杂化轨道类型为sp2,所以B原子的杂化类型不相同,故C错误;
D.六方相氮化硼中存在共价键和分子间作用力,与石墨类似属于混合晶体,而立方相氮化硼属于原子晶
体,故D错误。
故选:B。
17.(共11分,除标注外,每空1分)Na与Li同族,Na电子层数多,原子半径大,易失电子Li、Be、B
同周期,核电荷数依次增加(2分) Be为 全充满稳定结构,第一电离能最大。与Li相比,B核
电荷数大,原子半径小,较难失去电子,第一电离能较大(2分) 大于
Zn核外电子排布为全充满稳定结构,较难失电子(2分) O 大于 小于 3
【详解】
(1)Li和Na均为第ⅠA族元素,由于Na电子层数多,原子半径大,故Na比Li容易失去最外层电子,即
;Li、Be、B均为第二周期元素,随原子序数递增,第一电离能有增大的趋势,而Be的
2s能级处于全充满状态,较难失去电子,故第一电离能Be比B大;
(2)Cu原子的价层电子排布式为 ,4s轨道处于半充满状态,而Zn原子的4s轨道处于全充满状态,
Zn原子更不易失去l个电子,所以Zn原子的第一电离能较大;
(3)O是非金属元素,而Mn是金属元素,前者易得电子而不易失电子,后者则反之,所以O的第一电离能
大于Mn;
(4)同周期主族元素从左到右,原子半径逐渐减小,第一电离能呈增大趋势,Ga的原子半径大于As;Ga的第一电离能小于As;
(5)同周期元素从左到右,第一电高能整体里增大趋势,但由于氮原子的2p轨道处于半充满状态,较稳定,
其第一电离能比氧的大,被原子的2s轨道处于全充满状态,2p轨道处于全空状态,铍的第一电离能比硼
的大,所以第一电离能介于硼和氮之间的第二周期元素有铍、碳、氧3种。
18.(共12分,每空2分)D、C 4:5 Li+核电荷数较大、吸引电子能力较大
K、Cr和Cu 520 498
【详解】
(1) 原子核外电子排布中,如果电子所占的轨道能级越高,该原子能量越高,根据图知,电子排布能量最低
的是1s、2s能级,能量最高的是2s、2p能级,故答案为:D;C。
(2)基态 与 离子的外围电子构型分别3d6、3d5,未成对的电子数分别为4和5,故未成对的电子数
之比为4:5。
(3) 与 具有相同的电子构型,离子核电荷数: ,吸引电子能力: ,则 小
于 的原因是Li+核电荷数较大、吸引电子能力较大。
(4)与铁同周期元素中,4s轨道半充满的元素的外围电子构型有3种:4s1、3d54s1、3d104s1,对应的元素为
K、Cr和Cu。
(5)已知第一电离能为气态基态原子失去一个电子成为气态基态阳离子所需的能量,由图知,Li原子的第一
电离能为 , 键键能为1mol氧气分子变为气态氧原子所需能量,其键
能=2×249kJ/mol=498kJ/mol。
19.(共8分,每空1分) 24 HO与CHCHOH分子间能形成氢键 7
2 3 2
O>N>C 直线形 2 HO分子中有2对孤电子对,而NH 分子中有1对孤电子对
2 3
【详解】
Ⅰ.(1)Cr为24号元素,价电子排布式为3d54s1,排布图为 ;Cr原子核外有24个电子,
每个电子的空间运动状态各不相同;
(2) CH CHOH含有羟基,可以和水分子间形成氢键,增大溶解度;
3 2
Ⅱ.(1)苯环上的碳原子以及形成双键的碳原子均为sp2杂化,所以有7个;化合物乙中羟基中的O原子、氨
基中的N原子以及非苯环上的C原子均为sp3杂化,非金属性越强,电负性越大,所以电负性O>N>C;
(2)N 与CO 所含原子总数相同,价电子总数相同,互为等电子体,根据CO 的空间构型可知N 应为直线
2 2
形;
(3)仅由第二周期元素组成的共价分子中互为等电子体的有CO和N、CO 和NO,共2组;
2 2 2
(4)H O分子中有2对孤电子对,而NH 分子中有1对孤电子对,孤电子对对成键电子对有较强的排斥作用,
2 3
导致水分子的O-H键角较小。
20.(共12分,除标注外,每空1分)共价 4 分子 4 分子间作用力 金刚石晶体
金刚石 碘单质>冰 小于 MgO晶体中离子所带的电荷数大于NaCl晶体中离子所带的电荷数,且 、 (2分) (2分)
【详解】
(1)金刚石晶体中原子间以共价键结合形成空间网状结构,则金刚石晶体属于共价晶体,其中每个碳原子与
4个碳原子距离最近且相等;碘晶体熔沸点低,属于分子晶体,每个碘晶胞中实际占有的碘分子个数是
=4,碘晶体是分子晶体,熔化过程中克服的作用力为分子间作用力。
(2)冰晶体和碘晶体是分子晶体,铜形成的是金属晶体,氧化镁和氯化钙形成的是离子晶体,金刚石形成的
共价晶体,因此这些晶体中,微粒之间以共价键结合而形成的是金刚石晶体。
(3)熔点的一般规律:共价晶体>离子晶体>分子晶体,冰和碘属于分子晶体,熔点:碘>冰,MgO属于
离子晶体,金刚石是共价晶体,则冰、金刚石、MgO、碘单质四种晶体的熔点由高到低的顺序为:金刚石
>MgO>碘单质>冰;
(4)由于MgO晶体中离子所带的电荷数大于NaCl晶体中离子所带的电荷数,且 、
,晶格能前者大于后者,所以NaCl晶体的熔点小于MgO晶体的熔点。
(5)碘晶胞中实际占有的碘分子个数是 =4,碘晶胞中立方体的边长为acm,阿伏加德罗常数的
值为 ,则碘晶体的密度为 。
21.(共9分,除标注外,每空1分)d Mn 基态Mn原子的核外电子排布式为[Ar]3d54s2,4s能级是全
满结构,更稳定,失去一个电子所需能量更高 [Cr(H O) C1]2+ 正四面体形 F-半径更小,MnF 的晶
2 5 2
格能更大,熔点更高 4 ×1030 (2分)
【详解】
(1)铁、铬、锰都是第四周期的过渡元素,属于周期表中的d区元素,故答案为:d;
(2)铬元素的原子序数为24,电子排布式为[Ar]3d54s1,锰元素的原子序数为25,电子排布式为[Ar]3d54s2,
Mn原子的4s能级是全充满结构,结构更稳定,失去一个电子所需能量更高,则基态锰原子的第一电离能
大于基态铬原子,故答案为:Mn;基态Mn原子的核外电子排布式为[Ar]3d54s2,4s能级是全满结构,更稳
定,失去一个电子所需能量更高;
(3)①由相同物质的量的甲、乙、丙的水溶液中加入足量的AgNO 溶液,析出AgCl的物质的量之比分别为
3
3:2:1可知,暗绿色配合物的6个配体为1个氯离子和5个水分子,则暗绿色的配合物内界的化学式为
[Cr(H O) C1]2+,故答案为:[Cr(H O) C1]2+;
2 5 2 5
②水分子中氧原子的价层电子对数为4,则水分子的VSEPR模型为正四面体形,故答案为:正四面体形;
(4)离子晶体的晶格能越大,离子键越强,晶体的熔沸点越高,MnF 和MnCl 均为离子化合物,F—离子的
2 2
离子半径小于Cl—离子,MnF 的晶格能大于MnCl ,离子键更强,晶体的熔沸点更高,更答案为:F-半径
2 2
更小,MnF 的晶格能更大,熔点更高;
2
(5)①由晶胞结构可知,一氧化锰为为面心立方结构,晶胞中由O2-形成的正八面体存在八面体间隙,八面
体间隙原子处于八面体间隙中心,即处于面心立方晶胞的体心和棱边的中心,则晶胞中的八面体间隙数为4,故答案为:4;
②由晶胞结构可知,晶胞中Mn2+离子的个数为12× +1=4,则晶胞中含有4个MnO,晶胞的质量为
g,由晶胞中距离最近的两个O2-之间的距离为apm可知,晶胞的边长为 a×10—10cm,晶胞的体积为(
a×10-10)3 cm3,则MnO晶体的密度ρ为 g/cm3= g/cm3,故答案为: ×1030。
【点睛】在八面体型间隙相中,6个微粒构成八面体,间隙原子位于八面体中心的间隙位置,具有这种间
隙类型的间隙相可以是面心立方、密排六方、正交和体心立方等。