文档内容
下学期期末测试卷 03
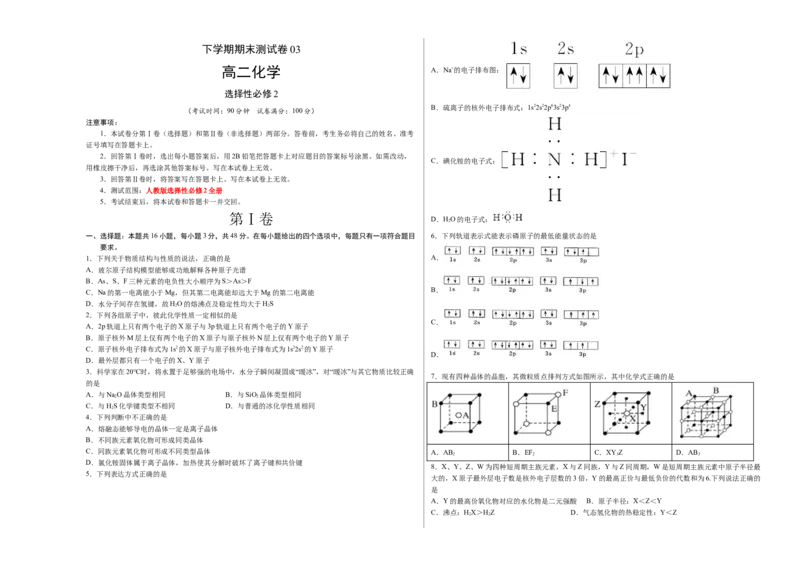
高二化学 A.Na+的电子排布图:
选择性必修2
B.硫离子的核外电子排布式:1s22s22p63s23p4
(考试时间:90分钟 试卷满分:100分)
注意事项:
1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考
证号填写在答题卡上。
2.回答第Ⅰ卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,
C.碘化铵的电子式:
用橡皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。
4.测试范围:人教版选择性必修2全册
5.考试结束后,将本试卷和答题卡一并交回。
第Ⅰ卷
D.HO的电子式:
2
一、选择题:本题共16小题,每小题3分,共48分。在每小题给出的四个选项中,每题只有一项符合题目 6.下列轨道表示式能表示磷原子的最低能量状态的是
要求。
1.下列关于物质结构与性质的说法,正确的是 A.
A.玻尔原子结构模型能够成功地解释各种原子光谱
B.As、S、F三种元素的电负性大小顺序为S>As>F
B.
C.Na的第一电离能小于Mg,但其第二电离能却远大于Mg的第二电离能
D.水分子间存在氢键,故HO的熔沸点及稳定性均大于HS
2 2
2.下列各组原子中,彼此化学性质一定相似的是
C.
A.2p轨道上只有两个电子的X原子与3p轨道上只有两个电子的Y原子
B.原子核外M层上仅有两个电子的X原子与原子核外N层上仅有两个电子的Y原子
C.原子核外电子排布式为1s2的X原子与原子核外电子排布式为1s22s2的Y原子
D.
D.最外层都只有一个电子的X、Y原子
3.科学家在20℃时,将水置于足够强的电场中,水分子瞬间凝固成“暖冰”,对“暖冰”与其它物质比较正确
7.现有四种晶体的晶胞,其微粒质点排列方式如图所示,其中化学式正确的是
的是
A.与NaO晶体类型相同 B.与SiO 晶体类型相同
2 2
C.与 HS化学键类型不相同 D.与普通的冰化学性质相同
2
4.下列判断中不正确的是
A.熔融态能够导电的晶体一定是离子晶体
B.不同族元素氧化物可形成同类晶体
C.同族元素氧化物可形成不同类型晶体 A.AB B.EF C.XY Z D.AB
2 2 3 3
D.氯化铵固体属于离子晶体,加热使其分解时破坏了离子键和共价键
8.X、Y、Z、W为四种短周期主族元素,X与Z同族,Y与Z同周期,W是短周期主族元素中原子半径最
5.下列表达方式正确的是
大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6.下列说法正确的
是
A.Y的最高价氧化物对应的水化物是二元强酸 B.原子半径:X<Z<Y
C.沸点:HX>HZ D.气态氢化物的热稳定性:Y<Z
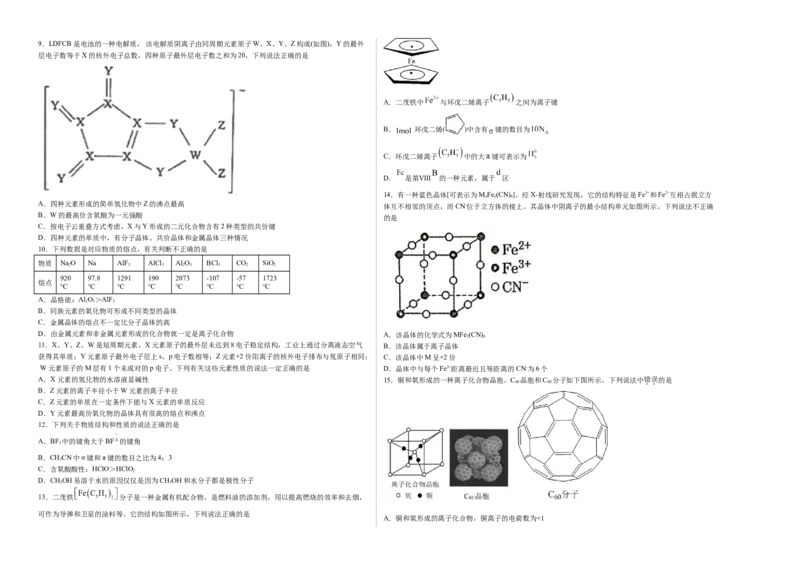
2 29.LDFCB 是电池的一种电解质, 该电解质阴离子由同周期元素原子W、X、Y、Z构成(如图),Y的最外
层电子数等于X的核外电子总数,四种原子最外层电子数之和为20,下列说法正确的是
A.二茂铁中 与环戊二烯离子 之间为离子键
B. 环戊二烯( )中含有 键的数目为
C.环戊二烯离子 中的大 键可表示为
D. 是第Ⅷ 的一种元素,属于 区
14.有一种蓝色晶体[可表示为MFe (CN) ],经X-射线研究发现,它的结构特征是Fe3+和Fe2+互相占据立方
x y 6
A.四种元素形成的简单氢化物中Z的沸点最高 体互不相邻的顶点,而CN-位于立方体的棱上。其晶体中阴离子的最小结构单元如图所示。下列说法不正确
B.W的最高价含氧酸为一元强酸
的是
C.按电子云重叠方式考虑,X与Y形成的二元化合物含有2种类型的共价键
D.四种元素的单质中,有分子晶体、共价晶体和金属晶体三种情况
10.下列数据是对应物质的熔点,有关判断不正确的是
物质 NaO Na AlF AlCl Al O BCl CO SiO
2 3 3 2 3 3 2 2
920 97.8 1291 190 2073 -107 -57 1723
熔点
℃ ℃ ℃ ℃ ℃ ℃ ℃ ℃
A.晶格能:Al O>AlF
2 3 3
B.同族元素的氧化物可形成不同类型的晶体
C.金属晶体的熔点不一定比分子晶体的高
D.由金属元素和非金属元素形成的化合物就一定是离子化合物 A.该晶体的化学式为MFe (CN)
2 6
11.X、Y、Z、W是短周期元素,X元素原子的最外层未达到8电子稳定结构,工业上通过分离液态空气 B.该晶体属于离子晶体
获得其单质;Y元素原子最外电子层上s、p电子数相等;Z元素+2价阳离子的核外电子排布与氖原子相同; C.该晶体中M呈+2 价
W元素原子的 M层有1个未成对的p电子。下列有关这些元素性质的说法一定正确的是 D.晶体中与每个 Fe3+距离最近且等距离的 CN-为6个
A.X 元素的氢化物的水溶液显碱性 15.铜和氧形成的一种离子化合物晶胞、C 晶胞和C 分子如下图所示,下列说法中错误的是
60 60
B.Z元素的离子半径小于W元素的离子半径
C.Z元素的单质在一定条件下能与 X元素的单质反应
D.Y元素最高价氧化物的晶体具有很高的熔点和沸点
12.下列关于物质结构和性质的说法正确的是
A.BF 中的键角大于BF 的键角
3
B.CHCN中σ键和π键的数目之比为4:3
3
C.含氧酸酸性:HClO>HClO
2
D.CHOH易溶于水的原因仅仅是因为CHOH和水分子都是极性分子
3 3
13.二茂铁 分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,
可作为导弹和卫星的涂料等。它的结构如图所示,下列说法正确的是
A.铜和氧形成的离子化合物,铜离子的电荷数为+1B.在C 晶胞中含有14个C 分子
60 60
(1)下列Li原子电子排布图表示的状态中,能量最低和最高的分别为___________ 填标号 。
C.C 与F 在一定条件下,发生加成反应生成C F
60 2 60 60
D.1molC 分子中,含有的δ键数目约为
60
A. B.
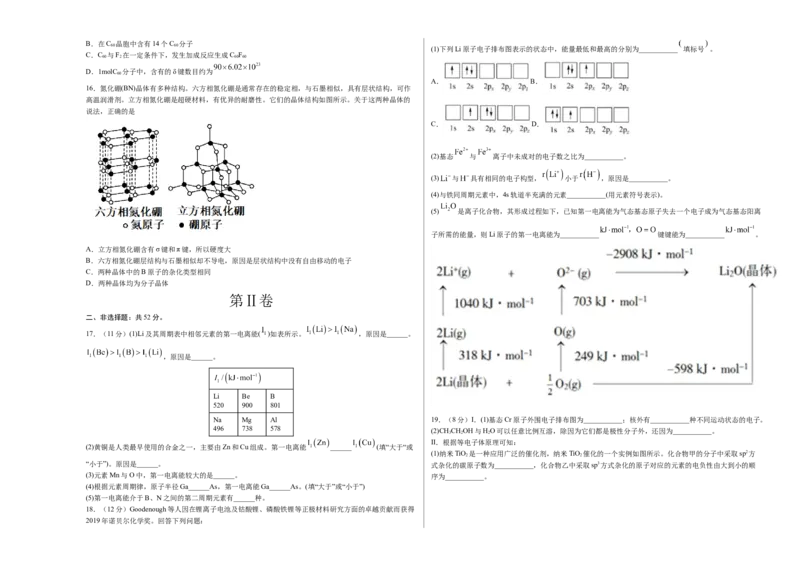
16.氮化硼(BN)晶体有多种结构。六方相氮化硼是通常存在的稳定相,与石墨相似,具有层状结构,可作
高温润滑剂。立方相氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的
说法,正确的是
C. D.
(2)基态 与 离子中未成对的电子数之比为___________。
(3) 与 具有相同的电子构型, 小于 ,原因是___________。
(4)与铁同周期元素中,4s轨道半充满的元素___________(用元素符号表示)。
(5) 是离子化合物,其形成过程如下,已知第一电离能为气态基态原子失去一个电子成为气态基态阳离
子所需的能量,则Li原子的第一电离能为___________ 键键能为___________ 。
A.立方相氮化硼含有σ键和π键,所以硬度大
B.六方相氮化硼层结构与石墨相似却不导电,原因是层状结构中没有自由移动的电子
C.两种晶体中的B原子的杂化类型相同
D.两种晶体均为分子晶体
第Ⅱ卷
二、非选择题:共52分。
17.(11分)(1)Li及其周期表中相邻元素的第一电离能( )如表所示。 ,原因是______。
,原因是______。
Li Be B
520 900 801
Na Mg Al 19.(8分)Ⅰ.(1)基态Cr原子外围电子排布图为___________;核外有___________种不同运动状态的电子。
496 738 578
(2)CH CHOH与HO可以任意比例互溶,除因为它们都是极性分子外,还因为___________。
3 2 2
Ⅱ.根据等电子体原理可知:
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能 ______ (填“大于“或
(1)纳米TiO 是一种应用广泛的催化剂,纳米TiO 催化的一个实例如图所示。化合物甲的分子中采取sp2方
2 2
“小于”)。原因是______。 式杂化的碳原子数为___________,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺
(3)元素Mn与O中,第一电离能较大的是______。 序为___________。
(4)根据元素周期律,原子半径Ga______As,第一电离能Ga______As。(填“大于”或“小于”)
(5)第一电离能介于B、N之间的第二周期元素有______种。
18.(12分)Goodenough等人因在锂离子电池及钴酸锂、磷酸铁锂等正极材料研究方面的卓越贡献而获得
2019年诺贝尔化学奖。回答下列问题:(2)试预测N 的空间构型为___________。
(3)仅由第二周期元素组成的共价分子中互为等电子体的有___________组。
(4)氨分子中N-H键角比水分子的O-H键角大的原因是___________。
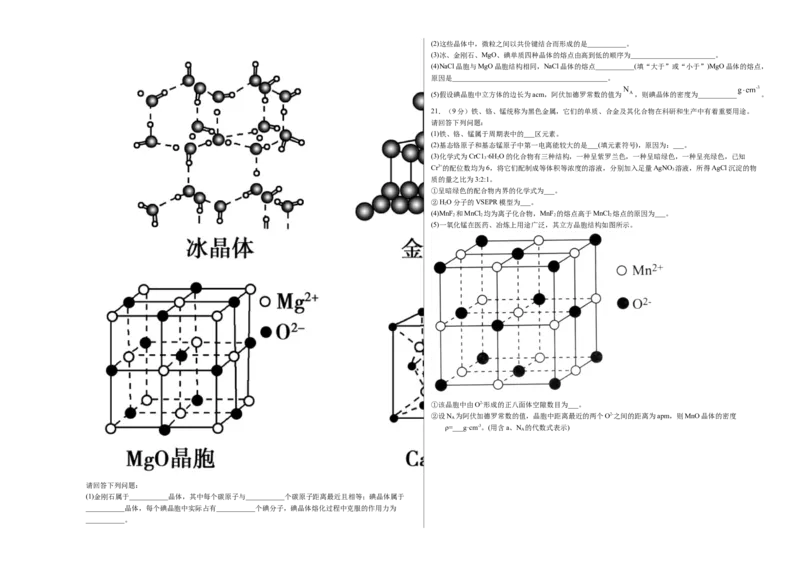
20.(12分)如图为几种晶体或晶胞的结构示意图。(2)这些晶体中,微粒之间以共价键结合而形成的是___________。
(3)冰、金刚石、MgO、碘单质四种晶体的熔点由高到低的顺序为________________________。
(4)NaCl晶胞与MgO晶胞结构相同,NaCl晶体的熔点___________(填“大于”或“小于”)MgO晶体的熔点,
原因是____________________________________________。
(5)假设碘晶胞中立方体的边长为acm,阿伏加德罗常数的值为 ,则碘晶体的密度为___________ 。
21.(9分)铁、铬、锰统称为黑色金属,它们的单质、合金及其化合物在科研和生产中有着重要用途。
请回答下列问题:
(1)铁、铬、锰属于周期表中的___区元素。
(2)基态铬原子和基态锰原子中第一电离能较大的是___(填元素符号),原因为:___。
(3)化学式为CrC1 ·6H O的化合物有三种结构,一种呈紫罗兰色,一种呈暗绿色,一种呈亮绿色,已知
3 2
Cr3+的配位数均为6,将它们配制成等体积等浓度的溶液,分别加入足量AgNO 溶液,所得AgCl沉淀的物
3
质的量之比为3:2:1。
①呈暗绿色的配合物内界的化学式为___。
②HO分子的VSEPR模型为___。
2
(4)MnF 和MnCl 均为离子化合物,MnF 的熔点高于MnCl 熔点的原因为___。
2 2 2 2
(5)一氧化锰在医药、冶炼上用途广泛,其立方晶胞结构如图所示。
①该晶胞中由O2-形成的正八面体空隙数目为___。
②设N 为阿伏加德罗常数的值,晶胞中距离最近的两个O2-之间的距离为apm,则MnO晶体的密度
A
ρ=___g·cm-3。(用含a、N 的代数式表示)
A
请回答下列问题:
(1)金刚石属于___________晶体,其中每个碳原子与___________个碳原子距离最近且相等;碘晶体属于
___________晶体,每个碘晶胞中实际占有___________个碘分子,碘晶体熔化过程中克服的作用力为
___________。