文档内容
… … … …
… … … …
… … … …
○ … ○ …
… … … …
… … … … … 2023-2024 学年上学期期末模拟考试 02 时,放出的热量相等
学 校
… … D.已知甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH(g) + 2O(g) =
_____ 4 2
外 … 内 …
… … _____ … … 2CO(g) + 2HO(l) ΔH = -890.3 kJ·mol-1
2 2
____ 高二化学
… … … …
姓 名 4.下列有关化学反应速率的说法中,正确的是
… …
_____
○ … ○ …
A. 的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变
_____
… … … … (考试时间:75分钟 试卷满分:100分)
___ 班
… … … … B.对有气体参加的化学反应,减小容器体积,使体系压强增大,可使单位体积内活化分子数目增大,
级 : 注意事项:
… …
_____ 化学反应速率加快
装 … 装 … 1.本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准考
_____
… … … … C.合成氨反应是一个放热反应,升高温度,正反应速率减慢,逆反应速率加快
… …_____ … … 证号填写在答题卡上。
… 考 号 … 2.回答第Ⅰ卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动, D. 在恒温恒压条件下进行,向容器中通入 ,化学反应速率不变
○ …_____ ○ …
… …_____ … … 用橡皮擦干净后,再选涂其他答案标号。写在本试卷上无效。 5.常温下,下列有关说法正确的是
… …_____ … …
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。
… _____ … A. 均为5的 溶液和 溶液中水的电离程度相同
订 …__ 订 … 4.测试范围:
… … … … B.向 的 溶液中缓慢通入 气体:
5.考试结束后,将本试卷和答题卡一并交回。
… … … …
… … 可能用到的相对原子质量:H-1 C-12 O-16 S-32 Cl-35.5 Fe-56 Cu-64 C.冰醋酸加水稀释过程中其电离程度一直增大
○ … ○ …
… … … … 一、选择题:本题共15个小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目 D.常温下 的某酸式盐 的水溶液中:
… … … …
要求的。
… …
6.下列叙述正确的是
线 … 线 … 1.下列说法能用勒夏特列原理解释的是
A.各能层的原子轨道数按s、p、d、f的顺序分别为1、3、5、7
… … … …
A.工业合成 常采用 作催化剂
… … … … B.各能层的能级都是从s能级开始到f能级结束
… …
○ … ○ … B.配制 溶液时,需要加入少量稀硫酸 C.钾的M层有8个电子,所以钾的M层有4个轨道
… … … … D.各能层含有的原子轨道数为2n2
C.工业合成氨的反应温度为500℃
… … … …
… … 7.根据下列实验操作和现象所得到的结论正确的是
D.对于反应 ,达到平衡后,缩小容器的体积可使体系颜色变深
选
实验操作和现象 结论
2.反应 用于捕捉废气中 ,有关化学用语正确的是
项
用pH计测定相同浓度的 溶液和NaClO溶液的pH,前者的 HClO的酸性弱于
A. 轨道的电子云轮廓图: A
pH小于后者的
向较浓的 溶液中滴入少量酸性 溶液,观察 溶液紫色
B 证明 有还原性
B. 的结构示意图:
是否褪去
常温下测得0.1mol/L 溶液和0.1mol/L 溶液的pH分别为0.7 硫元素的非金属性强于氮
C.基态C原子最外层电子的轨道表示式: C
元素
和1.0
D. 的空间填充模型:
向2mL1mol/LNaOH溶液中加1mL0.1mol/L 溶液,产生白色沉淀; 大于
3.下列说法不正确的是 D
再加入1mL0.1mol/L 溶液,产生红褐色沉淀。
A.ΔH < 0为放热反应
B.化学键断裂与形成时的能量变化是化学变化中能量变化的主要原因 8.500℃、101kPa下,将1molSO (g)和0.5molO(g)置于密闭容器中充分反应生成SO (g)放热a kJ,反应过
2 2 3
C.在25℃和101 kPa时,相同浓度的盐酸、醋酸溶液分别与NaOH溶液发生中和反应生成1 mol H O 程中的能量变化如图所示。下列有关叙述不正确的是
2
试题 第11页(共48页) 试题 第12页(共48页)
学学科科网网((北北京京))股股份份有有限限公公司司… … … …
… … … …
… … … …
○ … ○ …
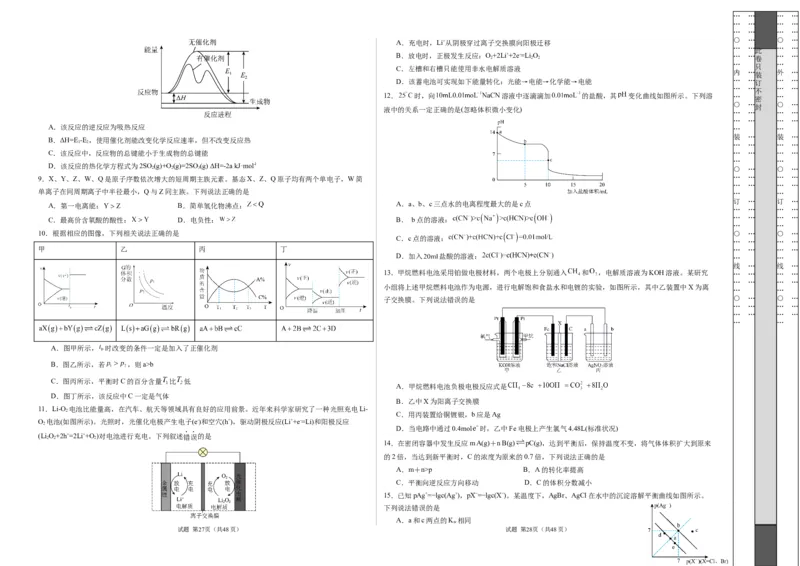
A.充电时,Li+从阴极穿过离子交换膜向阳极迁移
… … … …
此
B.放电时,正极发生反应:O+2Li++2e-=Li O … … … …
2 2 2 卷
… …
只
C.左槽和右槽只能使用非水电解质溶液
内 … 外 …
装
D.该蓄电池可实现如下能量转化:光能→电能→化学能→电能 … … 订 … …
… … … …
不
12. 时,向 溶液中逐滴滴加 的盐酸,其 变化曲线如图所示。下列溶 … …
密
○ … ○ …
封
液中的关系一定正确的是(忽略体积微小变化)
… … … …
… … … …
A.该反应的逆反应为吸热反应 … …
装 … 装 …
B.ΔH=E -E ,使用催化剂能改变化学反应速率,但不改变反应热
1 2 … … … …
C.该反应中,反应物的总键能小于生成物的总键能 … … … …
… …
D.该反应的热化学方程式为2SO (g)+O(g)=2SO(g) ΔH=-2a kJ·mol-l
2 2 3 ○ … ○ …
9.X、Y、Z、W、Q是原子序数依次增大的短周期主族元素。基态X、Z、Q原子均有两个单电子,W简 … … … …
… … … …
单离子在同周期离子中半径最小,Q与Z同主族。下列说法正确的是 … …
订 … 订 …
A.第一电离能: B.简单氢化物沸点: A.a、b、c三点水的电离程度最大的是c点
… … … …
… … … …
C.最高价含氧酸的酸性: D.电负性: B. b点的溶液:
… …
10.根据相应的图像,下列相关说法正确的是 ○ … ○ …
C.c点的溶液:
… … … …
甲 乙 丙 丁 … … … …
D.加入 盐酸的溶液: … …
线 … 线 …
13.甲烷燃料电池采用铂做电极材料,两个电极上分别通入 和 ,电解质溶液为KOH溶液。某研究 … … … …
… … … …
小组将上述甲烷燃料电池作为电源,进行电解饱和食盐水和电镀的实验,如图所示,其中乙装置中X为离
… …
子交换膜。下列说法错误的是 ○ … ○ …
… … … …
… … … …
… …
A.图甲所示, 时改变的条件一定是加入了正催化剂
B.图乙所示,若 ,则a>b
C.图丙所示,平衡时C的百分含量 比 低
A.甲烷燃料电池负极电极反应式是
D.图丁所示,该反应中C一定是气体
B.乙中X为阳离子交换膜
11.Li-O 电池比能量高,在汽车、航天等领域具有良好的应用前景。近年来科学家研究了一种光照充电Li-
2
C.用丙装置给铜镀银,b应是Ag
O 电池(如图所示)。光照时,光催化电极产生电子(e-)和空穴(h+),驱动阴极反应(Li++e-=Li)和阳极反应
2
D.当电路中通过0.4mol 时,乙中Fe电极上产生氯气4.48L(标准状况)
(Li O+2h+=2Li++O )对电池进行充电。下列叙述错误的是
2 2 2
14.在密闭容器中发生反应m A(g)+n B(g) pC(g),达到平衡后,保持温度不变,将气体体积扩大到原来
的2倍,当达到新平衡时,C的浓度为原来的0.7倍,下列说法正确的是
A.m+n>p B.A的转化率提高
C.平衡向逆反应方向移动 D.C的体积分数减小
15.已知pAg+=−lgc(Ag+),pX−=−lgc(X−)。某温度下,AgBr、AgCl在水中的沉淀溶解平衡曲线如图所示。
下列说法错误的是
A.a和c两点的K 相同
w
试题 第27页(共48页) 试题 第28页(共48页)… … … …
… … … …
… … … …
○ … ○ …
… … … …
… … … …
… …
内 … 外 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
装 … 装 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
订 … 订 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
线 … 线 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
… … … …
… … … …
… … … …
○ … ○ …
… … … …
… … … … … B.K sp (AgBr)=1.0×10−14 b.盛 溶液的锥形瓶滴定前用 溶液润洗 次
学 校
… …
_____ C.向饱和AgCl溶液中加入NaCl固体,可使a点变到e点 c.酸式滴定管在装液前末用标准盐酸润洗 次
外 … 内 …
_____
… … … …
d.读取盐酸体积时,开始仰视读数,滴定结束时俯视读数
… … ____ … … D.AgCl(s)+Br−(aq) AgBr (s)+Cl−(aq)平衡常数K=
… 姓 名 … 17.(14分)汽车尾气的储存还原技术法(NSR)可有效消除机动车尾气中NO 和CO的排放。
x
_____
○ … ○ …
_____ 第 II 卷(非选择题 共 55 分) (1)已知:
… … … …
___ 班
… … … …
级 :
… …
装 … _____ 装 … 二、非选择题:本题共4个小题,共55分。
_____
… … … … 则2NO(g)+2CO(g) 2CO(g)+N(g) △H= kJ∙mol-1。
… …_____ … … 16.(12分)某同学欲用 的标准盐酸测定未知浓度的氢氧化钠溶液,选择酚酞作指示剂。 2 2 3
… 考 号 …
其操作步骤可分为以下几步: (2)某同学设计实验对储存还原技术法进行研究。将NO和CO按表中相应的量充入一个1L恒容密闭容器
○ …_____ ○ …
… …_____ … … A.移取 待测氢氧化钠溶液注入洁净的锥形瓶中,并滴加 滴酚酞溶液。
… …_____ … … 中,在恒定温度下进行反应:2NO(g)+2CO(g) 2CO 2 (g)+N 2 (g),相关数据如下表所示:
… _____ … B.用标准溶液润洗滴定管 次。
订 …__ 订 … C.把盛有标准溶液的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液。 起始物质的量(n)/mol
… … … …
容器 NO的平衡转化率
… … … … D.取标准溶液注入酸式滴定管至“0”刻度以上 处。
NO CO CO N
… … 2 2
E.调节液面至“0”或“0”以下刻度,记下读数。
○ … ○ …
… … … … F.把锥形瓶放在滴定管的下面,用标准溶液滴定至终点,并记下滴定管液面的刻度。请填写下列空白: I 2 2 0 0 50%
… … … …
… … (1)正确的操作步骤顺序是 (用字母表示)。 II 0 0 4 2 /
线 … 线 …
(2)步骤B中应选择图1中的滴定管 (填“甲”或“乙”),该步操作的目的是 。
… … … …
III I 1 1 1 /
… … … …
… …
容器I在10min时反应达到平衡,该段时间内CO的平均反应速率为 mol·L-1·min-1;
○ … ○ …
… … … … 平衡常数K= ,达平衡时容器II中NO的体积分数比容器I (填“大”“小”或“相等”),容器Ⅲ
… … … …
起始时反应向 (填“正反应方向”“逆反应方向”或“不移动”)进行。
… …
(3)原料初始组成 ,在体系压强为pMPa,反应达到平衡时,某温度 时测得CO与N
2
的物质的量分数相等,均为0.2,计算该温度下的平衡常数K = (MPa)-1 (列出计算式,以分压表示,分
p
压=总压 物质的量分数)。
(3)若某次滴定结束时,酸式滴定管中的液面如图2所示,则读数为 。若仰视,会使读数
(4)在恒温恒容密闭容器中进行该反应,下列能说明该反应已经达到平衡状态的是 (填序号)。
偏 (填“大”或“小”)。
a.容器中压强不再变化
b.容器中密度不再变化
(4)结合下表数据,计算被测氢氧化钠溶液的物质的量浓度为 。
c.v(CO)=2v(N )
2
标准盐酸体积 d.混合气体的平均分子质量保持不变
待测溶液体积
滴定次数 e.CO与NO的转化率相等
滴定前的刻度 滴定后的刻度
f.该条件下NO达到最大转化率
18.(14分)已知CHCOOH是常见的弱酸,现有常温下0.lmol·L-1的CHCOOH溶液。
第一次 20.00 2.34 20.39 3 3
(1)取0.10molCHCOOH作导电性实验,测得其导电率随加入的水量变化如图所示。
3
第二次 20.00 3.20 20.42
第三次 20.00 0.60 17.80
(5)下列操作中可能使所测氢氧化钠溶液的浓度偏低的是 (填字母)。
a.开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
试题 第31页(共48页) 试题 第32页(共48页)
学学科科网网((北北京京))股股份份有有限限公公司司… … … …
… … … …
… … … …
○ … ○ …
… … … …
此
… … … …
卷
… …
只
内 … 外 …
装
… … … …
订
… … … …
不
… …
①n(H+):a b(填“>”、“<”或“=”,下同)。 密
○ … ○ …
封
①M为 (填“正极”“负极”“阴极”或“阳极”),镀铜时, (填“X”或“Y”)与铁
②c(CHCOO-):a b。 … … … …
3
电极相连,工作过程中,N极区域溶液中pH将 (填“增大”“减小”或“不变”)。 … … … …
③完全中和时消耗NaOH的物质的量:a b。
… …
②若M极消耗0.1mol氯乙烯,则铁电极增重 g,硫酸铜溶液的浓度将 (填“增大”
装 … 装 …
(2)若向醋酸中加入氢氧化钠溶液,使醋酸恰好被中和,所得溶液的pH 7(填“大于”“小
… … … …
“减小”或“不变”)。
于”或“等于”),用离子方程式表示其原因 ;中和后所得溶液中离子浓度由大到小的顺序为 … … … …
… …
。
○ … ○ …
(3)25℃时,部分物质的电离平衡常数如表所示: … … … …
… … … …
CHCOOH HCO HCN … …
3 2 3
订 … 订 …
1.7×10-5 K =4.3×10-7、K =5.6×10-11 4.9×10-10 … … … …
a1 a2
… … … …
CHCOOH、HCO、HCN的酸性由强到弱的顺序为 。 … …
3 2 3
○ … ○ …
19.(15分)电化学原理在现代工业中应用广泛,回答下列问题:
… … … …
… … … …
(1)氯碱工业上利用电解精制饱和食盐水的方法制取氯气、氯气、烧碱和氯的含氧酸盐等一系列化工产
… …
品,如图是离子交换膜法电解食盐水的示意图,图中的离子交换膜只允许阳离子通过。 线 … 线 …
… … … …
… … … …
… …
○ … ○ …
… … … …
… … … …
… …
①离子交换膜的作用为 、 。
②氯氧化钠溶液从图中 (填“a”“b”“c”或“d”)处收集。
(2) 可作超级电容器材料。用惰性电极电解 溶液制得 ,其阳极的电极反应式为
。
(3)金属镍有广泛的用途,粗镍中含有少量的Fe、Zn、Cu、Pt等杂质,故可用电解法制备高纯度的镍。
(金属活动性: )
①电解过程中,阳极杂质的电极反应式为 。
②电解过程中,阳极减少的质量与阴极增加的质量 (填“相等”或“不相等”),电解结束后,
Pt以 形式存在。
(4)图甲是一种将废水中的氯乙烯( )进行环境无害化处理的微生物电池装置,同时利用此装置
在铁上镀铜。
试题 第47页(共48页) 试题 第48页(共48页)