文档内容
高二化学上学期人教版(2019)选择性必修 2 综合复习与测试
一、选择题(共16题)
1.砷是第ⅤA族元素,黄砷( )是其一种单质,其分子空间结构与白磷( )相似,以下关于黄砷与白磷
的比较正确的是
A.分子中共价键键角均为 B.黄砷中共价键键能大于白磷
C.黄砷易溶于水 D.黄砷的熔点高于白磷
2.某元素的基态原子最外层电子排布式是 ,该元素或其化合物不可能具有的性质是
A.该元素单质是导体
B.该元素单质在一定条件下能与盐酸反应
C.该元素最高价氧化物对应的水化物显碱性
D.该元素的最高化合价为+5
3.共价键、离子键和范德华力都是微观粒子之间的不同作用力,下列物质:
①Na O;②SiO;③石墨;④金刚石;⑤CaH;⑥白磷,其中含有两种结合力的组合是( )
2 2 2 2
A.①③⑤⑥ B.①③⑥ C.②④⑥ D.①②③⑥
4.短周期元素X、Y、乙在元素周期表中的相对位置如图所示。下列说法正确的是
X
Y Z
A.原子半径:
B.若X的一种单质为共价晶体,则含Y元素的盐溶液一定能与 溶液反应
C.若Y可作半导体材料,则X、Z的单质均为分子晶体
D.若Y与乙的核电荷数之和为X的4倍,则X、Z的氢化物的熔、沸点:
5.下列关于共价键的理解不正确的是
A.σ键可以绕键轴旋转,而π键不能绕键轴旋转
B.共价键都具有方向性和饱和性
C. 分子和 分子中都含有5个σ键
D.σ键以“头碰头”方式重叠,π键以“肩并肩”方式重叠
6.下列性质的比较正确的是A.单质的熔点: B.电负性:
C.第一电离能: D.微粒半径:
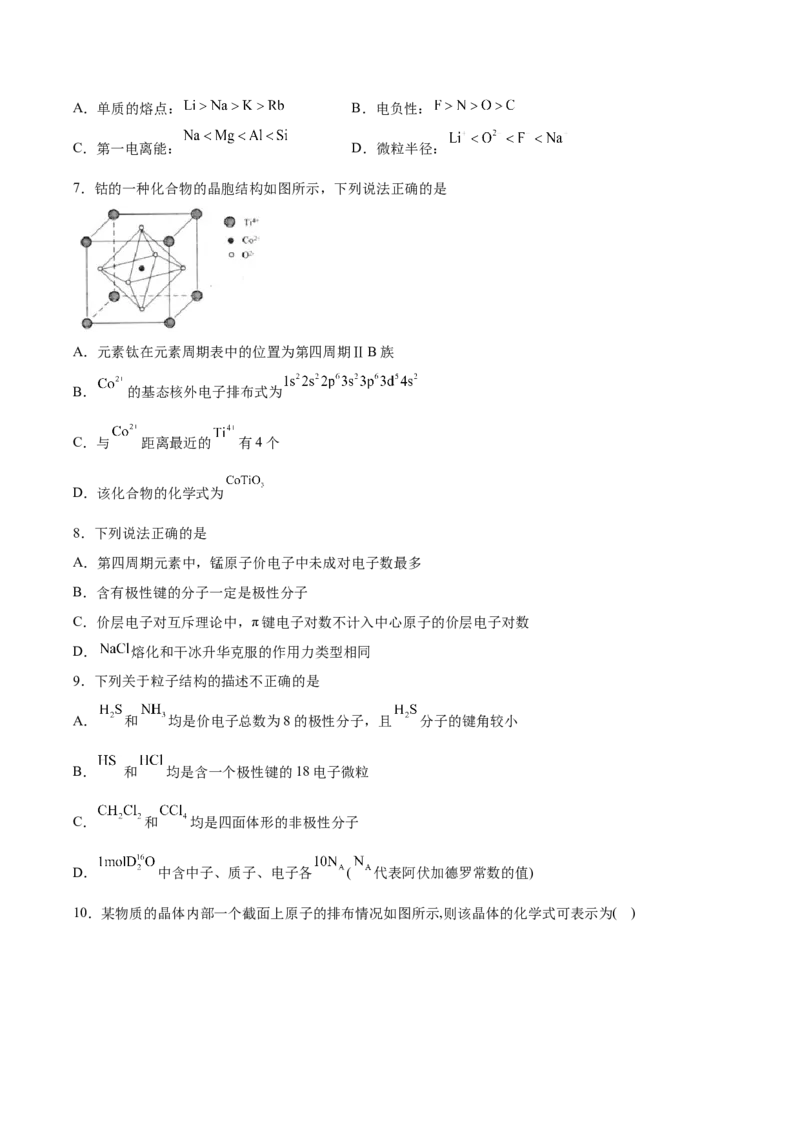
7.钴的一种化合物的晶胞结构如图所示,下列说法正确的是
A.元素钛在元素周期表中的位置为第四周期ⅡB族
B. 的基态核外电子排布式为
C.与 距离最近的 有4个
D.该化合物的化学式为
8.下列说法正确的是
A.第四周期元素中,锰原子价电子中未成对电子数最多
B.含有极性键的分子一定是极性分子
C.价层电子对互斥理论中,π键电子对数不计入中心原子的价层电子对数
D. 熔化和干冰升华克服的作用力类型相同
9.下列关于粒子结构的描述不正确的是
A. 和 均是价电子总数为8的极性分子,且 分子的键角较小
B. 和 均是含一个极性键的18电子微粒
C. 和 均是四面体形的非极性分子
D. 中含中子、质子、电子各 ( 代表阿伏加德罗常数的值)
10.某物质的晶体内部一个截面上原子的排布情况如图所示,则该晶体的化学式可表示为( )A.AB B.AB C.AB D.AB
2 2 3
11.下列有关晶体的叙述中,错误的是
A.氯化钠晶体中,每个 周围距离最近且相等的 共有6个
B.金属晶体中,自由电子为许多金属离子所共有
C.干冰晶体中,每个 分子周围距离最近且相等的 分子共有12个
D.金刚石网状结构中,每个碳原子与4个碳原子形成共价键
12.下列有关说法正确的是
A. 水合铜离子的球棍模型,1个水合铜离子有2个配位键
B. 冰晶胞示意图,类似金刚石晶胞,冰晶胞内水分子间以共价键结合
C. H原子的电子云图,由图可见H原子核外靠近核运动的电子多
D. K与氧形成的某化合物晶胞,其中黑球为K+,由图可知该晶体化学式为KO
2
13.近年来我国科学家发现了一系列意义重大的铁系超导材料,其中一类为 、 、 、 、 组成的
化合物。下列说法正确的是
A.元素 与 同族可预测 分子中 键的键角小于 中 键的键角
B. 成为阳离子时首先失去 轨道电子C.配合物 ,可用作催化剂, 内中心原子价电子数与配体提供电子总数之和为18,则
D.每个 分子最多可与两个 分子形成两个氢键
14.氯仿 常因保存不慎而被氧化,产生剧毒物光气 : ,其中光
气的结构式如图所示,下列说法不正确的是
A. 分子为含极性键的正四面体形分子
B. 分子中含有3个σ键、1个π键,中心C原子采取 杂化
C. 分子中所有原子的最外层都满足8电子稳定结构
D.使用氯仿前可用 稀溶液检验氯仿是否变质
15.现有四种元素基态原子的电子排布式如下。则下列有关比较中正确的是
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
A.第一电离能:④>③>①>② B.原子半径:②>①>③>④
C.电负性:④>①>③>② D.最高正化合价:④>③=②>①
16.已知某元素+3价离子的电子排布式为1s22s22p63s23p63d3,该元素在周期表中的位置和区域是
A.第三周期第ⅥB族;p区 B.第三周期第ⅢB族;ds区
C.第四周期第ⅥB族;d区 D.第四周期第ⅢB族;f区
二、综合题(共2题)
17.实施以减少能源浪费和降低废气排放为基本内容的节能减排政策,是应对全球气候问题、建设资源节
约型、环境友好型社会的必然选择。化工行业的发展必须符合国家节能减排的总体要求,依靠理论知识做
基础。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为:K= ,它所对应的化学反应为:________________。
(2)利用水煤气合成二甲醚的三步反应如下:
①2H(g)+CO(g) CHOH(g) △H=-90.8 kJ/mol
2 3②2CH OH(g) CHOCH (g)+HO(g) △H=-23.5 kJ/mol
3 3 3 2
③CO(g)+H O(g) CO(g)+H(g) △H=-41.3 kJ/mol
2 2 2
总反应:3H(g)+3CO(g) CHOCH (g)+CO (g) 的△H =____________;二甲醚(CHOCH )直接作燃料电
2 3 3 2 3 3
池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为________________。
(3)煤化工通常通过研究不同温度下平衡常数以解决各种实际问题.已知等体积的一氧化碳和水蒸气进入反
应器时,会发生如下反应:CO(g)+HO(g) CO(g)+H(g),该反应平衡常数随温度的变化如下表所示:
2 2 2
温度/℃ 400 500 800
平衡常数K 9.94 9 1
该反应的正反应方向是_______反应(填“吸热”或“放热”),若在500℃时进行,设起始时CO和HO的
2
起始浓度均为 0.020 mol/L,在该条件下,CO的平衡转化率为:________________。
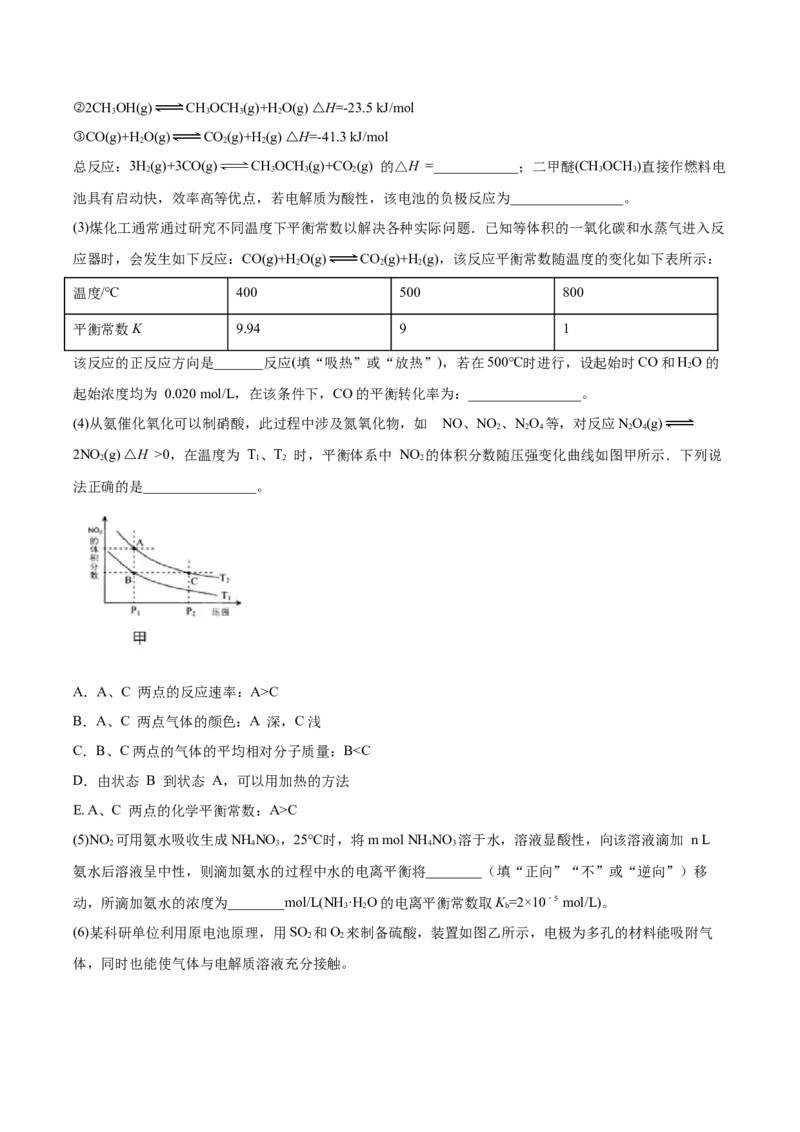
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如 NO、NO 、NO 等,对反应NO(g)
2 2 4 2 4
2NO (g) △H >0,在温度为 T、T 时,平衡体系中 NO 的体积分数随压强变化曲线如图甲所示.下列说
2 1 2 2
法正确的是________________。
A.A、C 两点的反应速率:A>C
B.A、C 两点气体的颜色:A 深,C浅
C.B、C两点的气体的平均相对分子质量:BC
(5)NO 可用氨水吸收生成NH NO ,25℃时,将m mol NH NO 溶于水,溶液显酸性,向该溶液滴加 n L
2 4 3 4 3
氨水后溶液呈中性,则滴加氨水的过程中水的电离平衡将________(填“正向”“不”或“逆向”)移
动,所滴加氨水的浓度为________mol/L(NH ·H O的电离平衡常数取K =2×10﹣5 mol/L)。
3 2 b
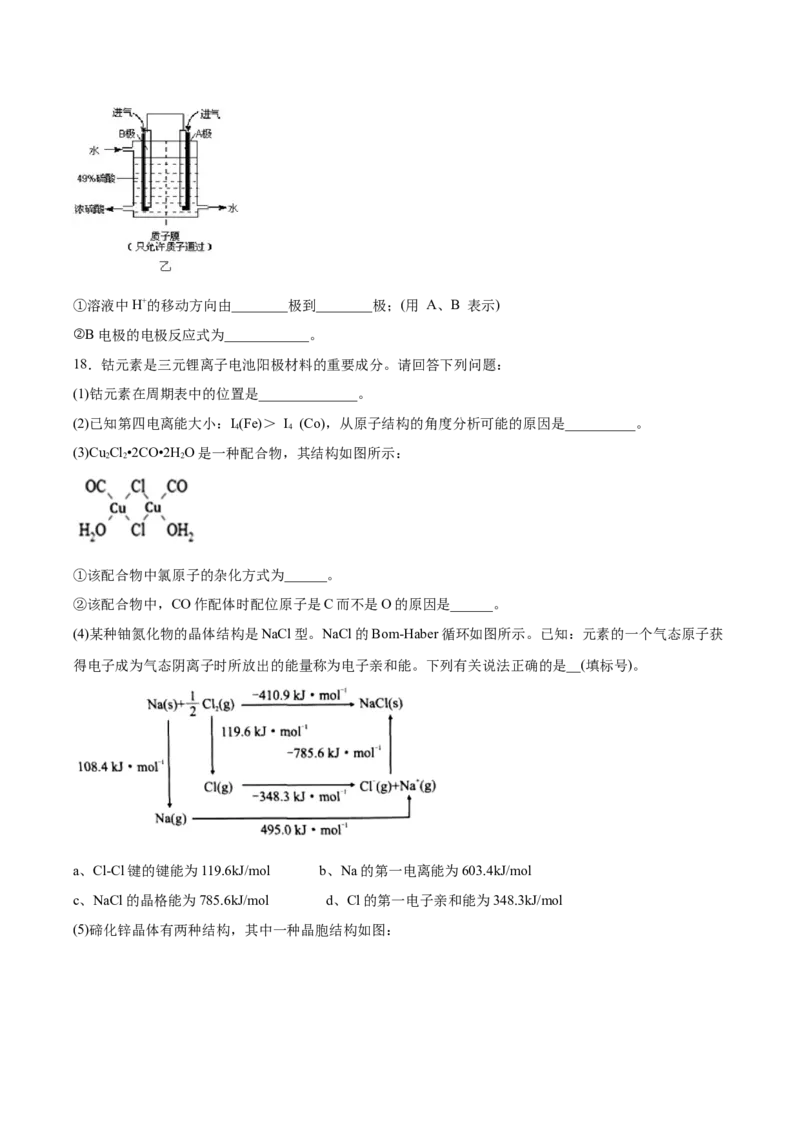
(6)某科研单位利用原电池原理,用SO 和O 来制备硫酸,装置如图乙所示,电极为多孔的材料能吸附气
2 2
体,同时也能使气体与电解质溶液充分接触。①溶液中H+的移动方向由________极到________极;(用 A、B 表示)
②B电极的电极反应式为____________。
18.钴元素是三元锂离子电池阳极材料的重要成分。请回答下列问题:
(1)钴元素在周期表中的位置是______________。
(2)已知第四电离能大小:I(Fe)> I (Co),从原子结构的角度分析可能的原因是__________。
4 4
(3)Cu Cl•2CO•2H O是一种配合物,其结构如图所示:
2 2 2
①该配合物中氯原子的杂化方式为______。
②该配合物中,CO作配体时配位原子是C而不是O的原因是______。
(4)某种铀氮化物的晶体结构是NaCl型。NaCl的Bom-Haber循环如图所示。已知:元素的一个气态原子获
得电子成为气态阴离子时所放出的能量称为电子亲和能。下列有关说法正确的是__(填标号)。
a、Cl-Cl键的键能为119.6kJ/mol b、Na的第一电离能为603.4kJ/mol
c、NaCl的晶格能为785.6kJ/mol d、Cl的第一电子亲和能为348.3kJ/mol
(5)碲化锌晶体有两种结构,其中一种晶胞结构如图:若与Zn距离最近的Te原子间距为a pm,则晶体密度为__________g/cm3。参考答案
1.D
【详解】
A.分子中共价键键角均为60°,A项错误;
B.原子半径As>P,一般键长越长,键能越小,B项错误;
C.黄砷分子为非极性分子,根据“相似相溶”规律,黄砷不易溶于水,C项错误;
D.黄砷和白磷都为分子晶体,相对分子质量越大,分子间作用力越强,则熔点越高,D项正确。
故选:D。
2.D
【详解】
A.某元素的基态原子最外层电子排布式是 ,位于p区,属于第ⅢA族元素,同主族元素自上而
下,金属性逐渐增强,故该元素的金属性比Al的强,该元素单质是导体,A正确;
B.该元素的金属性比Al的强,在一定条件下能与盐酸反应放出 ,B正确;
C. 显弱碱性,该元素的金属性比Al的强,故该元素最高价氧化物对应水化物的碱性比
的强,C正确;
D.该元素原子最外层电子数为3,最高化合价为+3,D错误。
故选:D。
3.B
【详解】
①Na O 中存在离子键共价键;
2 2
②SiO 中只存在共价键;
2
③石墨中存在共价键和分子间作用力;
④金刚石中只存在共价键;
⑤CaH 中只存在离子键;
2
⑥白磷中存在共价键和分子间作用力;含有两种结合力的是①③⑥;
答案选B
4.C
【详解】A.原子半径大小应该是 ,A错误;
B.X可能是C,则Y是 , 溶液能与 溶液反应,但 溶液不能与 溶液反应,B
错误;
C.Y是 ,X、Z分别是N和S,N和S的单质都是分子晶体,C正确;
D.X为O,Y为P,Z为 ,由于 分子间存在氢键,故 的熔、沸点高于 ,D错误;
故选C。
5.B
【详解】
A. σ键以“头碰头”方式重叠,为球形对称,π键以“肩并肩”方式重叠,为镜面对称,故σ键可以绕
键轴旋转,而π键不能绕键轴旋转,A项正确;
B. s轨道的电子云是球形对称,相互重叠时无方向性,B项错误;
C. 的结构式为 , 的结构式为 , 分子和 分子中都含有5个
σ键,C项正确;
D. σ键以“头碰头”方式重叠,为球形对称,π键以“肩并肩”方式重叠,为镜面对称,D项正确;
故选B。
6.A
【详解】
A.同主族的金属元素从上到下,金属原子的价层电子数不变,原子半径逐渐增大,金属键逐渐减弱,金
属熔点逐渐降低,故A正确;
B.同周期元素电负性从左到右依次增大,电负性F>O>N>C,故B错误;
C.同周期元素第一电离能呈增大趋势,但IIA和VA族为全满和半满稳定状态,第一电离能反常的比相邻
下一主族大,故第一电离能Na①>③>④,故B正确;
C.同周期主族元素从左到右电负性逐渐增大,所以电负性: , ,N元素非金属性比S元素强,
所以电负性: ,故电负性:④>③>①>②,故C错误;
D.最高正化合价等于最外层电子数,但F元素没有正化合价,所以最高正化合价:①>③=②,故D错
误;
故选B。
16.C
【详解】
某+3价离子的电子排布式为1s22s22p63s23p63d3,其原子核外电子数为21+3=24,为Cr元素,原子核外排布
式为1s22s22p63s23p63d5s1,处于周期表中第4周期第VIB族,属于d区,故选C。
17.C(s)+HO(g) CO(g)+H(g) ﹣246.4 kJ/mol CH OCH -12e﹣+3H O=2CO+12H+ 放热
2 2 3 3 2 2
75% D 逆向 B A SO -2e-+2H O═SO2-+4H+
2 2 4
【分析】
(1)根据质量守恒定律,结合可逆反应平衡常数的含义及表达式书写反应方程式;
(2)根据盖斯定律,将已知的热化学方程式叠加,就得到相应的反应的热化学方程式;CHOCH 在负极失去
3 3
电子,被氧化变为CO、HO,据此书写电极反应式;
2 2
(3)根据温度对化学平衡常数的影响判断反应的热效应;利用500℃时K=9,利用物质的起始浓度及反应转
化关系计算CO的平衡转化率;
(4)根据外界条件对化学反应速率、化学平衡常数、化学平衡移动的影响分析判断;
(5)依据铵根离子水解分析回答;依据同粒子效应,一水合氨对铵根离子水解起到抑制作用;依据一水合氨
的电离平衡常数计算得到氨水浓度;
(6)SO 与O 反应生成SO ,SO 再与水化合生成硫酸,根据硫酸的出口判断原电池的正负极,负极发生氧
2 2 3 3
化反应,正极发生还原反应,原电池放电时,电解质溶液中阳离子向正极移动。
【详解】
(1)平衡常数为生成物的浓度幂之积除以反应物的浓度幂之积,在平衡常数表达式中,分子为生成物,分母为反应物,固体或纯液体物质不能写入表达式中,再结合质量守恒定律,所以该反应的方程式为C(s)
+H O(g) CO(g)+H(g);
2 2
(2)①2H(g)+CO(g) CHOH(g) △H=-90.8 kJ/mol
2 3
②2CH OH(g) CHOCH (g)+HO(g) △H=-23.5 kJ/mol
3 3 3 2
③CO(g)+H O(g) CO(g)+H(g) △H=-41.3 kJ/mol
2 2 2
根据盖斯定律,将①×2+②+③,整理可得总反应的热化学方程式:3H(g)+3CO(g) CHOCH (g)+CO (g)
2 3 3 2
的△H =﹣246.4 kJ/mol;
二甲醚(CHOCH )直接作燃料电池具有启动快,效率高等优点,若电解质为酸性,该电池的负极反应为二
3 3
甲醚失电子生成二氧化碳,负极的电极反应为:CHOCH -12e-+3H O=2CO+12H+;
3 3 2 2
(3)由于升高温度,化学平衡向吸热反应方向移动,对该反应来说,温度升高化学平衡常数K值减小,说明
升高温度化学平衡逆向移动,逆反应为吸热反应,所以该反应的正反应为放热反应,假设反应消耗的CO
浓度为x,则根据方程式CO(g)+HO(g) CO(g)+H(g)可知物质改变的物质的量相等,因此平衡时各种
2 2 2
气体的物质的量浓度分别是:c(CO)=c(H O)=(0.02-x) mol/L,c(CO)=c(H )=x mol/L,所以
2 2 2
=9,解得x=0.015 mol/L,所以CO的平衡转化率为 ×100%=75%;
(4)对反应NO(g) 2NO (g) △H >0,由于该反应的正反应为吸热反应,升高温度,平衡正向移动,
2 4 2
NO 平衡时体积分数增大,根据图象可知NO 平衡时体积分数:A>B,说明温度:T>T。
2 2 2 1
A.A点、C点温度相同,A点压强小于C点的压强,增大压强,化学反应速率越大,则反应速率:
AB,在相同压强下,升高温度,化学平衡向吸热的正反应方向移
动,则NO 的体积分数增大,所以由状态B到状态A,可以用加热的方法,D正确;
2
E.化学平衡常数只与温度有关,A、C两点的温度相同,所以它们的平衡常数也相等,E错误;
故合理选项是D;
(5)NO 可用氨水吸收生成NH NO ,25℃时,将m mol NH NO 溶于水,溶液显酸性,是由于NH +水解,
2 4 3 4 3 4
消耗水电离产生的OH-,最终达到平衡时,溶液中c(H+)>c(OH-),反应的离子方程式为:NH ++H O
4 2
NH •H O+H+;向其中加入氨水,使c(NH •H O)增大,抑制了铵根离子水解,水解平衡逆向进行,水的电
3 2 3 2离平衡逆向移动;将m mol NH NO 溶于水,向该溶液滴加n L氨水后溶液呈中性,则根据电荷守恒计算可
4 3
知,溶液中氢氧根离子浓度c(OH-)=10-7 mol/L,NH •H O的电离平衡常数取K =2×10-5 mol/L,设混合后溶
3 2 b
液体积为1 L,c(NH +)=c(NO -)=m mol/L;根据一水合氨电离平衡得到:NH •H O NH ++OH-,平衡常
4 3 3 2 4
数K= =2×10-5 mol/L,解得c(NH •H O)= mol/L;
3 2
(6)该原电池中,负极上失电子被氧化,发生氧化反应,所以负极上投放的气体是SO ,SO 失电子和水反
2 2
应生成SO 2-和H+,正极上投放的气体是O,正极上O 得电子和H+反应生成水,根据硫酸和水的出口方向
4 2 2
知,B极是负极,A极是正极,所以B极上的电极反应式为:SO -2e-+2H O═SO2-+4H+,原电池放电时,
2 2 4
溶液中的H+由负极B移向正极A,所以其电池反应式为:2SO +O +2H O=2HSO 。
2 2 2 2 4
【点睛】
本题考查了热化学方程式的书写、原电池原理应用、平衡移动相关计算、盐类水解判断等,把握图象分析
方法、盖斯定律等化学反应原理是本题解答的关键,注意结合电解质溶液的书写及分析原电池电极反应。
18.第四周期Ⅷ Co失去的是3d6上的一个电子,而Fe失去的是半充满状态3d5上的一个电子,故Fe需
要的能量较高 sp3 电负性C<O,C对孤电子对的吸引力较弱,更容易给出孤电子对 cd
【分析】
根据原子的电子层数及其价电子数确定元素在周期表中的位置。根据原子及其离子的价电子排布分析其电
离能的相对大小。根据价层电子对互斥理论分析原子的杂化类型。根据电负性的大小分析配合物中的配位
原子。分析表中数据并结合相关概念判断有关变化中能量变化。根据晶胞结构分析晶体的化学式并进行相
关计算。
【详解】
(1)钴是27号元素,其有4个电子层,其价电子排布式为3d74s2,因此,其在周期表中的位置是第四周期Ⅷ
族。
(2)Fe的价电子排布式为3d64s2,其失去3个电子后变为较稳定的半充满结构3d5,而Co的价电子排布式为
3d74s2,其失去3个电子后变为3d6。因此,从原子结构的角度分析I(Fe)> I (Co)的可能原因是:Co失去
4 4
的是3d6上的一个电子,而Fe失去的是半充满状态3d5上的一个电子,故Fe需要的能量较高。(3)由Cu Cl•2CO•2H O的结构 可知:
2 2 2
①该配合物中氯原子均形成2个σ键,另外每个氯原子还有2个孤电子对,故其价层电子对数为4,其杂
化方式为sp3。
②CO分子中的C原子和O原子均有孤电子对,但是O元素的电负性大于C元素,故O原子对孤电子对的
吸引力更强,因此,该配合物中,CO作配体时配位原子是C而不是O的原因是:电负性C<O,C对孤电
子对的吸引力较弱,更容易给出孤电子对(用于形成配位键)。
(4)a、由图中信息可知, Cl(g)=Cl(g)的∆H=119.6kJ/mol,因此, Cl-Cl键的键能为239.2kJ/mol ,a不正
2
确;
b、由图中信息可知,Na(g)=Na+(g)+e-的∆H=495.0kJ/mol,因此, Na的第一电离能为603.4kJ/mol,b不正
确;
c、由图中信息可知,Cl-(g)+ Na+(g)= NaCl(s)的∆H= -785kJ/mol,因此,NaCl的晶格能为785.6kJ/mol,c正
确;
d、由图中信息可知,Cl(g) +e-=Cl-(g) 的∆H= -348.3kJ/mol,因此,Cl的第一电子亲和能为348.3kJ/mol,d
正确。
综上所述,有关说法正确的是cd。
(5)由碲化锌晶体的晶胞结构示意图可知,其晶胞结构与金刚石相似,Te原子堆积方式为面心立方最密堆
积,Zn距离最近的Te原子间距为体对角线长度的 ,高晶胞参数(即该晶胞的边长)为x,则晶胞的体对
角线长度为, x=4a pm,故x= pm,晶胞的体积为x3= 。该晶胞中占有4个Te原子和4个
Zn原子,则晶胞的质量为 。因此,该晶体密度为 g/cm3。
【点睛】本题中关于晶胞的计算是难点,尤其是确定与Zn距离最近的Te原子的间距为体对角线长度的 ,这也是
解题的关键所在。解题时,要求学生能掌握常见晶胞中原子的堆积方式,并能迁移到新的情境之中,做到
轻车熟路、得心应手。另外,还要掌握常见于晶胞计算中的长度单位的换算,不能在这种小的地方失误。