文档内容
期初联合调研考试高三化学参考答案
1-5 C C B A B
6-10 A A B D C
11-13 A B D
14.(15分)
(1)1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3;(2分)
(2)适当提高温度;适当提高H O 、H SO 的浓度等(合理即可);(2分)
2 2 2 4
(3)2Cu As+6H SO +11H O =6CuSO +2H AsO +14H O;(3分)
2 2 4 2 2 4 3 4 2
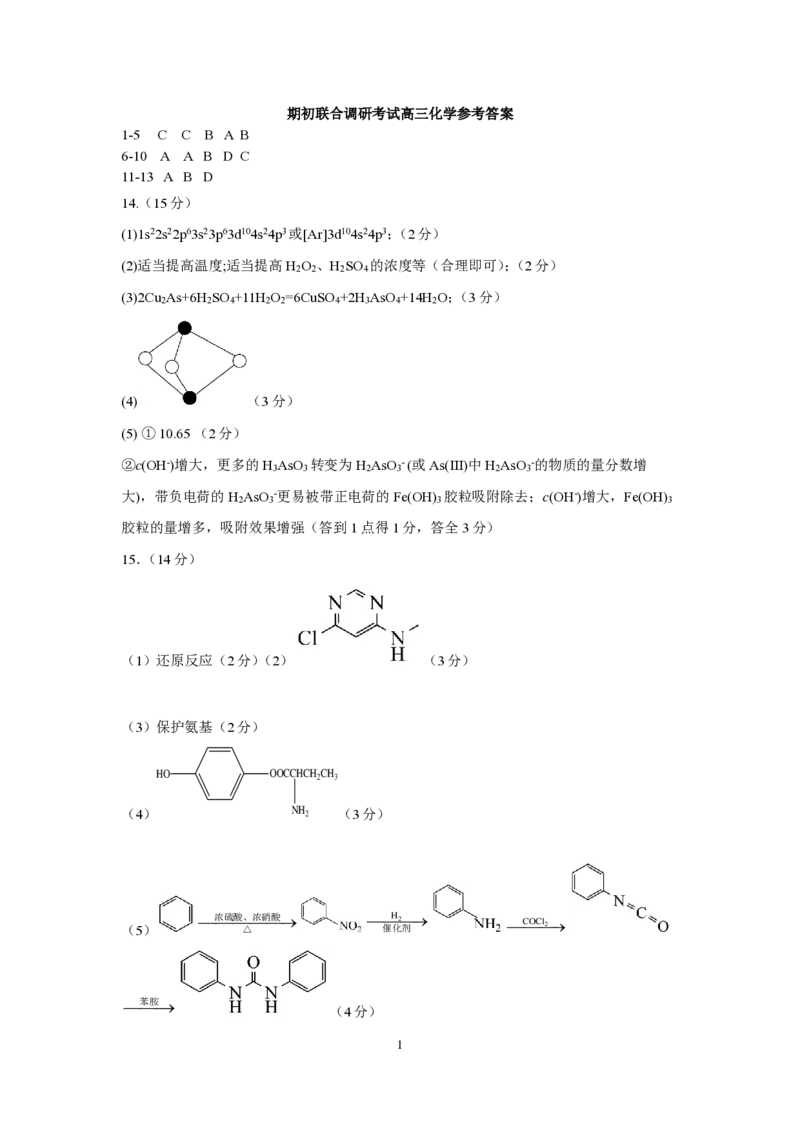
(4) (3分)
(5) ① 10.65 (2分)
②c(OH-)增大,更多的H AsO 转变为H AsO - (或As(Ⅲ)中H AsO -的物质的量分数增
3 3 2 3 2 3
大),带负电荷的H AsO -更易被带正电荷的Fe(OH) 胶粒吸附除去;c(OH-)增大,Fe(OH)
2 3 3 3
胶粒的量增多,吸附效果增强(答到1点得1分,答全3分)
15.(14分)
(1)还原反应(2分)(2) (3分)
(3)保护氨基(2分)
(4) (3分)
(5)
1
⎯ 浓⎯ 硫 酸⎯ 、△ 浓⎯ 硝 酸⎯ → ⎯ ⎯催 H化 ⎯2剂 → ⎯ C⎯ O C l⎯2 →
⎯苯⎯胺⎯→
(4分)
H O O O C C
N
H
H
C
2
H C2 H
3
{#{QQABSYSEggAAQBAAAQgCQw06CAOQkBGACKoGwAAIIAABiQFABAA=}#}16.(16分)
(1)将生成的NO部分转化为NO ,便于NO 被NaOH溶液完全吸收(2分)三颈烧瓶内无
2 x
红棕色气体出现(2分)
(2) 2Ni2++4HCO -=NiCO ·Ni(OH) ↓+3CO ↑+H O (3分)
3 3 2 2 2
(3)向所得溶液中加入NiCO 至反应液3.2<pH<7.2,(1分)静置,过滤,向滤液中加入适
3
量盐酸,(1分)用pH计控制溶液pH小于2,(1分)蒸发浓缩,冷却至0℃左右结晶,(1
分)过滤,用冰水洗涤,干燥(1分)(每一步见错,后续熔断,共5分)
(4)舍去误差明显偏大的19.60mL,消耗EDTA溶液平均体积为20.00mL,根据
250mL
2010-3Lcmol/L281g/mol
25mL
Ni2++H Y2-=NiY2-+2H+反应可知,纯度为 wg 100%=
2
2
2 0 2
ω
8 1 c
,故答案为:
2 0 2
ω
8 1 c
。(4分)
17.(16分)
(1)-985.2 kJ·mol-1(2分)
(2)当温度低于780K时,反应未达到平衡,升高温度,反应速率加快(或反应正向进行的
程度增大),NO的去除率升高(3分)
高于780K时,升高温度,催化剂活性降低,(1分)部分NO被氧化NO ,(1分)NO的
2
去除率随温度升高而降低(答到1点得1分,答全3分)
(3)①NO+5e-+5H+ = NH +H O(3分) 0.19(2分)
3 2
②随着电解电压的不断增大,*NO结合H+与e-得到*NOH(或*NO+H++e-=*NOH)的
量增多;(1分)*NOH在催化剂表面失水转化成N O(或2*NOH=N O↑+H O)的选择
2 2 2
性增大,导致N O的量增多(1分)(答到1点得1分,答全3分)
2
{#{QQABSYSEggAAQBAAAQgCQw06CAOQkBGACKoGwAAIIAABiQFABAA=}#}