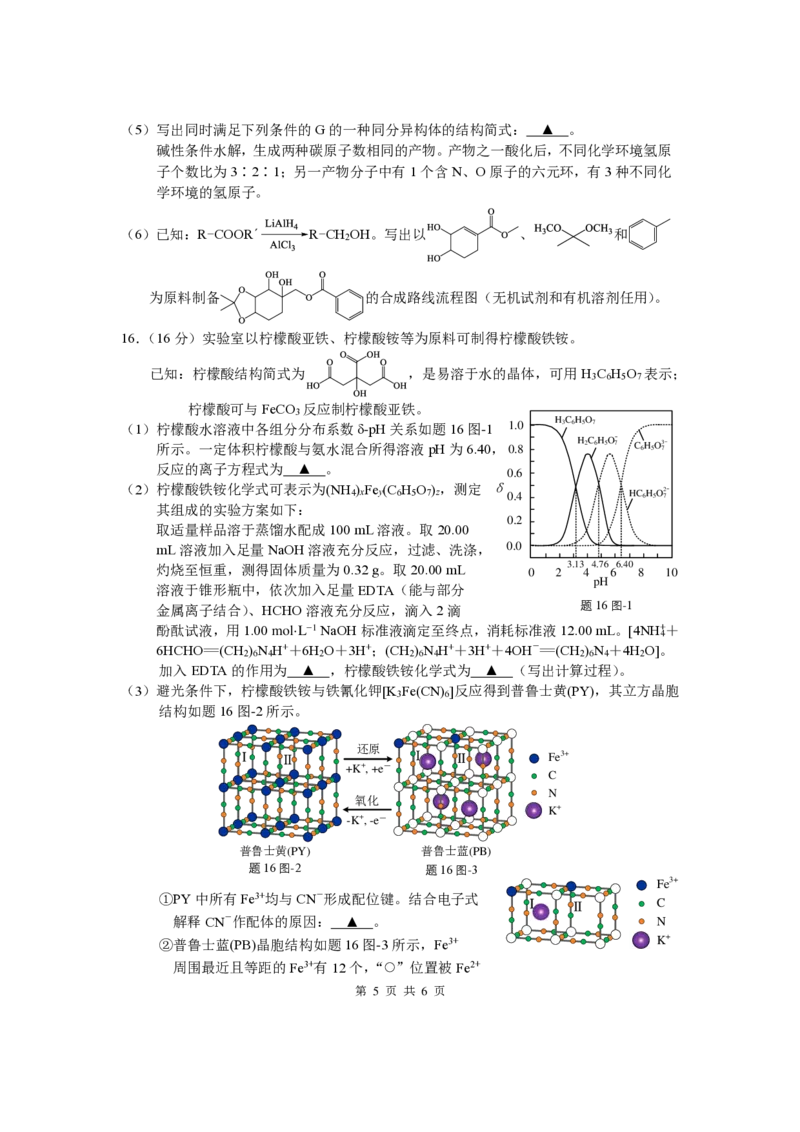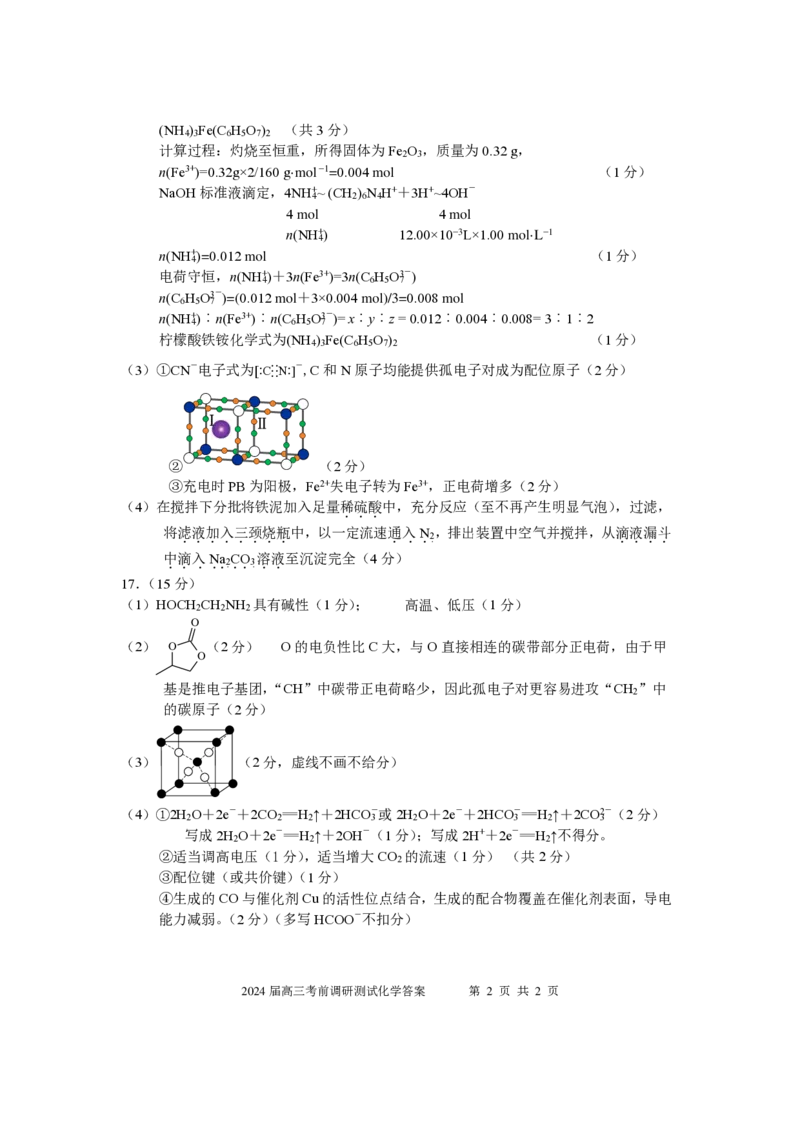文档内容
扬州市 2024 届高三考前调研测试
化学
2024.05
注意事项:
考生在答题前请认真阅读本注意事项及各题答题要求
1.本试卷共6页,包含选择题[第1题~第13题,共39分]、非选择题[第14题~第17
题,共61分]两部分。本次考试时间为75分钟,满分100分。考试结束后,请将答题
卡交回。
2.答题前,请考生务必将自己的学校、姓名、准考证号用 0.5 毫米的黑色签字笔写在答题
卡上相应的位置,在相应区域贴好条形码。
3.选择题每小题选出答案后,请用 2B 铅笔在答题卡指定区域填涂,如需改动,用橡皮擦
干净后,再填涂其它答案。非选择题请用0.5毫米的黑色签字笔在答题卡指定区域作答。
在试卷或草稿纸上作答一律无效。
4.如有作图需要,可用2B铅笔作答,并请加黑加粗,描写清楚。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 P-31 S-32 Fe-56
选择题(共 39分)
单项选择题:本题包括13小题,每小题3分,共计39分。每小题只有一个选项符合题意。
1.钠钾合金常温下呈液态,可用作快中子反应堆的热交换剂,这主要是因为钠钾合金
A.易与O 反应 B.易与H O反应
2 2
C.熔点低、导热性好 D.密度小、硬度小
2.K Cr O 检验酒精的反应为 2K Cr O +3C H OH+8H SO =3CH COOH+2Cr (SO ) +
2 2 7 2 2 7 2 5 2 4 3 2 4 3
2K SO +11H O。下列说法正确的是
2 4 2
A.中子数为28的铬原子:24 Cr B.H O的电子式:H O H
52 2
C.K+的结构示意图:+18 2 88 D.C 2 H 5 OH中氧元素的化合价:-2
3.实验室制取少量C H 的原理及装置均正确的是
2 4
浓硫酸
碱石灰
气体
气体
气体
H2O
乙醇
A.制取C H B.干燥C H C.收集C H D.吸收C H
2 4 2 4 2 4 2 4
4.将Ca (PO ) 、SiO 和C在高温下焙烧可以得到单质磷。下列说法正确的是
3 4 2 2
A.电负性:χ(Ca)>χ(P) B.原子半径:r(P)>r(Ca)
C.电离能:I (O)>I (C) D.热稳定性:SiH >CH
1 1 4 4
第 1 页 共 6 页
{{##{{QQQQAABBYaQQACpE5ogggigwAgJJJbAAACAAh4CqAAw03nEwCCggsEQQkkJBOEgAJCUYgEgGgQRCAOAMOAMwADAQBQJNRANBAIAB=A}A#=}}#}阅读下列材料,完成5~7题:Cu、Ag位于元素周期表ⅠB族。Ag与空气中微量H S接触发
2
生反应生成黑色Ag S。Cu可以形成CuCl 、CuSO 、Cu O、Cu S等化合物。有研究表明,
2 2 4 2 2
无水CuCl 为长链状结构,其片断如图 。
2
5.下列说法正确的是
A.CuCl 属于离子化合物 B.CO2-的空间构型为三角锥
2 3
C.SO2-中的键角比SO2-中的小 D.NO-中心原子的轨道杂化类型为sp2
4 3 3
6.下列化学反应表示正确的是
A.Ag与空气中H S的反应:4Ag+2H S+O =2Ag S+2H O
2 2 2 2 2
△
B.加热CuCl ·2H O:CuCl ·2H O====CuCl +2H O
2 2 2 2 2 2
C.用惰性电极电解CuSO 溶液的阴极反应:2H O—4e-=4H++O ↑
4 2 2
△
D.Cu S与热的浓硝酸反应:Cu S+6H++2NO-====2Cu2++H S↑+2NO ↑+2H O
2 2 3 2 2 2
7.下列物质结构与性质或物质性质与用途不具有对应关系的是
...
A.H O中的O存在孤电子对,Cu2+能与H O形成[Cu(H O) ] 2+
2 2 2 4
B.H SO 中H元素呈+1价,浓H SO 具有强氧化性
2 4 2 4
C.CuSO 具有杀菌能力,可用于游泳池的水处理
4
D.无水CuSO 吸水后显现蓝色,可用于检验乙醇所含的微量水分
4
8.工业生产H SO 过程中发生反应2SO (g)+O (g) 2SO (g)。下列说法正确的是
2 4 2 2 3
c2(SO2)·c(O2)
A.反应的平衡常数K= c2(SO3)
B.该反应S<0、H>0
C.使用合适的催化剂,可以降低反应的活化能,加快反应速率
D.上述反应中每消耗1 mol O ,转移电子的数目约为2×6.02×1023
2
9.氯及其化合物的转化具有重要应用。下列说法不正确的是
...
A.实验室利用浓盐酸的氧化性制备Cl
2
B.利用ClO 的氧化性对饮用水进行消毒
2
C.Cl 与石灰乳反应制备漂白粉及漂白粉使用时加水浸泡片刻的物质转化:
2
第 2 页 共 6 页
C l2
石 灰 乳
C a ( C lO )
2
H
C
O2O
2
H C lO
D.制备FeCl 的路径之一: 3
10.化合物Z是合成非诺洛芬的中间体,其合成路线如下:
HO
O
Br K CO 、Cu O O NaBH 4 O OH
2 3
X Y Z
下列说法正确的是
A.X→Y反应中的K CO 可以用H CO 代替
2 3 2 3
B.根据Y→Z的反应可知NaBH 具有还原性
4
C.Y与足量H 的加成产物中含2个手性碳原子
2
D.Y、Z可用FeCl 溶液进行鉴别
3
C u
C
C
l
l
C u
C
C
l
l
C u
Fe Cl HCl FeCl 2 FeCl 2 3
{{##{{QQQQAABBYaQQACpE5ogggigwAgJJJbAAACAAh4CqAAw03nEwCCggsEQQkkJBOEgAJCUYgEgGgQRCAOAMOAMwADAQBQJNRANBAIAB=A}A#=}}#}11.室温下,下列实验探究方案能达到探究目的的是
选项 探究方案 探究目的
向NaCl、NaI混合溶液中滴加少量AgNO 溶液,
A 3 K (AgCl)>K (AgI)
观察沉淀的颜色 sp sp
将少量SO 气体通入0.1 mol·L−1 Ba(NO ) 溶液中,
B 2 3 2 BaSO 难溶于水
观察实验现象 3
向0.1 mol·L−1 H O 溶液中滴加0.1 mol·L−1 KMnO
C 2 2 4 H O 具有氧化性
溶液,观察溶液颜色变化 2 2
向 FeCl 溶液中滴加少量 KI 溶液,再滴加少量淀
D 3 Fe3+的氧化性比I 的强
粉溶液,观察溶液颜色变化 2
12.CuCl 为难溶于水的白色固体。室温
下,以CuO为原料制备CuCl的过程
如题12图所示。下列说法正确的是
A.0.1 mol·L−1 Na SO 溶液中:
2 3 题12图
c(OH—)=c(HSO-)+c(H SO )+c(H+)
3 2 3
B.“还原”发生反应的离子方程式为:2Cu2++SO2-+2Cl—+H O=2CuCl+SO2-+2H+
3 2 4
C.“还原”后的溶液中:2c(Cu2+)+c(H+)=c(OH—)+2c(SO2-)+c(Cl—)
4
K (CuCl)
D.“过滤”后得到的滤液中:c(Cu+)> sp
c(Cl—)
13.丙烷催化脱氢制备丙烯的主要反应为
反应1 C H (g)=C H (g)+H (g) ΔH=125 kJ·mol−1 3 8 3 6 2
反应2 C H (g)=C H (g)+CH (g) ΔH=81 kJ·mol−1 3 8 2 4 4
反应3 C H (g)=3C(g)+4H (g)
3 8 2
n(H )
2
在1.0×105Pa时,将H 2 与C 3 H 8 的混合气体[n(C 3 H 8 )=0.25]
按一定流速通过催化反应管,测得C H 的转化率、C H
3 8 3 6
n (C H )
生成 3 6
的收率[C 3 H 6 的收率= n 起始 (C 3 H 8 )×100%]与C 3 H 6 的选择
n (C H )
生成 3 6
性[C 3 H 6 的选择性= n 反应 (C 3 H 8 )×100%]随温度变化的
关系如题13图所示。下列说法不正确的是
...
A.图中曲线②表示C H 的收率
3 6
B.其他条件相同,630℃时生成的C H 物质的量比580℃时的多
3 6
C.C H 中混入H 的主要目的是为了延长催化剂的使用寿命
3 8 2
D.升高温度对反应2和反应3的影响比对反应1的影响更显著
非选择题(共 61分)
14.(15 分)以钛白副产品(含 FeSO 及少量 TiOSO )和 H C O 为原料制备的超微细
4 4 2 2 4
FeC O ·2H O,可广泛用于新型电池材料、感光材料的生产。
2 4 2
已知:①25℃时,K [TiO(OH) ]=1×10−29;K [Fe(OH) ]=8×10−16;
sp 2 sp 2
②FeC O ·2H O不溶于水,溶于硫酸。
2 4 2
③沉淀速度过快,沉淀的粒径会变大,包裹的杂质会变多。
第 3 页 共 6 页
)%(率收6H3C或)%(率化转8H3C
4 8
4 4
4 0
3 6
3 2
2 8
5 8 0 5 9 0 6 0
温
0
度 (/
6 1 0
)
6 2 0 6 3 0
1 0
9 5
9 0
8 5
0
)%(性择选的6H3C
题13图
C u O
稀
酸
硫
溶
酸 N a S O
2
还
、3
原
N a C l
过 滤 、 洗 涤 C u C l
{{##{{QQQQAABBYaQQACpE5ogggigwAgJJJbAAACAAh4CqAAw03nEwCCggsEQQkkJBOEgAJCUYgEgGgQRCAOAMOAMwADAQBQJNRANBAIAB=A}A#=}}#}(1)FeC O ·2H O的制备。将一定量的钛白副产品用热水溶解,在搅拌下加入还原铁粉,
2 4 2
反应后pH为4~5,过滤得到FeSO 溶液。在搅拌下先后加入氨水和草酸溶液,经H SO
4 2 4
调节pH、过滤、水洗、烘干后得到超微细FeC O ·2H O。
2 4 2
①加入还原铁粉的作用是 ▲ ;
②温度对沉淀粒径的影响如题 14 图-1,
加入氨水和草酸溶液过程需控制温度
在40℃的原因是 ▲ ;
③pH对产品纯度的影响如题14图-2。
沉淀过程pH>2时会导致产品纯度
降低,产生的杂质为 ▲ 。 题14图-1 题14图-2
(2)FeC O 的结构。FeC O ·2H O晶体为片层结构,层内每个Fe2+与2个C O2-和2个H O
2 4 2 4 2 2 4 2
相连,形成 1 个铁氧八面体。在答题卡的题 14 图-3 补全该结构。FeC O ·2H O 晶体
........... 2 4 2
层与层之间的作用力为 ▲ 。
题14图-3
题14图-4
(3)FeC O 的性质。将FeC O ·2H O在氮气的氛围中加热分解。加热过程中固体残留率[固
2 4 2 4 2
剩余固体质量
体残留率= ×100%]随温度的变化如题14图-4所示,B点时,固体只含有
起始固体质量
一种铁的氧化物,则AB段发生反应的化学方程式: ▲ 。
15.(15分)化合物G是新型小分子抗凝剂的关键中间体,其合成路线如下:
A B C D
E F G
其中“-Boc”为基团“-COOC(CH ) ”的缩写
3 3
(1)A中含氧官能团的名称为 ▲ 。
(2)A→B过程中(C H ) N的作用为 ▲ 。
2 5 3
(3)反应历程:C X D。X的分子式为C H O N ,X→D的反应类型为 ▲ 。
8 14 4 2
(4)E转化为F的过程中,还生成另一种有机物。该物质相对分子质量为32,其分子式
为 ▲ 。
第 4 页 共 6 页
O
O
H
H
O2
F
O2
e
H
O
F
O2
H
e
2
O
F
O
mμ/d径粒
H
e
H
1 0
8
6
4
2
0
2
2
3 0
O
O
4 0
温
5度 0
/
%/率留残体固
6 0
1 0 0
8 0
6 0
4 000
B
7 0
(4
1 0
0
0
%/度纯品产
0
9 9 .6
9 9 .2
9 8 .8
9 8 .4
1 .0 1 .5
, A (2 0 0 8
, ) 4 2 .9 6 %
3 0 0
0
2 .0p
H
) .0 0 %
5 0 0
2 .5 3 .0 3 .5
{{##{{QQQQAABBYaQQACpE5ogggigwAgJJJbAAACAAh4CqAAw03nEwCCggsEQQkkJBOEgAJCUYgEgGgQRCAOAMOAMwADAQBQJNRANBAIAB=A}A#=}}#}(5)写出同时满足下列条件的G的一种同分异构体的结构简式: ▲ 。
碱性条件水解,生成两种碳原子数相同的产物。产物之一酸化后,不同化学环境氢原
子个数比为3∶2∶1;另一产物分子中有1个含N、O原子的六元环,有3种不同化
学环境的氢原子。
(6)已知:R-COOR´ R-CH OH。写出以 、 和
2
为原料制备 的合成路线流程图(无机试剂和有机溶剂任用)。
16.(16分)实验室以柠檬酸亚铁、柠檬酸铵等为原料可制得柠檬酸铁铵。
已知:柠檬酸结构简式为 ,是易溶于水的晶体,可用H C H O 表示;
3 6 5 7
柠檬酸可与FeCO 反应制柠檬酸亚铁。
3
(1)柠檬酸水溶液中各组分分布系数δ-pH关系如题16图-1
所示。一定体积柠檬酸与氨水混合所得溶液pH为6.40,
反应的离子方程式为 ▲ 。
(2)柠檬酸铁铵化学式可表示为(NH ) Fe (C H O ),测定 4 x y 6 5 7 z
其组成的实验方案如下:
取适量样品溶于蒸馏水配成100 mL溶液。取20.00
mL溶液加入足量NaOH溶液充分反应,过滤、洗涤,
灼烧至恒重,测得固体质量为0.32 g。取20.00 mL
溶液于锥形瓶中,依次加入足量EDTA(能与部分
金属离子结合)、HCHO溶液充分反应,滴入2滴
酚酞试液,用1.00 mol·L−1 NaOH标准液滴定至终点,消耗标准液12.00 mL。[4NH++
4
6HCHO=(CH ) N H++6H O+3H+;(CH ) N H++3H++4OH-=(CH ) N +4H O]。
2 6 4 2 2 6 4 2 6 4 2
加入EDTA的作用为 ▲ ,柠檬酸铁铵化学式为 ▲ (写出计算过程)。
(3)避光条件下,柠檬酸铁铵与铁氰化钾[K Fe(CN) ]反应得到普鲁士黄(PY),其立方晶胞
3 6
结构如题16图-2所示。
第 5 页 共 6 页
Ⅰ
普 鲁 士 黄
Ⅱ
(P Y
还 原
Ⅰ
+ - + K , + e
氧 化
+ - -K , -e
普 鲁 ) 士
Ⅱ
蓝 (P B )
F
C
N
K
3+ e
+
δ
题16图-1
题16图-2 题16图-3
①PY中所有Fe3+均与CN-形成配位键。结合电子式
解释CN-作配体的原因: ▲ 。
②普鲁士蓝(PB)晶胞结构如题16图-3所示,Fe3+
周围最近且等距的Fe3+有12个,“ ”位置被Fe2+
1
0
0
0
0
0
.0
.8
.6
.4
.2
.0
0
H C H O
3 6 5 7
H C H O 3 2 6 5 7 C H O 6 5 7
2 H C H O 6 5 7
3 .1 3 4 .7 6 6 .4 0 2 4 6 8 1
p H
0
Fe3+
Ⅰ Ⅱ C
N
K+
{{##{{QQQQAABBYaQQACpE5ogggigwAgJJJbAAACAAh4CqAAw03nEwCCggsEQQkkJBOEgAJCUYgEgGgQRCAOAMOAMwADAQBQJNRANBAIAB=A}A#=}}#}或Fe3+占据,用“ ”在答题卡上补全PB结构图中Ⅰ和Ⅱ两个小立方体中的Fe3+。
③由于PB中的K+能容易地嵌入和脱嵌,因此PB可作为钾离子电池的正极材料。
充电过程中,推测K+会从PB中脱嵌出来,理由是 ▲ 。
(4)补充完整由铁泥(主要含有单质铁、少量SiO 和铁的氧化物)
2
制备FeCO 的实验方案,部分装置如题16图-4所示:取一定
3
量的铁泥, ▲ ,所得产物经过滤、洗涤、干燥,得到FeCO 。
3
(须使用试剂:N 、Na CO 溶液、稀硫酸)
2 2 3
17.(15分)CO 资源利用具有重要意义。
2
(1)燃煤烟气中CO 的捕集可通过如下所示的物质转化实现。
2
吸收剂X能吸收CO 的原因是 ▲ ;“解吸”的条件是 ▲ 。
2
(2)CO 与环氧化合物反应可以转化为有价值的有机物。转化过程如题17图-1所示。Y为
2
五元环状化合物,Y的结构简式为 ▲ ;N原子上的孤电子对主要进攻甲基环氧乙烷
中“CH ”上的碳原子,而不是“CH”上的碳原子,原因是 ▲ 。
2
(3)高活性CO 催化剂的主要成分为Cu O。该催化剂中铜的氧化物晶胞投影如题17图-2
2 2
所示(沿x轴,y轴和z轴的投影都相同)。请在答题卡上相应位置补全该晶胞图,晶胞
内部距离最近的原子之间请用虚线相连接。
(4)CO 通过电催化还原可转化为有机物。以0.1 mol·L−1的KHCO 溶液为电解质溶液,
2 3
将CO 通入Cu基催化剂的电极材料上(Cu是催化剂的活性位点),相同条件下,电解
2
得到的部分还原产物的法拉第效率(FE%)随电解电压的变化如题17图-3所示。
FE%=
nX(生成还原产物X所需电子的物质的量)
×100% n (电解过程中通过电子的总物质的量)
总
①当电压为U 时,生成H 的电极反应式为 ▲ 。 1 2
②为了降低H 的法拉第效率,可以采取的措施为 ▲ 。 2
③生成的中间产物CO中C原子与Cu之间存在强烈的相互
作用,该作用力为 ▲ 。
④电压从U 增大到U 时,电流减小的可能原因是 ▲ 。 2 3
第 6 页 共 6 页
燃 煤 烟 气 吸 收
H O C H
吸
2
C
收
H
剂
N
2
X
H +2 C O O -
解 吸 C O
2
题16图-4
题17图-1 题17图-2
101
80 电流 H2 2m )
率 % /60 100 c/A m
效 第 拉40 CH4 流 电 (/
法 HCOO 10-1 C2H4
20
CO
0
U1 U2 U3
电解电压/V
题17图-3
O
N
N
O
N+
N
C O 2
Y
+
N
N
{{##{{QQQQAABBYaQQACpE5ogggigwAgJJJbAAACAAh4CqAAw03nEwCCggsEQQkkJBOEgAJCUYgEgGgQRCAOAMOAMwADAQBQJNRANBAIAB=A}A#=}}#}扬州市 2024 届高三考前调研测试
化学参考答案与评分建议
单项选择题(本题包括13小题,每题3分,共39分。每小题只有一个选项符合题意)
....
1.C 2.D 3.B 4.C 5.D 6.A 7.B 8.C 9.A 10.B
11.D 12.B 13.A
非选择题(包括4小题,共61分)
14.(15分)
(1)①调节pH,促进TiO2+水解,提升Fe2+浓度。(2分)
②温度过高,氨水挥发(分解),反应速度增加,产品粒径增大,包裹的杂质会变多;
温度过低,反应速度减慢(3分)
③Fe (C O ) 、Fe(OH) (2分)
2 2 4 3 3
(2)(3分)
2024届高三考前调研测试化学答案 第 1 页 共 2 页
O
O
H
H
O2
F
O2
e
O
O
C
C
O
O
H
O
F
O2
H
e
2 O
O
C
C
O
O
O
F
O
H
e
H
2
2
O
O
或
O
O
H
H
O2
F
O2
e
O
O
C
C
O
O
H
O
F
O2
H
e
2 O
O
C
C
O
O
O
F
O
H
e
H
2
2
O
O
范德华力和氢键(或分子间作用力)(2分)
200℃~400℃
(3)3FeC O =======Fe O +4CO↑+2CO ↑(3分)
2 4 3 4 2
15.(15分)
(1)酯基(1分)
(2)中和反应生成的酸,有利于反应正向进行,提高反应物的转化率(2分)
(3)加成反应(或环加成反应、周环反应、协同反应等,D-A反应不给分)(2分)
(4)CH O(2分)
4
(5) 或 (3分)
(6)
(5分)
16.(16分)
(1)2H C H O +5NH ·H O = HC H O2-+C H O3-+5NH++5H O(2分)
3 6 5 7 3 2 6 5 7 6 5 7 4 2
(2)与Fe3+结合(形成配离子,避免滴定时消耗更多的NaOH,影响组成测定)(1分)
{{##{{QQQQAABBYaQQACpE5ogggigwAgJJJbAAACAAh4CqAAw03nEwCCggsEQQkkJBOEgAJCUYgEgGgQRCAOAMOAMwADAQBQJNRANBAIAB=A}A#=}}#}(NH ) Fe(C H O ) (共3分)
4 3 6 5 7 2
计算过程:灼烧至恒重,所得固体为Fe O ,质量为0.32 g,
2 3
n(Fe3+)=0.32g×2/160 g·mol −1=0.004 mol (1分)
NaOH标准液滴定,4NH+~ (CH ) N H++3H+~4OH-
4 2 6 4
4 mol 4 mol
n(NH+) 12.00×10−3L×1.00 mol·L−1
4
n(NH+)=0.012 mol (1分)
4
电荷守恒,n(NH+)+3n(Fe3+)=3n(C H O3-)
4 6 5 7
n(C H O3-)=(0.012 mol+3×0.004 mol)/3=0.008 mol
6 5 7
n(NH+)︰n(Fe3+)︰n(C H O3-)=x︰y︰z = 0.012︰0.004︰0.008= 3︰1︰2
4 6 5 7
柠檬酸铁铵化学式为(NH ) Fe(C H O ) (1分)
4 3 6 5 7 2
(3)①CN-电子式为[· ·C· ·
·
· ·
·
N· ·] -,C和N原子均能提供孤电子对成为配位原子(2分)
②
2024届高三考前调研测试化学答案 第 2 页 共 2 页
Ⅰ Ⅱ
(2分)
③充电时PB为阳极,Fe2+失电子转为Fe3+,正电荷增多(2分)
(4)在搅拌下分批将铁泥加入足量稀硫酸中,充分反应(至不再产生明显气泡),过滤,
...
将滤液加入三颈烧瓶中,以一定流速通入N ,排出装置中空气并搅拌,从滴液漏斗
........ ...2. ....
中滴入Na CO 溶液至沉淀完全(4分)
.....2. ..3. ..
17.(15分)
(1)HOCH CH NH 具有碱性(1分); 高温、低压(1分)
2 2 2
(2) (2分) O的电负性比C大,与O直接相连的碳带部分正电荷,由于甲
基是推电子基团,“CH”中碳带正电荷略少,因此孤电子对更容易进攻“CH ”中
2
的碳原子(2分)
(3) (2分,虚线不画不给分)
(4)①2H O+2e-+2CO =H ↑+2HCO-或2H O+2e-+2HCO-=H ↑+2CO2-(2分)
2 2 2 3 2 3 2 3
写成2H O+2e-=H ↑+2OH-(1分);写成2H++2e-=H ↑不得分。
2 2 2
②适当调高电压(1分),适当增大CO 的流速(1分) (共2分)
2
③配位键(或共价键)(1分)
④生成的CO与催化剂Cu的活性位点结合,生成的配合物覆盖在催化剂表面,导电
能力减弱。(2分)(多写HCOO-不扣分)
O
O
O
{{##{{QQQQAABBYaQQACpE5ogggigwAgJJJbAAACAAh4CqAAw03nEwCCggsEQQkkJBOEgAJCUYgEgGgQRCAOAMOAMwADAQBQJNRANBAIAB=A}A#=}}#}