文档内容
驻马店市 2023—2024 学年度高三年级期末统一考试
化学
本试卷满分100分,考试用时90分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考生号、考场号,座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,
用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷
上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.本试卷主要考试内容:高考全部内容。
5.可能用到的相对原子质量:H-1 Li-7 C-12 O-16 Na-23 S-32 Cr-52 Co-59
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项
是符合题目要求的。
1.2023年10月26日17时46分,神舟十七号载人飞船与空间站组合体完成自主快速交会对接。下列不能作
发射载人飞船的推进剂的是
A.液氧和甲烷 B.液氧和液氢
C.液氧和二氧化氮 D.液氧和煤油
2.下列化学用语表示正确的是
A.MgCl 的形成过程:
2
B.HCl分子中σ键的形成:
C.反-2-丁烯的结构简式:
D.基态钙原子最外层电子的电子云轮廓图:
3.劳动创造世界,成就梦想。下列劳动项目与所涉及的化学知识关联正确的是
选项 劳动项目 化学知识
A 热的纯碱溶液洗涤油污 纯碱水解溶液显碱性,加热促进水解
B 用糯米酿制米酒 酒精能使蛋白质变性
C 用白醋清洗水壶中的水垢 乙酸易挥发,有刺激性
D 用FeCl 溶液刻蚀印剧电路板 FeCl 溶液显酸性
3 3
学科网(北京)股份有限公司4.常温下,下列各组离子在指定溶液中能大量共存的是
A.中性溶液中;Fe3+、 、 、Cl-
B.澄清透明溶液中:Cu2+、 、Cl-,Mg2+
C.含有NaI的溶液中: 、H+,K+,Ca2+
D.水电离出的c(H+)=0.001mol·L-1的溶液中: ,Na+,OH-、S2-
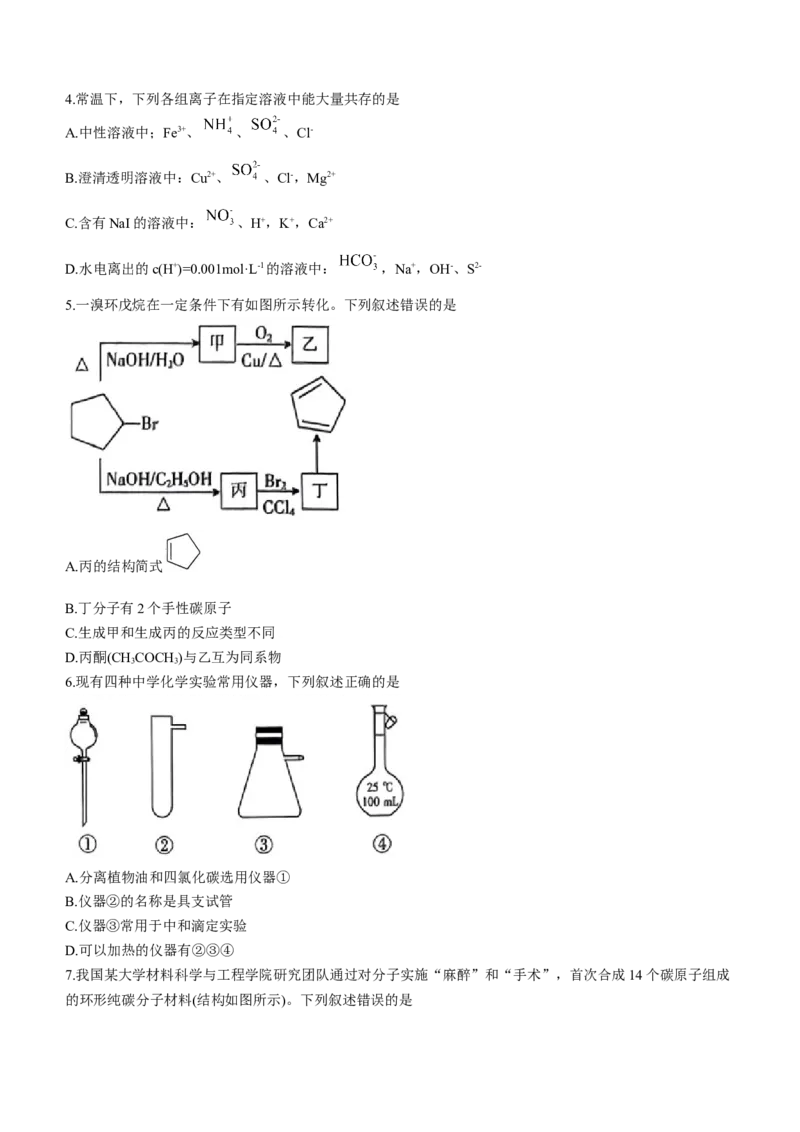
5.一溴环戊烷在一定条件下有如图所示转化。下列叙述错误的是
A.丙的结构简式
B.丁分子有2个手性碳原子
C.生成甲和生成丙的反应类型不同
D.丙酮(CHCOCH )与乙互为同系物
3 3
6.现有四种中学化学实验常用仪器,下列叙述正确的是
A.分离植物油和四氯化碳选用仪器①
B.仪器②的名称是具支试管
C.仪器③常用于中和滴定实验
D.可以加热的仪器有②③④
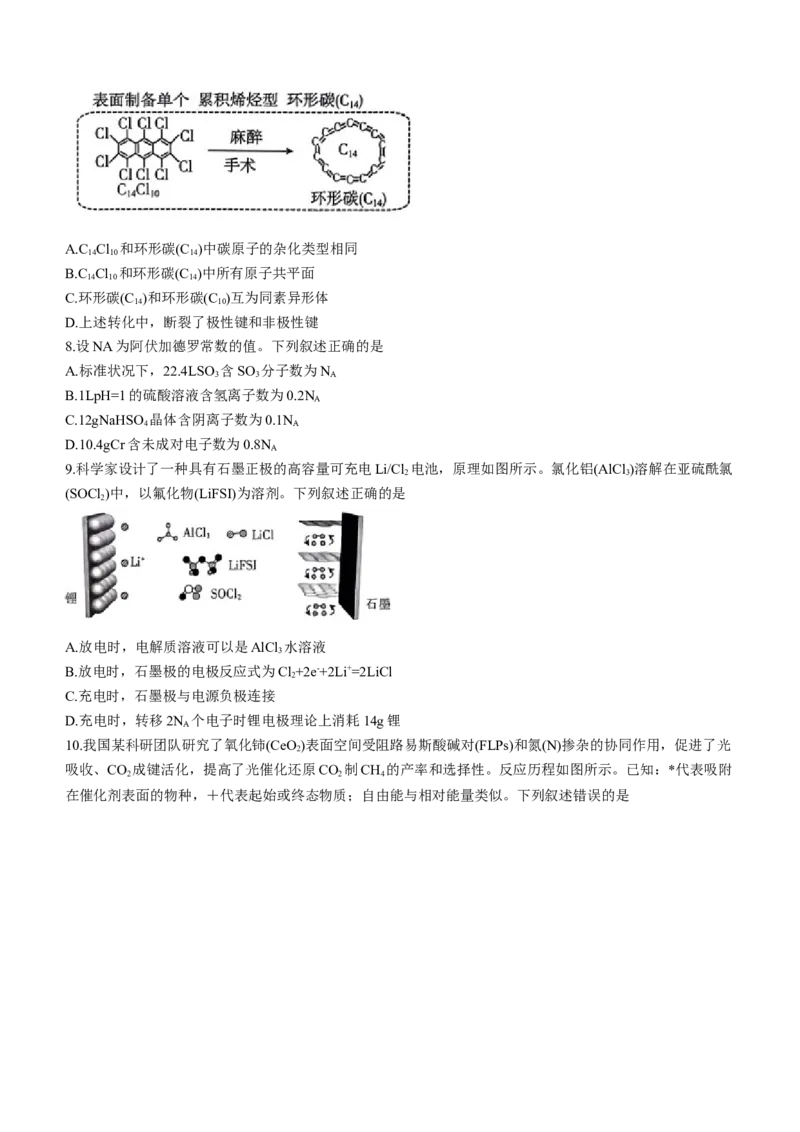
7.我国某大学材料科学与工程学院研究团队通过对分子实施“麻醉”和“手术”,首次合成14个碳原子组成
的环形纯碳分子材料(结构如图所示)。下列叙述错误的是
学科网(北京)股份有限公司A.C Cl 和环形碳(C )中碳原子的杂化类型相同
14 10 14
B.C Cl 和环形碳(C )中所有原子共平面
14 10 14
C.环形碳(C )和环形碳(C )互为同素异形体
14 10
D.上述转化中,断裂了极性键和非极性键
8.设NA为阿伏加德罗常数的值。下列叙述正确的是
A.标准状况下,22.4LSO 含SO 分子数为N
3 3 A
B.1LpH=1的硫酸溶液含氢离子数为0.2N
A
C.12gNaHSO 晶体含阴离子数为0.1N
4 A
D.10.4gCr含未成对电子数为0.8N
A
9.科学家设计了一种具有石墨正极的高容量可充电Li/Cl 电池,原理如图所示。氯化铝(AlCl )溶解在亚硫酰氯
2 3
(SOCl )中,以氟化物(LiFSI)为溶剂。下列叙述正确的是
2
A.放电时,电解质溶液可以是AlCl 水溶液
3
B.放电时,石墨极的电极反应式为Cl+2e-+2Li+=2LiCl
2
C.充电时,石墨极与电源负极连接
D.充电时,转移2N 个电子时锂电极理论上消耗14g锂
A
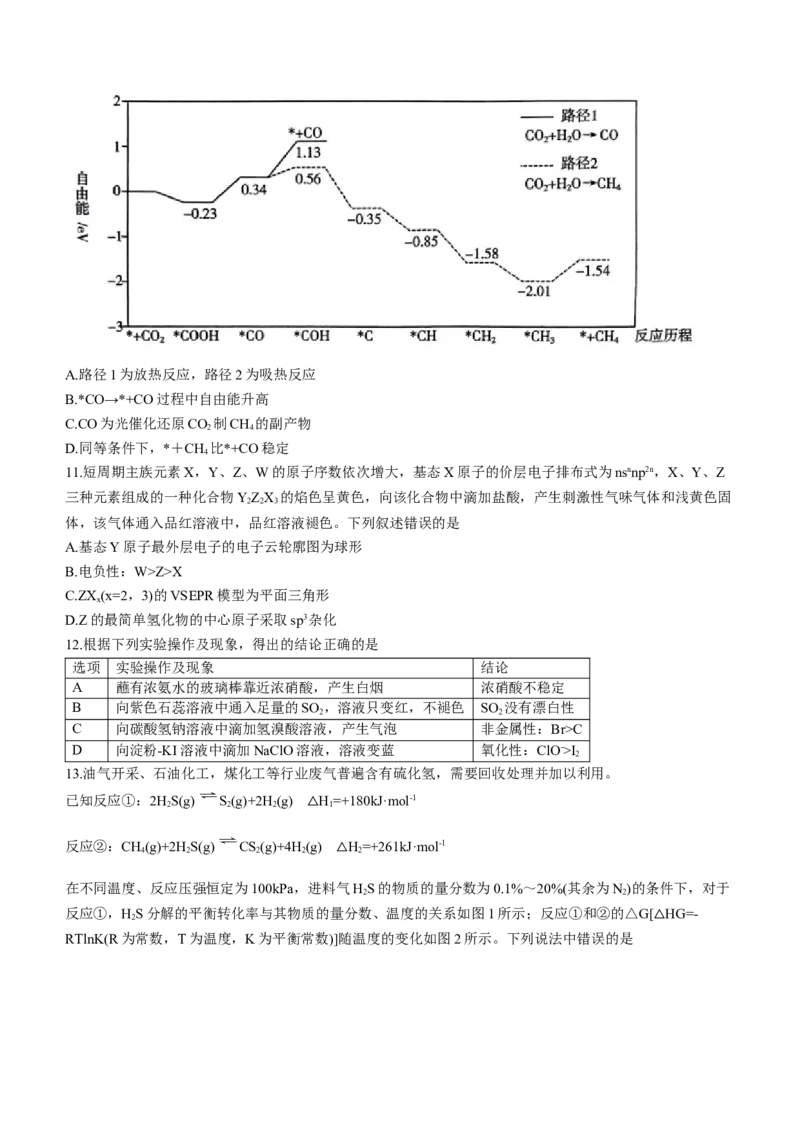
10.我国某科研团队研究了氧化铈(CeO)表面空间受阻路易斯酸碱对(FLPs)和氮(N)掺杂的协同作用,促进了光
2
吸收、CO 成键活化,提高了光催化还原CO 制CH 的产率和选择性。反应历程如图所示。已知:*代表吸附
2 2 4
在催化剂表面的物种,+代表起始或终态物质;自由能与相对能量类似。下列叙述错误的是
学科网(北京)股份有限公司A.路径1为放热反应,路径2为吸热反应
B.*CO→*+CO过程中自由能升高
C.CO为光催化还原CO 制CH 的副产物
2 4
D.同等条件下,*+CH 比*+CO稳定
4
11.短周期主族元素X,Y、Z、W的原子序数依次增大,基态X原子的价层电子排布式为nsnnp2n,X、Y、Z
三种元素组成的一种化合物YZX 的焰色呈黄色,向该化合物中滴加盐酸,产生刺激性气味气体和浅黄色固
2 2 3
体,该气体通入品红溶液中,品红溶液褪色。下列叙述错误的是
A.基态Y原子最外层电子的电子云轮廓图为球形
B.电负性:W>Z>X
C.ZX (x=2,3)的VSEPR模型为平面三角形
x
D.Z的最简单氢化物的中心原子采取sp3杂化
12.根据下列实验操作及现象,得出的结论正确的是
选项 实验操作及现象 结论
A 蘸有浓氨水的玻璃棒靠近浓硝酸,产生白烟 浓硝酸不稳定
B 向紫色石蕊溶液中通入足量的SO ,溶液只变红,不褪色 SO 没有漂白性
2 2
C 向碳酸氢钠溶液中滴加氢溴酸溶液,产生气泡 非金属性:Br>C
D 向淀粉-KI溶液中滴加NaClO溶液,溶液变蓝 氧化性:ClO->I
2
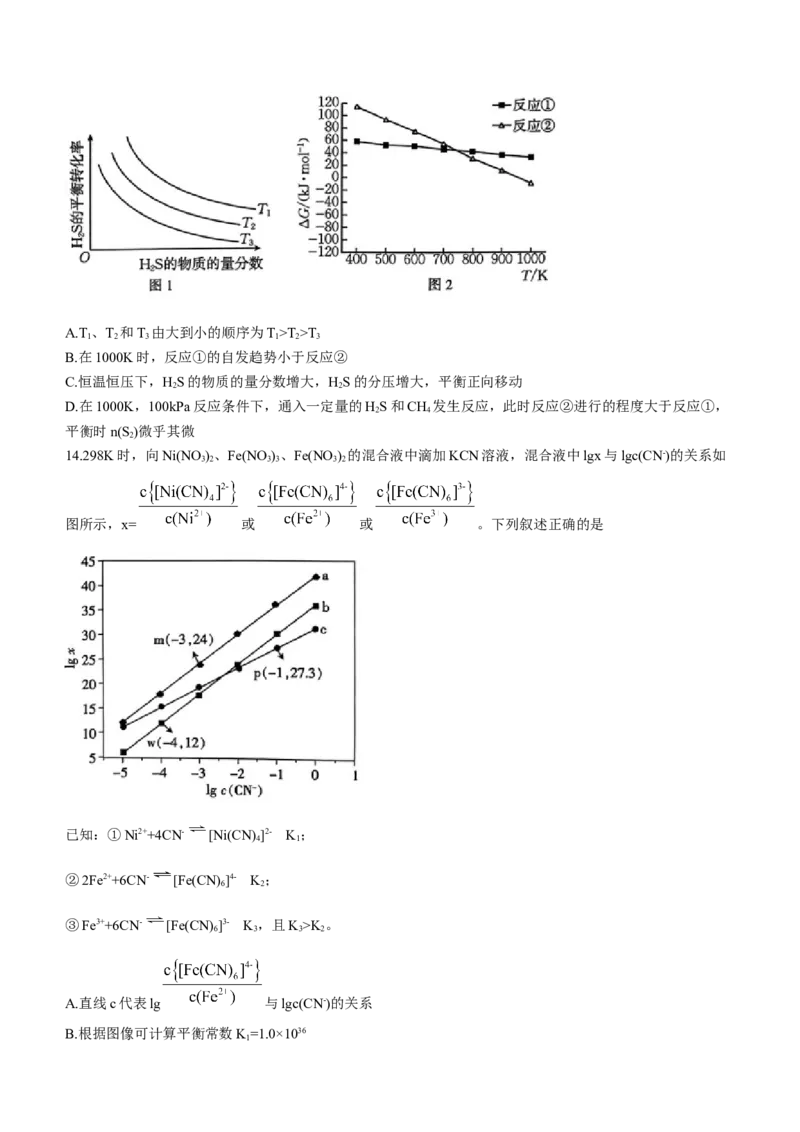
13.油气开采、石油化工,煤化工等行业废气普遍含有硫化氢,需要回收处理并加以利用。
已知反应①:2HS(g) S(g)+2H(g) H=+180kJ·mol-1
2 2 2 1
△
反应②:CH(g)+2HS(g) CS(g)+4H(g) H=+261kJ·mol-1
4 2 2 2 2
△
在不同温度、反应压强恒定为100kPa,进料气HS的物质的量分数为0.1%~20%(其余为N)的条件下,对于
2 2
反应①,HS分解的平衡转化率与其物质的量分数、温度的关系如图1所示;反应①和②的△G[ HG=-
2
RTlnK(R为常数,T为温度,K为平衡常数)]随温度的变化如图2所示。下列说法中错误的是
△
学科网(北京)股份有限公司A.T 、T 和T 由大到小的顺序为T>T>T
1 2 3 1 2 3
B.在1000K时,反应①的自发趋势小于反应②
C.恒温恒压下,HS的物质的量分数增大,HS的分压增大,平衡正向移动
2 2
D.在1000K,100kPa反应条件下,通入一定量的HS和CH 发生反应,此时反应②进行的程度大于反应①,
2 4
平衡时n(S )微乎其微
2
14.298K时,向Ni(NO )、Fe(NO )、Fe(NO ) 的混合液中滴加KCN溶液,混合液中lgx与lgc(CN-)的关系如
3 2 3 3 3 2
图所示,x= 或 或 。下列叙述正确的是
已知:①Ni2++4CN- [Ni(CN) ]2- K;
4 1
②2Fe2++6CN- [Fe(CN) ]4- K;
6 2
③Fe3++6CN- [Fe(CN) ]3- K,且K>K 。
6 3 3 2
A.直线c代表lg 与lgc(CN-)的关系
B.根据图像可计算平衡常数K=1.0×1036
1
学科网(北京)股份有限公司C.[Fe(CN) ]4-+Fe3+ [Fe(CN) ]3-+Fe2+的平衡常数K=1.0×106
6 6
D.向含相同浓度的Fe2+和Fe3+的溶液中滴加KCN溶液,先生成[Fe(CN) ]4-
6
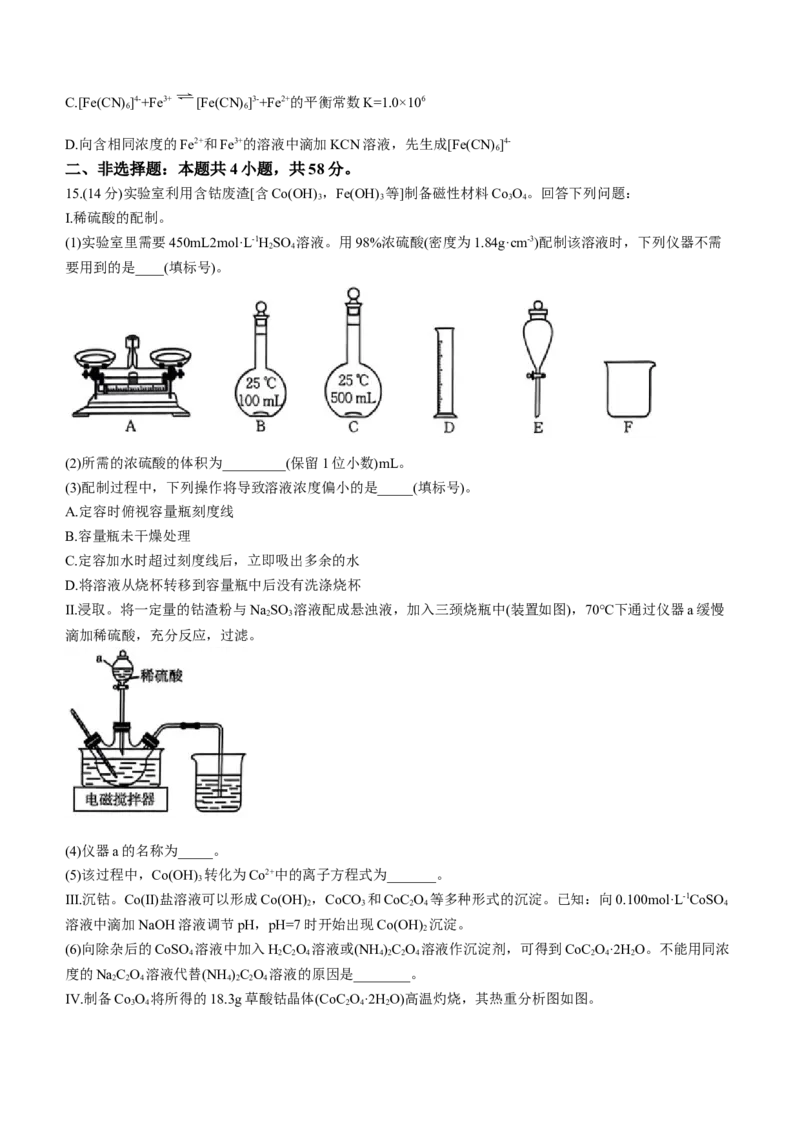
二、非选择题:本题共4小题,共58分。
15.(14分)实验室利用含钴废渣[含Co(OH) ,Fe(OH) 等]制备磁性材料Co O。回答下列问题:
3 3 3 4
Ⅰ.稀硫酸的配制。
(1)实验室里需要450mL2mol·L-1HSO 溶液。用98%浓硫酸(密度为1.84g·cm-3)配制该溶液时,下列仪器不需
2 4
要用到的是____(填标号)。
(2)所需的浓硫酸的体积为_________(保留1位小数)mL。
(3)配制过程中,下列操作将导致溶液浓度偏小的是_____(填标号)。
A.定容时俯视容量瓶刻度线
B.容量瓶未干燥处理
C.定容加水时超过刻度线后,立即吸出多余的水
D.将溶液从烧杯转移到容量瓶中后没有洗涤烧杯
Ⅱ.浸取。将一定量的钴渣粉与NaSO 溶液配成悬浊液,加入三颈烧瓶中(装置如图),70℃下通过仪器a缓慢
2 3
滴加稀硫酸,充分反应,过滤。
(4)仪器a的名称为_____。
(5)该过程中,Co(OH) 转化为Co2+中的离子方程式为_______。
3
Ⅲ.沉钴。Co(Ⅱ)盐溶液可以形成Co(OH) ,CoCO 和CoC O 等多种形式的沉淀。已知:向0.100mol·L-1CoSO
2 3 2 4 4
溶液中滴加NaOH溶液调节pH,pH=7时开始出现Co(OH) 沉淀。
2
(6)向除杂后的CoSO 溶液中加入HC O 溶液或(NH )C O 溶液作沉淀剂,可得到CoC O·2H O。不能用同浓
4 2 2 4 4 2 2 4 2 4 2
度的NaC O 溶液代替(NH )C O 溶液的原因是________。
2 2 4 4 2 2 4
Ⅳ.制备Co O 将所得的18.3g草酸钴晶体(CoC O·2H O)高温灼烧,其热重分析图如图。
3 4 2 4 2
学科网(北京)股份有限公司(7)写出B点对应的物质的化学式:_______,CD段发生反应的化学方程式为___________。
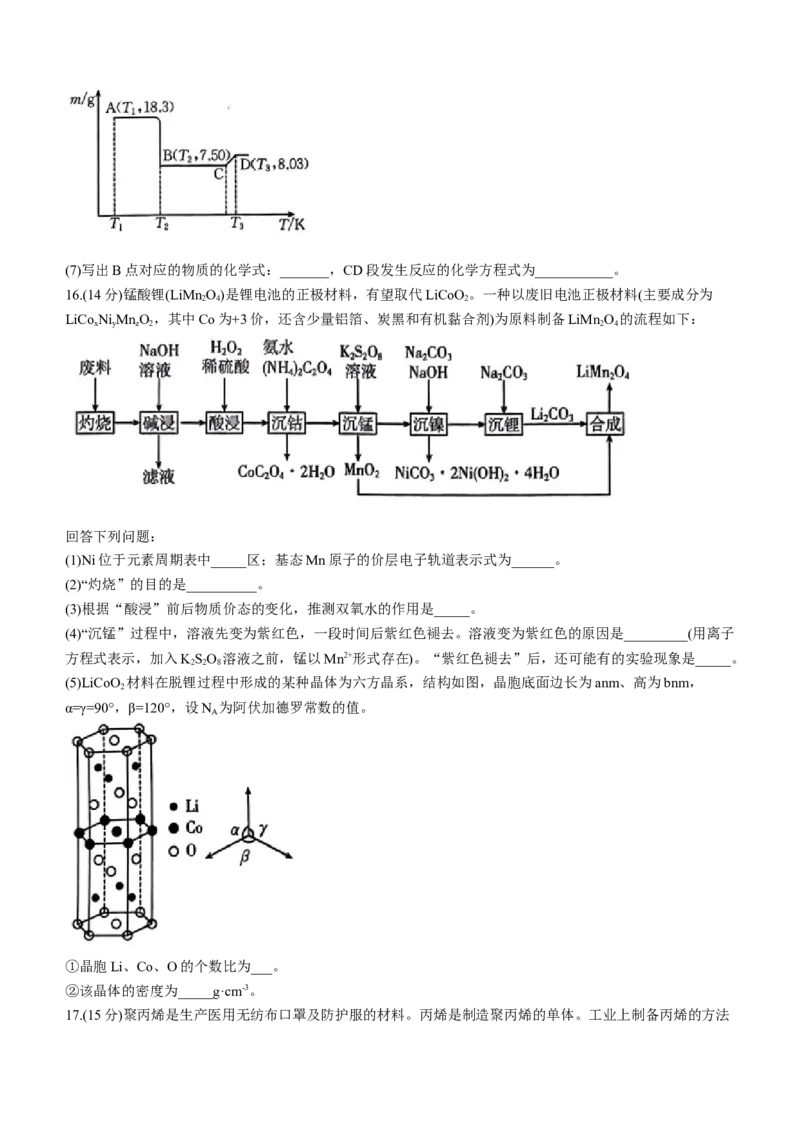
16.(14分)锰酸锂(LiMn O)是锂电池的正极材料,有望取代LiCoO 。一种以废旧电池正极材料(主要成分为
2 4 2
LiCo Ni MnO,其中Co为+3价,还含少量铝箔、炭黑和有机黏合剂)为原料制备LiMn O 的流程如下:
x y z 2 2 4
回答下列问题:
(1)Ni位于元素周期表中_____区;基态Mn原子的价层电子轨道表示式为______。
(2)“灼烧”的目的是__________。
(3)根据“酸浸”前后物质价态的变化,推测双氧水的作用是_____。
(4)“沉锰”过程中,溶液先变为紫红色,一段时间后紫红色褪去。溶液变为紫红色的原因是_________(用离子
方程式表示,加入KSO 溶液之前,锰以Mn2+形式存在)。“紫红色褪去”后,还可能有的实验现象是_____。
2 2 8
(5)LiCoO 材料在脱锂过程中形成的某种晶体为六方晶系,结构如图,晶胞底面边长为anm、高为bnm,
2
α=γ=90°,β=120°,设N 为阿伏加德罗常数的值。
A
①晶胞Li、Co、O的个数比为___。
②该晶体的密度为_____g·cm-3。
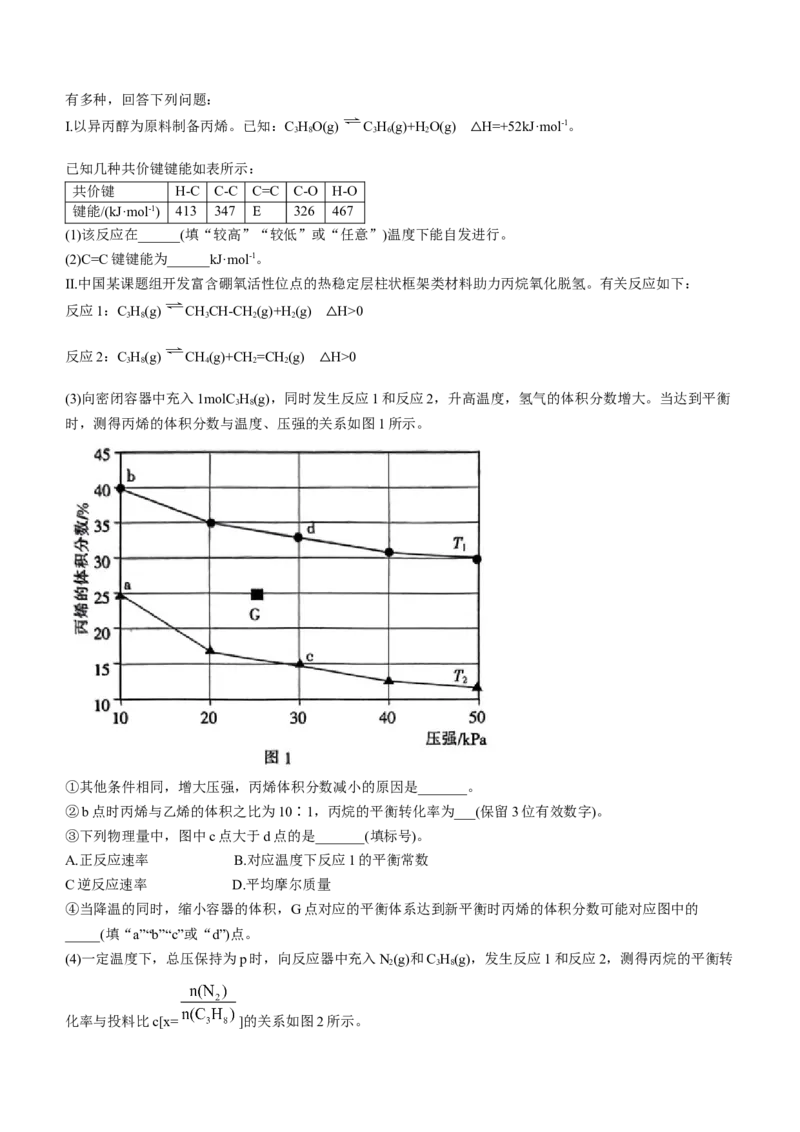
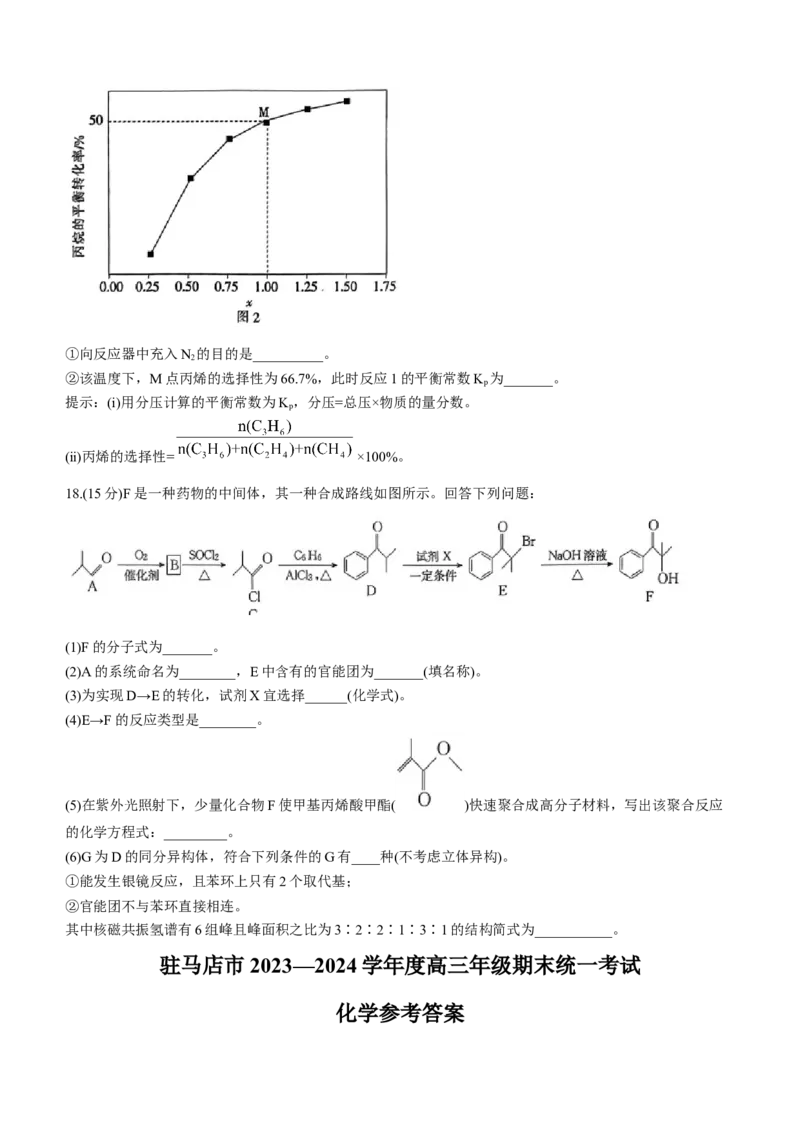
17.(15分)聚丙烯是生产医用无纺布口罩及防护服的材料。丙烯是制造聚丙烯的单体。工业上制备丙烯的方法
学科网(北京)股份有限公司有多种,回答下列问题:
Ⅰ.以异丙醇为原料制备丙烯。已知:C HO(g) C H(g)+HO(g) H=+52kJ·mol-1。
3 8 3 6 2
△
已知几种共价键键能如表所示:
共价键 H-C C-C C=C C-O H-O
键能/(kJ·mol-1) 413 347 E 326 467
(1)该反应在______(填“较高”“较低”或“任意”)温度下能自发进行。
(2)C=C键键能为______kJ·mol-1。
Ⅱ.中国某课题组开发富含硼氧活性位点的热稳定层柱状框架类材料助力丙烷氧化脱氢。有关反应如下:
反应1:C H(g) CHCH-CH (g)+H(g) H>0
3 8 3 2 2
△
反应2:C H(g) CH(g)+CH =CH (g) H>0
3 8 4 2 2
△
(3)向密闭容器中充入1molC H(g),同时发生反应1和反应2,升高温度,氢气的体积分数增大。当达到平衡
3 8
时,测得丙烯的体积分数与温度、压强的关系如图1所示。
①其他条件相同,增大压强,丙烯体积分数减小的原因是_______。
②b点时丙烯与乙烯的体积之比为10∶1,丙烷的平衡转化率为___(保留3位有效数字)。
③下列物理量中,图中c点大于d点的是_______(填标号)。
A.正反应速率 B.对应温度下反应1的平衡常数
C逆反应速率 D.平均摩尔质量
④当降温的同时,缩小容器的体积,G点对应的平衡体系达到新平衡时丙烯的体积分数可能对应图中的
_____(填“a”“b”“c”或“d”)点。
(4)一定温度下,总压保持为p时,向反应器中充入N(g)和C H(g),发生反应1和反应2,测得丙烷的平衡转
2 3 8
化率与投料比c[x= ]的关系如图2所示。
学科网(北京)股份有限公司①向反应器中充入N 的目的是__________。
2
②该温度下,M点丙烯的选择性为66.7%,此时反应1的平衡常数K 为_______。
p
提示:(ⅰ)用分压计算的平衡常数为K,分压=总压×物质的量分数。
p
(ⅱ)丙烯的选择性= ×100%。
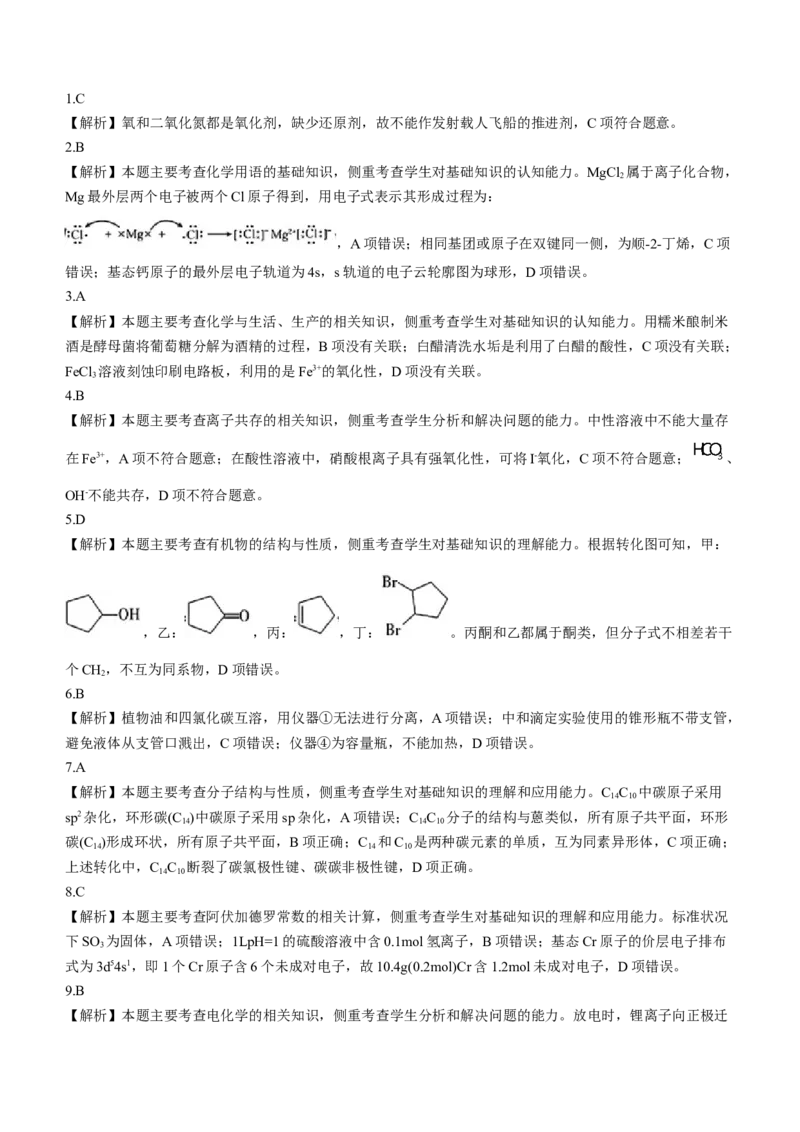
18.(15分)F是一种药物的中间体,其一种合成路线如图所示。回答下列问题:
(1)F的分子式为_______。
(2)A的系统命名为________,E中含有的官能团为_______(填名称)。
(3)为实现D→E的转化,试剂X宜选择______(化学式)。
(4)E→F的反应类型是________。
(5)在紫外光照射下,少量化合物F使甲基丙烯酸甲酯( )快速聚合成高分子材料,写出该聚合反应
的化学方程式:_________。
(6)G为D的同分异构体,符合下列条件的G有____种(不考虑立体异构)。
①能发生银镜反应,且苯环上只有2个取代基;
②官能团不与苯环直接相连。
其中核磁共振氢谱有6组峰且峰面积之比为3∶2∶2∶1∶3∶1的结构简式为___________。
驻马店市 2023—2024 学年度高三年级期末统一考试
化学参考答案
学科网(北京)股份有限公司1.C
【解析】氧和二氧化氮都是氧化剂,缺少还原剂,故不能作发射载人飞船的推进剂,C项符合题意。
2.B
【解析】本题主要考查化学用语的基础知识,侧重考查学生对基础知识的认知能力。MgCl 属于离子化合物,
2
Mg最外层两个电子被两个Cl原子得到,用电子式表示其形成过程为:
,A项错误;相同基团或原子在双键同一侧,为顺-2-丁烯,C项
错误;基态钙原子的最外层电子轨道为4s,s轨道的电子云轮廓图为球形,D项错误。
3.A
【解析】本题主要考查化学与生活、生产的相关知识,侧重考查学生对基础知识的认知能力。用糯米酿制米
酒是酵母菌将葡萄糖分解为酒精的过程,B项没有关联;白醋清洗水垢是利用了白醋的酸性,C项没有关联;
FeCl 溶液刻蚀印刷电路板,利用的是Fe3+的氧化性,D项没有关联。
3
4.B
【解析】本题主要考查离子共存的相关知识,侧重考查学生分析和解决问题的能力。中性溶液中不能大量存
在Fe3+,A项不符合题意;在酸性溶液中,硝酸根离子具有强氧化性,可将I-氧化,C项不符合题意; 、
OH-不能共存,D项不符合题意。
5.D
【解析】本题主要考查有机物的结构与性质,侧重考查学生对基础知识的理解能力。根据转化图可知,甲:
,乙: ,丙: ,丁: 。丙酮和乙都属于酮类,但分子式不相差若干
个CH,不互为同系物,D项错误。
2
6.B
【解析】植物油和四氯化碳互溶,用仪器①无法进行分离,A项错误;中和滴定实验使用的锥形瓶不带支管,
避免液体从支管口溅出,C项错误;仪器④为容量瓶,不能加热,D项错误。
7.A
【解析】本题主要考查分子结构与性质,侧重考查学生对基础知识的理解和应用能力。C C 中碳原子采用
14 10
sp2杂化,环形碳(C )中碳原子采用sp杂化,A项错误;C C 分子的结构与蒽类似,所有原子共平面,环形
14 14 10
碳(C )形成环状,所有原子共平面,B项正确;C 和C 是两种碳元素的单质,互为同素异形体,C项正确;
14 14 10
上述转化中,C C 断裂了碳氯极性键、碳碳非极性键,D项正确。
14 10
8.C
【解析】本题主要考查阿伏加德罗常数的相关计算,侧重考查学生对基础知识的理解和应用能力。标准状况
下SO 为固体,A项错误;1LpH=1的硫酸溶液中含0.1mol氢离子,B项错误;基态Cr原子的价层电子排布
3
式为3d54s1,即1个Cr原子含6个未成对电子,故10.4g(0.2mol)Cr含1.2mol未成对电子,D项错误。
9.B
【解析】本题主要考查电化学的相关知识,侧重考查学生分析和解决问题的能力。放电时,锂离子向正极迁
学科网(北京)股份有限公司移,锂为负极,石墨为正极。锂能与水发生反应,A项错误;充电时,石墨极与电源的正极连接,C项错误;
充电时,锂电极上生成锂,D项错误。
10.A
【解析】本题主要考查反应历程,侧重考查学生对基础知识的理解和运用能力。由图可知,路径1为吸热反
应,路径2为放热反应,A项错误。
11.B
【解析】本题主要考查元素周期律的相关知识,侧重考查学生分析和解决问题的能力。由基态X原子的价层
电子排布式可知,n=2,X为O;根据实验现象可知:Y为Na,Z为S;根据原子序数依次增大,推出W为
Cl。三种元素中,S的电负性最小,B项错误。
12.D
【解析】产生白烟是因为浓硝酸和浓氨水易挥发,A项错误;二氧化硫可以使品红褪色,此时二氧化硫具有
漂白性,B项错误;需要用HBrO 与HCO 的酸性进行比较,C项错误。
4 2 3
13.C
【解析】本题主要考查化学反应原理,侧重考查学生对化学反应原理的理解能力和综合运用知识的能力。恒
温恒压下﹐HS的物质的量分数增大,HS的分压增大,平衡逆向移动,HS的转化率降低,C项错误。
2 2 2
14.C
【解析】本题主要考查向混合液中滴加KCN溶液的相关知识,侧重考查学生对电解质溶液图像的分析能力。
由已知信息可知,等物质的量的Fe2+和Fe3+消耗的CN-的物质的量相同,即二者在图像中对应的直线的斜率相
同,故c代表lg 与lgc(CN-)的关系,A项错误;由p点计算K,代入数据计算:K=
1 1
=1027.3×104=1031.3,B项错误;因K 大于K,再根据m点、w点数据可以算出
3 2
K=1.0×1036,K=1.0×1042,C项正确;K越大,产物越稳定,先生成[Fe(CN) ]3-,D项错误。
2 3 6
15.(1)ABE(写对但不全得1分,错写不得分,2分)
(2)54.4(答54.3也给分,1分)
(3)CD(2分)
(4)分液漏斗(1分)
(5)2Co(OH) + +4H+=2Co2++ +5H O(2分)
3 2
(6)若用草酸钠溶液代替草酸铵溶液,会有氢氧化亚钴沉淀生成,导致CoC O 的产率降低(2分)
2 4
(7)CoO(2分);6CoO+O 2Co O(反应条件写“△”亦可,2分)
2 3 4
【解析】本题主要考查实验设计与探究,考查学生对实验的应用和分析能力。
(6)草酸钠是强碱弱酸盐,草酸铵是弱酸弱碱盐,草酸钠溶液的碱性强于草酸铵溶液,若用草酸钠溶液代替草
酸铵溶液﹐会有氢氧化亚钴沉淀生成,导致CoC O 的产率降低,所以不能用草酸钠溶液代替草酸铵溶液。
2 4
学科网(北京)股份有限公司(7)n(CoC O·2H O)= =0.1mol,m(Co)=0.1mol×59g/mol=5.9g,则B点时,固体中氧原子的物质的量
2 4 2
为n(O)= =0.1mol,则钴原子与氧原子的物质的量之比为0.lmol:0.1mol=1∶1,即B点固体物质的
化学式为CoO;D点氧化物的质量为8.03g,则n(O)= ≈0.133mol,钴原子与氧原子的物质的量之
比为0.1mol:0.133mol=3∶4,可知C点固体的化学式为Co O,则CD段发生反应的化学方程式为6CoO+O
3 4 2
2Co O。
3 4
16.(1)d(1分); (1分)
(2)除去炭黑、有机物(2分)
(3)作还原剂,还原Co(2分)
(4)5 +2Mn2++8H O=10 +2 +16H+(2分);产生黑色沉淀(2分)
2
(5)①2:1:3(2分)
②
【解析】本题主要考查制备LiMn O 的工艺流程以及晶胞结构,考查学生对元素化合物知识和晶胞结构知识
2 4
的理解和综合运用能力。
(3)钴与铁位于同族,Co3+有强氧化性,双氧水可将其转化成Co2+,离子方程式为2Co3++H O+2H+=2Co2+
2 2
+2H O。
2
(4) 有强氧化性,可将Mn2+氧化成 。2 +3Mn2++2H O=5MnO ↓+4H+,紫红色褪去,产生黑
2 2
色固体。
(5)①根据分摊法,Li均在晶胞内部,数目为6,Co的数目为6× +1=3,O的数目为12× +6+2× =9。
17.(1)较高(1分)
(2)567(2分)
(3)①反应1的正反应是气体分子数增大的反应,其他条件不变,增大压强,平衡逆向移动(2分)
②78.6%(2分)
③D(2分)
学科网(北京)股份有限公司④c(2分)
(4)①减小反应体系分压,提高丙烯产率(2分)
② (2分)
【解析】本题主要考查化学反应原理,考查学生对化学反应原理的理解能力和综合运用知识的能力。
(3)②设b点时,乙烯的物质的量为xmol,则:
C H(g) CHCH=CH(g)+H(g)
3 8 3 2 2
起始物质的量/mol 1 0 0
变化的物质的量/mol 10x 10x 10x
平衡时物质的量/mol 1-10x 10x 10x
C H(g) CH(g)+CH =CH (g)
3 8 4 2 2
起始物质的量/mol 1-10x 0 0
变化的物质的量/mol x x x
平衡时物质的量/mol 1-11x x x
平衡时总物质的量为(1+11x)mol,由 =40%,11x= 。
(4)②根据M点数据,丙烷的平衡转化率为50%,丙烯选择性为66.7%,设通入1molC H 和lmolN。平衡时
3 8 2
体系中存在0.5molC H,0.4molC H,0.4molH,0.1molCH,0.1molC H 和1molN ,总物质的量为2.5mol。
3 8 3 6 2 4 2 4 2
p(C H)= ,p(C H)=p(H)= ,反应1的平衡常数K= × × = 。
3 8 3 6 2 p
18.(1)C H O(2分)
10 12 2
(2)2-甲基丙醛(2分);酮羰基、碳溴键(2分)
(3)Br (2分)
2
(4)取代反应(或水解反应,1分)
(5) (2分)
(6)9(2分); (2分)
学科网(北京)股份有限公司