文档内容
兰州一中高三年级诊断考试试卷
高三化学
说明:本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100 分。考试时间75
分钟。答案写在答题卡上,交卷时只交答题卡
可能用到的原子量: H-1 C-12 O-16 Na-23 S-32 Fe-56 Cu-64 Ba-137
第 I 卷(共 42分)
一、单选题(每小题只有一个选项符合题意,每题3分,共42 分)
1.化学与生活、科技密切相关。下列叙述正确的是
A.纤维素在人体内水解成葡萄糖,可为人体供能
B.涤纶属于合成高分子化合物
C.活性炭既能除去水中的异味,又能杀死环境中的病毒
D.空间站太阳能电池板的主要材料是硅酸盐
2.下列表示正确的是
A.乙醚的结构简式:CH —O—CH B.NH 的电子式为:
3 3 3
C.中子数为8的氮原子:8N D. 基态硫原子的价电子轨道表示式:
7
3.下列有关焰色试验的说法中正确的是
A.某溶液焰色试验火焰呈黄色,则该溶液一定含有钠离子,一定不含钾离子
B.焰色试验是化学变化,利用的是元素的性质
C.焰色试验与电子跃迁有关
D.该实验中使用的铂丝可以用玻璃棒代替
4.不能正确表示下列变化的离子方程式是
A.氯化铁溶液腐蚀铜箔:2Fe3Cu2Fe2Cu2
B.铁粉与过量稀硝酸反应:Fe+NO+4H+=Fe3++NO↑+2H O
3 2
C.氯化铝溶液中滴入过量氨水:Al3++3NH •H O=Al(OH) ↓+3NH
3 2 3 4
D.硫酸铜溶液中通入硫化氢:Cu2++S2-=CuS↓
5.下列各组离子在给定溶液中一定能大量共存的是
A.澄清透明的溶液中:Fe3、Mg2、SO2、Br
4
B.中性溶液中: Fe3+、SO 2-、Al3+、Cl-
4
C.在0.1molL1氨水中:Ag、 Ba2、NO、CH COO
3 3
兰州一中高三年级诊断考试试卷 第 1 页 共 6 页
{#{QQABDYIAggCAAoBAARhCQwU6CECQkBAACYgGxFAIsAAAQRNABAA=}#}D.加入铝粉能放出氢气的溶液中:Ba2+、Fe3+、NO - 、I-
3
6. N 为阿伏加德罗常数的值。下列说法正确的是
A
A.32gCu与足量S充分反应,转移电子数为0.5N
A
B.7.8gNa O 固体中含有离子总数为0.4N
2 2 A
C.标准状况下,2.24LCCl 含有的氯原子数为0.4
4
D.0.1mol环戊烯醇( ),含有极性键的数目为0.8N
A
7.下列关于胶体的叙述错误的是
A.用激光分别照射NaCl溶液和Fe(OH) 胶体,后者产生丁达尔效应
3
B.实验室通常以NaOH溶液和FeCl 溶液反应制备Fe(OH) 胶体
3 3
C.胶体区别于其他分散系的本质特征是分散质的微粒直径在1~100nm之间
D.Fe(OH) 胶体能够使水中悬浮的固体颗粒沉降,达到净水目的
3
8.下列物质的转化在给定条件下不能实现的是
A.NaHCO (s) Na CO (s)澄清石灰水NaOH(aq)
3 2 3
△
B.MgCl
2
(aq)�� 石�� 灰乳Mg(OH)
2
煅烧MgO
C.CO NaHCO (aq) Na CO (aq)
2 3 2 3
D.CaCl
2
(aq)CO2(g)CaCO
3
(s)煅烧CaO(s)
9.X溶液中可能含有下列5种离子中的几种:Fe3、Fe2、NH、Cl、SO2-,某同学为确定其
4 4
中含有的离子,设计并完成以下实验(所加试剂均足量)。下列说法正确的是
A.X溶液中一定存在SO2-,可能不存在C1
4
B.X溶液中一定存在NH+、SO2-,至少含有Fe3、Fe2中的一种
4 4
C.取少量X溶液,先加入适量氯水,再加少量KSCN溶液,若溶液呈红色,则含有Fe2
D.X溶液中一定含有Cl,且c Cl0.1mol/L
10.如图是一种综合处理SO 废气的工艺流程。下列说法正确的是
2
兰州一中高三年级诊断考试试卷 第 2 页 共 6 页
{#{QQABDYIAggCAAoBAARhCQwU6CECQkBAACYgGxFAIsAAAQRNABAA=}#}A.操作Ⅱ发生反应的离子方程式为4Fe2++4H++O =4Fe3++2H O
2 2
B.溶液b中阳离子只有Fe2+
C.溶液a转化为溶液b的反应中,SO 被还原
2
D.加入FeO可以使溶液c转化为溶液a
11.FeSO 可用于制备一种新型、高效、多功能绿色水处理剂高铁酸钠,反应如下:
4
2FeSO +6Na O =2Na FeO +2Na O+2Na SO +O ↑,下列说法正确的是( )
4 2 2 2 4 2 2 4 2
A.氧化产物只有Na FeO B.生成1molO ,转移8mol电子
2 4 2
C.氧化剂和还原剂的物质的量之比为1:3
D.当6molNa O 参加反应时,被FeSO 还原的Na O 有4mol
2 2 4 2 2
12.下列说法正确的有几项
①Na O 投入到紫色石蕊试液中,溶液先变红,后褪色;
2 2
②足量O 和质量相等的Na在常温和加热条件下反应,转移的电子数相等;
2
③质量相等的NaHCO 与Na CO 分别与足量的相同浓度盐酸完全反应时,NaHCO 产生CO 的物质
3 2 3 3 2
的量更多;
④鉴别NaHCO 与Na CO 溶液,可用澄清石灰水溶液;
3 2 3
A.1 B.2 C.3 D.4
13.NaAlH 是一种强还原剂,在碱性条件下能够与CuSO 发生反应
4 4
NaAlH +4CuSO +8NaOH=Na[Al(OH) ]+4Cu+4Na SO +4H O,下列说法不正确的是( )
4 4 4 2 4 2
A.还原剂和还原产物之比为1:4
B.NaAlH 遇水可能发生爆炸,并产生白色沉淀
4
C.H O中中心原子为sp3杂化,VSEPR空间构型为四面体
2
D.每生成1molNa[Al(OH) ]转移电子的物质的量为8mol
4
14.通过下列实验以印刷线路板碱性蚀刻废液(主要成分为[Cu(NH ) ]Cl )为原料制备还原性物质
3 4 2
CuCl。下列说法不正确的是
A.“沉铜”得到的沉淀主要为Cu(OH)
2
B.“还原”时离子方程式为SO2+Cu2++Cl-+H O=CuCl↓+SO2+2H+
3 2 4
C.“过滤”、“洗涤”时应该在隔绝空气的条件下进行
D.可循环利用的物质为H SO
2 4
兰州一中高三年级诊断考试试卷 第 3 页 共 6 页
{#{QQABDYIAggCAAoBAARhCQwU6CECQkBAACYgGxFAIsAAAQRNABAA=}#}第II 卷(共58 分)
15.(14分)按照要求回答下列问题:
(1)下列物质:①铁片 ②稀盐酸 ③蔗糖 ④ 熔融状态的KNO ⑤BaSO 固体
3 4
(a)以上物质中能导电的是 。(填序号,下同)
(b)以上物质中属于电解质的是 。
(2)铜器久置于空气中会产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”[化学式为Cu (OH) CO ],
2 2 3
某同学利用下述系列反应实现了“铜→铜绿→…→铜”的转化。
铜①铜绿②A③Cu(OH) ④B⑤Cu
2 H2
(a)写出B的化学式 。
(b)写出②反应的离子方程式: 。
(3)工业上从金矿中提炼黄金可以采用氰化法,即:用NaCN稀溶液浸取粉碎的金矿石,生成溶于
水的配位化合物Na[Au(CN) ],再用Zn置换出Au,产生的含氰废水经处理后排放。
2
①配离子[Au(CN) ]−中的中心离子是 ,配体是 。
2
②可用Cl 处理含CN−废水:
2
_______CN−+_______Cl +______=________HCO+_______N ↑+________Cl−+___________。
2 3 2
(a)CN−中各原子均达到8电子稳定结构,写出CN−的电子式 。
(b)将上述离子方程式补充完整并配平。
16.(14分)绿矾(FeSO ·7H O)可作人体补血剂。某同学欲测定补血剂中铁元素的含量,设计
4 2
了如下实验步骤:
请回答下列问题:
(1)②加入过量H O 溶液的目的是 。
2 2
(2)③加入足量氨水,反应的离子方程式为 。
(3)若实验中铁无损耗,则每片补血剂中含铁元素的质量为 g。
(4)该小组有些同学认为用酸性KMnO 溶液滴定也能进行铁元素含量的测定。
4
①该实验原理用离子方程式可表示为 。
②实验前,首先要精确配制一定物质的量浓度的KMnO 溶液250mL,配制时需要的仪器除天平、
4
玻璃棒、烧杯、胶头滴管外,还需 。
兰州一中高三年级诊断考试试卷 第 4 页 共 6 页
{#{QQABDYIAggCAAoBAARhCQwU6CECQkBAACYgGxFAIsAAAQRNABAA=}#}③若取bg该补血剂用0.1mol∙L−1的KMnO 溶液进行滴定,在此实验过程中共用去KMnO 溶液
4 4
100mL,则该补血剂中铁元素的质量分数为 。
17.(15分)碳酸钠俗称纯碱,用途非常广泛,我国化学家侯德榜发明了“侯氏制碱法”。
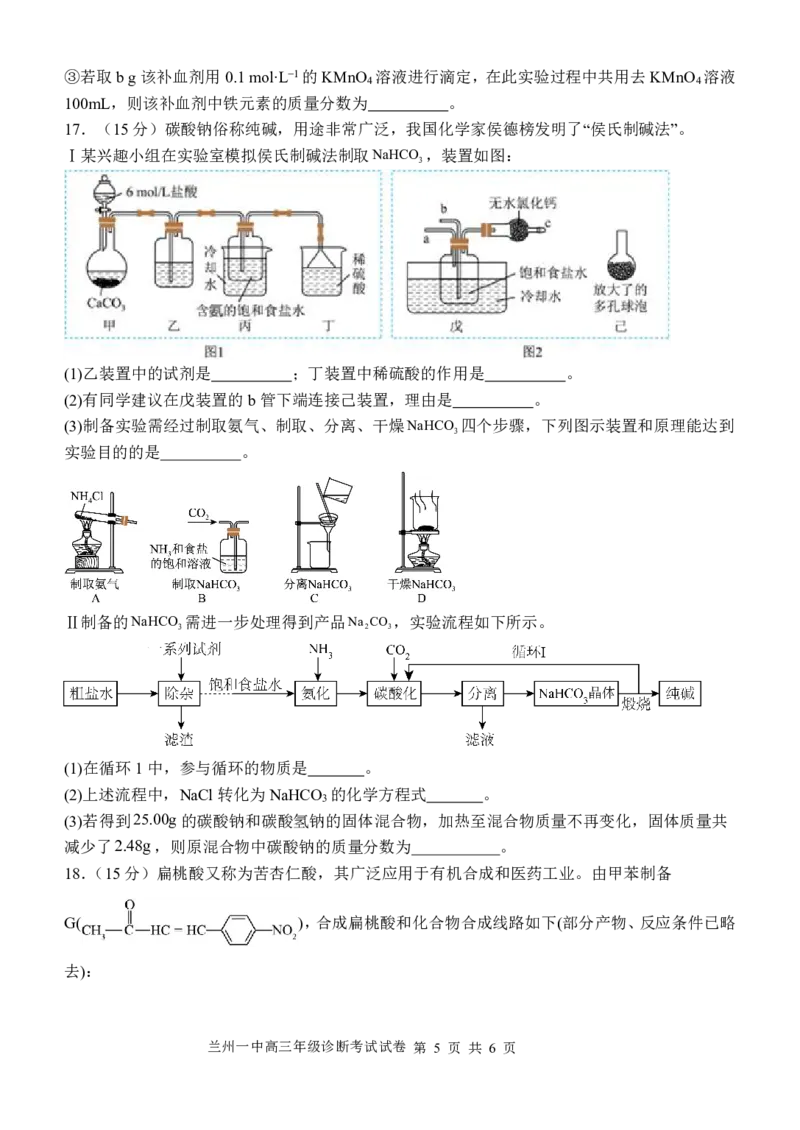
Ⅰ某兴趣小组在实验室模拟侯氏制碱法制取NaHCO ,装置如图:
3
(1)乙装置中的试剂是 ;丁装置中稀硫酸的作用是 。
(2)有同学建议在戊装置的b管下端连接己装置,理由是 。
(3)制备实验需经过制取氨气、制取、分离、干燥NaHCO 四个步骤,下列图示装置和原理能达到
3
实验目的的是 。
Ⅱ制备的NaHCO 需进一步处理得到产品Na CO ,实验流程如下所示。
3 2 3
(1)在循环1中,参与循环的物质是 。
(2)上述流程中,NaCl转化为NaHCO 的化学方程式 。
3
(3)若得到25.00g的碳酸钠和碳酸氢钠的固体混合物,加热至混合物质量不再变化,固体质量共
减少了2.48g,则原混合物中碳酸钠的质量分数为 。
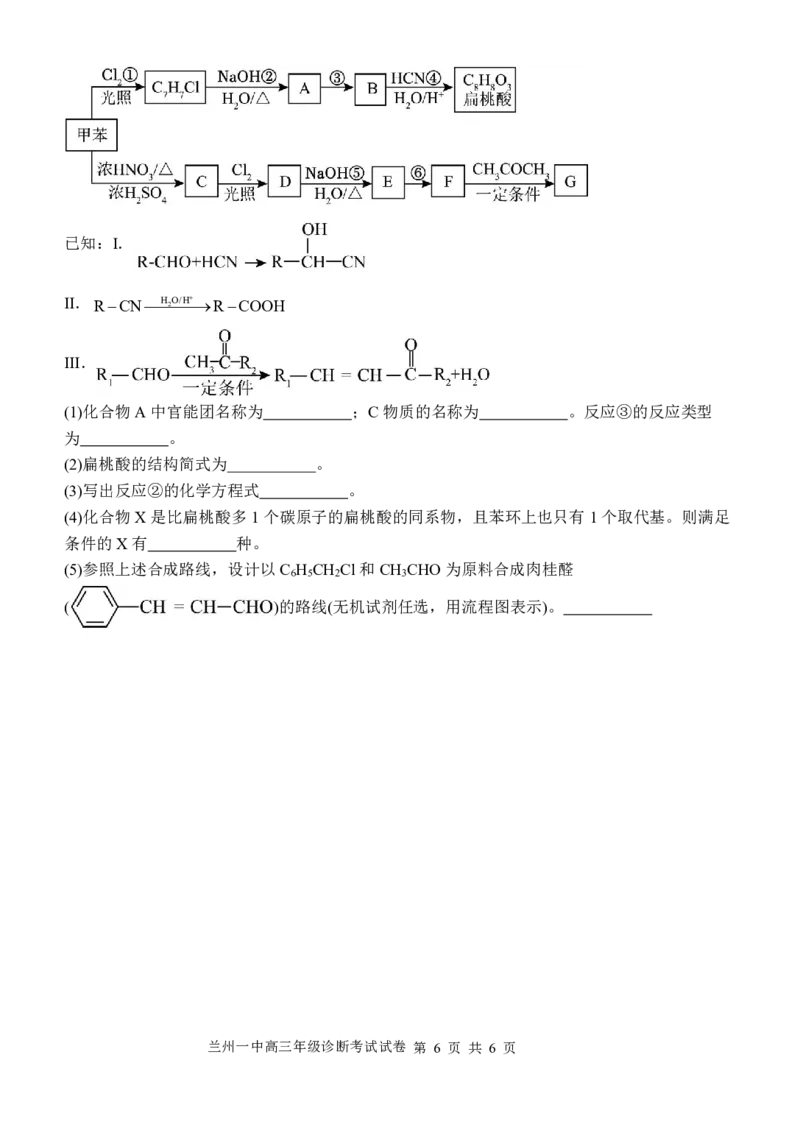
18.(15分)扁桃酸又称为苦杏仁酸,其广泛应用于有机合成和医药工业。由甲苯制备
G( ),合成扁桃酸和化合物合成线路如下(部分产物、反应条件已略
去):
兰州一中高三年级诊断考试试卷 第 5 页 共 6 页
{#{QQABDYIAggCAAoBAARhCQwU6CECQkBAACYgGxFAIsAAAQRNABAA=}#}已知:I.
II. RCNH2O/HRCOOH
III.
(1)化合物A中官能团名称为 ;C物质的名称为 。反应③的反应类型
为 。
(2)扁桃酸的结构简式为 。
(3)写出反应②的化学方程式 。
(4)化合物X是比扁桃酸多1个碳原子的扁桃酸的同系物,且苯环上也只有1个取代基。则满足
条件的X有 种。
(5)参照上述合成路线,设计以C H CH Cl和CH CHO为原料合成肉桂醛
6 5 2 3
( )的路线(无机试剂任选,用流程图表示)。
兰州一中高三年级诊断考试试卷 第 6 页 共 6 页
{#{QQABDYIAggCAAoBAARhCQwU6CECQkBAACYgGxFAIsAAAQRNABAA=}#}