文档内容
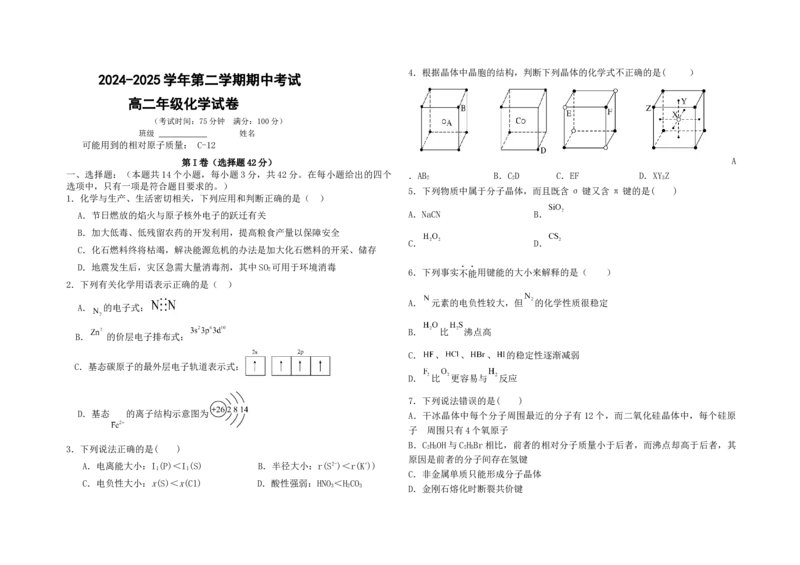
4.根据晶体中晶胞的结构,判断下列晶体的化学式不正确的是( )
2024-2025 学年第二学期期中考试
高二年级化学试卷
(考试时间:75分钟 满分:100分)
班级 姓名
可能用到的相对原子质量: C-12
第I卷(选择题42分) A
一、选择题:(本题共14个小题,每小题3分,共42分。在每小题给出的四个 .AB B.C D C.EF D.XY Z
2 2 3
选项中,只有一项是符合题目要求的。)
5.下列物质中属于分子晶体,而且既含σ键又含π键的是( )
1.化学与生产、生活密切相关,下列应用和判断正确的是( )
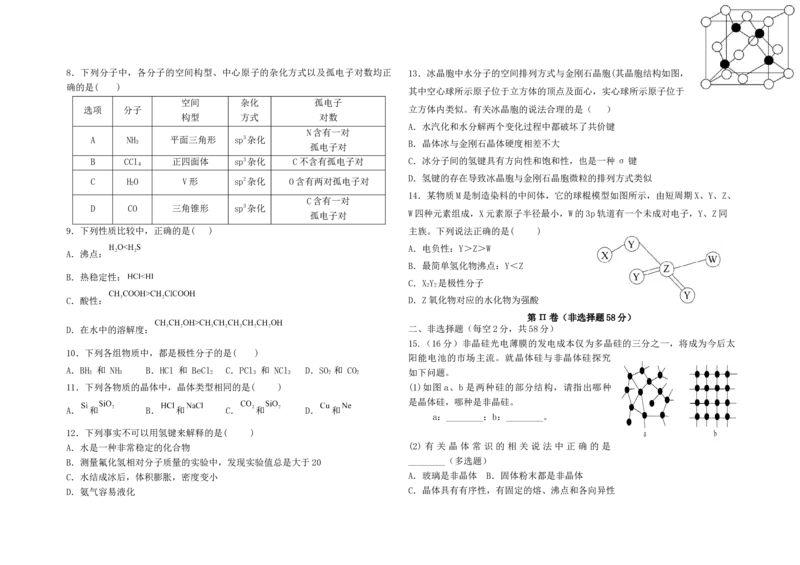
A.节日燃放的焰火与原子核外电子的跃迁有关 A.NaCN B.
B.加大低毒、低残留农药的开发利用,提高粮食产量以保障安全
C. D.
C.化石燃料终将枯竭,解决能源危机的办法是加大化石燃料的开采、储存
D.地震发生后,灾区急需大量消毒剂,其中SO 可用于环境消毒
2 6.下列事实不能用键能的大小来解释的是( )
2.下列有关化学用语表示正确的是( )
A. 元素的电负性较大,但 的化学性质很稳定
A. 的电子式:
B. 比 沸点高
B. 的价层电子排布式:
C. 、 、 、 的稳定性逐渐减弱
C.基态碳原子的最外层电子轨道表示式:
D. 比 更容易与 反应
7.下列说法错误的是( )
D.基态 的离子结构示意图为 A.干冰晶体中每个分子周围最近的分子有12个,而二氧化硅晶体中,每个硅原
子 周围只有4个氧原子
B.C H OH与C H Br相比,前者的相对分子质量小于后者,而沸点却高于后者,其
3.下列说法正确的是( ) 2 5 2 5
原因是前者的分子间存在氢键
A.电离能大小:I (P)<I (S) B.半径大小:r(S2-)<r(K+))
1 1
C.非金属单质只能形成分子晶体
C.电负性大小:x(S)<x(Cl) D.酸性强弱:HNO <H CO
3 2 3 D.金刚石熔化时断裂共价键8.下列分子中,各分子的空间构型、中心原子的杂化方式以及孤电子对数均正 13.冰晶胞中水分子的空间排列方式与金刚石晶胞(其晶胞结构如图,
确的是( )
其中空心球所示原子位于立方体的顶点及面心,实心球所示原子位于
空间 杂化 孤电子
选项 分子 立方体内类似。有关冰晶胞的说法合理的是( )
构型 方式 对数
A.水汽化和水分解两个变化过程中都破坏了共价键
N含有一对
A NH 平面三角形 sp3杂化
3 B.晶体冰与金刚石晶体硬度相差不大
孤电子对
B CCl 正四面体 sp3杂化 C不含有孤电子对 C.冰分子间的氢键具有方向性和饱和性,也是一种σ键
4
D.氢键的存在导致冰晶胞与金刚石晶胞微粒的排列方式类似
C H O V形 sp2杂化 O含有两对孤电子对
2
14.某物质M是制造染料的中间体,它的球棍模型如图所示,由短周期X、Y、Z、
C含有一对
D CO 三角锥形 sp3杂化
W四种元素组成,X元素原子半径最小,W的3p轨道有一个未成对电子,Y、Z同
孤电子对
9.下列性质比较中,正确的是( ) 主族。下列说法正确的是( )
A.电负性:Y>Z>W
A.沸点:
B.最简单氢化物沸点:Y<Z
B.热稳定性:
C.X Y 是极性分子
2 2
C.酸性: D.Z氧化物对应的水化物为强酸
第Π卷(非选择题58分)
D.在水中的溶解度: 二、非选择题(每空2分,共58分)
15.(16分)非晶硅光电薄膜的发电成本仅为多晶硅的三分之一,将成为今后太
10.下列各组物质中,都是极性分子的是( )
阳能电池的市场主流。就晶体硅与非晶体硅探究
A.BH 和 NH B.HCl 和 BeCl C.PCl 和 NCl D.SO 和 CO
3 3 2 3 3 2 2 如下问题。
11.下列各物质的晶体中,晶体类型相同的是( ) (1)如图 a、b 是两种硅的部分结构,请指出哪种
是晶体硅,哪种是非晶硅。
A. 和 B. 和 C. 和 D. 和
a:________;b:________。
12.下列事实不可以用氢键来解释的是( )
A.水是一种非常稳定的化合物 (2) 有 关 晶 体 常 识 的 相 关 说 法 中 正 确 的 是
B.测量氟化氢相对分子质量的实验中,发现实验值总是大于20 ________(多选题)
C.水结成冰后,体积膨胀,密度变小 A.玻璃是非晶体 B.固体粉末都是非晶体
D.氨气容易液化 C.晶体具有有序性,有固定的熔、沸点和各向异性D.区别晶体和非晶体最有效的方法是进行X射线衍射实验 道填满且电子均成对。
(3)关于晶体的自范性,下列叙述正确的是________。
(1)请用元素符号完成下列空白:
A.破损的晶体能够在固态时自动变成规则的多面体
①元素:D 、E 、F 。
B.缺角的氯化钠晶体在饱和NaCl溶液中慢慢变为完美的立方体晶块
②A、B、C三种元素的电负性由大到小的顺序是:
C.圆形容器中结出的冰是圆形的,体现了晶体的自范性
。
D.由玻璃制成规则的玻璃球,体现了晶体的自范
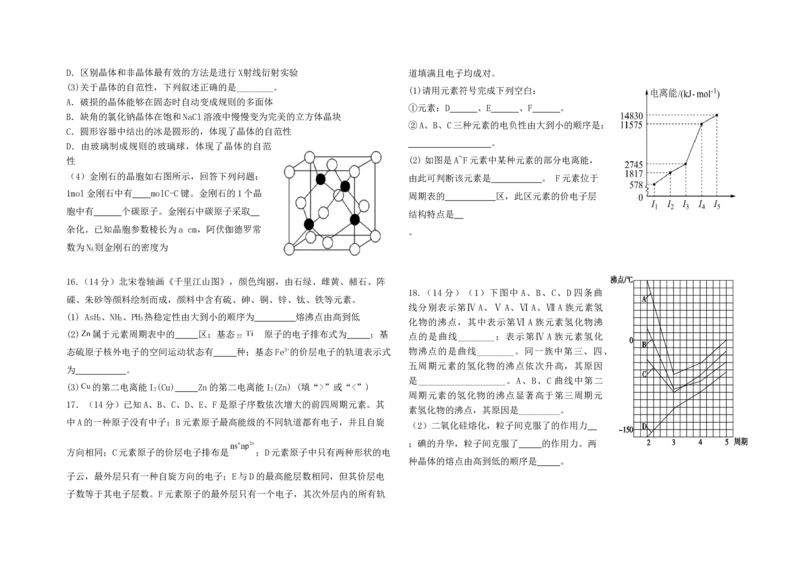
性 (2)如图是A~F元素中某种元素的部分电离能,
(4)金刚石的晶胞如右图所示,回答下列问题: 由此可判断该元素是 。 F元素位于
1mol金刚石中有 molC-C键。金刚石的1个晶
周期表的 区,此区元素的价电子层
胞中有 个碳原子。金刚石中碳原子采取
结构特点是
杂化。已知晶胞参数棱长为a cm,阿伏伽德罗常
。
数为N 则金刚石的密度为
A
16.(14分)北宋卷轴画《千里江山图》,颜色绚丽,由石绿、雌黄、赭石、阵
18.(14 分)(1)下图中 A、B、C、D 四条曲
磲、朱砂等颜料绘制而成,颜料中含有硫、砷、铜、锌、钛、铁等元素。
线分别表示第Ⅳ A、Ⅴ A、Ⅵ A、Ⅶ A 族元素氢
(1) AsH 、NH 、PH 热稳定性由大到小的顺序为 熔沸点由高到低
3 3 3 化物的沸点,其中表示第Ⅵ A 族元素氢化物沸
(2) 属于元素周期表中的 区;基态 原子的电子排布式为 ;基
22 点的是曲线________;表示第Ⅳ A 族元素氢化
态硫原子核外电子的空间运动状态有 种;基态Fe3+的价层电子的轨道表示式 物沸点的是曲线________。同一族中第三、四、
五周期元素的氢化物的沸点依次升高,其原因
为 。
是___________________。A、B、C 曲线中第二
(3) 的第二电离能I (Cu) Zn的第二电离能I (Zn) (填“>”或“<”)
2 2
周期元素的氢化物的沸点显著高于第三周期元
17.(14分)已知A、B、C、D、E、F是原子序数依次增大的前四周期元素。其
素氢化物的沸点,其原因是_________。
中A的一种原子没有中子;B元素原子最高能级的不同轨道都有电子,并且自旋
(2)二氧化硅熔化,粒子间克服了的作用力
;碘的升华,粒子间克服了 的作用力。两
方向相同;C元素原子的价层电子排布是 ;D元素原子中只有两种形状的电
种晶体的熔点由高到低的顺序是 。
子云,最外层只有一种自旋方向的电子;E与D的最高能层数相同,但其价层电
子数等于其电子层数。F元素原子的最外层只有一个电子,其次外层内的所有轨