文档内容
按秘密级事项管理
丹东市 2024 届高三总复习阶段测试
化 学
命题人:王春芳 吴宏军 刘岩 校对、审核:王桂芹 刘晓东
考试时间75分钟,满分100分
注意事项:
1. 答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2. 答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。若需改动,用橡皮擦
干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3. 考试结束后,将答题卡上交。
可能用到的相对原子质量:C-12 N-14 O-16 Na-23 S-32 K-39 Ca-40 Mn-55 Ba-137
第 Ⅰ 卷(选择题 共 45 分)
一、选择题(本题共15小题,每小题3分,共45分,每小题只有一个正确选项)
1.化学与生活、生产密切相关,下列说法正确的是
A.食盐中通常加入碘单质为人体补充碘元素
B.ClO 泡腾片、75%酒精均可杀灭病毒,二者消毒原理不相同
2
C.维生素C常用作水果罐头的抗氧化剂,其性质稳定、不易被氧化
D.“天和”核心舱腔体使用的氮化硼陶瓷基复合材料属于传统无机非金属材料
2.“天宫一号”和“神舟八号”是我国航天事业发展的里程碑。运载火箭的推进剂引燃
后发生反应:2N H (l)+N O (l) = 3N (g)+4H O(g)。用N 表示阿伏加德罗常数的值,下列
2 4 2 4 2 2 A
有关说法正确的是
A.1 mol N H 中含有的共用电子对数为4N
2 4 A
B.9.2 g NO 、N O 混合物中含有的质子数为4.6N
2 2 4 A
C.相同质量的NO 和NO含有的氮原子数相等
2
D.当生成6.72 L N 时转移电子数为0.8N
2 A
3.下列说法正确的是
A.上图为NaCl固体溶解并形成水合离子的示意图:a离子为Na+,b离子为Cl-
B.KHSO 在熔融状态下的电离方程式为:KHSO =K++H++SO2-
4 4 4
C.透明溶液中一定能大量共存的离子:K+、Na+、Cu2+、SO2-
4
D.与铝反应放出H 的溶液中可能大量共存的离子:NH+、K+、Cl-、N O−
2 4 3
高三化学试卷 第1页(共8页)
{#{QQABbYqQogiAAAAAAAhCEwWiCkCQkAGCCAoORAAAsAABwAFABAA=}#}4.下列关于胶体的说法正确的是
A.溶液和胶体的本质区别是能否产生丁达尔效应
B.树林中的丁达尔效应是由于胶体粒子对光线的散射
C.0.1mol AlCl 水解形成的Al(OH) 胶体粒子数约为6.02×1022个
3 3
D.向饱和FeCl 溶液中滴加氨水制备Fe(OH) 胶体
3 3
5.下列应用中不涉及氧化还原反应的是
A.“84消毒液”久置失效 B.暖贴中的铁粉遇空气放热
C.小苏打用作食品膨松剂 D.谷物发酵酿造食醋
6.下列关于溶液中离子检验的实验方案设计、现象和结论都正确的是
待检
选项 实验方案设计、现象及结论
离子
取少量溶液于试管中,加入KSCN溶液,无明显现象,再加入H O
2 2
A Fe2+
溶液,溶液变为血红色,该溶液中含有Fe2+
取少量溶液于试管中,加入AgNO 溶液,产生白色沉淀,该溶液中
3
B Cl-
含有Cl-
取少量溶液于试管中,加入稀NaOH溶液,将湿润的红色石蕊试纸
C NH+
4
放在试管口,试纸不变蓝,该溶液中不含NH+
4
D Na+ 用玻璃棒蘸取某无色溶液,灼烧,观察火焰呈黄色,该溶液中含有Na+
7.下列反应的离子方程式正确的是
A.向H 18O中投入Na O 固体:2H 18O+2Na O =4Na++4OH−+18O ↑
2 2 2 2 2 2 2
B.小苏打溶液与少量的Ba(OH) 溶液混合:HCO-+Ba2++OH-=BaCO ↓+H O
2 3 3 2
C.向含有1mol FeBr 的溶液中通入一定量氯气发生反应,当转移电子数为6.02×1023时:
2
2Fe2++2Br−+2Cl =2Fe3++Br +4Cl−
2 2
D.向一元弱酸H PO 的溶液中加入足量的NaOH溶液:H PO +OH-=H O+H PO−
3 2 3 2 2 2 2
高三化学试卷 第2页(共8页)
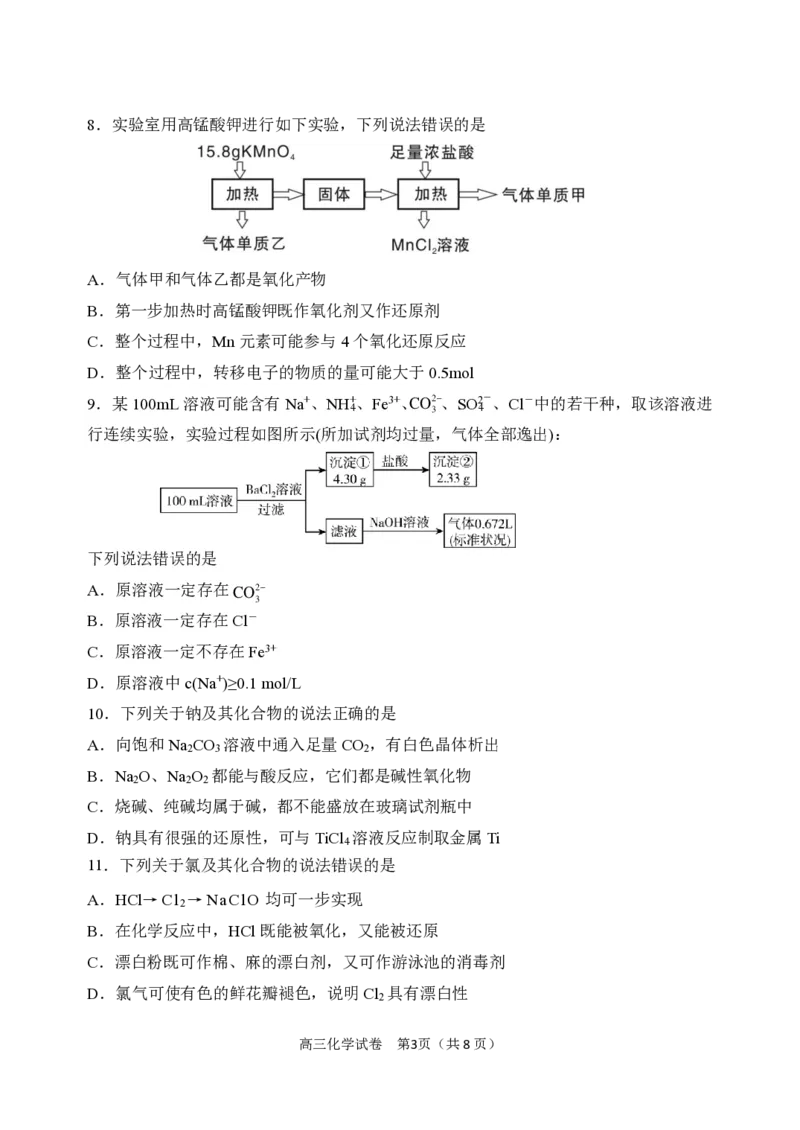
{#{QQABbYqQogiAAAAAAAhCEwWiCkCQkAGCCAoORAAAsAABwAFABAA=}#}8.实验室用高锰酸钾进行如下实验,下列说法错误的是
A.气体甲和气体乙都是氧化产物
B.第一步加热时高锰酸钾既作氧化剂又作还原剂
C.整个过程中,Mn元素可能参与4个氧化还原反应
D.整个过程中,转移电子的物质的量可能大于0.5mol
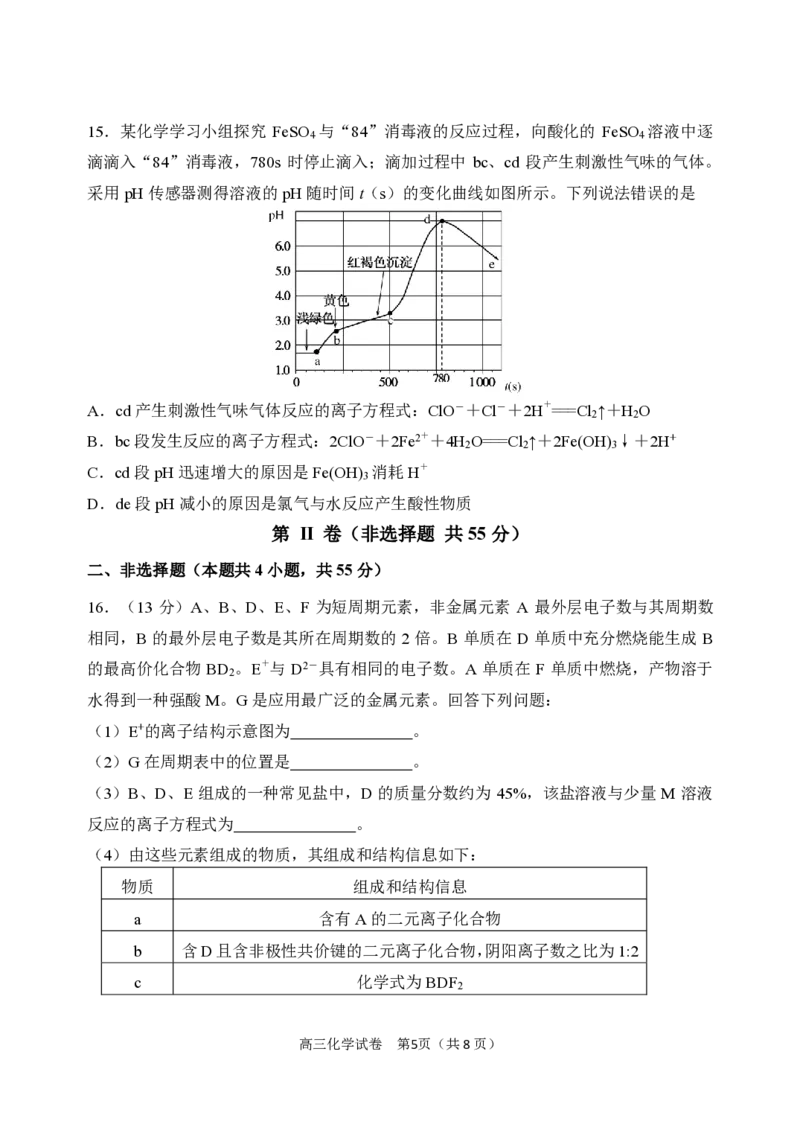
9.某100mL溶液可能含有Na+、NH+、Fe3+、C O 2 −、SO2-、Cl-中的若干种,取该溶液进
4 3 4
行连续实验,实验过程如图所示(所加试剂均过量,气体全部逸出):
下列说法错误的是
A.原溶液一定存在CO2−
3
B.原溶液一定存在Cl-
C.原溶液一定不存在Fe3+
D.原溶液中c(Na+)≥0.1 mol/L
10.下列关于钠及其化合物的说法正确的是
A.向饱和Na CO 溶液中通入足量CO ,有白色晶体析出
2 3 2
B.Na O、Na O 都能与酸反应,它们都是碱性氧化物
2 2 2
C.烧碱、纯碱均属于碱,都不能盛放在玻璃试剂瓶中
D.钠具有很强的还原性,可与TiCl 溶液反应制取金属Ti
4
11.下列关于氯及其化合物的说法错误的是
A.HCl→Cl →NaClO 均可一步实现
2
B.在化学反应中,HCl既能被氧化,又能被还原
C.漂白粉既可作棉、麻的漂白剂,又可作游泳池的消毒剂
D.氯气可使有色的鲜花瓣褪色,说明Cl 具有漂白性
2
高三化学试卷 第3页(共8页)
{#{QQABbYqQogiAAAAAAAhCEwWiCkCQkAGCCAoORAAAsAABwAFABAA=}#}12.如图为铁元素的价类二维图,“→”表示物质间的转化关系。下列说法正确的是
A.铁与水蒸气在高温条件下反应可实现转化①
B.FeO在空气中受热可实现转化②
C.Fe(OH) 溶解于足量稀硝酸可实现转化④
2
D.高铁酸盐(FeO2−)具有强氧化性,可用于杀灭水中细菌
4
13.下列关于钠、铁、氯及其化合物的说法错误的是
A.钠着火时不能使用泡沫灭火器灭火
B.1 mol Cl 与足量Fe反应,转移的电子的物质的量为2mol
2
C.可用澄清石灰水鉴别Na CO 溶液和NaHCO 溶液
2 3 3
D.Fe(OH) 和FeCl 均能通过化合反应制得
3 2
14.下列除杂试剂、除杂方法和除杂装置均正确的是
被提纯的物质 Cl Fe Na CO 固体 Al(OH) 胶体
2 2 3 3
(杂质) (HCl) (I ) (NaHCO ) (AlCl )
2 3 3
方法 洗气 升华 加热 渗析
除杂试剂及装置
选项 A B C D
高三化学试卷 第4页(共8页)
{#{QQABbYqQogiAAAAAAAhCEwWiCkCQkAGCCAoORAAAsAABwAFABAA=}#}15.某化学学习小组探究 FeSO 与“84”消毒液的反应过程,向酸化的 FeSO 溶液中逐
4 4
滴滴入“84”消毒液,780s 时停止滴入;滴加过程中 bc、cd 段产生刺激性气味的气体。
采用pH传感器测得溶液的pH随时间t(s)的变化曲线如图所示。下列说法错误的是
A.cd产生刺激性气味气体反应的离子方程式:ClO-+Cl-+2H+===Cl ↑+H O
2 2
B.bc段发生反应的离子方程式:2ClO-+2Fe2++4H O===Cl ↑+2Fe(OH) ↓+2H+
2 2 3
C.cd段pH迅速增大的原因是Fe(OH) 消耗H+
3
D.de段pH减小的原因是氯气与水反应产生酸性物质
第 Ⅱ 卷(非选择题 共 55分)
二、非选择题(本题共4小题,共55分)
16.(13 分)A、B、D、E、F 为短周期元素,非金属元素 A 最外层电子数与其周期数
相同,B 的最外层电子数是其所在周期数的 2 倍。B 单质在 D 单质中充分燃烧能生成 B
的最高价化合物 BD 。E+与 D2-具有相同的电子数。A 单质在 F 单质中燃烧,产物溶于
2
水得到一种强酸M。G是应用最广泛的金属元素。回答下列问题:
(1)E+的离子结构示意图为 。
(2)G在周期表中的位置是 。
(3)B、D、E 组成的一种常见盐中,D 的质量分数约为45%,该盐溶液与少量 M 溶液
反应的离子方程式为 。
(4)由这些元素组成的物质,其组成和结构信息如下:
物质 组成和结构信息
a 含有A的二元离子化合物
b 含D且含非极性共价键的二元离子化合物,阴阳离子数之比为1:2
c 化学式为BDF
2
高三化学试卷 第5页(共8页)
{#{QQABbYqQogiAAAAAAAhCEwWiCkCQkAGCCAoORAAAsAABwAFABAA=}#}①a的化学式为 。
②b的一种常见用途为 。
③已知c中所有原子均满足8电子稳定结构,该化合物的电子式为 。
(5)下列关于元素A、B、D、E、F的说法正确的是 。
a.最高价含氧酸的酸性:F>B
b.离子半径比较: D2- >E+
c.A、B均可与D形成直线形分子
d.可用pH试纸测EFD溶液的pH
17.(14分)某种胃药的有效成分为碳酸钙,测定其中碳酸钙含量的操作如下(设该药片
中的其他成分不与盐酸或氢氧化钠反应):
①配制0.10mol/L NaOH溶液
②配制0.10mol/L稀盐酸
③向一粒研碎后的药片(0.10g)中加入20.00mL蒸馏水充分溶解,再加25.00mL 0.10mol/L
稀盐酸
④用0.10mol/L NaOH溶液中和过量的稀盐酸,记录所消耗的NaOH溶液的体积
⑤再重复上述操作③④三次
请回答下列问题:
(1)完成上述操作①所需要的仪器除容量瓶、量筒外还需要 (填字母)。
序号 a b c d e f g
仪器
(2)下列关于使用容量瓶的操作,正确的是 。
高三化学试卷 第6页(共8页)
{#{QQABbYqQogiAAAAAAAhCEwWiCkCQkAGCCAoORAAAsAABwAFABAA=}#}(3)实验室现有50mL、100mL、250mL、500mL四种规格的容量瓶,则配制稀盐酸应
选用的容量瓶的规格为 。
(4)如图为实验室某浓盐酸试剂瓶上标签的有关内容,若用该浓盐酸配制上述稀盐酸,
需要用量筒量取 mL浓盐酸。
(5)操作③发生反应的离子方程式为 。
(6)某同学4次测定所消耗的NaOH溶液的体积如下:
测定次数 第1次 第2次 第3次 第4次
V[NaOH(aq)]/mL 13.20 13.00 13.10 13.90
通过该实验可测得胃药中碳酸钙的含量为 。
(7)下列操作会使碳酸钙的含量测定结果偏高的是 。
A.配制0.10mol/L 稀盐酸时未洗涤烧杯和玻璃棒
B.配制0.10mol/L 稀盐酸定容时俯视标线
C.配制0.10mol/L NaOH溶液时,小烧杯中浓溶液未冷却至室温就转移到容量瓶中
D.配制0.10mol/L NaOH溶液时,摇匀后发现液面低于标线加水至标线
18.(14分)油画中使用的无机颜料雄黄(As S )在不同空气湿度和光照条件下会发生
2 3
褪色,主要发生以下两种化学反应:
(1)紫外光照射下,被氧化的元素是 (填元素符号),每生成1mol As O ,
2 3
转移电子的物质的量为 mol。
(2)自然光照射下发生反应的化学方程式: 。
(3)氧化等量AsS 时,紫外光与自然光照射下消耗O 的物质的量之比为 。
2 3 2
(4)Na S 和 Na CO 按物质的量之比为 2:1 混合后加热,向溶液中通入 SO 即可获得
2 2 3 2
Na S O 和 CO ,该反应的离子方程式: 。上述过程一般在碱性环境下
2 2 3 2
进行,若在酸性条件下由于生成副产物 导致产品会发黄。
(5)芯片制造工业中利用GaAs与H O 反应,将As氧化为+5价,该反应的氧化剂与还
2 2
原剂物质的量之比为 。
高三化学试卷 第7页(共8页)
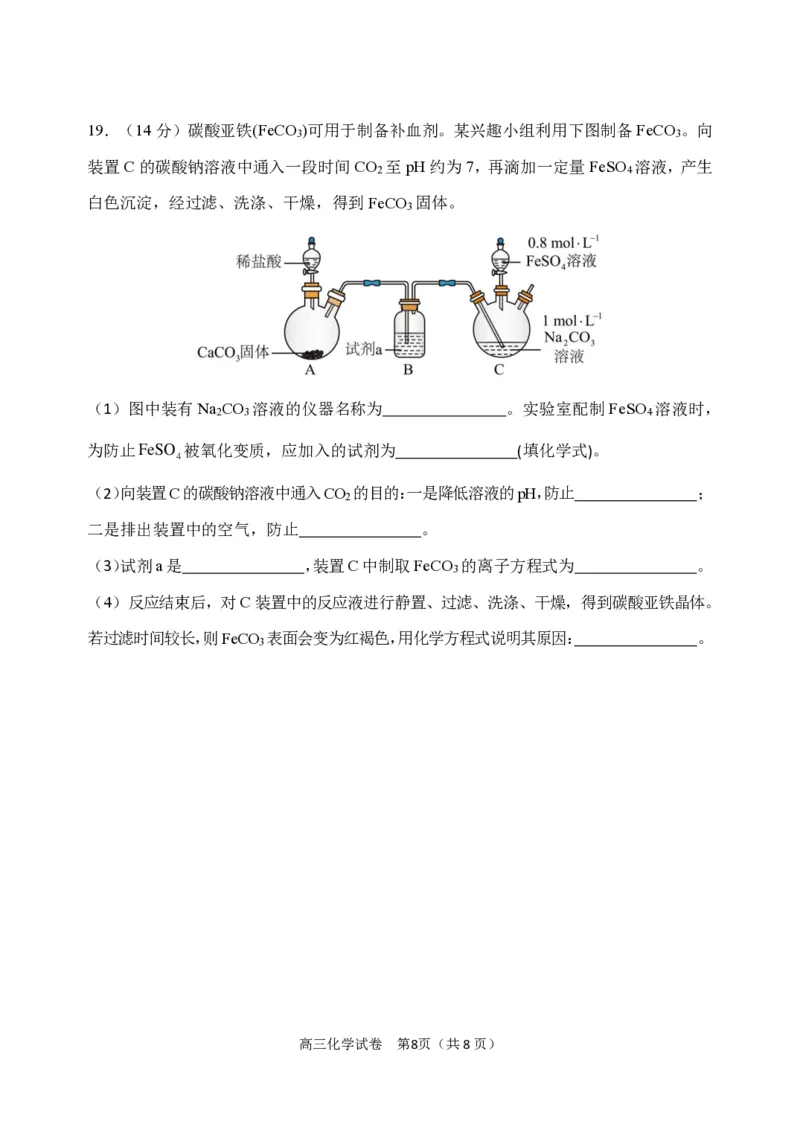
{#{QQABbYqQogiAAAAAAAhCEwWiCkCQkAGCCAoORAAAsAABwAFABAA=}#}19.(14分)碳酸亚铁(FeCO )可用于制备补血剂。某兴趣小组利用下图制备FeCO 。向
3 3
装置C的碳酸钠溶液中通入一段时间CO 至pH约为7,再滴加一定量FeSO 溶液,产生
2 4
白色沉淀,经过滤、洗涤、干燥,得到FeCO 固体。
3
(1)图中装有Na CO 溶液的仪器名称为 。实验室配制FeSO 溶液时,
2 3 4
为防止FeSO 被氧化变质,应加入的试剂为 (填化学式)。
4
(2)向装置C的碳酸钠溶液中通入CO 的目的:一是降低溶液的pH,防止 ;
2
二是排出装置中的空气,防止 。
(3)试剂a是 ,装置C中制取FeCO 的离子方程式为 。
3
(4)反应结束后,对C装置中的反应液进行静置、过滤、洗涤、干燥,得到碳酸亚铁晶体。
若过滤时间较长,则FeCO 表面会变为红褐色,用化学方程式说明其原因: 。
3
高三化学试卷 第8页(共8页)
{#{QQABbYqQogiAAAAAAAhCEwWiCkCQkAGCCAoORAAAsAABwAFABAA=}#}