文档内容
炎德·英才大联考长郡中学 2025 届高三月考试卷(二)
化学
得分:__________
本试题卷分选择题和非选择题两部分,共 8页。时量 75分钟,满分100分。
可能用到的相对原子质量:H~1 C~12 O~16 Na~23 Al~27 S~32
一、选择题(本题共 14 小题,每小题 3分,共 42分。在每小题给出的四个选项中,只有一
项是符合题目要求的。)
1.在巴黎奥运会舞台上,科技与体育双向奔赴,释放更加迷人的魅力。下列说法不正确的是
A.奥运火炬燃料中的丙烷、丁烷属于烃
B.生产橡胶弹性地板的原料天然橡胶是异戊二烯的聚合物
C.中国队领奖服采用的环保再生纤维材料为有机高分子材料
D.比赛乒乓球台可变灯光系统的控制芯片的主要成分为SiO
2
2.下列化学用语表示正确的是
A.NH Cl的电子式:
4
B.铜的基态原子的简化电子排布式:[Ar]3d94s2
C.SO2−的VSEPR模型:
3
D.HCl中σ键的电子云轮廓图:
3.实验室在进行“电解CuCl
2
溶液”实验时,与该实验无
.
关
.
的安全注意事项是
A.正确使用火源 B.小心用电 C.实验后洗手 D.开启排风扇
4.下列有关物质结构与性质的说法错误的是
A.酸性强弱:氯乙酸>乙酸>丙酸
B.邻羟甲基苯甲醛的沸点低于对羟甲基苯甲醛
C.O 是含有极性键的强极性分子,它在四氯化碳中的溶解度低于在水中的溶解度
3
D.由R N+与PF−。构成的离子液体常温下呈液态,与其离子的体积较大有关
4 6
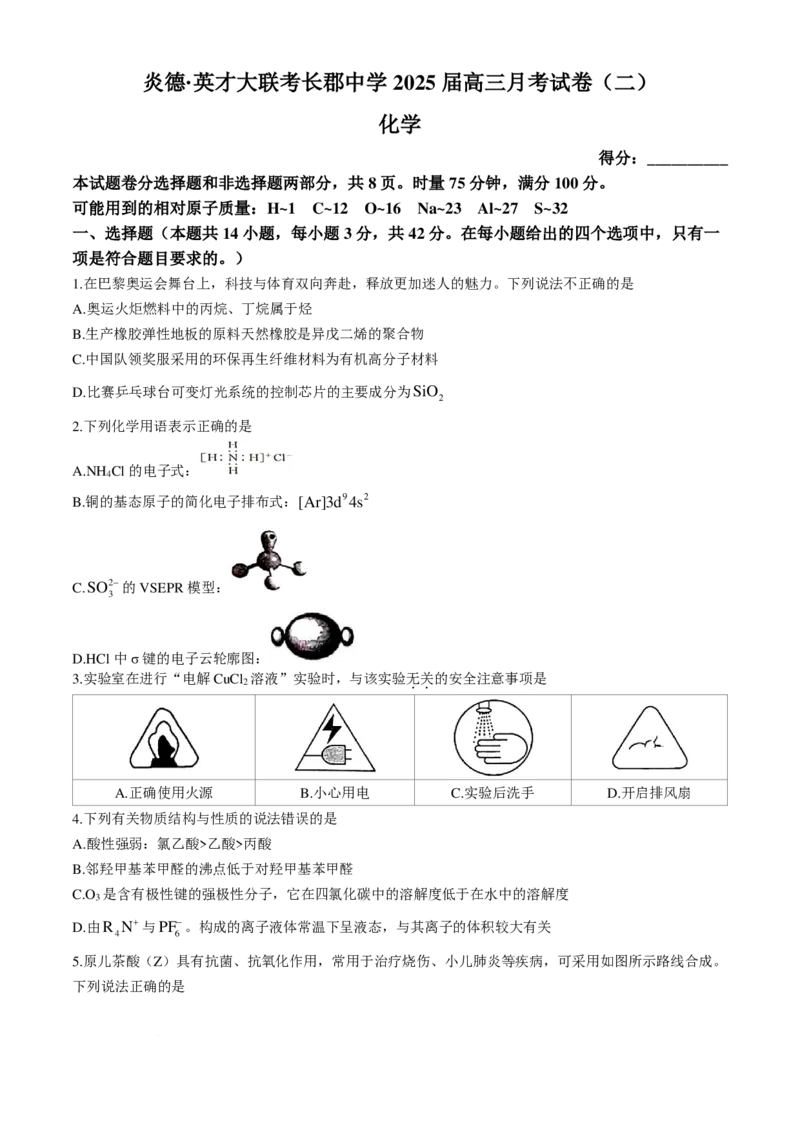
5.原儿茶酸(Z)具有抗菌、抗氧化作用,常用于治疗烧伤、小儿肺炎等疾病,可采用如图所示路线合成。
下列说法正确的是
学科网(北京)股份有限公司A.Y存在二元芳香酸的同分异构体
B.可用酸性KMnO 溶液鉴别X和Z
4
C.X分子中所有原子可能共平面
D.Z与足量的溴水反应消耗3molBr
2
6.下列过程中,对应反应方程式正确的是
A.用氢氟酸刻蚀玻璃:SiO2− +4F− +6H+ =SiF ↑+3H O
3 4 2
B.AgCl溶于浓氨水:Ag+ +2NH
3
⋅H
2
O=
Ag ( NH
3
)
2
+ +2H
2
O
C.酸性K Cr O 溶液氧化H O :Cr O2− +8H+ +5H O =9H O+2Cr3+ +4O ↑
2 2 7 2 2 2 7 2 2 2 2
△
D.四氯化钛水解:TiCl +(x+2)H O TiO ⋅xH O↓+4HCl
4 2 2 2
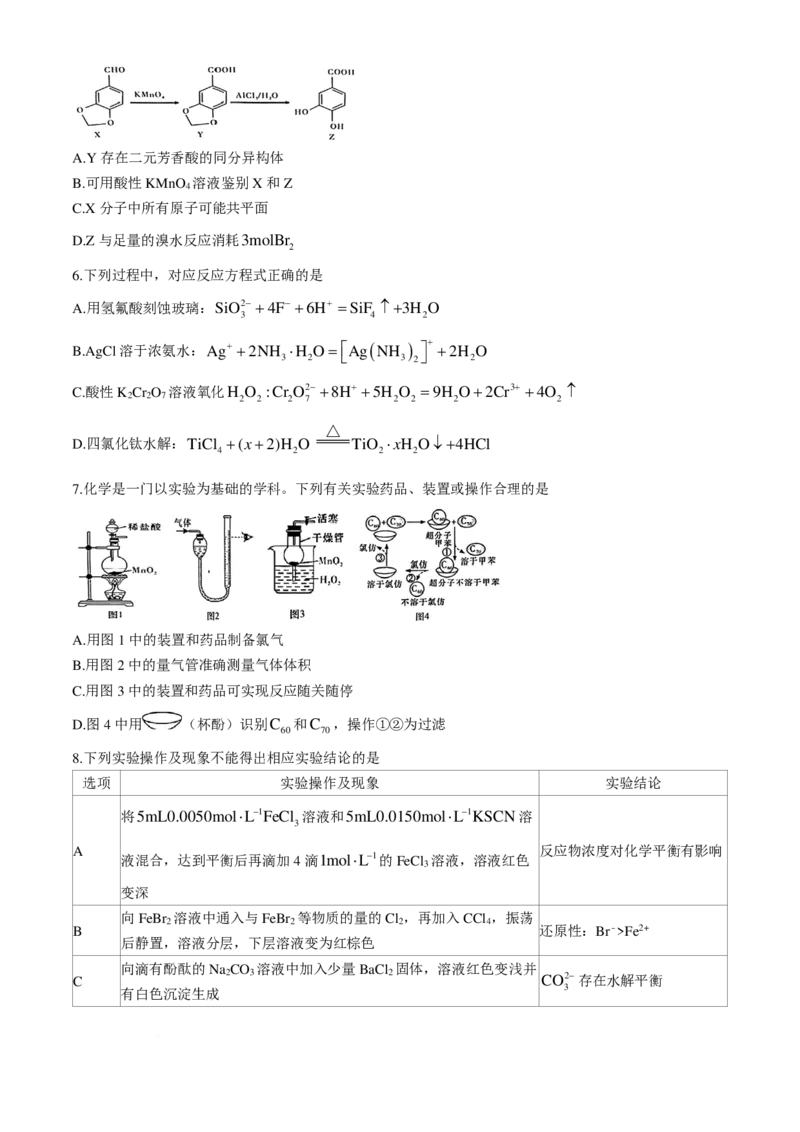
7.化学是一门以实验为基础的学科。下列有关实验药品、装置或操作合理的是
A.用图1中的装置和药品制备氯气
B.用图2中的量气管准确测量气体体积
C.用图3中的装置和药品可实现反应随关随停
D.图4中用 (杯酚)识别C 和C ,操作①②为过滤
60 70
8.下列实验操作及现象不能得出相应实验结论的是
选项 实验操作及现象 实验结论
将5mL0.0050mol⋅L−1FeCl 溶液和5mL0.0150mol⋅L−1KSCN溶
3
A 反应物浓度对化学平衡有影响
液混合,达到平衡后再滴加4滴1mol⋅L−1的FeCl 溶液,溶液红色
3
变深
向FeBr 溶液中通入与FeBr 等物质的量的Cl ,再加入CCl ,振荡
2 2 2 4
B 还原性:Br⁻>Fe2+
后静置,溶液分层,下层溶液变为红棕色
向滴有酚酞的Na CO 溶液中加入少量BaCl 固体,溶液红色变浅并
C
2 3 2 CO2−存在水解平衡
有白色沉淀生成 3
学科网(北京)股份有限公司常温下,将Ba(OH) ⋅8H O晶体研细后与NH Cl晶体置于烧杯
2 2 4 Ba(OH) ⋅8H O与NH Cl反
2 2 4
D
中,快速搅拌混合物,并触摸杯壁,杯壁变凉,同时闻到刺激性气
应对应的∆H 和∆S均大于0
味
9.联氨(
N H
)为二元弱碱,在水中的电离方式与氨相似,可用于处理锅炉水中的溶解氧,防止锅炉被腐
2 4
蚀,其中一种反应机理如图所示。下列说法正确的是
A.每个N H 分子中有一个π键
2 4
B.第一电离能:I (O)> I (N)> I (Cu)
1 1 1
C.H—N—H键角:
Cu ( NH
3
)
4
2+ > NH
3
D.理论上,2molN H 最多能处理44.8LO
2 4 2
10.近日,我国化学家通过对过渡金属基尖晶石氧化物(
NiCO O
)进行性能优化,成功开发出锌-空气二次
2 4
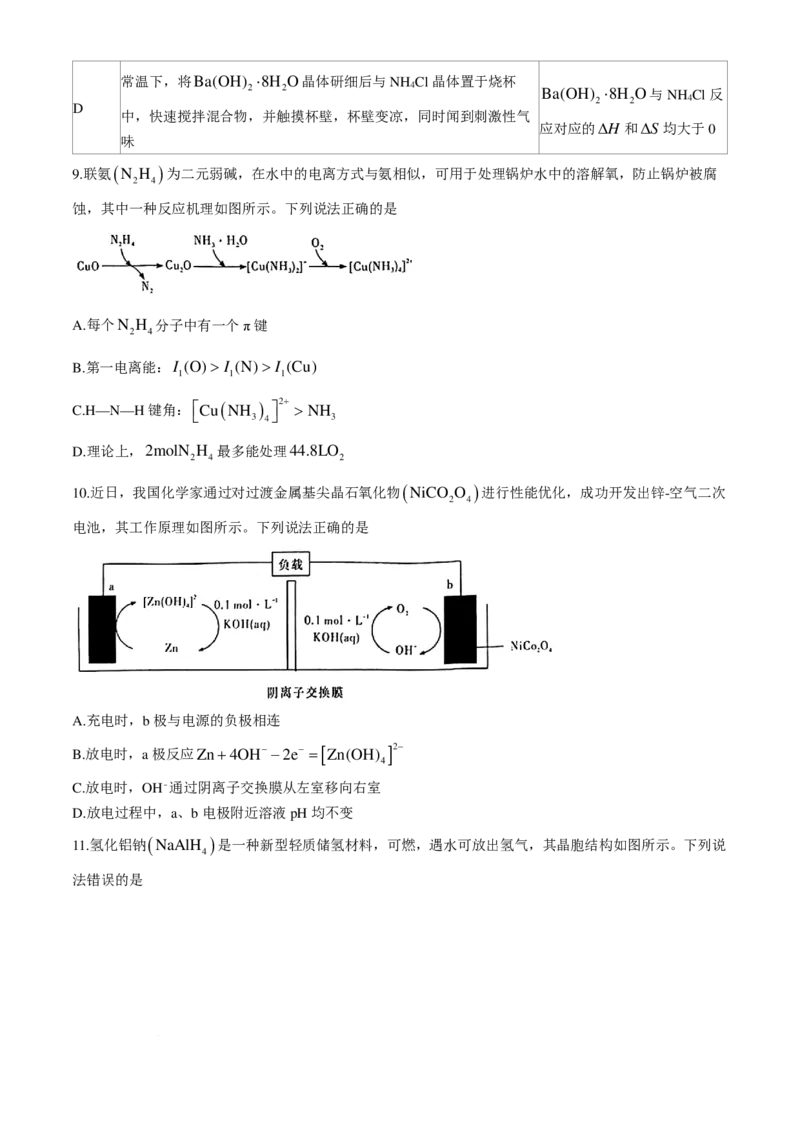
电池,其工作原理如图所示。下列说法正确的是
A.充电时,b极与电源的负极相连
B.放电时,a极反应Zn+4OH− −2e− =[ Zn(OH) ]2−
4
C.放电时,OH⁻通过阴离子交换膜从左室移向右室
D.放电过程中,a、b电极附近溶液pH均不变
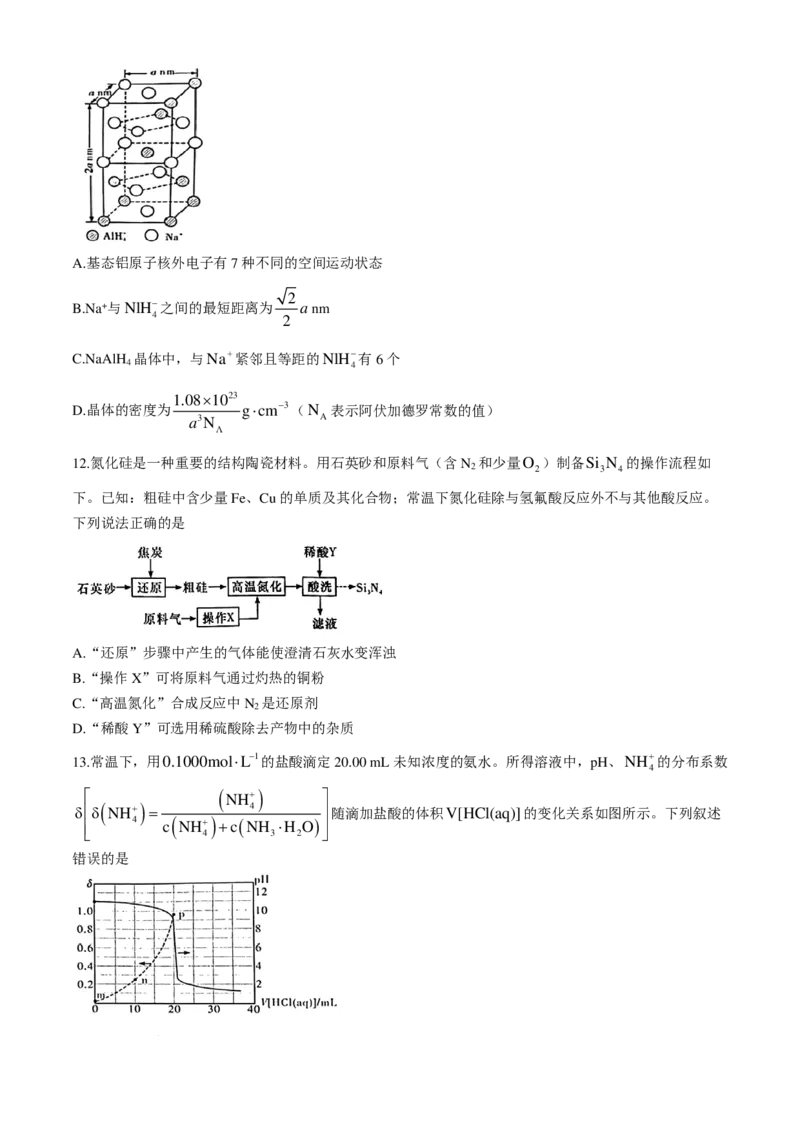
11.氢化铝钠(
NaAlH
)是一种新型轻质储氢材料,可燃,遇水可放出氢气,其晶胞结构如图所示。下列说
4
法错误的是
学科网(北京)股份有限公司A.基态铝原子核外电子有7种不同的空间运动状态
2
B.Na+与NlH−之间的最短距离为 anm
4 2
C.NaAlH
晶体中,与Na+紧邻且等距的NlH−有6个
4 4
1.08×1023
D.晶体的密度为 g⋅cm−3(N 表示阿伏加德罗常数的值)
a3N A
Λ
12.氮化硅是一种重要的结构陶瓷材料。用石英砂和原料气(含N 和少量O )制备Si N 的操作流程如
2 2 3 4
下。已知:粗硅中含少量Fe、Cu的单质及其化合物;常温下氮化硅除与氢氟酸反应外不与其他酸反应。
下列说法正确的是
A.“还原”步骤中产生的气体能使澄清石灰水变浑浊
B.“操作X”可将原料气通过灼热的铜粉
C.“高温氮化”合成反应中N 是还原剂
2
D.“稀酸Y”可选用稀硫酸除去产物中的杂质
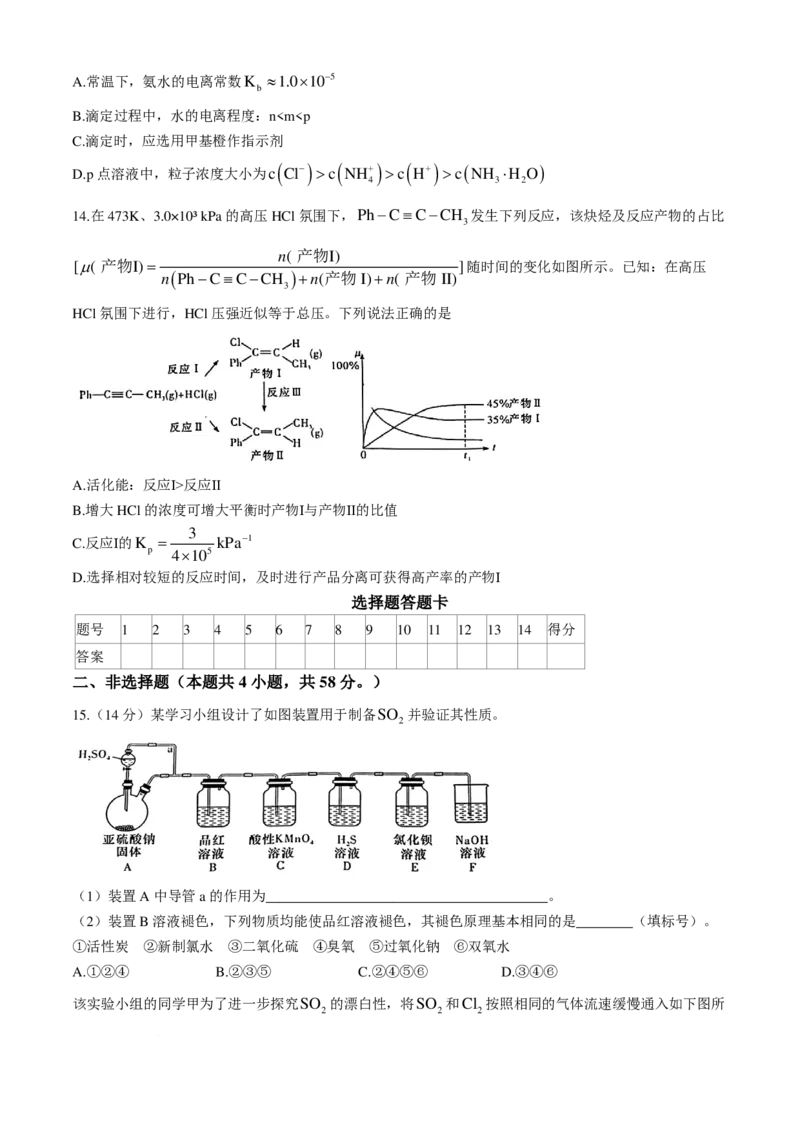
13.常温下,用0.1000mol⋅L−1的盐酸滴定20.00 mL未知浓度的氨水。所得溶液中,pH、NH+的分布系数
4
( NH+)
δδ ( NH+) = 4 随滴加盐酸的体积V[HCl(aq)]的变化关系如图所示。下列叙述
4 c ( NH+) +c ( NH ⋅H O )
4 3 2
错误的是
学科网(北京)股份有限公司A.常温下,氨水的电离常数K ≈1.0×10−5
b
B.滴定过程中,水的电离程度:nc ( NH+) >c ( H+) >c ( NH ⋅H O )
4 3 2
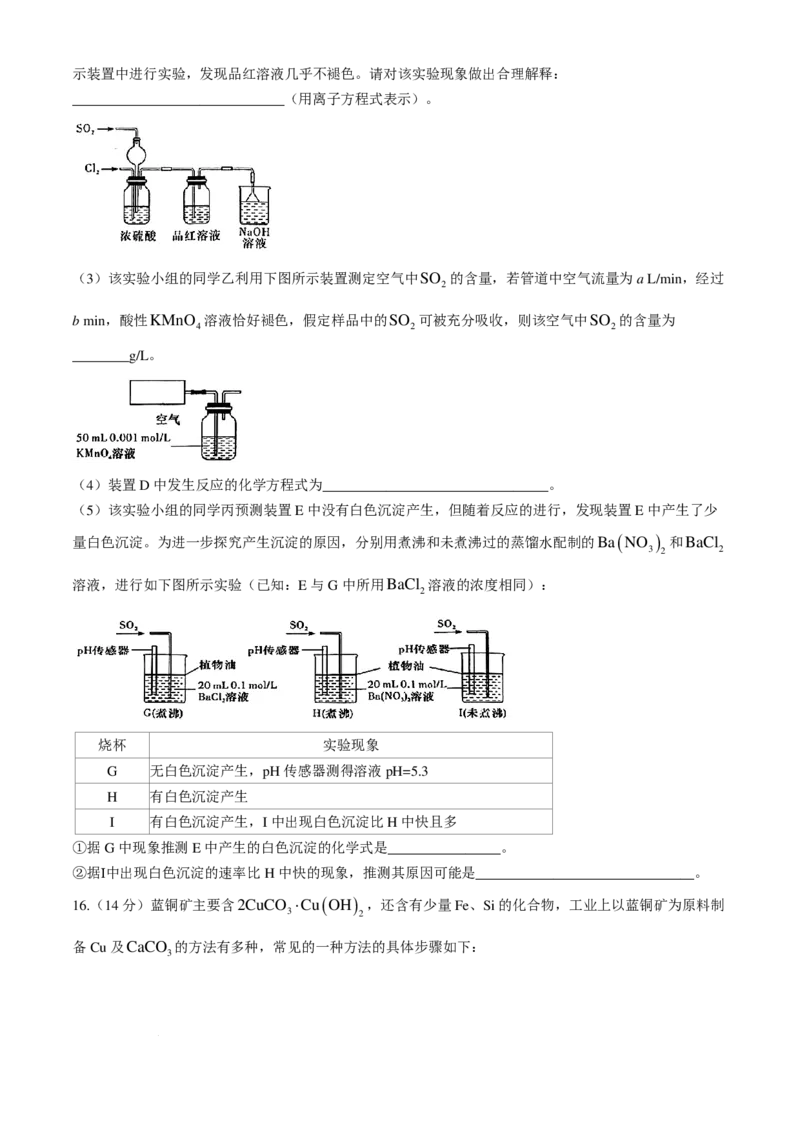
14.在473K、3.0×10³ kPa的高压HCl氛围下,Ph−C≡C−CH 发生下列反应,该炔烃及反应产物的占比
3
n( 产物I)
[µ( 产物I)= ]随时间的变化如图所示。已知:在高压
n ( Ph−C≡C−CH )+n(产物 I)+n( 产物 II)
3
HCl氛围下进行,HCl压强近似等于总压。下列说法正确的是
A.活化能:反应Ⅰ>反应Ⅱ
B.增大HCl的浓度可增大平衡时产物Ⅰ与产物Ⅱ的比值
3
C.反应Ⅰ的K = kPa−1
p 4×105
D.选择相对较短的反应时间,及时进行产品分离可获得高产率的产物Ⅰ
选择题答题卡
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 得分
答案
二、非选择题(本题共 4小题,共 58分。)
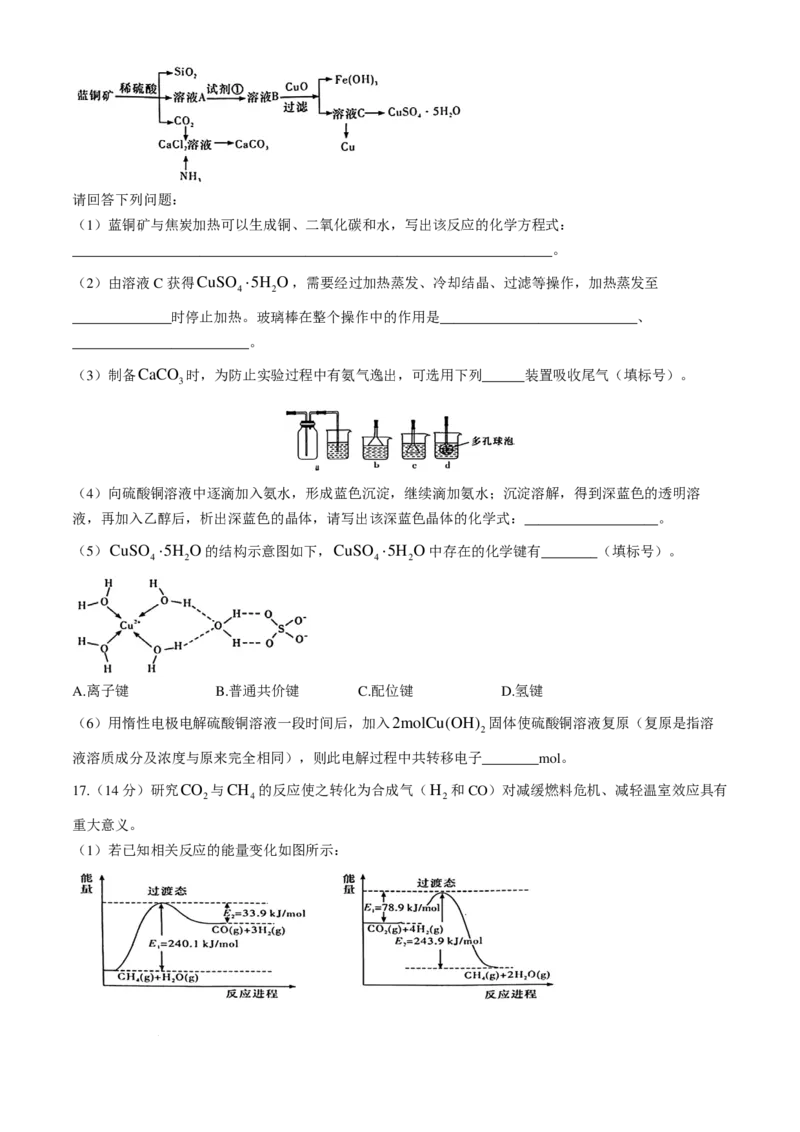
15.(14分)某学习小组设计了如图装置用于制备SO 并验证其性质。
2
(1)装置A中导管a的作用为________________________________________。
(2)装置B溶液褪色,下列物质均能使品红溶液褪色,其褪色原理基本相同的是________(填标号)。
①活性炭 ②新制氯水 ③二氧化硫 ④臭氧 ⑤过氧化钠 ⑥双氧水
A.①②④ B.②③⑤ C.②④⑤⑥ D.③④⑥
该实验小组的同学甲为了进一步探究SO 的漂白性,将SO 和Cl 按照相同的气体流速缓慢通入如下图所
2 2 2
学科网(北京)股份有限公司示装置中进行实验,发现品红溶液几乎不褪色。请对该实验现象做出合理解释:
______________________________(用离子方程式表示)。
(3)该实验小组的同学乙利用下图所示装置测定空气中SO 的含量,若管道中空气流量为a L/min,经过
2
b min,酸性KMnO 溶液恰好褪色,假定样品中的SO 可被充分吸收,则该空气中SO 的含量为
4 2 2
________g/L。
(4)装置D中发生反应的化学方程式为________________________________。
(5)该实验小组的同学丙预测装置E中没有白色沉淀产生,但随着反应的进行,发现装置E中产生了少
量白色沉淀。为进一步探究产生沉淀的原因,分别用煮沸和未煮沸过的蒸馏水配制的Ba ( NO ) 和BaCl
3 2 2
溶液,进行如下图所示实验(已知:E与G中所用BaCl 溶液的浓度相同):
2
烧杯 实验现象
G 无白色沉淀产生,pH传感器测得溶液pH=5.3
H 有白色沉淀产生
I 有白色沉淀产生,I中出现白色沉淀比H中快且多
①据G中现象推测E中产生的白色沉淀的化学式是________________。
②据Ⅰ中出现白色沉淀的速率比H中快的现象,推测其原因可能是_______________________________。
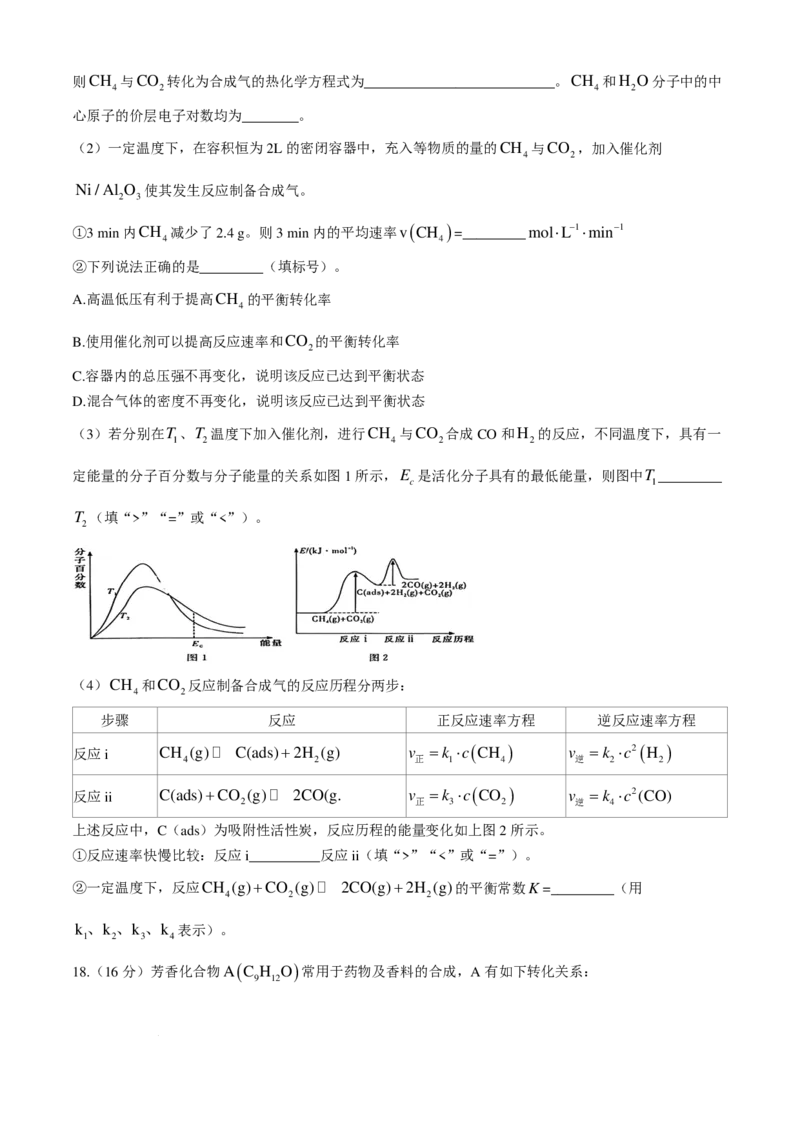
16.(14分)蓝铜矿主要含2CuCO ⋅Cu ( OH ) ,还含有少量Fe、Si的化合物,工业上以蓝铜矿为原料制
3 2
备Cu及CaCO 的方法有多种,常见的一种方法的具体步骤如下:
3
学科网(北京)股份有限公司请回答下列问题:
(1)蓝铜矿与焦炭加热可以生成铜、二氧化碳和水,写出该反应的化学方程式:
____________________________________________________________________。
(2)由溶液C获得CuSO ⋅5H O,需要经过加热蒸发、冷却结晶、过滤等操作,加热蒸发至
4 2
______________时停止加热。玻璃棒在整个操作中的作用是____________________________、
_________________________。
(3)制备CaCO 时,为防止实验过程中有氨气逸出,可选用下列______装置吸收尾气(填标号)。
3
(4)向硫酸铜溶液中逐滴加入氨水,形成蓝色沉淀,继续滴加氨水;沉淀溶解,得到深蓝色的透明溶
液,再加入乙醇后,析出深蓝色的晶体,请写出该深蓝色晶体的化学式:___________________。
(5)CuSO ⋅5H O的结构示意图如下,CuSO ⋅5H O中存在的化学键有________(填标号)。
4 2 4 2
A.离子键 B.普通共价键 C.配位键 D.氢键
(6)用惰性电极电解硫酸铜溶液一段时间后,加入2molCu(OH) 固体使硫酸铜溶液复原(复原是指溶
2
液溶质成分及浓度与原来完全相同),则此电解过程中共转移电子________mol。
17.(14分)研究CO 与CH 的反应使之转化为合成气(H 和CO)对减缓燃料危机、减轻温室效应具有
2 4 2
重大意义。
(1)若已知相关反应的能量变化如图所示:
学科网(北京)股份有限公司则CH 与CO 转化为合成气的热化学方程式为___________________________。CH 和H O分子中的中
4 2 4 2
心原子的价层电子对数均为________。
(2)一定温度下,在容积恒为2L的密闭容器中,充入等物质的量的CH 与CO ,加入催化剂
4 2
Ni/Al O 使其发生反应制备合成气。
2 3
①3 min内CH 减少了2.4 g。则3 min内的平均速率v ( CH ) =_________mol⋅L−1⋅min−1
4 4
②下列说法正确的是_________(填标号)。
A.高温低压有利于提高CH 的平衡转化率
4
B.使用催化剂可以提高反应速率和CO 的平衡转化率
2
C.容器内的总压强不再变化,说明该反应已达到平衡状态
D.混合气体的密度不再变化,说明该反应已达到平衡状态
(3)若分别在T 、T 温度下加入催化剂,进行CH 与CO 合成CO和H 的反应,不同温度下,具有一
1 2 4 2 2
定能量的分子百分数与分子能量的关系如图1所示,E 是活化分子具有的最低能量,则图中T _________
c 1
T (填“>”“=”或“<”)。
2
(4)CH 和CO 反应制备合成气的反应历程分两步:
4 2
步骤 反应 正反应速率方程 逆反应速率方程
反应i CH (g) C(ads)+2H (g) v =k ⋅c ( CH ) v =k ⋅c2( H )
4 2 正 1 4 逆 2 2
反应ii C(ads)+CO (g) 2CO(g. v =k ⋅c ( CO ) v =k ⋅c2(CO)
2 正 3 2 逆 4
上述反应中,C(ads)为吸附性活性炭,反应历程的能量变化如上图2所示。
①反应速率快慢比较:反应i__________反应ii(填“>”“<”或“=”)。
②一定温度下,反应CH (g)+CO (g) 2CO(g)+2H (g)的平衡常数K=_________(用
4 2 2
k、k 、k 、k 表示)。
1 2 3 4
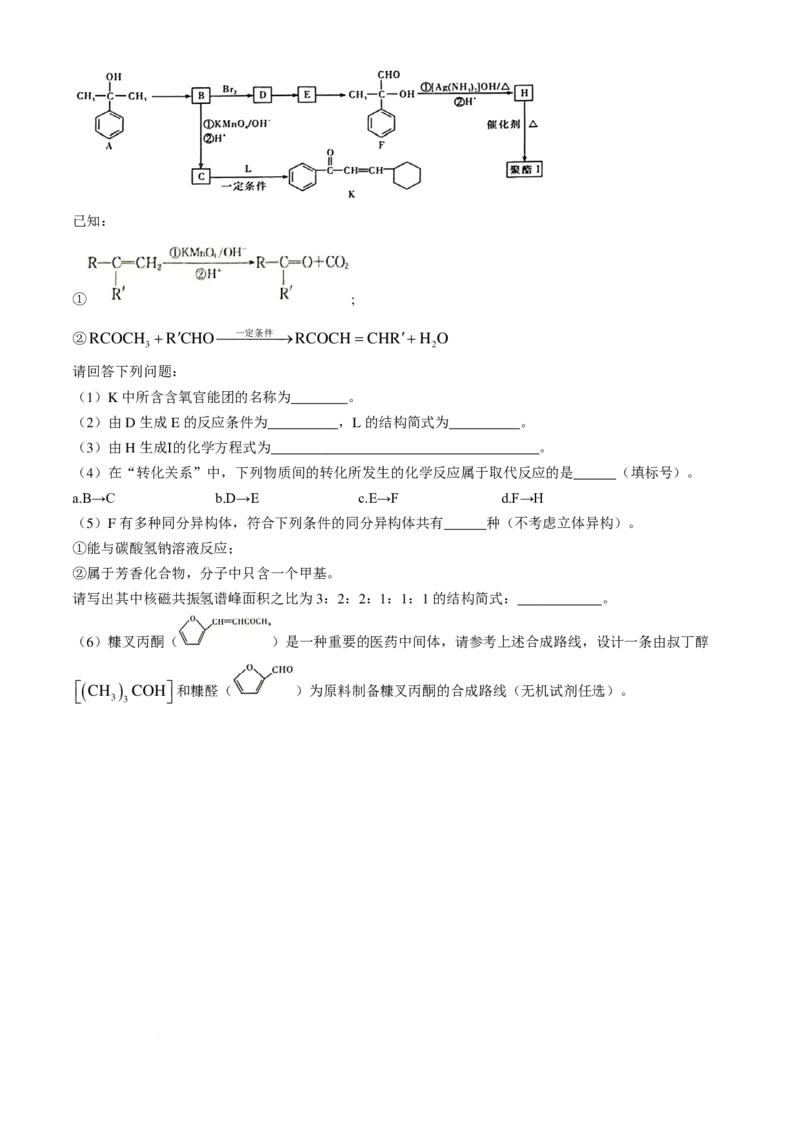
18.(16分)芳香化合物A ( C H O )常用于药物及香料的合成,A有如下转化关系:
9 12
学科网(北京)股份有限公司已知:
① ;
②RCOCH +R′CHO 一定条件 →RCOCH=CHR′+H O
3 2
请回答下列问题:
(1)K中所含含氧官能团的名称为________。
(2)由D生成E的反应条件为__________,L的结构简式为__________。
(3)由H生成Ⅰ的化学方程式为______________________________________。
(4)在“转化关系”中,下列物质间的转化所发生的化学反应属于取代反应的是______(填标号)。
a.B→C b.D→E c.E→F d.F→H
(5)F有多种同分异构体,符合下列条件的同分异构体共有______种(不考虑立体异构)。
①能与碳酸氢钠溶液反应;
②属于芳香化合物,分子中只含一个甲基。
请写出其中核磁共振氢谱峰面积之比为3:2:2:1:1:1的结构简式:____________。
(6)糠叉丙酮( )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇
( CH
3
)
3
COH
和糠醛( )为原料制备糠叉丙酮的合成路线(无机试剂任选)。
学科网(北京)股份有限公司炎德·英才大联考长郡中学 2025 届高三月考试卷(二)
化学参考答案
一、选择题(本题共 14 小题,每小题 3分,共 42分。在每小题给出的四个选项中,只有一
项是符合题目要求的。)
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14
答案 D C A C A D D B C B C B B D
1.D【解析】丙烷、丁烷属于烷烃,化学性质较稳定,能燃烧,其燃烧热值高,A正确;天然橡胶是以顺
式聚异戊二烯为主要成分的天然高分子,其单体为异戊二烯,B正确;环保再生纤维材料属于有机高分子
材料,C正确;乒乓球台可变灯光系统的控制芯片的主要成分为Si,D错误。
2.C【解析】氯化铵是离子化合物,电子式为 ,故A错误;铜的基态原子的简化电子排布
( 6+2 )−2×3
式为[Ar]3d104s1,故B错误;SO2−中硫原子价层电子对数为3+ =4,VSEPR模型为四面
3 2
体形,故C正确;HCl中氢原子的ls轨道提供的1个未成对电子与氯原子的3p轨道提供的1个未成对电
子形成H—Cl的s-pσ键,电子云轮廓图为 ,故D错误。
3.A【解析】此实验不需要用明火,A符合题意;电解CuCl 溶液需要接通电源,要注意小心用电,B不符
2
合题意;实验结束后,离开实验室前需要用肥皂等清洗双手,C不符合题意;电解CuCl 溶液时在阳极产
2
生氯气,在实验过程中需要排风以免中毒,D不符合题意。
4.C【解析】《选择性必修2》P ——Cl为吸电子基团,导致氯乙酸羧基中的羟基极性增大,更易电离出
54
氢离子,烷基是推电子基团,烷基越长推电子效应越大,导致丙酸羧基中的羟基极性减小,故酸性:氯乙
酸>乙酸>丙酸,A正确;《选择性必修2》P ——邻羟甲基苯甲醛在分子内形成氢键,分子内氢键使物质
57
沸点降低,而对羟甲基苯甲醛只在分子间形成氢键,分子间氢键使物质沸点升高,故邻羟甲基苯甲醛的沸
点低于对羟甲基苯甲醛,B正确;《选择性必修2》P ——O 分子有极性,但很微弱,所以它在四氯化碳
53 3
中的溶解度高于在水中的溶解度,C错误;《选择性必修2》P ——大多数离子液体含有体积很大的阴、
88
阳离子,D正确。
5.A【解析】Y的分子式为C H O ,不饱和度为6,存在二元芳香酸的同分异构体,A项正确;X中存在
8 6 4
的—CHO、Z中存在的酚羟基均能被酸性KMnO 溶液氧化,故无法鉴别,B项错误;X分子中存在饱和
4
碳原子,所有原子不可能共平面,C项错误;Z的物质的量未明确,不能确定消耗的Br 的物质的量,D
2
项错误。
6.D【解析】玻璃的主要成分为SiO ,用氢氟酸刻蚀玻璃时,SiO 和氢氟酸反应生成SiF 气体和水,反
2 2 4
应方程式为SiO +4HF=SiF ↑+2H O,A错误;AgCl是难溶物,不可拆,离子方程式为
2 4 2
学科网(北京)股份有限公司AgCl+2NH 3 ⋅H 2 O= Ag ( NH 3 ) 2 + +Cl− +2H 2 O,B错误;酸性K 2 Cr 2 O 7 溶液氧化H 2 O 2 ,Cr 2 O 7 2−被
还原成Cr3+,H O 被氧化成O ,离子方程式为Cr O2− +8H+ +3H O =7H O+2Cr3+ +3O ↑,C错
2 2 2 2 7 2 2 2 2
误;TiCl 在水中发生水解反应生成TiO ⋅xH O 沉淀,同时生成HCl(《选择性必修1》P ),D正
4 2 2 77
确。
7.D【解析】稀盐酸与二氧化锰不反应,图1中应选浓盐酸,故A错误;图2中要上下移动量气管,使两
边液面平齐时,再读数,故B错误;图3中MnO 是黑色粉末,该装置不能实现反应的随关随停,故C
2
错误;图4用杯酚识别C 和C ,超分子不溶于甲苯,杯酚可溶于氯仿,故操作①②为过滤,故D正
60 70
确。
8.B【解析】增大FeCl 溶液浓度,溶液红色加深,说明平衡正向移动,A正确;等物质的量的FeBr 和
3 2
Cl 反应,Fe2+先被氧化,剩余Cl 与Br⁻反应生成Br ,无法验证还原性:Br− >Fe2+,B错误;向滴有
2 2 2
酚酞的Na CO 溶液中加入少量BaCl 固体,溶液红色变浅并有白色沉淀生成可证明CO2−存在水解平
2 3 2 3
衡,C正确;烧杯壁变凉说明反应的焓变∆H >0,该反应有氨气生成,则熵变∆S >0,D正确。
9.C【解析】N H 分子中原子间以单键相连接,不含π键,A错误;同周期主族元素,原子序数越大,第
2 4
一电离能呈增大趋势,但氮原子属于半充满结构,第一电离能大于相邻元素,故第一电离能:N>O>Cu,B
错误;
Cu ( NH
3
)
4
2+ 中氮原子孤电子对形成配位键( ),NH
3
中含1个孤电子对,孤电
子对与成键电子对间的斥力较大,H—N—H键角小,C正确;未指明气体是否处于标准状况,因此无法计
算2molN H 能处理的氧气体积,D错误。
2 4
10.B【解析】由图可知,放电时,a电极为原电池的负极,碱性条件下锌失去电子发生氧化反应生成四羟
基合锌离子,电极反应式为Zn−2e− +4OH− =[ Zn(OH) ]2− ;b电极为正极,水分子作用下氧气在正极
4
得到电子生成OH−,电极反应式为O +4e− +2H O=4OH−充电时,a极与电源负极连接,b极与电源
2 2
正极连接。
由分析可知,充电时,b极与电源正极连接,A错误;放电时,a电极为原电池的负极,电极反应式为
Zn−2e− +4OH− =[ Zn(OH) ]2− ,B正确;放电时,阴离子向负极移动,OH−通过阴离子交换膜从右室
4
移向左室,C错误;放电过程中,a极电极反应:Zn−2e− +4OH− =[ Zn(OH) ]2− ,则a电极附近溶液
4
pH减小,b极电极反应:O +4e− +2H O=4OH−,OH−通过阴离子交换膜从右室移向左室,b极反应
2 2
消耗水,导致b电极附近溶液pH增大,D错误。
11.C【解析】Al的电子排布式:1s22s22p63s23p1,核外含有电子的轨道有1+1+3+1+1=7个,A正
学科网(北京)股份有限公司2
确;Na+和AlH−之间的最短距离为下底面面对角线长的一半,为 anm,B正确;NaAlH 晶体中,
4 2 4
以体心的AlH−为例,与之紧邻且等距的Na+位于晶胞棱上、晶胞中上层立方体左右侧面心、晶胞中下层
4
立方体前后面面心,有8个,结合化学式可知与Na+紧邻且等距的AlH−有8个,C错误;晶胞中AlH−数
4 4
1 1 1 1 ( 23+27+1×4 )×4
目为1+8× +4× =4,Na+数目为6× +4× =4,晶胞质量为 g,晶胞体积为
8 2 2 4 N
A
a×10−7×a×10−7×2a×10−7cm3,则晶体的密度为
( 23+27+1×4 )×4 1.08×1023
g⋅cm−3 = g⋅cm−3,D正确。
( a×10−7×a×10−7×2a×10−7 ) N a3N
A A
高温
12.B【解析】“还原”步骤中焦炭和石英砂反应生成粗硅和CO:2C+SiO Si+2CO↑,CO不能
2
使澄清石灰水变浑浊,A错误;“高温氮化”是Si与N 反应,原料气中含有N 和少量的O ,O 能与Si
2 2 2 2
反应生成SiO ,灼热的铜粉可与O 反应,从而除去N 中含有的少量O ,B正确;“高温氮化”合成反
2 2 2 2
高温
应为3Si+2N Si N ,反应中N的化合价降低,被还原,故N 是氧化剂,C错误;“高温氮化”
2 3 4 2
制备的Si N 中含有少量Fe和Cu,Fe与稀硫酸反应,得到可溶于水的FeSO ,但Cu与稀硫酸不反应,D
3 4 4
错误。
13.B【解析】达到滴定终点时消耗盐酸的体积是20.00 mL,根据反应方程式
HCl+NH ⋅H O= NH Cl+H O,n ( NH ⋅H O )=n ( HCl ),由于二者的体积相同,故它们的浓度相
3 2 4 2 3 2
等,c ( NH ⋅H O )=0.1000mol⋅L−1。开始滴定前溶液pH=11,则c ( OH−) =10−3mol⋅L−1,则根据
3 2
NH ⋅H O NH+ +OH−,可知c ( NH+) =10−3mol⋅L−1,故NH ·H O的电离平衡常数
3 2 4 4 3 2
10−3×10−3
K = ≈1.0×10−5,A正确;向NH ⋅H O中滴加盐酸,溶液的碱性逐渐减弱,碱电离产生
b 0.1000−10−3 3 2
的OH⁻对水电离的抑制作用逐渐减弱,则在恰好中和前,水的电离程度逐渐增大,因此水的电离程度:
mc ( NH+) ,H O H+ +OH−,c ( H+) >c ( NH ⋅H O ),故
4 2 3 2
c ( Cl−) >c ( NH+) >c ( H+) >c ( NH ⋅H O ),D正确。
4 3 2
学科网(北京)股份有限公司14.D【解析】反应所需的活化能越小,反应速率越快,相同时间内所占比例越大,根据图知,短时间内,
产物Ⅰ的占比远远大于产物Ⅱ,说明反应Ⅰ的速率远远大于反应Ⅱ,则活化能:反应Ⅰ<反应Ⅱ,A错误;由于
存在产物Ⅰ与产物Ⅱ之间的可逆反应,K与氯化氢含量无关,因此产物Ⅰ与产物Ⅱ的比值不会随着HCl的浓度
的改变而改变,B错误;根据已知,因反应在高压HCl氛围下进行,故HCl压强近似等于总压,设反应前
反应物是1 mol,根据图像,生成产物Ⅱ的物质的量为0.45 mol,产物Ⅰ的物质的量为0.35 mol,则剩余
Ph−C≡C−CH 的物质的量为0.20 mol,反
3
n
(产物I )
× p
总
n 7
应Ⅰ的K = 总 = kPa−1,C错误;根据图知,相对较短的反应时
p n ( Ph−C≡CH ) 12×103
p ( HCl )× 3 × p
总
n
总
间内产物Ⅰ的占比较大,所以选择相对较短的反应时间,及时进行产品分离可获得高产率的产物Ⅰ,D正
确。
二、非选择题(本题共 4小题,共 58分。)
15.(每空2分,共14分)
(1)平衡气压,便于液体顺利滴下
(2)C SO +Cl +2H O=SO2− +2Cl− +4H+
2 2 2 4
8×10−3
(3)
ab
(4)SO +2H S=3S↓+2H O
2 2 2
(5)①BaSO ②该实验条件下,O 氧化SO 的速率快于NO−氧化SO 的速率
4 2 2 3 2
【解析】(3)5SO +2MnO− +2H O=2Mn2+ +5SO2− +4H+,当管道中注入空气的流量为a L/min,
2 4 2 4
通入b min空气时,酸性KMnO 溶液恰好褪色,则该空气中二氧化硫的含量为
4
5
0.05L×0.001mol/L× ×64g/mol
8×10−3
2 = g/L。
a L/min×bmin ab
16.(除特殊说明外,每空2分,共14分)
△
(1)2
2CuCO
3
⋅Cu ( OH )
2
+3C 6Cu+7CO
2
↑+2H
2
O
(2)有少量晶膜出现(有少量晶体出现)加热时,需要用玻璃棒进行搅拌(1分)过滤时,需要用玻璃棒
引流(1分)
(3)b
(4)
Cu ( NH
3
)
4
SO
4
⋅H
2
O
(5)ABC
学科网(北京)股份有限公司(6)8
【解析】(3)氨气极易溶于水,故在处理尾气时要注意防倒吸,a装置广口瓶内的进气管过长,容易倒
吸,c装置中的倒置漏斗、d装置中的多孔球泡都会发生倒吸,只有b装置不会发生倒吸。
(6)用惰性电极电解硫酸铜溶液时,首先阴极Cu2+得电子发生还原反应析出Cu,Cu2+消耗完后,H O
2
得电子发生还原反应析出H ;而阳极始终是H O失电子发生氧化反应析出O ,综合考虑,第一阶段相当
2 2 2
于电解CuO,第二阶段相当于电解H O。又由于向电解池中加入2molCu ( OH ) 固体时恰好恢复为电解前
2
2
的浓度,结合“析出什么加什么”的原则可知,该过程中共电解了2 mol CuO和2molH O,据以上分析
2
1 1
进行计算;由于CuO∼ O ∼2e−,H O∼ O ∼2e−,则转移电子的物质的量为
2 2 2 2 2
2mol×( 2+2 )=8mol。
17.(每空2分,共14分)
(1)CH (g)+CO (g)=2CO(g)+2H (g) ∆H =+247.4kJ⋅mol−1 4
4 2 2
(2)①0.025 ②AC
(3)<
k ×k
(4)①< ② 1 3
k ×k
2 4
【解析】(1)CH 与CO 转化为合成气(H 和CO)的化学反应为
4 2 2
CH (g)+CO (g)=2CO(g)+2H (g)。由能量-反应进程曲线得热化学方程式:
4 2 2
CH (g)+H O(g)=CO(g)+3H (g) ∆H =+206.2kJ⋅mol−1(i)
4 2 2
CO (g)+4H (g)=CH (g)+2H O(g) ∆H =−165kJ⋅mol−1(ii)
2 2 4 2
根据盖斯定律,(i)×2+(ii)得热化学方程式:CH (g)+CO (g)=2CO(g)+2H (g)
4 2 2
∆H =+247.4kJ⋅mol−1。
(4)①由图像可知,反应ii活化能低,反应速率:反应i <反应ii;
k
c2(
H
)
②反应达到平衡状态时,正、逆反应速率相等,反应①中k ⋅c ( CH )=k ⋅c2( H ),故 1 = 2 ,
1 4 2 2 k c ( CH )
2 4
k
c2(
CO
)
反应②中k ⋅c ( CO )=k ⋅c2( CO ),故 3 = ,一定温度下,反应
3 2 4 k c ( CO )
4 2
c2( CO )⋅c2( H ) k ×k
CH (g)+CO (g) 2CO(g)+2H (g)的平衡常数K = 2 = 1 3 。
4 2 2 c ( CH )⋅c ( CO ) k ×k
4 2 2 4
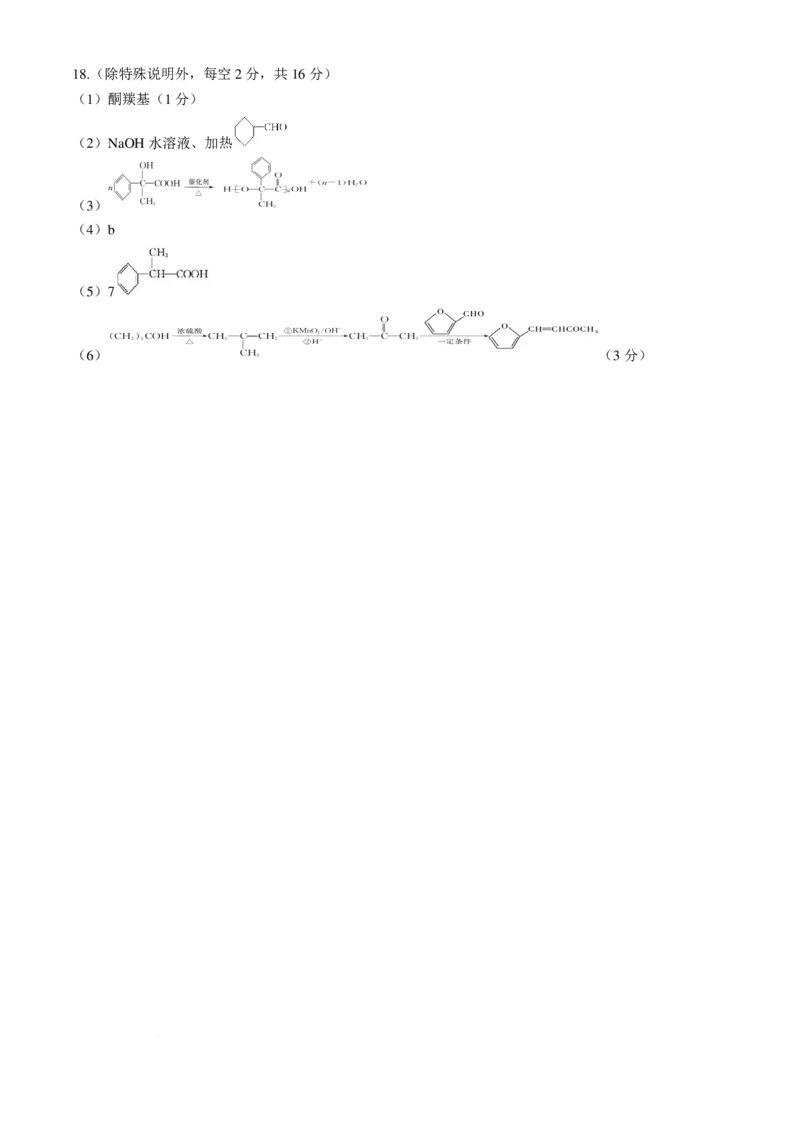
学科网(北京)股份有限公司18.(除特殊说明外,每空2分,共16分)
(1)酮羰基(1分)
(2)NaOH水溶液、加热
(3)
(4)b
(5)7
(6) (3分)
学科网(北京)股份有限公司