文档内容
玉溪一中 2024-2025 学年下学期高二年级开学考
化学学科试卷
总分:100分 考试时间:75分钟
可能用到的相对原子质量:H-1 Li-7 C-12 N-14 O-16
第I卷 选择题
一、选择题(每题3分,共42分,在每小题给出的四个选项中,只有一个选项是正确的。)
1.春节将至,年味渐浓。关于这些“年味”叙述错误的是( )
A.美丽的烟花是可见光,属于吸收光谱
B.“扫尘”中会用到去油污的碳酸钠溶液,涉及到盐类的水解
C.古代“压岁钱”指的是铜制钱币,属于一种合金材料
D.“年夜饭”中用到的食盐是一种混合物,主要成分为氯化钠
2.下列化学用语表示正确的是( )
A. 电离: B. 的电子式:
C. 分子的球棍模型: D. 的形成过
3.下列有关原子结构和元素性质的说法正确的是( )
A. 能级最多能容纳10个电子
B.基态原子轨道排布式: 违背了洪特规则
C.最外层电子数为2的元素均分布在周期表的 区
D.共价化合物中,电负性大的成键元素表现为正价
4.下列反应的方程式错误的是( )
A.工业废水中的 用 去除:
B. 加入水中:
C. 溶液中加入稀硫酸:
D.用绿矾 将酸性工业废水中的 转化为Cr3+:
5.设 为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,5.6L14CH 含有中子的数目为2N
4 A
B.标准状况下, 氯气与铁粉反应转移电子数目为
试卷第1页,共1页C. 溶液中加入足量稀硫酸,生成的 数目为
D. 的 溶液中 的数目为
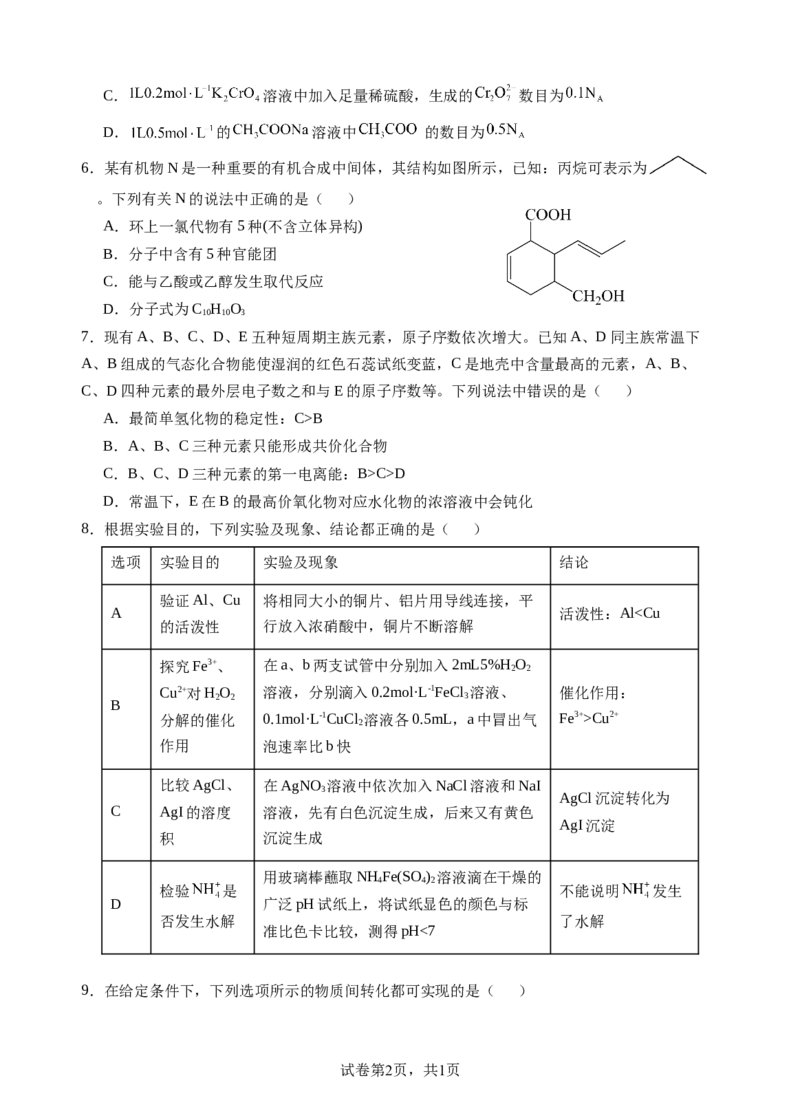
6.某有机物N是一种重要的有机合成中间体,其结构如图所示,已知:丙烷可表示为
。下列有关N的说法中正确的是( )
A.环上一氯代物有5种(不含立体异构)
B.分子中含有5种官能团
C.能与乙酸或乙醇发生取代反应
D.分子式为C H O
10 10 3
7.现有A、B、C、D、E五种短周期主族元素,原子序数依次增大。已知A、D同主族常温下
A、B组成的气态化合物能使湿润的红色石蕊试纸变蓝,C是地壳中含量最高的元素,A、B、
C、D四种元素的最外层电子数之和与E的原子序数等。下列说法中错误的是( )
A.最简单氢化物的稳定性:C>B
B.A、B、C三种元素只能形成共价化合物
C.B、C、D三种元素的第一电离能:B>C>D
D.常温下,E在B的最高价氧化物对应水化物的浓溶液中会钝化
8.根据实验目的,下列实验及现象、结论都正确的是( )
选项 实验目的 实验及现象 结论
验证Al、Cu 将相同大小的铜片、铝片用导线连接,平
A 活泼性:AlCu2+
2
作用 泡速率比b快
比较AgCl、 在AgNO 溶液中依次加入NaCl溶液和NaI
3
AgCl沉淀转化为
C AgI的溶度 溶液,先有白色沉淀生成,后来又有黄色
AgI沉淀
积 沉淀生成
用玻璃棒蘸取NH Fe(SO ) 溶液滴在干燥的
4 4 2
检验 是 不能说明 发生
D 广泛pH试纸上,将试纸显色的颜色与标
否发生水解 了水解
准比色卡比较,测得pH<7
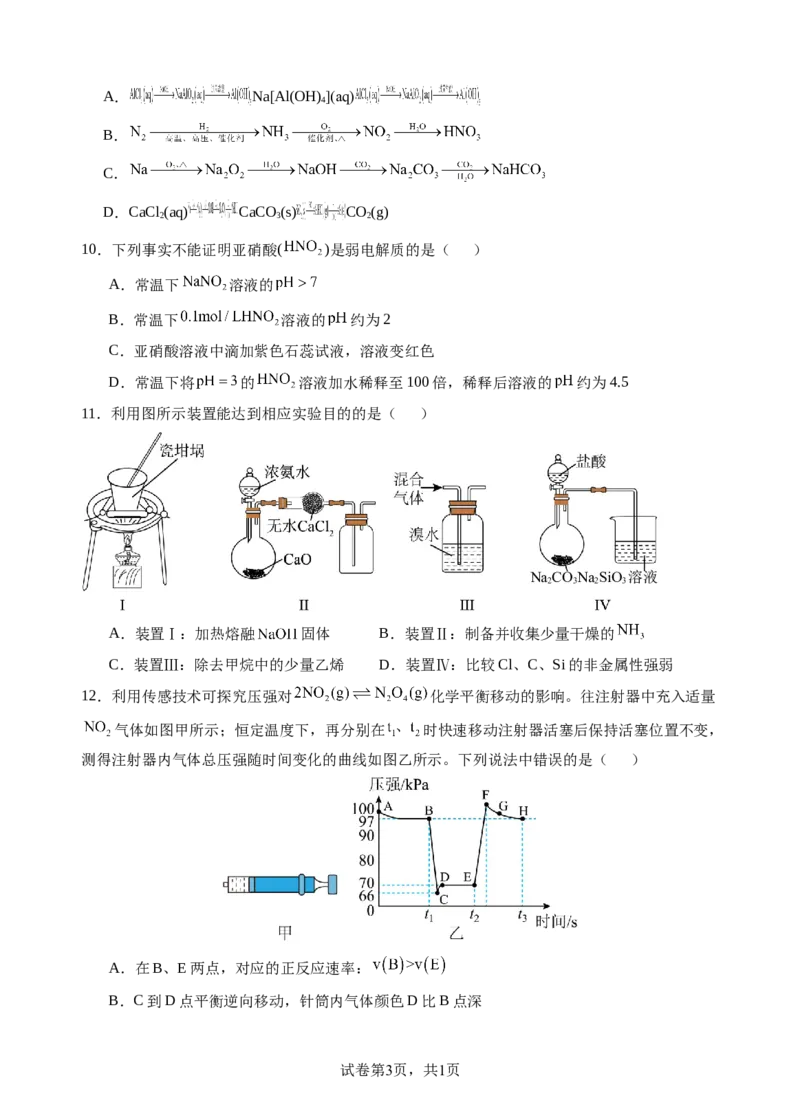
9.在给定条件下,下列选项所示的物质间转化都可实现的是( )
试卷第2页,共1页A. Na[Al(OH) ](aq)
4
B.
C.
D.CaCl (aq) CaCO (s) CO(g)
2 3 2
10.下列事实不能证明亚硝酸( )是弱电解质的是( )
A.常温下 溶液的
B.常温下 溶液的 约为2
C.亚硝酸溶液中滴加紫色石蕊试液,溶液变红色
D.常温下将 的 溶液加水稀释至100倍,稀释后溶液的 约为4.5
11.利用图所示装置能达到相应实验目的的是( )
NaCONaSiO 溶液
2 3 2 3
A.装置Ⅰ:加热熔融 固体 B.装置Ⅱ:制备并收集少量干燥的
C.装置Ⅲ:除去甲烷中的少量乙烯 D.装置Ⅳ:比较Cl、C、Si的非金属性强弱
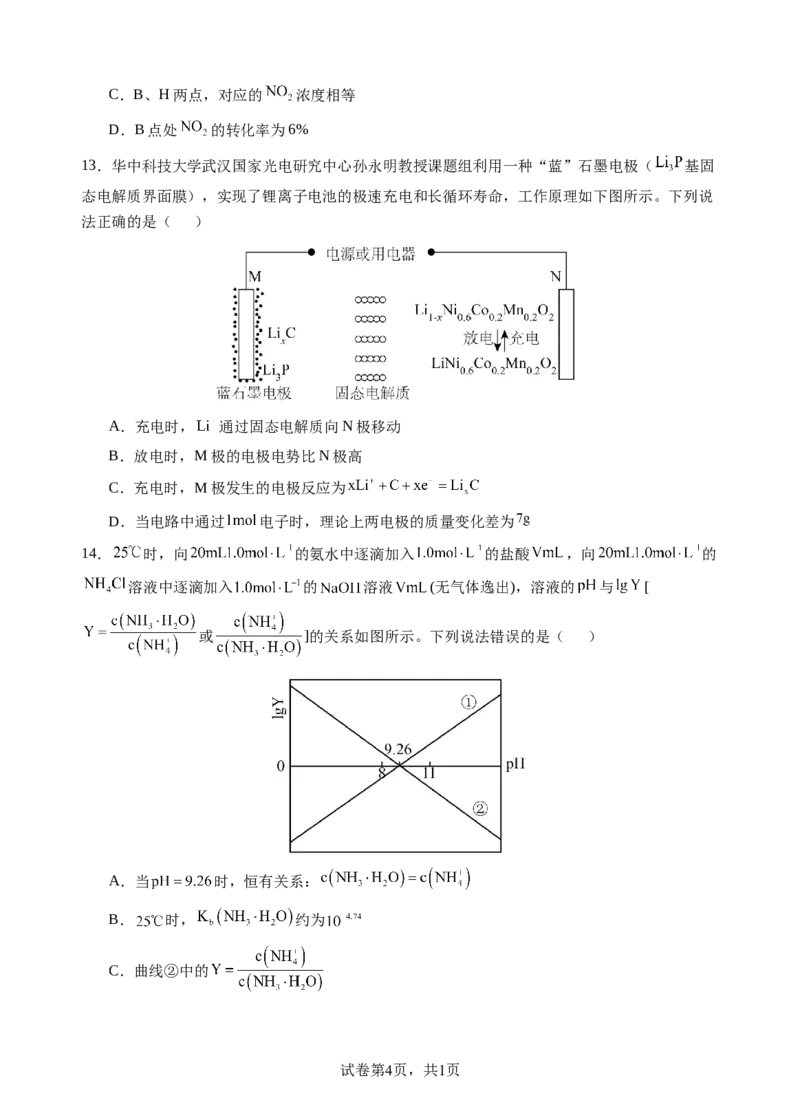
12.利用传感技术可探究压强对 化学平衡移动的影响。往注射器中充入适量
气体如图甲所示;恒定温度下,再分别在 时快速移动注射器活塞后保持活塞位置不变,
测得注射器内气体总压强随时间变化的曲线如图乙所示。下列说法中错误的是( )
A.在B、E两点,对应的正反应速率:
B.C到D点平衡逆向移动,针筒内气体颜色D比B点深
试卷第3页,共1页C.B、H两点,对应的 浓度相等
D.B点处 的转化率为6%
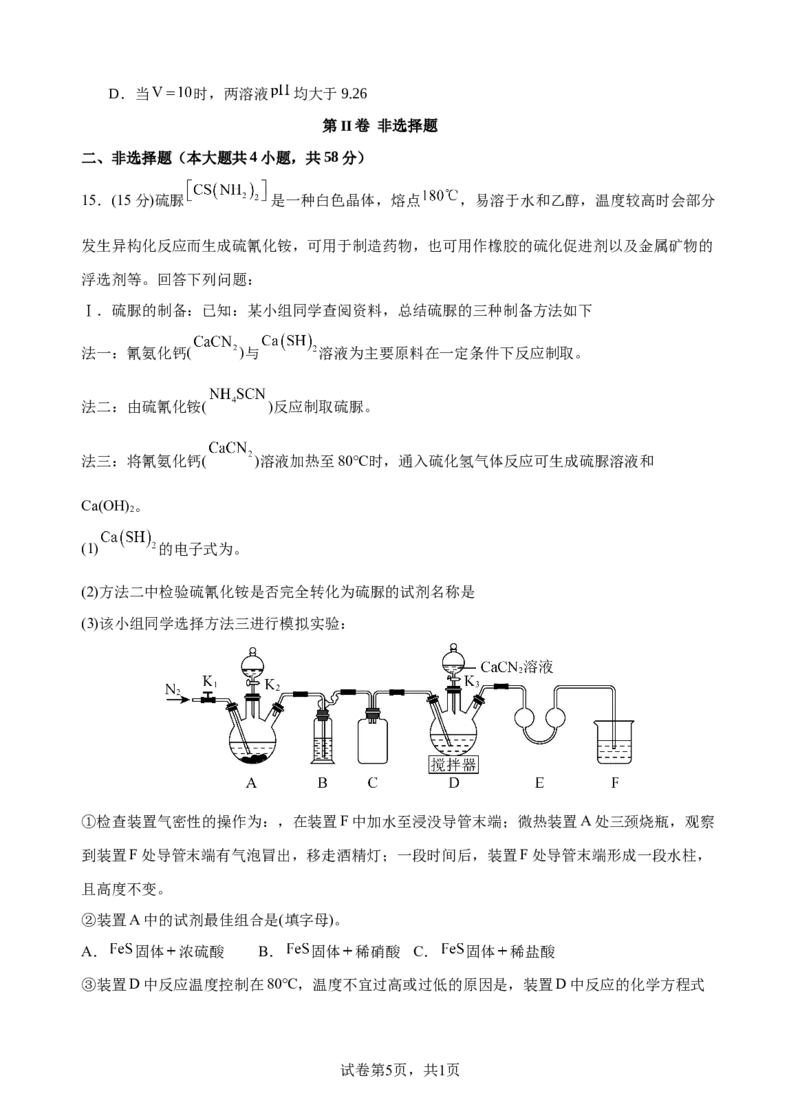
13.华中科技大学武汉国家光电研究中心孙永明教授课题组利用一种“蓝”石墨电极( 基固
态电解质界面膜),实现了锂离子电池的极速充电和长循环寿命,工作原理如下图所示。下列说
法正确的是( )
A.充电时, 通过固态电解质向N极移动
B.放电时,M极的电极电势比N极高
C.充电时,M极发生的电极反应为
D.当电路中通过 电子时,理论上两电极的质量变化差为
14. 时,向 的氨水中逐滴加入 的盐酸 ,向 的
溶液中逐滴加入 的 溶液 (无气体逸出),溶液的 与 [
或 ]的关系如图所示。下列说法错误的是( )
A.当 时,恒有关系:
B. 时, 约为
C.曲线②中的
试卷第4页,共1页D.当 时,两溶液 均大于9.26
第II卷 非选择题
二、非选择题(本大题共4小题,共58分)
15.(15分)硫脲 是一种白色晶体,熔点 ,易溶于水和乙醇,温度较高时会部分
发生异构化反应而生成硫氰化铵,可用于制造药物,也可用作橡胶的硫化促进剂以及金属矿物的
浮选剂等。回答下列问题:
Ⅰ.硫脲的制备:已知:某小组同学查阅资料,总结硫脲的三种制备方法如下
法一:氰氨化钙( )与 溶液为主要原料在一定条件下反应制取。
法二:由硫氰化铵( )反应制取硫脲。
法三:将氰氨化钙( )溶液加热至80℃时,通入硫化氢气体反应可生成硫脲溶液和
Ca(OH)。
2
(1) 的电子式为。
(2)方法二中检验硫氰化铵是否完全转化为硫脲的试剂名称是
(3)该小组同学选择方法三进行模拟实验:
①检查装置气密性的操作为:,在装置F中加水至浸没导管末端;微热装置A处三颈烧瓶,观察
到装置F处导管末端有气泡冒出,移走酒精灯;一段时间后,装置F处导管末端形成一段水柱,
且高度不变。
②装置A中的试剂最佳组合是(填字母)。
A. 固体 浓硫酸 B. 固体 稀硝酸 C. 固体 稀盐酸
③装置D中反应温度控制在80℃,温度不宜过高或过低的原因是,装置D中反应的化学方程式
试卷第5页,共1页为。
Ⅱ.硫脲的分离及产品含量的测定:反应后将装置D中的液体过滤,将滤液减压蒸发浓缩,冷却结
晶,过滤,烘干即可得到产品。
(4) 称取mg产品,加水溶解配成100ml溶液,量取 于锥形瓶中,滴加一定量的 酸
化,用 标准溶液滴定,初始读数为 ,当滴入最后半滴溶液时,溶液颜色,
且半分钟无变化时达到滴定终点,标准溶液读数为 。已知:
。(硫脲的相对分子质量
为76),样品中硫脲的质量分数为%(用含m、c、 、 的式子表示)。某同学在配制待测液的过
程中,忘记将洗涤液转移到容量瓶中,请分析该同学最终计算所得的结果会(填偏高、偏低或无影
响)。
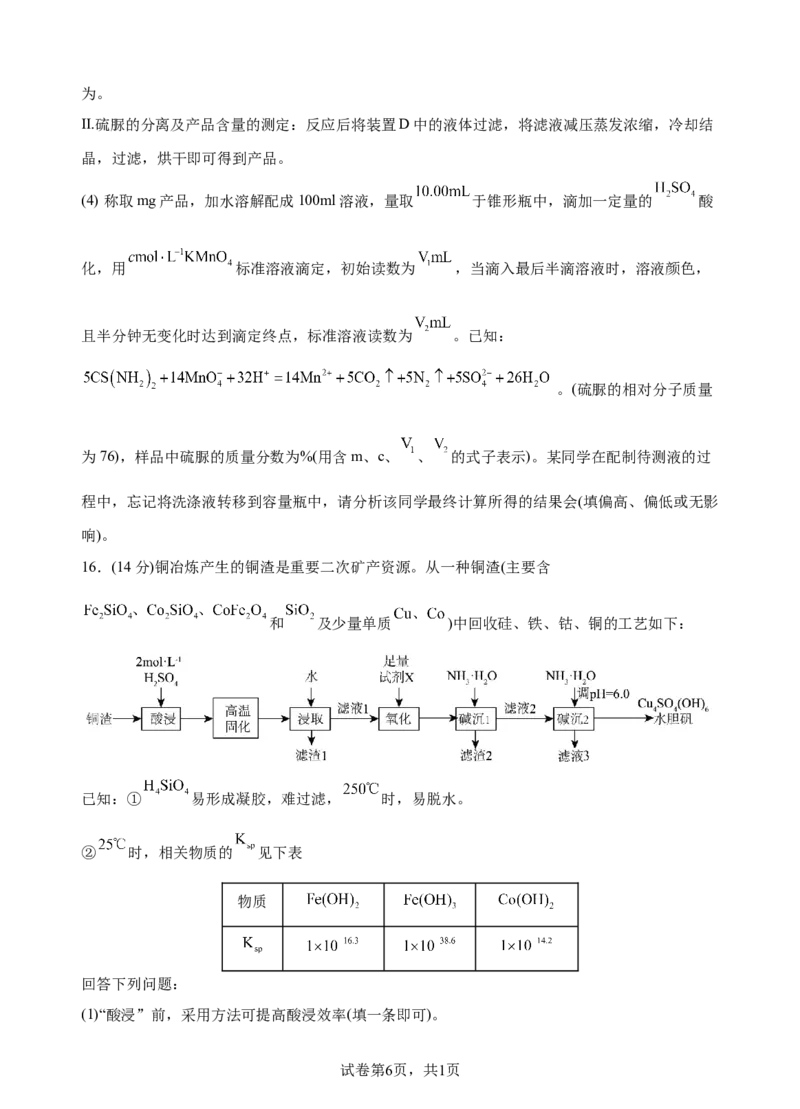
16.(14分)铜冶炼产生的铜渣是重要二次矿产资源。从一种铜渣(主要含
和 及少量单质 )中回收硅、铁、钴、铜的工艺如下:
已知:① 易形成凝胶,难过滤, 时,易脱水。
② 时,相关物质的 见下表
物质
回答下列问题:
(1)“酸浸”前,采用方法可提高酸浸效率(填一条即可)。
试卷第6页,共1页(2)“酸浸”时,有空气参与反应, 溶解的化学方程式为。从环保角度考虑,不使用 酸浸
的原因可能是(填一条即可)。
(3)“高温固化”的作用是。
(4)“氧化”中可选用的最佳试剂X为(填标号)。
A. B. C.
(5) “碱沉1”中, 时, 沉淀完全 。
(6)“滤液3”中可回收的盐主要有 和。
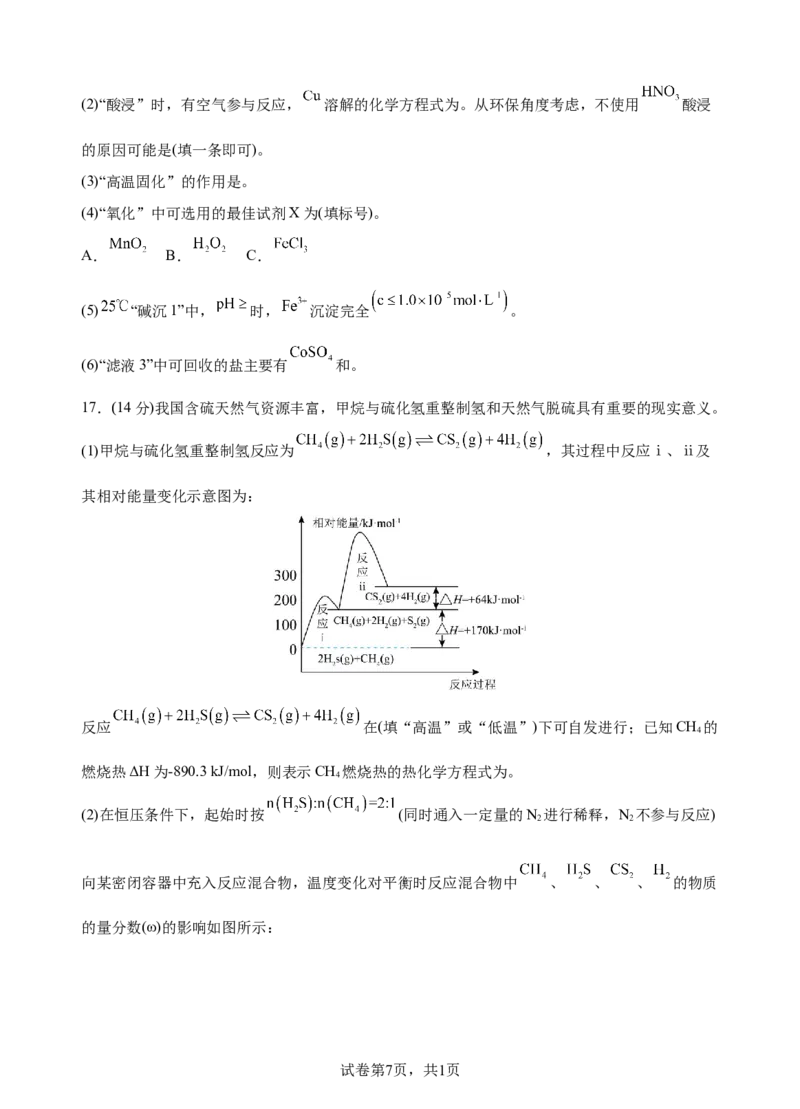
17.(14分)我国含硫天然气资源丰富,甲烷与硫化氢重整制氢和天然气脱硫具有重要的现实意义。
(1)甲烷与硫化氢重整制氢反应为 ,其过程中反应ⅰ、ⅱ及
其相对能量变化示意图为:
反应 在(填“高温”或“低温”)下可自发进行;已知CH 的
4
燃烧热ΔH为-890.3 kJ/mol,则表示CH 燃烧热的热化学方程式为。
4
(2)在恒压条件下,起始时按 (同时通入一定量的N 进行稀释,N 不参与反应)
2 2
向某密闭容器中充入反应混合物,温度变化对平衡时反应混合物中 、 、 、 的物质
的量分数(ω)的影响如图所示:
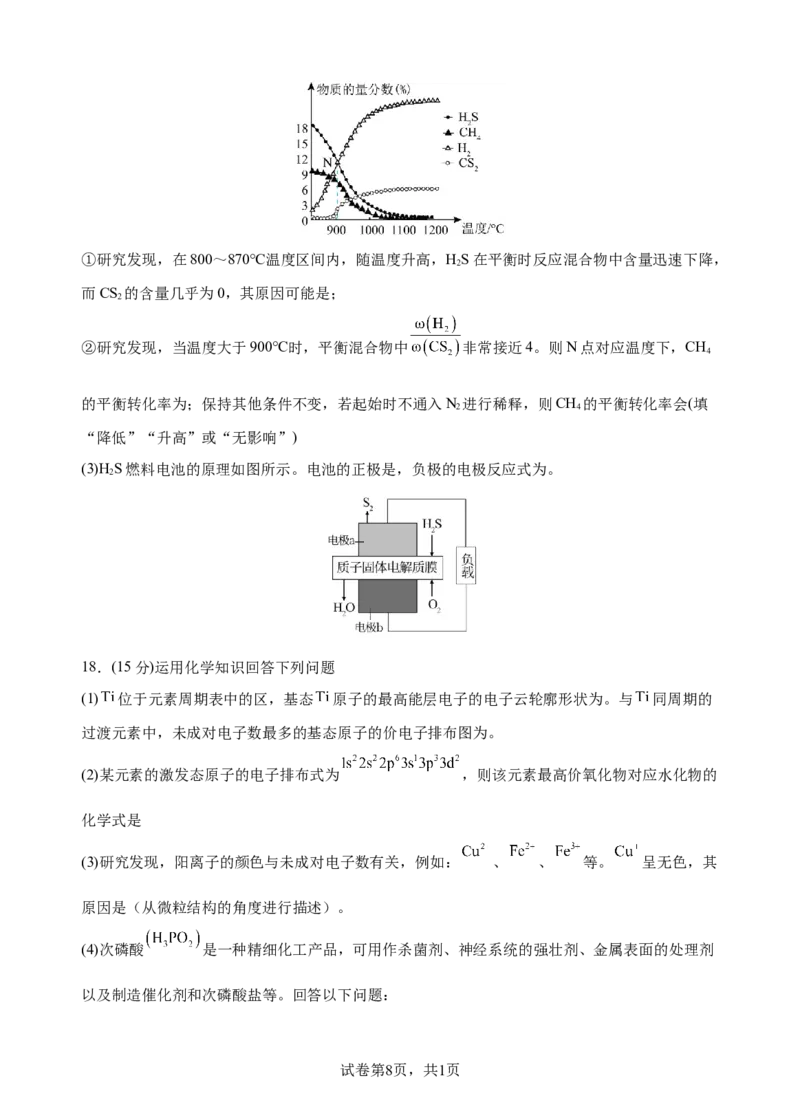
试卷第7页,共1页①研究发现,在800~870℃温度区间内,随温度升高,HS在平衡时反应混合物中含量迅速下降,
2
而CS 的含量几乎为0,其原因可能是;
2
②研究发现,当温度大于900℃时,平衡混合物中 非常接近4。则N点对应温度下,CH
4
的平衡转化率为;保持其他条件不变,若起始时不通入N 进行稀释,则CH 的平衡转化率会(填
2 4
“降低”“升高”或“无影响”)
(3)H S燃料电池的原理如图所示。电池的正极是,负极的电极反应式为。
2
18.(15分)运用化学知识回答下列问题
(1) 位于元素周期表中的区,基态 原子的最高能层电子的电子云轮廓形状为。与 同周期的
过渡元素中,未成对电子数最多的基态原子的价电子排布图为。
(2)某元素的激发态原子的电子排布式为 ,则该元素最高价氧化物对应水化物的
化学式是
(3)研究发现,阳离子的颜色与未成对电子数有关,例如: 、 、 等。 呈无色,其
原因是(从微粒结构的角度进行描述)。
(4)次磷酸 是一种精细化工产品,可用作杀菌剂、神经系统的强壮剂、金属表面的处理剂
以及制造催化剂和次磷酸盐等。回答以下问题:
试卷第8页,共1页①次磷酸 在加热到 时,易发生歧化反应,补全下列化学方程式:
。若0.3molHPO 反应,转移 电子。
3 2
②已知次磷酸是一元弱酸,则 溶液与足量 溶液反应的离子方程式为:。
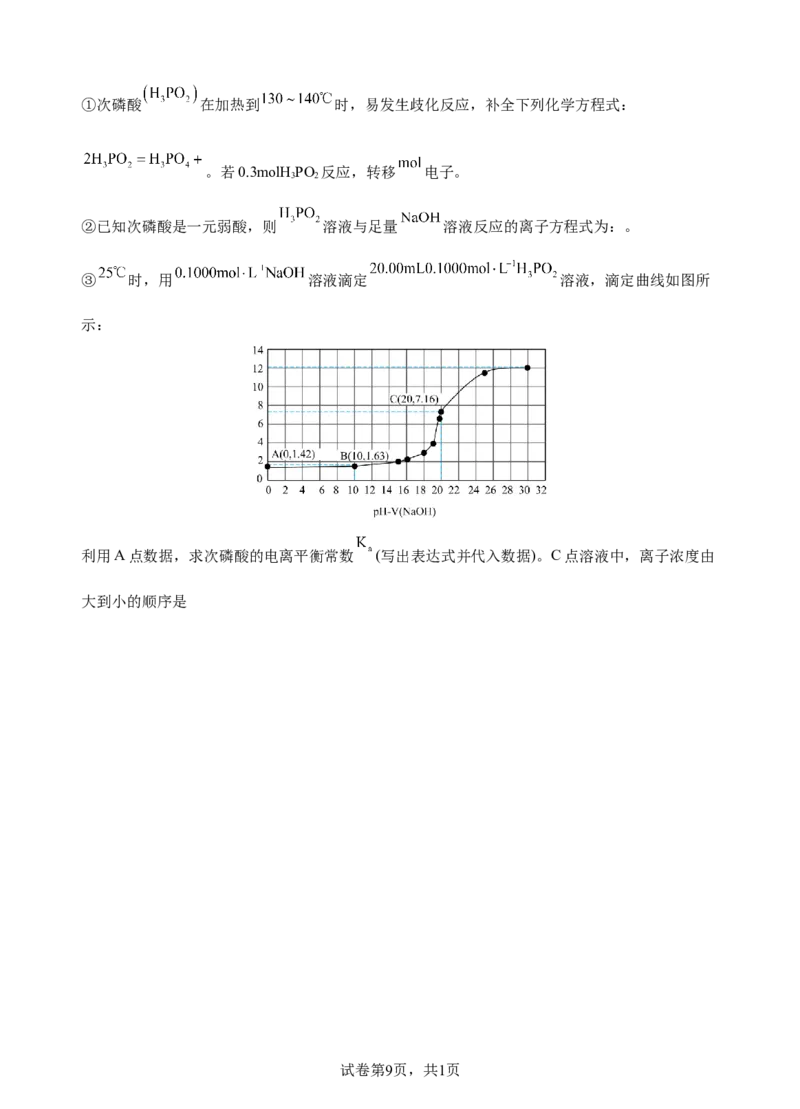
③ 时,用 溶液滴定 溶液,滴定曲线如图所
示:
利用A点数据,求次磷酸的电离平衡常数 (写出表达式并代入数据)。C点溶液中,离子浓度由
大到小的顺序是
试卷第9页,共1页参考答案:
1A 2B 3B 4A 5A 6C 7B 8D 9C 10C 11C 12B 13C 14D
15 (15分)(除标注外,其余每空2分)
(1) (1分)(2)氯化铁溶液或硫酸铁溶液(1分)(3)①关闭K、K、K、(1分)②C③
1 2 3
温度过高,硫脲会部分发生异构化反应而生成硫氰化铵;温度过低,反应速率缓慢
190c(V 2 -V 1)
(4) 由无色变为浅紫色或浅红色或(紫)红色 偏低
7m
16(14分)(每空2分)
(1) 粉碎铜渣等(合理均给分)
(2) 2Cu+O +2H SO =2CuSO+2H O 硝酸与铜反应会生成氮氧化物,氮氧化物会污染空气
2 2 4 4 2
(3)使 凝胶脱水生成SiO,便于除去(4)B(5)2.8(6)(NH )SO
2 4 2 4
17(14分)(每空2分)
(1) 高温 CH(g)+2O(g)=CO (g)+2HO(l)
4 2 2 2
(2) ①反应ⅱ的活化能比反应ⅰ大,在较低温度下,反应ⅱ未发生或其他合理答案
② 或33.3% 降低
(3) b 2H S-4e-=4H++S
2 2
18(15分)(除标注外,其余每空2分)
(1) (1分) 球形(1分) (1分)
(2) (1分)
(3) 的核外电子排布为 ,没有未成对电子(2分)
(4)① (1分) 0.6 ②
答案第1页,共2页③
答案第2页,共2页