文档内容
河南省信阳高级中学北湖校区
2024-2025 学年高二上期开学测试
化学试题
命题人:龚珂珂 审题人:周娅岚 刘胜兰
一、单选题
1.化学和生活、科技、社会发展息息相关,下列说法正确的是
A.大量开发可燃冰作为能源有利于实现碳达峰、碳中和
B.富勒烯是一系列笼状烃分子的总称,其中的足球烯是富勒烯的代表物
C.在规定的范围内合理使用食品添加剂,对人体健康不会产生不良影响
D.油脂在人体中通过酶的催化可以发生分解反应,生成高级脂肪酸和甘油
2.N 为阿伏加德罗常数的值。下列说法正确的是
A
A.常温下,将足量的Zn投入50mL18mol/L浓硫酸中,转移的电子数为0.9N
A
B.12.8gCu和0.2mol S充分反应转移电子数为0.4N
A
C.1molFeCl 在沸水中充分反应能产生氢氧化铁胶体粒子数为N
3 A
D.2.0gND 中含有的质子数、中子数、电子数均为N
3 A
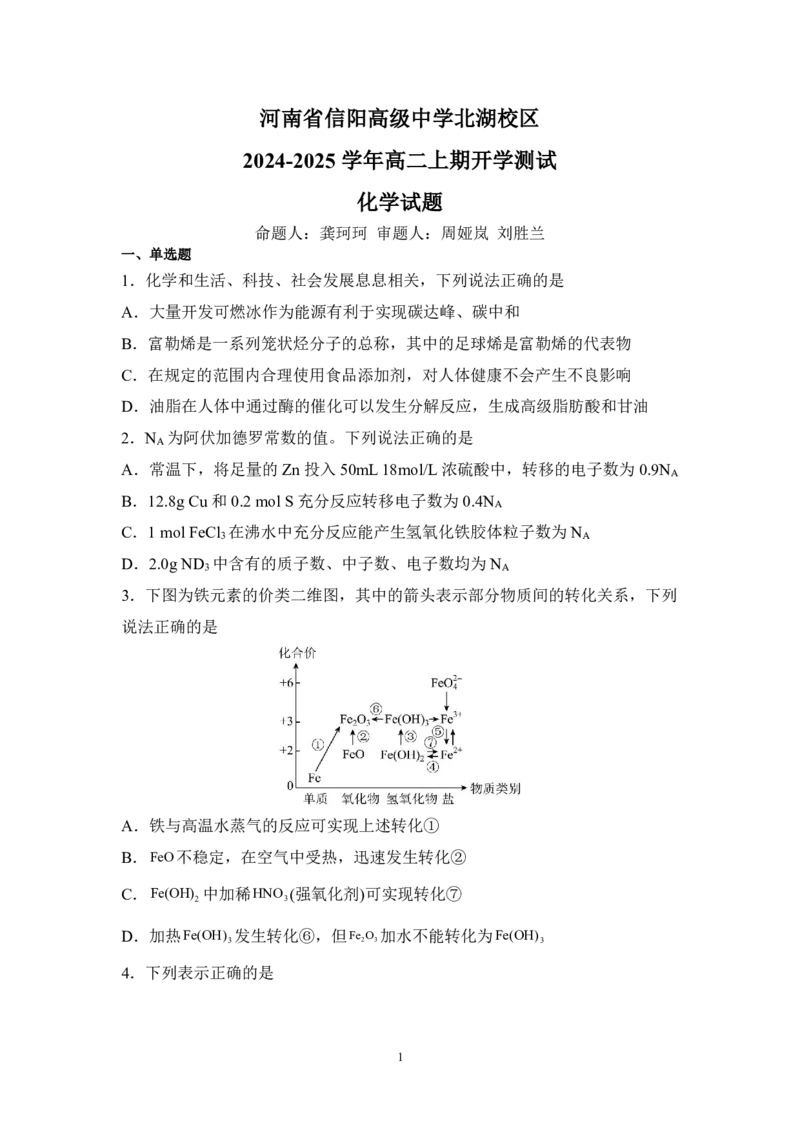
3.下图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系,下列
说法正确的是
A.铁与高温水蒸气的反应可实现上述转化①
B.FeO不稳定,在空气中受热,迅速发生转化②
C.Fe(OH) 中加稀HNO (强氧化剂)可实现转化⑦
2 3
D.加热Fe(OH) 发生转化⑥,但Fe O 加水不能转化为Fe(OH)
3 2 3 3
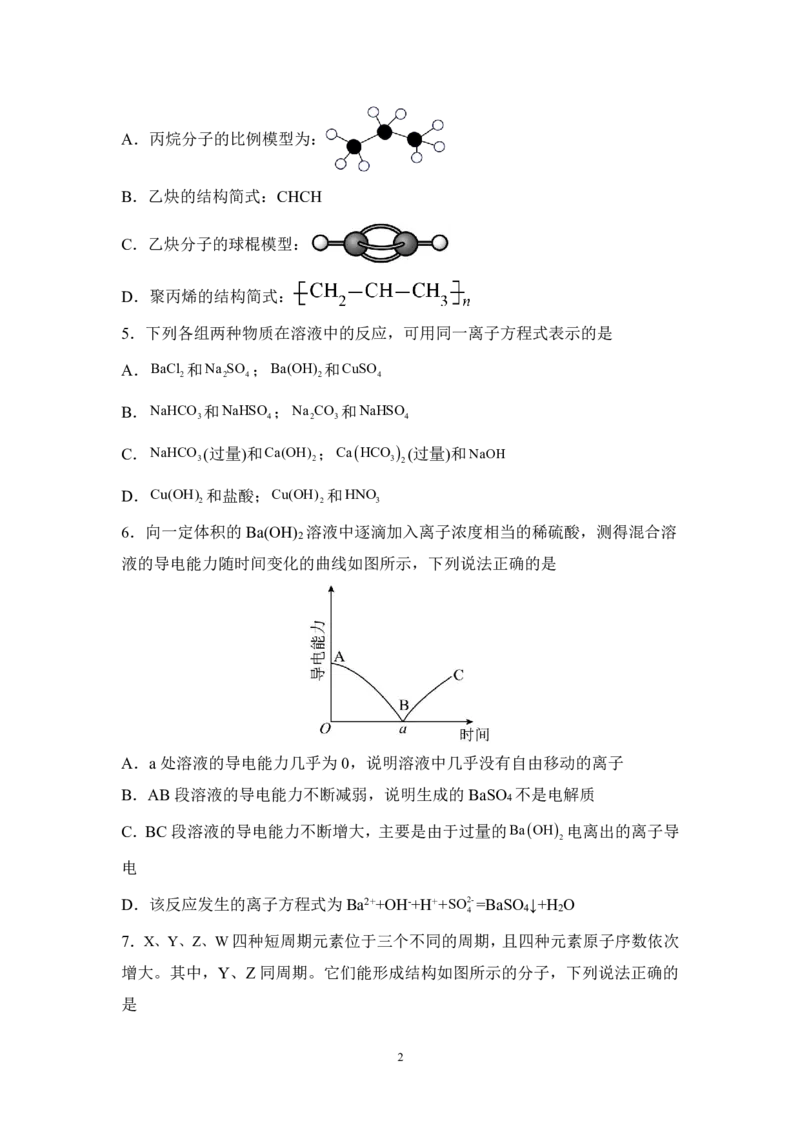
4.下列表示正确的是
1
学科网(北京)股份有限公司A.丙烷分子的比例模型为:
B.乙炔的结构简式:CHCH
C.乙炔分子的球棍模型:
D.聚丙烯的结构简式:
5.下列各组两种物质在溶液中的反应,可用同一离子方程式表示的是
A.BaCl 和Na SO ;Ba(OH) 和CuSO
2 2 4 2 4
B.NaHCO 和NaHSO ;Na CO 和NaHSO
3 4 2 3 4
C.NaHCO (过量)和Ca(OH) ;CaHCO (过量)和NaOH
3 2 3 2
D.Cu(OH) 和盐酸;Cu(OH) 和HNO
2 2 3
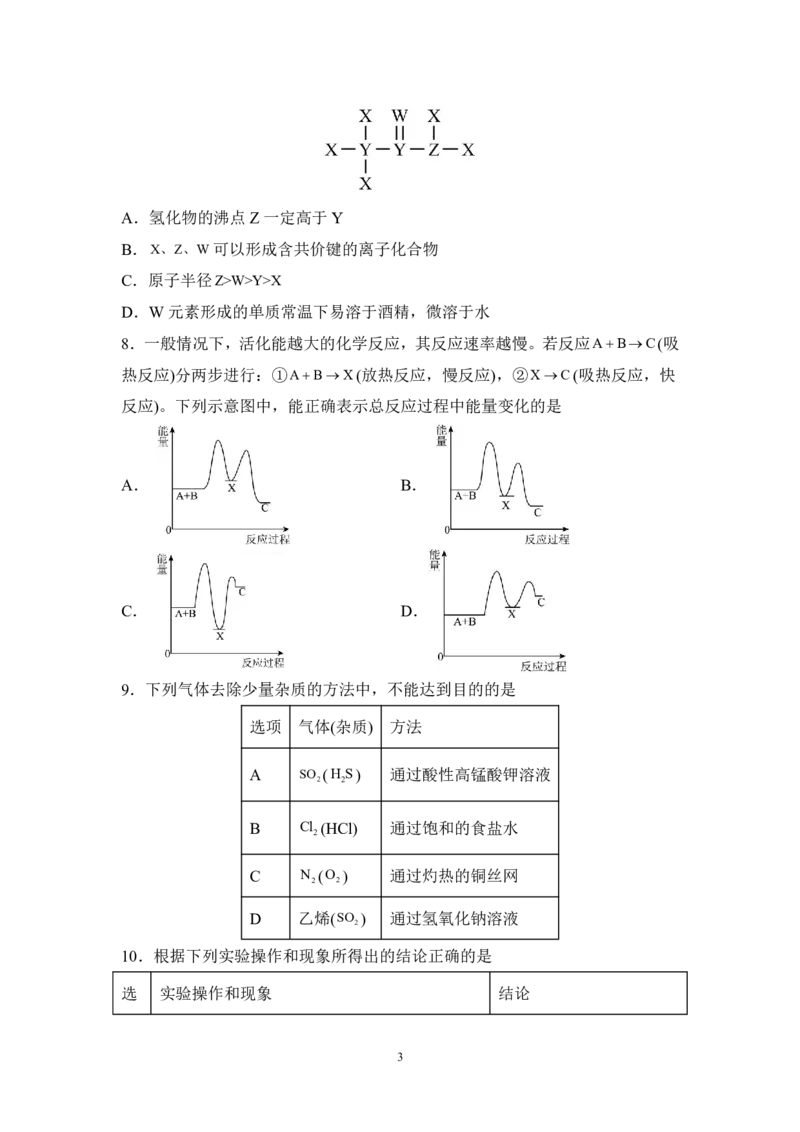
6.向一定体积的Ba(OH) 溶液中逐滴加入离子浓度相当的稀硫酸,测得混合溶
2
液的导电能力随时间变化的曲线如图所示,下列说法正确的是
A.a处溶液的导电能力几乎为0,说明溶液中几乎没有自由移动的离子
B.AB段溶液的导电能力不断减弱,说明生成的BaSO 不是电解质
4
C.BC 段溶液的导电能力不断增大,主要是由于过量的BaOH 电离出的离子导
2
电
D.该反应发生的离子方程式为Ba2++OH-+H++SO2-=BaSO ↓+H O
4 4 2
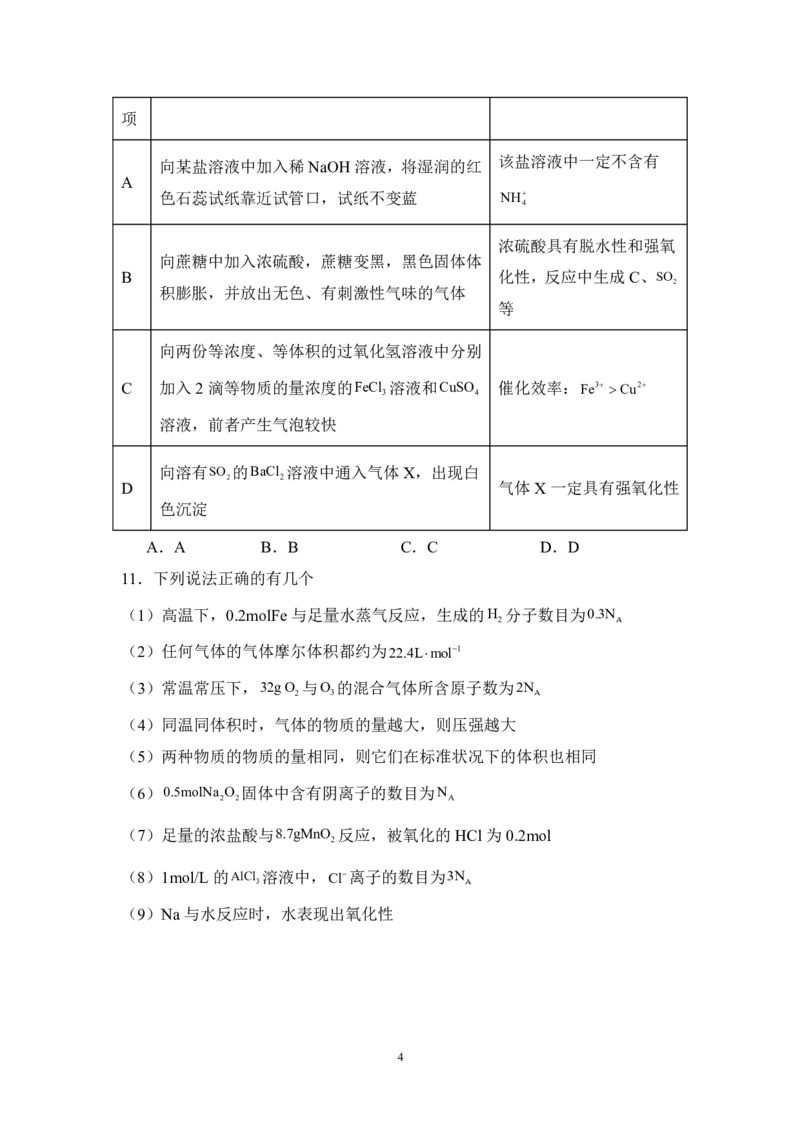
7.X、Y、Z、W四种短周期元素位于三个不同的周期,且四种元素原子序数依次
增大。其中,Y、Z同周期。它们能形成结构如图所示的分子,下列说法正确的
是
2
学科网(北京)股份有限公司A.氢化物的沸点Z一定高于Y
B.X、Z、W可以形成含共价键的离子化合物
C.原子半径Z>W>Y>X
D.W元素形成的单质常温下易溶于酒精,微溶于水
8.一般情况下,活化能越大的化学反应,其反应速率越慢。若反应ABC(吸
热反应)分两步进行:①ABX(放热反应,慢反应),②XC(吸热反应,快
反应)。下列示意图中,能正确表示总反应过程中能量变化的是
A. B.
C. D.
9.下列气体去除少量杂质的方法中,不能达到目的的是
选项 气体(杂质) 方法
A SO (H S) 通过酸性高锰酸钾溶液
2 2
B Cl (HCl) 通过饱和的食盐水
2
C N (O ) 通过灼热的铜丝网
2 2
D 乙烯(SO ) 通过氢氧化钠溶液
2
10.根据下列实验操作和现象所得出的结论正确的是
选 实验操作和现象 结论
3
学科网(北京)股份有限公司项
该盐溶液中一定不含有
向某盐溶液中加入稀NaOH 溶液,将湿润的红
A
色石蕊试纸靠近试管口,试纸不变蓝 NH
4
浓硫酸具有脱水性和强氧
向蔗糖中加入浓硫酸,蔗糖变黑,黑色固体体
B 化性,反应中生成 C、SO
2
积膨胀,并放出无色、有刺激性气味的气体
等
向两份等浓度、等体积的过氧化氢溶液中分别
C 加入2滴等物质的量浓度的FeCl 溶液和CuSO 催化效率: Fe3 Cu2
3 4
溶液,前者产生气泡较快
向溶有SO 的BaCl 溶液中通入气体X,出现白
2 2
D 气体X一定具有强氧化性
色沉淀
A.A B.B C.C D.D
11.下列说法正确的有几个
(1)高温下,0.2molFe与足量水蒸气反应,生成的H 分子数目为0.3N
2 A
(2)任何气体的气体摩尔体积都约为22.4Lmol1
(3)常温常压下,32gO 与O 的混合气体所含原子数为2N
2 3 A
(4)同温同体积时,气体的物质的量越大,则压强越大
(5)两种物质的物质的量相同,则它们在标准状况下的体积也相同
(6)0.5molNa O 固体中含有阴离子的数目为N
2 2 A
(7)足量的浓盐酸与8.7gMnO 反应,被氧化的HCl为0.2mol
2
(8)1mol/L的AlCl 溶液中,Cl离子的数目为3N
3 A
(9)Na与水反应时,水表现出氧化性
4
学科网(北京)股份有限公司12.某小组拟用酸性KMnO 溶液与H C O 溶液的反应来探究“条件对化学反应速
4 2 2 4
率的影响”(已知:2KMnO 5H C O 3H SO K SO 2MnSO 10CO 8H O ),
4 2 2 4 2 4 2 4 4 2 2
设计了如下实验方案并记录实验结果。
V(0.20
编 V(蒸馏 V(0.01 mol·L1酸性 mMnSO /
4
mol·L1 H C O 溶 T/℃
2 2 4
号 水)/mL KMnO 溶液)/mL
4 g
液)/mL
① 2.0 0 4.0 0 50
② 2.0 0 4.0 0 25
③ 1.5 a 4.0 0 25
④ 2.0 0 4.0 0.1 25
下列说法错误的是
A.实验①、②是探究温度对化学反应速率的影响
B.实验②、④是探究催化剂对化学反应速率的影响
C.若a为0.5,则实验①、③是探究浓度对化学反应速率的影响
D.实验②中出现反应速率先增大后减小的现象,反应速率减小可能是反应物浓
度降低造成的
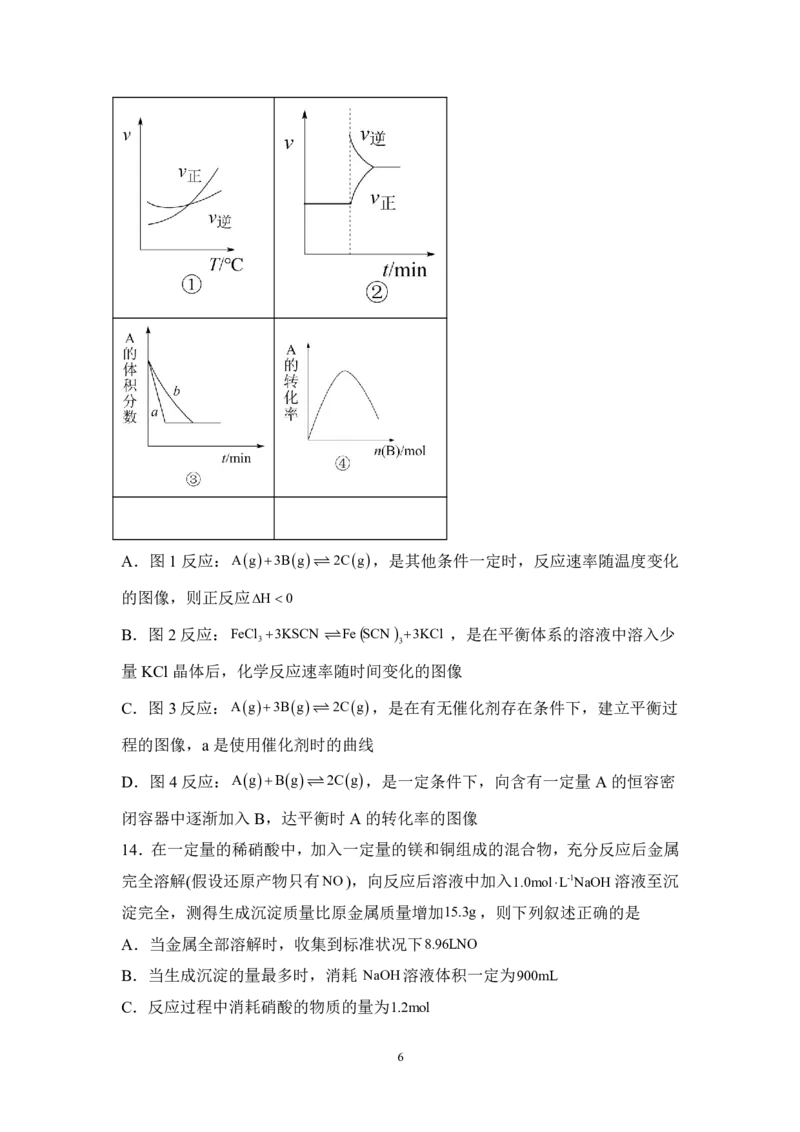
13.下列是有关外界条件对化学反应速率和化学平衡影响的图像,其中图像和实
验结论表达均正确的是
5
学科网(北京)股份有限公司A.图1反应:Ag3Bg 2Cg,是其他条件一定时,反应速率随温度变化
的图像,则正反应H0
B.图2反应:FeCl 3KSCN FeSCN 3KCl ,是在平衡体系的溶液中溶入少
3 3
量KCl 晶体后,化学反应速率随时间变化的图像
C.图3反应:Ag3Bg 2Cg,是在有无催化剂存在条件下,建立平衡过
程的图像,a是使用催化剂时的曲线
D.图4反应:AgBg 2Cg,是一定条件下,向含有一定量A的恒容密
闭容器中逐渐加入B,达平衡时A的转化率的图像
14.在一定量的稀硝酸中,加入一定量的镁和铜组成的混合物,充分反应后金属
完全溶解(假设还原产物只有NO),向反应后溶液中加入 1.0molL-1NaOH 溶液至沉
淀完全,测得生成沉淀质量比原金属质量增加15.3g,则下列叙述正确的是
A.当金属全部溶解时,收集到标准状况下8.96LNO
B.当生成沉淀的量最多时,消耗 NaOH溶液体积一定为900mL
C.反应过程中消耗硝酸的物质的量为1.2mol
6
学科网(北京)股份有限公司D.参加反应的金属总质量可能为10.8g
二、填空题
15.(14分,每空1分)I.高中化学中常见物质:①盐酸②二氧化碳③熔融氯化
钠④小苏打⑤铜⑥硫酸钡。
上述物质中能导电的是 ,属于电解质的是 。(填序号)
Ⅱ.现有各组物质:①O 和O ②CH CHCH 和CH CHCHCH ③ 和
2 3 2 3 2 2
④1H O和2H O⑤CH CH CH 和CH C(CH ) ⑥235A和质量数为238中子数
1 2 1 2 3 2 3 3 3 3 92
为146的原子 ⑦ 和 ⑧ 和
CH (CH ) CH 。属于同系物的是 ;属于同分异构体的是 ;属于同位素
3 2 3 3
的是 ;属于同素异形体的是 ;属于同种物质的是 。(填序号)
(2)在下列反应中,属于取代反应的是 (填序号,下同);属于加成反应的
是 ;属于氧化反应的是 。
①由乙烯制一氯乙烷;②乙烯使酸性高锰酸钾溶液褪色;③乙烷在光照下与氯气
反应;④乙烯使溴水褪色。
Ⅲ.有下列物质:①
CO2
、②
KCl
、③氮气、④
H2
、⑤
NH4Cl
、⑥
NaOH
、⑦
H2SO4
.试
用以上编号填空:
(1)只有非极性键的是 .
(2)既有离子键,又有极性键的是 .
(3)属于共价化合物的是 .
(4)用电子式表示下列物质的形成过程。
HCl: NaCl:
16.(12分,除标注外,每空2分)某工厂以硝酸为原料生产亚硝酸钠,其工艺
流程如图:
7
学科网(北京)股份有限公司已知:Na CO +NO +NO =2NaNO +CO
2 3 2 2 2
(1)“分解塔”中SO 从塔底进入,硝酸从塔顶喷淋,其目的是 。
2
(2)“分解塔”中的温度不宜过高,其原因是 。
(3)按一定计量比在“分解塔”中通SO 和喷入硝酸,若反应后生成的NO 与NO
2 2
物质的量之比恰好1∶1,则“分解塔”中发生反应的化学方程式为 。
(4)为提高氮氧化物的转化率,可向“尾气”中通入一定量的 气体,再通
入“吸收塔”中,实现循环吸收。
(5)NaNO 可将正常血红蛋白中的铁元素由+2 价变为+3 价,此时血红蛋白就失去
2
了携氧能力,美蓝是亚硝酸盐中毒的有效解毒剂,解毒剂美蓝体现 性
(填“氧化”或“还原”)。
(6)用NH 催化还原NO 还可以消除氮氧化物的污染。
3 x
①NH 电子式为: 。
3
②已知:①4NH (g)+3O (g)=2N (g)+6H O(g) ΔH =a kJ·mol-1;
3 2 2 2 1
②N (g)+O (g)=2NO(g) ΔH =b kJ·mol-1
2 2 2
则NH 还原NO 至N ,则该反应的热化学方程式为: 。
3 2
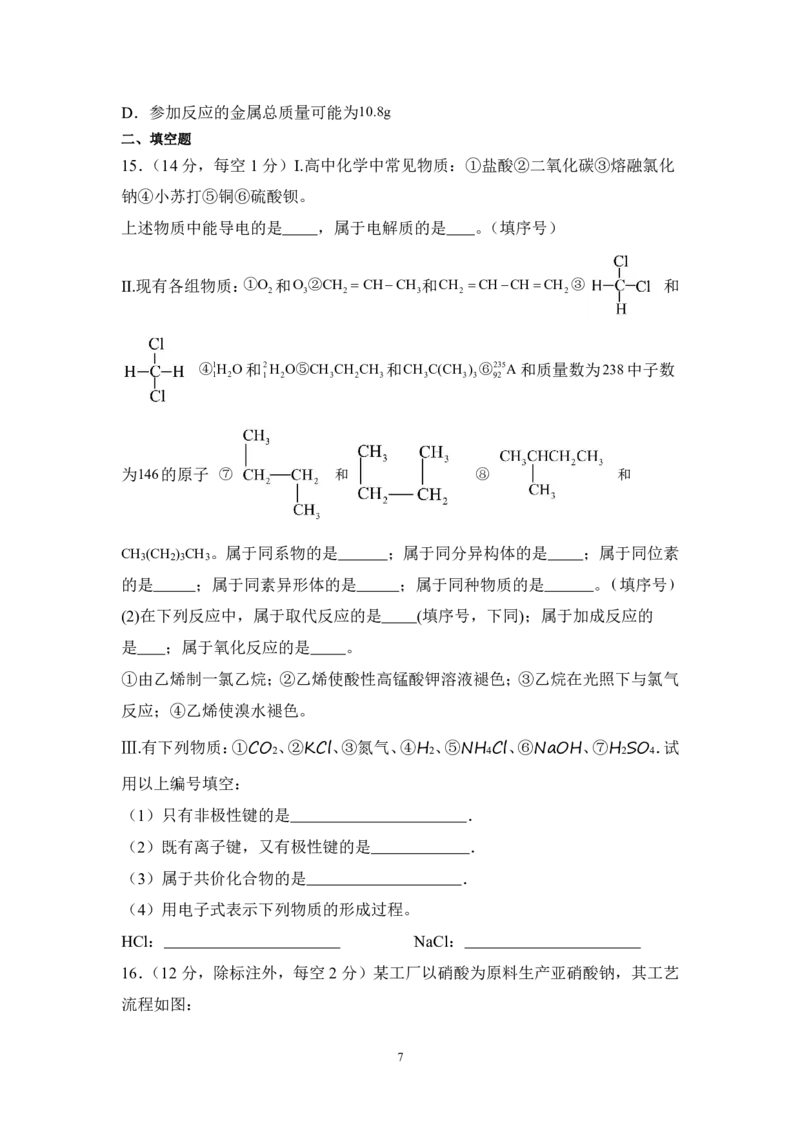
17.(16分,除标注外,每空2分)I. 某同学设计了如图所示装置(夹持装置已
省略)进行乙醇的催化氧化实验。先按图示安装好实验装置,关闭活塞a、b、c,
在铜丝的中间部分加热片刻,然后打开活塞a、b、c,通过控制活塞a和b,有
节
.
奏 .(间
.
歇
.
性 .)地通入气体,已知:乙醛可被氧化为乙酸,乙醛的沸点:20.8℃,
乙酸的沸点:117.9℃。
8
学科网(北京)股份有限公司回答下列问题:
(1)乙醇在铜催化作用下发生反应的化学方程式为 。
(2)硬质玻璃管E中可观察到 现象,乙醇催化氧化产物与足量新制氢氧
化铜悬浊液混合后加热,现象为 。
(3)装置B 的作用是 ,装置C 中水浴的作用是 。
Ⅱ. 乙酸乙酯是重要的有机合成中间体,广泛应用于化学工业。实验室利用如图
的装置制备乙酸乙酯。
(4)与教材采用的实验装置不同,此装置中采用了球形干燥管,其作用是: 。
(每空1分)
(5)长玻璃导管的作用为: ,(1分)反应中浓硫酸的作用 ;(1分)
试管②中饱和Na CO 溶液的作用是 ;反应前加入三种药品(①乙醇②乙酸
2 3
③98%浓硫酸)的先后顺序是 (填序号)。(1分)
(6)请写出用CH CH 18OH 制备乙酸乙酯的化学方程式: ,反应类型
3 2
为 。
(7)若现有乙酸90g,乙醇138g发生酯化反应得到80g乙酸乙酯,试计算该反应
的产率为 (用百分数表示,保留一位小数)。
18.(16分,除标注外,每空2分)研究氮的氧化物的性质对环境保护有重要意
义。回答下列问题:
9
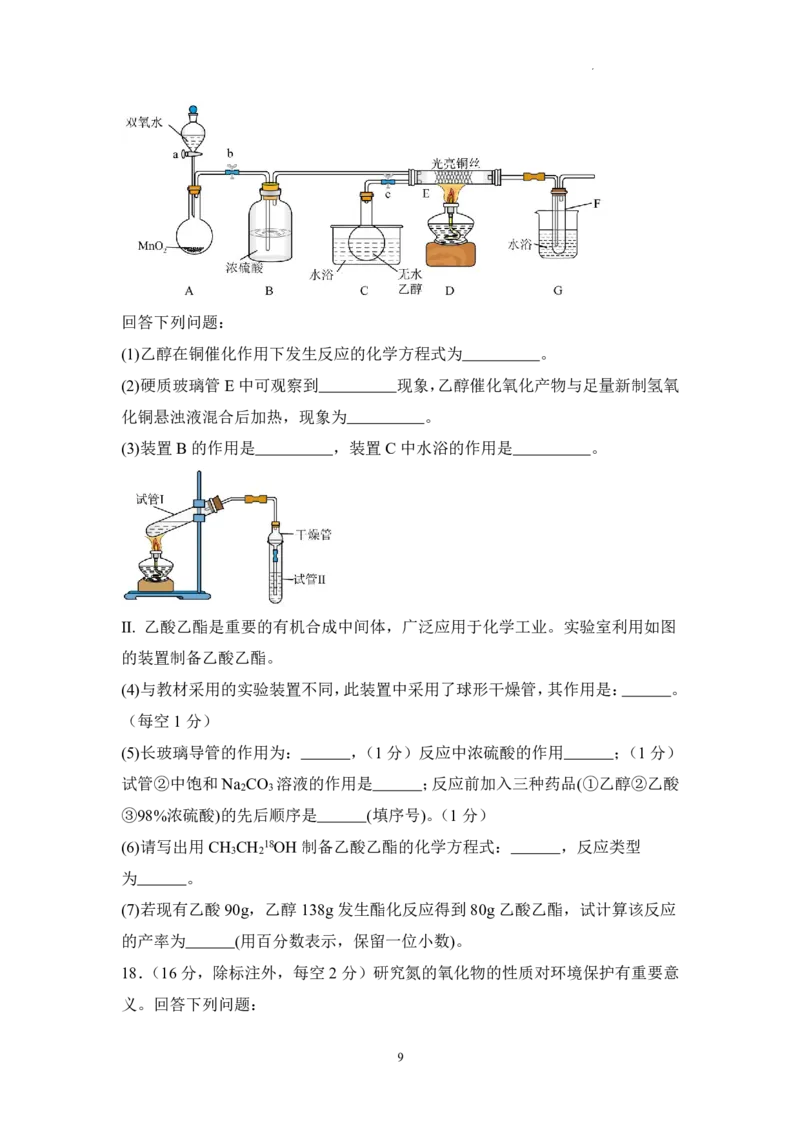
学科网(北京)股份有限公司(1)用NaClO 溶液吸收硝酸尾气,可提高尾气中NO的去除率。在酸性溶液中,
HClO氧化NO生成Cl和NO的离子方程式为 。
3
(2)(每空1分)如图为1molN (g)和1molO (g)充分反应生成2molNO(g)的能量变化
2 2
图。若断裂1molO (g)分子中的化学键,需要 能量。该反应中反应物所
2
具有的总能量 (填“高于”“低于”或“等于”)生成物所具有的总能量。
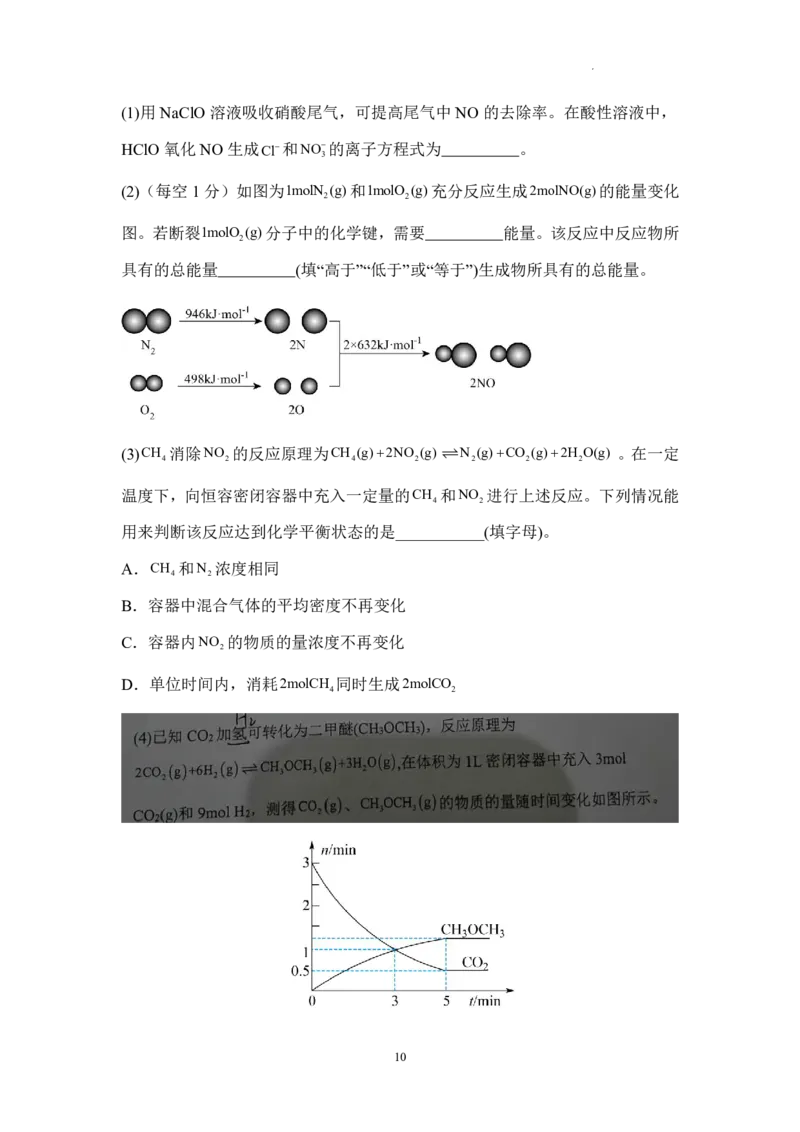
(3)CH 消除NO 的反应原理为CH (g)2NO (g) N (g)CO (g)2H O(g) 。在一定
4 2 4 2 2 2 2
温度下,向恒容密闭容器中充入一定量的CH 和NO 进行上述反应。下列情况能
4 2
用来判断该反应达到化学平衡状态的是___________(填字母)。
A.CH 和N 浓度相同
4 2
B.容器中混合气体的平均密度不再变化
C.容器内NO 的物质的量浓度不再变化
2
D.单位时间内,消耗2molCH 同时生成2molCO
4 2
10
学科网(北京)股份有限公司①反应到达3min时,v v (填“>”“<”或“=”)。
正 逆
②0~5min内,vH molL1min1。
2
③反应达到平衡状态时,CH OCH g的体积分数为 %(保留1位小数)。
3 3
④“二甲醚(CH OCH )酸性燃料电池”的工作原理示意图如图所示。X电极为
3 3
(填“正”或“负”)极(1分);X电极的电极反应式为 ,Y 电极的电极反
应式为 。
11
学科网(北京)股份有限公司河南省信阳高级中学北湖校区
2024-2025 学年高二上期开学测试
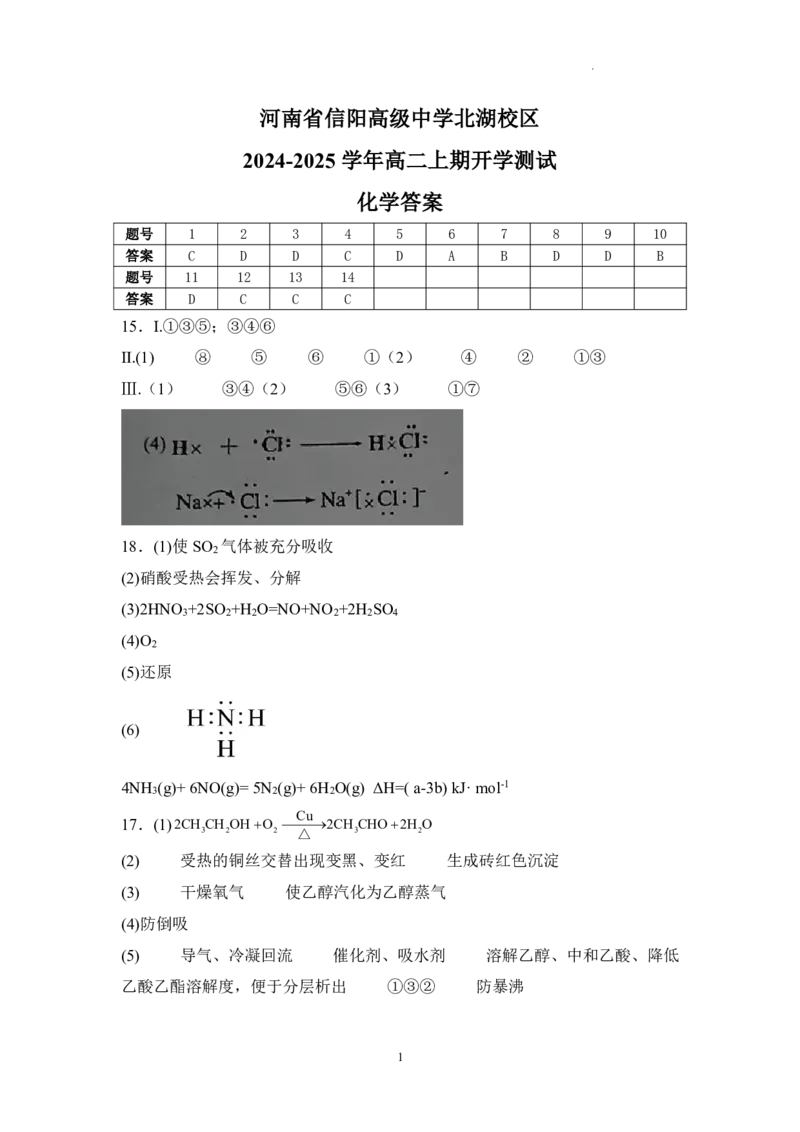
化学答案
题号 1 2 3 4 5 6 7 8 9 10
答案 C D D C D A B D D B
题号 11 12 13 14
答案 D C C C
15.I.①③⑤;③④⑥
Ⅱ.(1) ⑧ ⑤ ⑥ ①(2) ④ ② ①③
Ⅲ.(1) ③④(2) ⑤⑥(3) ①⑦
18.(1)使SO 气体被充分吸收
2
(2)硝酸受热会挥发、分解
(3)2HNO +2SO +H O=NO+NO +2H SO
3 2 2 2 2 4
(4)O
2
(5)还原
(6)
4NH (g)+ 6NO(g)= 5N (g)+ 6H O(g) ΔH=( a-3b) kJ·mol-1
3 2 2
Cu
17.(1)2CH CH OHO 2CH CHO2H O
3 2 2 △ 3 2
(2) 受热的铜丝交替出现变黑、变红 生成砖红色沉淀
(3) 干燥氧气 使乙醇汽化为乙醇蒸气
(4)防倒吸
(5) 导气、冷凝回流 催化剂、吸水剂 溶解乙醇、中和乙酸、降低
乙酸乙酯溶解度,便于分层析出 ①③② 防暴沸
1
学科网(北京)股份有限公司(6) CH 3 COOH+CH 3 CH 2 18OH 浓 加 硫 热 酸 CH 3 CO18OCH 2 CH 3 +H 2 O 酯化反应
(或取代反应)
(7)60.6%
18.(1)2NO3HClOH O3Cl2NO5H
2 3
(2) 吸收498kJ 低于
(3)C
(4) > 1.5 17.9 负
2
学科网(北京)股份有限公司