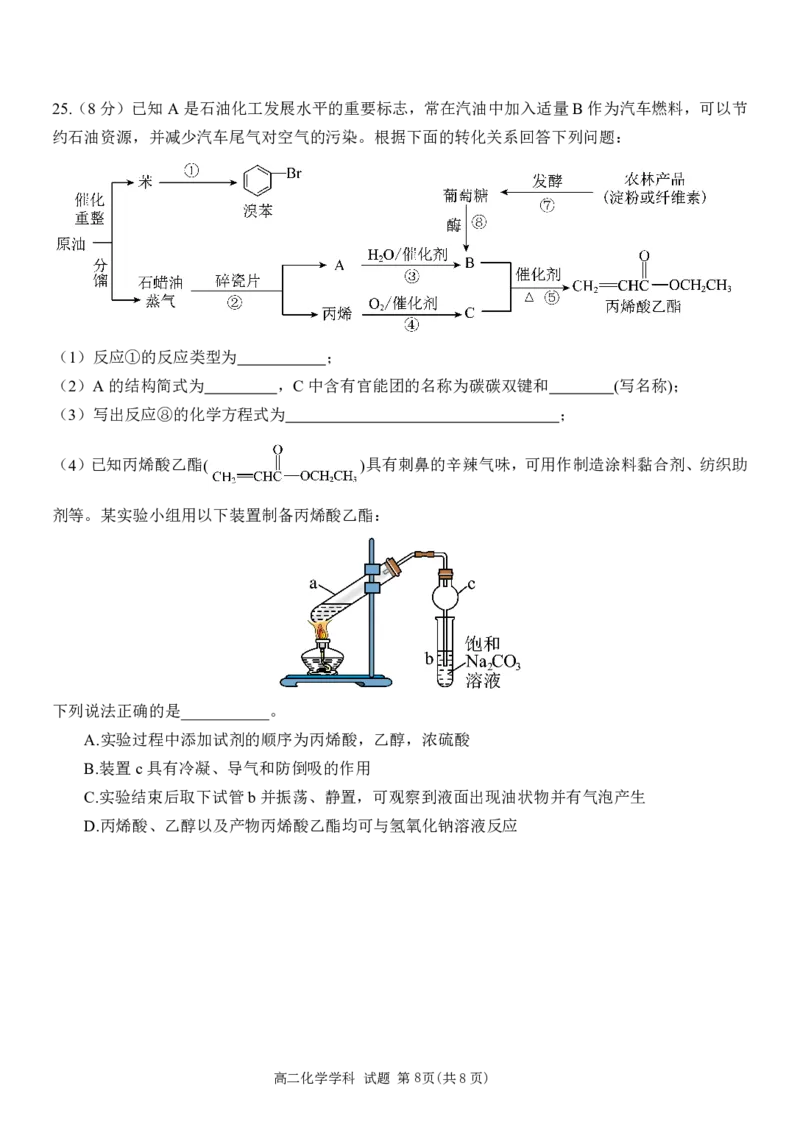
文档内容
绝密★考试结束前
学年第一学期丽水五校高中发展共同体 月联考
2024 10
高二年级化学学科 试题
考生须知:
1.本卷共8 页满分100分,考试时间90分钟。
2.答题前,在答题卷指定区域填写班级、姓名、考场号、座位号及准考证号并填涂相应数字。
3.所有答案必须写在答题纸上,写在试卷上无效。
4.考试结束后,只需上交答题纸。
可能用到的相对原子质量:H1 C12 N14 O16 Na23 S32 Cl35.5
选择题部分
一、选择题(本大题共20小题,1-10题每小题2分,11-20题每小题3分,共50分。每小题列出
的四个备选项中只有一个是符合题目要求的,不选、多选、错选均不得分。)
1. 下列物质因水解呈酸性的是( )
A.NH Cl B.Na CO C.Na SO D.NH ·H O
4 2 3 2 4 3 2
2. 下列仪器与名称相符的是( )
A. 封液漏斗 B. 坩埚 C. 三脚架 D. 干燥管
3. 下列说法正确的是( )
A.35Cl 和37Cl 互为同素异形体 B.葡萄糖与蔗糖互为同分异构体
2 2
C.D和T互为同位素 D.乙烷和环己烷互为同系物
4. 下列关于物质的叙述错误的是( )
A.糖类、蛋白质和油脂都是天然有机高分子 B.Cl 可用于自来水的杀菌消毒
2
C.单晶硅可用作半导体材料 D.SO 可用于漂白纸浆
2
5. 已知可逆反应:2A(g)+B(g)⇌ 3C(g)+2D(s),向恒温恒容密闭容器中加入2molA和1molB发生反
应,下列现象不能说明反应达到平衡的是( )
A.混合气体的平均摩尔质量保持不变 B.A和B的物质的量之比保持不变
C.混合气体密度不再发生变化 D.v (A)=2v (B)
正 逆
6. 高铁酸钾(K FeO )作净水剂时会产生Fe3+,该过程既能消毒杀菌,也能吸附水中悬浮物。制备FeO 2-
2 4 4
的原理为:3ClO−+2Fe3++10OH−=2FeO 2-+3Cl−+5H O。下列说法错误的是( )
4 2
A.K FeO 中铁元素的化合价为+6价 B.0.6molClO−参与反应时生成0.4molFeO 2−
2 4 4
C.ClO−作氧化剂,Fe3+被还原 D.K FeO 净水时会生成Fe(OH) 胶体
2 4 3
7. 下列指定反应的离子方程式正确的是( )
A.常温条件下,将少量Fe放置于浓硝酸中:Fe+6H++3NO −=Fe3++3NO ↑+3H O
3 2 2
B.NH Al(SO ) 溶液与过量NaOH溶液反应:Al3++4OH−=[Al(OH) ]−
4 4 2 4
C.泡沫灭火器(主要成分为硫酸铝和碳酸氢钠)原理:3HCO −+Al3+=Al(OH) ↓+3CO ↑
3 3 2
D.用CH COOH溶解CaCO :CaCO +2H+=Ca2++H O+CO ↑
3 3 3 2 2
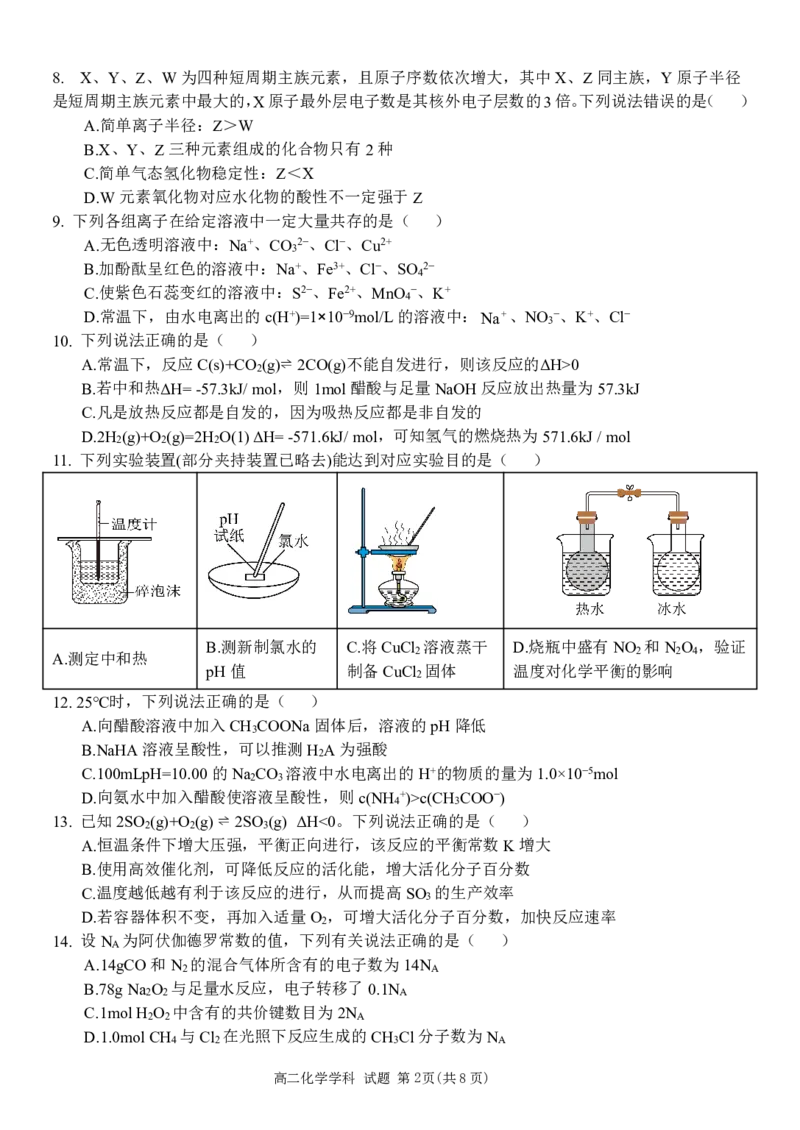
高二化学学科 试题 第1页(共8页)8. X、Y、Z、W为四种短周期主族元素,且原子序数依次增大,其中X、Z同主族,Y原子半径
是短周期主族元素中最大的,X原子最外层电子数是其核外电子层数的3倍。下列说法错误的是( )
A.简单离子半径:Z>W
B.X、Y、Z三种元素组成的化合物只有2种
C.简单气态氢化物稳定性:Z<X
D.W元素氧化物对应水化物的酸性不一定强于Z
9. 下列各组离子在给定溶液中一定大量共存的是( )
A.无色透明溶液中:Na+、CO 2−、Cl−、Cu2+
3
B.加酚酞呈红色的溶液中:Na+、Fe3+、Cl−、SO 2−
4
C.使紫色石蕊变红的溶液中:S2−、Fe2+、MnO −、K+
4
D.常温下,由水电离出的c(H+)=1×10−9mol/L的溶液中:Na、NO
3
−、K+、Cl−
10. 下列说法正确的是( )
A.常温下,反应C(s)+CO (g)⇌ 2CO(g)不能自发进行,则该反应的ΔH>0
2
B.若中和热ΔH=-57.3kJ/mol,则1mol醋酸与足量NaOH反应放出热量为57.3kJ
C.凡是放热反应都是自发的,因为吸热反应都是非自发的
D.2H (g)+O (g)=2H O(1)ΔH=-571.6kJ/mol,可知氢气的燃烧热为571.6kJ/mol
2 2 2
11. 下列实验装置(部分夹持装置已略去)能达到对应实验目的是( )
B.测新制氯水的 C.将CuCl 溶液蒸干 D.烧瓶中盛有NO 和N O ,验证
A.测定中和热 2 2 2 4
pH值 制备CuCl 固体 温度对化学平衡的影响
2
12.25℃时,下列说法正确的是( )
A.向醋酸溶液中加入CH COONa固体后,溶液的pH降低
3
B.NaHA溶液呈酸性,可以推测H A为强酸
2
C.100mLpH=10.00的Na CO 溶液中水电离出的H+的物质的量为1.0×10−5mol
2 3
D.向氨水中加入醋酸使溶液呈酸性,则c(NH +)>c(CH COO−)
4 3
13. 已知2SO (g)+O (g)⇌ 2SO (g) ΔH<0。下列说法正确的是( )
2 2 3
A.恒温条件下增大压强,平衡正向进行,该反应的平衡常数K增大
B.使用高效催化剂,可降低反应的活化能,增大活化分子百分数
C.温度越低越有利于该反应的进行,从而提高SO 的生产效率
3
D.若容器体积不变,再加入适量O ,可增大活化分子百分数,加快反应速率
2
14. 设N 为阿伏伽德罗常数的值,下列有关说法正确的是( )
A
A.14gCO和N 的混合气体所含有的电子数为14N
2 A
B.78gNa O 与足量水反应,电子转移了0.1N
2 2 A
C.1molH O 中含有的共价键数目为2N
2 2 A
D.1.0molCH 与Cl 在光照下反应生成的CH Cl分子数为N
4 2 3 A
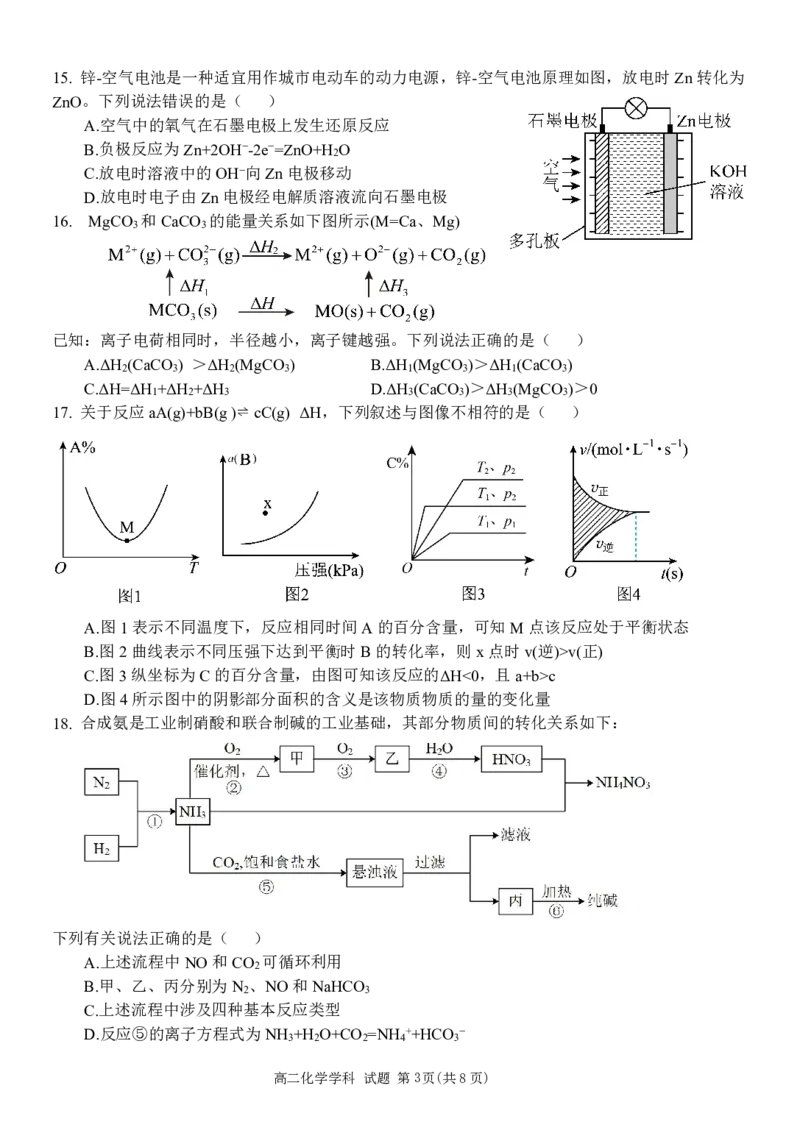
高二化学学科 试题 第2页(共8页)15. 锌-空气电池是一种适宜用作城市电动车的动力电源,锌-空气电池原理如图,放电时Zn转化为
ZnO。下列说法错误的是( )
A.空气中的氧气在石墨电极上发生还原反应
B.负极反应为Zn+2OH−-2e−=ZnO+H O
2
C.放电时溶液中的OH−向Zn电极移动
D.放电时电子由Zn电极经电解质溶液流向石墨电极
16. MgCO 和CaCO 的能量关系如下图所示(M=Ca、Mg)
3 3
已知:离子电荷相同时,半径越小,离子键越强。下列说法正确的是( )
A.ΔH (CaCO ) >ΔH (MgCO ) B.ΔH (MgCO )>ΔH (CaCO )
2 3 2 3 1 3 1 3
C.ΔH=ΔH +ΔH +ΔH D.ΔH (CaCO )>ΔH (MgCO )>0
1 2 3 3 3 3 3
17. 关于反应aA(g)+bB(g)⇌ cC(g) ΔH,下列叙述与图像不相符的是( )
A.图1表示不同温度下,反应相同时间A的百分含量,可知M点该反应处于平衡状态
B.图2曲线表示不同压强下达到平衡时B的转化率,则x点时v(逆)>v(正)
C.图3纵坐标为C的百分含量,由图可知该反应的ΔH<0,且a+b>c
D.图4所示图中的阴影部分面积的含义是该物质物质的量的变化量
18. 合成氨是工业制硝酸和联合制碱的工业基础,其部分物质间的转化关系如下:
下列有关说法正确的是( )
A.上述流程中NO和CO 可循环利用
2
B.甲、乙、丙分别为N 、NO和NaHCO
2 3
C.上述流程中涉及四种基本反应类型
D.反应⑤的离子方程式为NH +H O+CO =NH ++HCO −
3 2 2 4 3
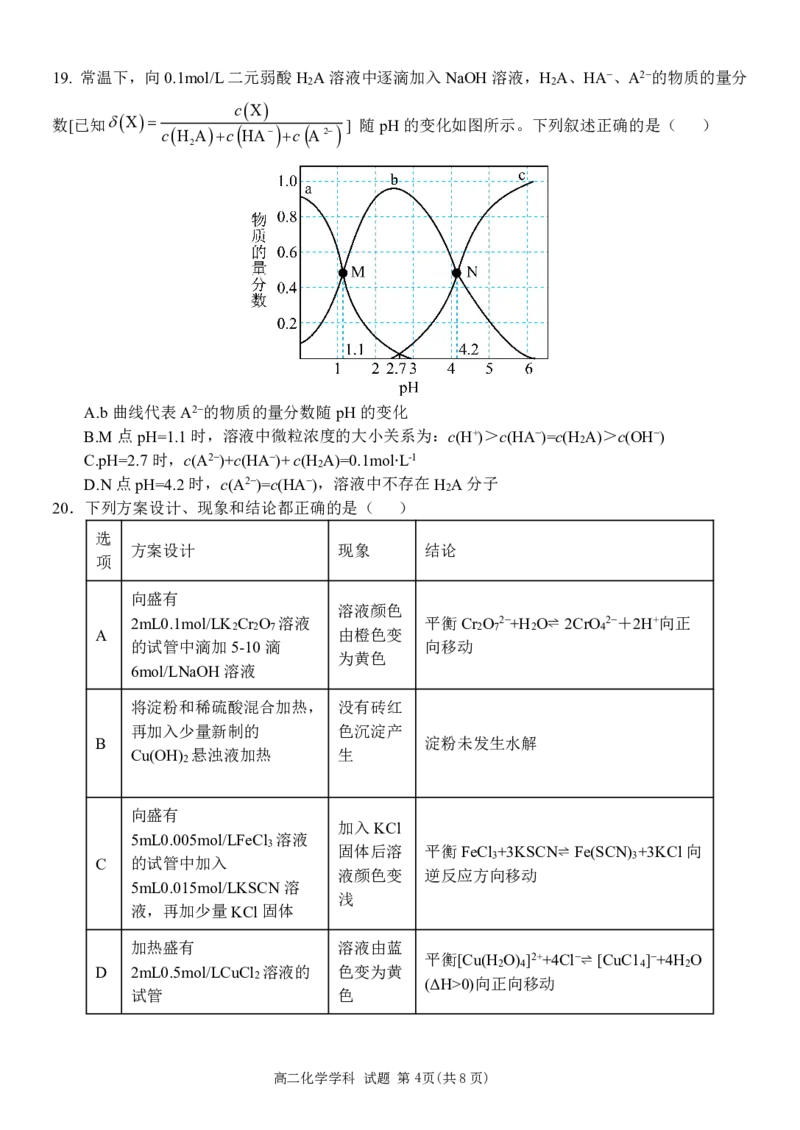
高二化学学科 试题 第3页(共8页)19. 常温下,向0.1mol/L二元弱酸H A溶液中逐滴加入NaOH溶液,H A、HA−、A2−的物质的量分
2 2
cX
数[已知X
cH Ac HA c A2] 随pH的变化如图所示。下列叙述正确的是( )
2
A.b曲线代表A2−的物质的量分数随pH的变化
B.M点pH=1.1时,溶液中微粒浓度的大小关系为:c(H+)>c(HA−)=c(H A)>c(OH−)
2
C.pH=2.7时,c(A2−)+c(HA−)+c(H A)=0.1molL-1
2
D.N点pH=4.2时,c(A2−)=c(HA−),溶液中不存在H A分子
2
∙
20.下列方案设计、现象和结论都正确的是( )
选
方案设计 现象 结论
项
向盛有
溶液颜色
2mL0.1mol/LK Cr O 溶液 平衡Cr O 2−+H O⇌ 2CrO 2−+2H+向正
A 2 2 7 由橙色变 2 7 2 4
的试管中滴加5-10滴 向移动
为黄色
6mol/LNaOH溶液
将淀粉和稀硫酸混合加热, 没有砖红
再加入少量新制的 色沉淀产
B 淀粉未发生水解
Cu(OH) 悬浊液加热 生
2
向盛有
加入KCl
5mL0.005mol/LFeCl 溶液
3 固体后溶 平衡FeCl +3KSCN⇌ Fe(SCN) +3KCl向
C 的试管中加入 3 3
液颜色变 逆反应方向移动
5mL0.015mol/LKSCN溶
浅
液,再加少量KCl固体
加热盛有 溶液由蓝
平衡[Cu(H O) ]2++4Cl−⇌ [CuC1 ]−+4H O
D 2mL0.5mol/LCuCl 溶液的 色变为黄 2 4 4 2
2 (ΔH>0)向正向移动
试管 色
高二化学学科 试题 第4页(共8页)非选择题部分
二、非选择题(本大题共5小题,共50分)
21.(10分)氮、磷是重要的元素,能形成多种化合物。
(1)写出铜与稀HNO 反应的离子方程式 ;
3
(2)写出NH 的电子式 ;
3
(3)已知:某温度下,纯水中的c(H+)=2.0×10−7mol/L。在该温度下,将aLpH=12NaOH溶液与b
LpH=2的HNO 溶液混合后恰好呈中性,则a :b= ;
3
(4)亚磷酸(H PO )是二元酸,某温度下亚磷酸(H PO )的溶液存在电离平衡:
3 3 3 3
H PO ⇌ H++H PO − H PO −⇌ H++HPO 2− ,回答下列问题:
3 3 2 3 2 3 3
①Na HPO 属于 (填“正盐”或“酸式盐”);
2 3
②写出Na HPO 溶液中的电荷守恒式 。
2 3
22.(10分)氧化铁俗名铁红,是重要的铁的氧化物。
流程一:制备氧化铁
用废铁屑制备氧化铁的流程如图:
(1)废铁屑中加入Na CO 溶液的作用是 ;
2 3
(2)加入NH HCO 溶液产生FeCO 沉淀的离子方程式为 ;
4 3 3
(3)写出“煅烧”发生反应的化学方程式 ;
流程二:探究氧化铁的性质
A、B、C、D均是含铁元素的物质,氧化铁发生的反应及物质转化关系如图:
(4)检验A溶液中金属阳离子的实验过程是 ;
(5)写出物质C与O 反应的化学方程式 。
2
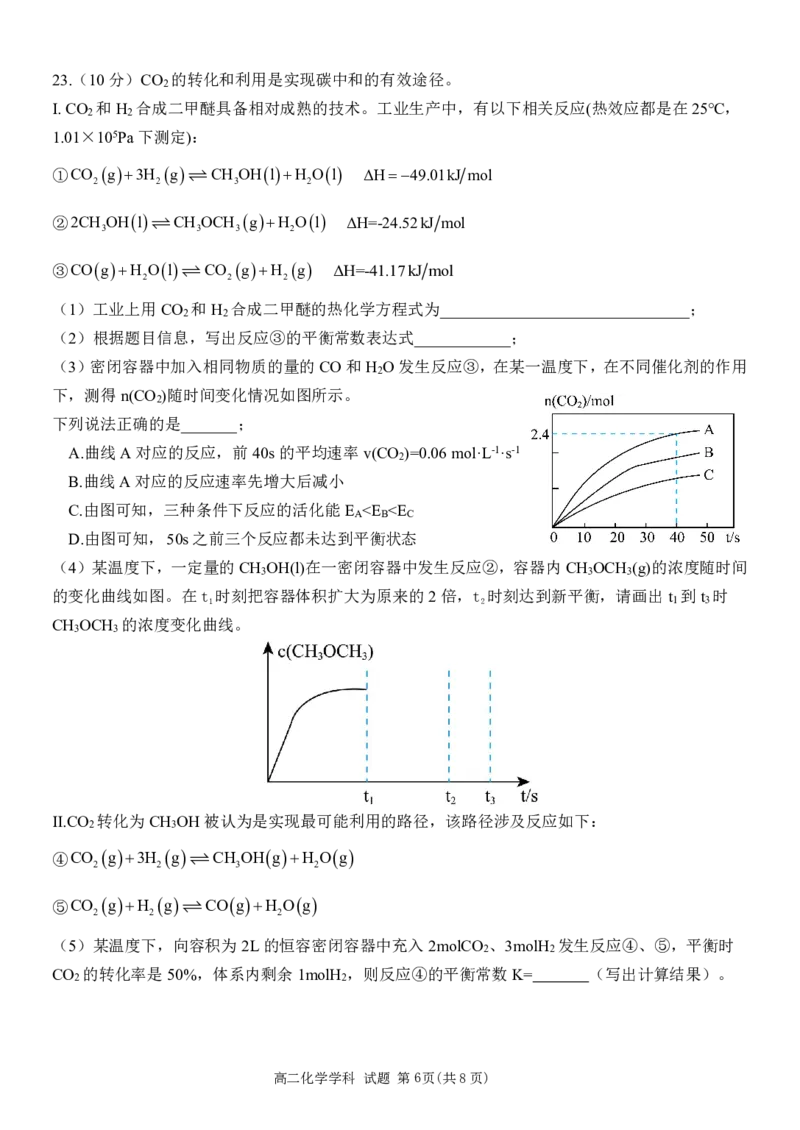
高二化学学科 试题 第5页(共8页)23.(10分)CO 的转化和利用是实现碳中和的有效途径。
2
I.CO 和H 合成二甲醚具备相对成熟的技术。工业生产中,有以下相关反应(热效应都是在25℃,
2 2
1.01×105Pa下测定):
①CO g3H g CH OHlH Ol ΔH49.01kJ mol
2 2 3 2
②2CH OHl CH OCH gH Ol ΔH=-24.52kJ mol
3 3 3 2
③COgH Ol CO gH g ΔH=-41.17kJ mol
2 2 2
(1)工业上用CO 和H 合成二甲醚的热化学方程式为_______________________________;
2 2
(2)根据题目信息,写出反应③的平衡常数表达式____________;
(3)密闭容器中加入相同物质的量的CO和H O发生反应③,在某一温度下,在不同催化剂的作用
2
下,测得n(CO )随时间变化情况如图所示。
2
下列说法正确的是_______;
A.曲线A对应的反应,前40s的平均速率v(CO )=0.06mol·L-1·s-1
2
B.曲线A对应的反应速率先增大后减小
C.由图可知,三种条件下反应的活化能E