文档内容
2024 年湖北云学名校联盟高二年级 10 月联考
化学试卷
命题学校:钟祥一中 命题人:高二化学组 审题人:夷陵中学 黄岗
考试时间:2024年 10月 16日 14:30-17:05 时长:75分钟 满分:100分
可能用到的相对原子质量:H:1 O:16 C:12 Zn:65
一、选择题:本题共 15小题,每小题 3分,共 45分。在每小题给出的四个选项中,只有一项
是符合题目要求的。
1.中华传统文化博大精深,蕴含着丰富的化学知识。下列说法错误的是( )
A.“高奴县出脂水,燃之如麻,但烟甚浓”,所述“脂水”就是现在的石油
B.“烈火焚烧若等闲”涉及的碳酸钙分解反应在低温下能自发进行
C.《本草经集注》中写到“如握雪不冰,以火烧之,紫青烟起,仍成灰,乃真硝石也。“硝石”是指KNO
3
D.“煮豆燃豆其,豆在釜中泣”,这里的能量变化主要是化学能转化为热能
2.生活中处处有化学,下列物质的性质与用途对应关系正确的是( )
A.NH HCO 可中和酸并受热分解,产生大量气体,可用作食品膨松剂
4 3
B.SO 具有漂白性,可用作葡萄酒的添加剂
2
C.氯化钙能够吸水,可用作豆腐的制作过程中的凝固剂
D.乙烯能够发生加成反应,可用作果实催熟剂
3.欲除去下列物质中混有的少量杂质,所用试剂和分离方法均正确的是( )
选项 物质 杂质 试剂 分离方法
A 乙醇 水 生石灰 蒸馏
B 乙酸乙酯 乙酸 饱和Na CO 溶液 过滤
2 3
C 乙烷 乙烯 酸性高锰酸钾溶液 洗气
D CO SO 饱和Na CO 溶液 洗气
2 2 2 3
A.A B.B C.C D.D
4.设N 为阿伏加德罗常数的值,下列说法正确的是( )
A
A.将0.1mol NO和0.05mol O 充入密闭容器中,充分反应后,容器内分子数目为0.1N
2 A
B.常温常压下,17g甲基(-14CH )含有电子数目为7N
3 A
C.10g 46%的乙醇溶液与足量的钠反应生成H 分子数目为0.05N
2 A
D.0.5mol CH 与1molCl 混合光照充分反应后分子总数目为1.5N
4 2 A
学科网(北京)股份有限公司5.解释下列事实的化学方程式或离子方程式正确的是( )
高温
A.用石英和焦炭制取粗硅:SiO +C Si+CO ↑
2 2
B.向氨水中通入过量SO :NH ⋅H O+SO =NH++HSO-
2 3 2 2 4 3
△
C.碳酸氢铵溶液与足量的NaOH溶液混合后加热:NH++OH- NH↑+H O
4 2
D.向Na S O 溶液中加入稀硫酸:3S O2-+2H+=4S↓+2SO2-+H O
2 2 3 2 3 4 2
6.海洋是一个资源宝库,海水资源的开发和利用是现代和未来永恒的主题。下列是海水利用的部分过程,有
关说法正确的是( )
A.制纯碱:NaClCO 2→NH 3→NaHCO △→Na CO
3 2 3
B.提取镁:海水石灰乳→Mg(OH) △→MgO电解→Mg
2
C.制漂白粉:NaCl(aq)电解→Cl 石灰乳→漂白粉
2
D.提取溴:NaBrCl 2→Br 蒸馏→液溴
2
7.下列说法错误的是( )
A.在反应热的测定实验中,用温度计测定盐酸起始温度后,直接测定氢氧化钠溶液的温度,会使中和反应反
应热测定值ΔH偏大
B.甲烷燃烧热为890.3kJ⋅mol-1,则CH (g)+2O (g)=CO (g)+2H O(g) ΔH>-890.3kJ⋅mol-1
4 2 2 2
C.相同条件下,稀盐酸和稀NaOH溶液反应的中和热与稀硫酸和稀氢氧化钾溶液反应的中和热相等
D.恒温恒容时,0.5mol N (g)和1.5mol H (g)充分反应生成NH (g),放出热量19.3kJ,其热化学方程式
2 2 3
可表示为N (g)+3H (g) 2NH (g) ΔH=-38.6kJ⋅mol-1
2 2 3
8.下列事实中,不能用勒夏特列原理解释的是( )
A.打开可口可乐瓶塞,可产生大量气泡
B.实验室制取乙酸乙酯时,将乙酸乙酯不断蒸出以提高其产量
C.恒温密闭容器中反应CO(g)+NO (g) CO (g)+NO(g)达到平衡后,缩小体积增大压强气体颜色变深
2 2
D.实验室可用浓氨水和氢氧化钠固体快速制取氨气
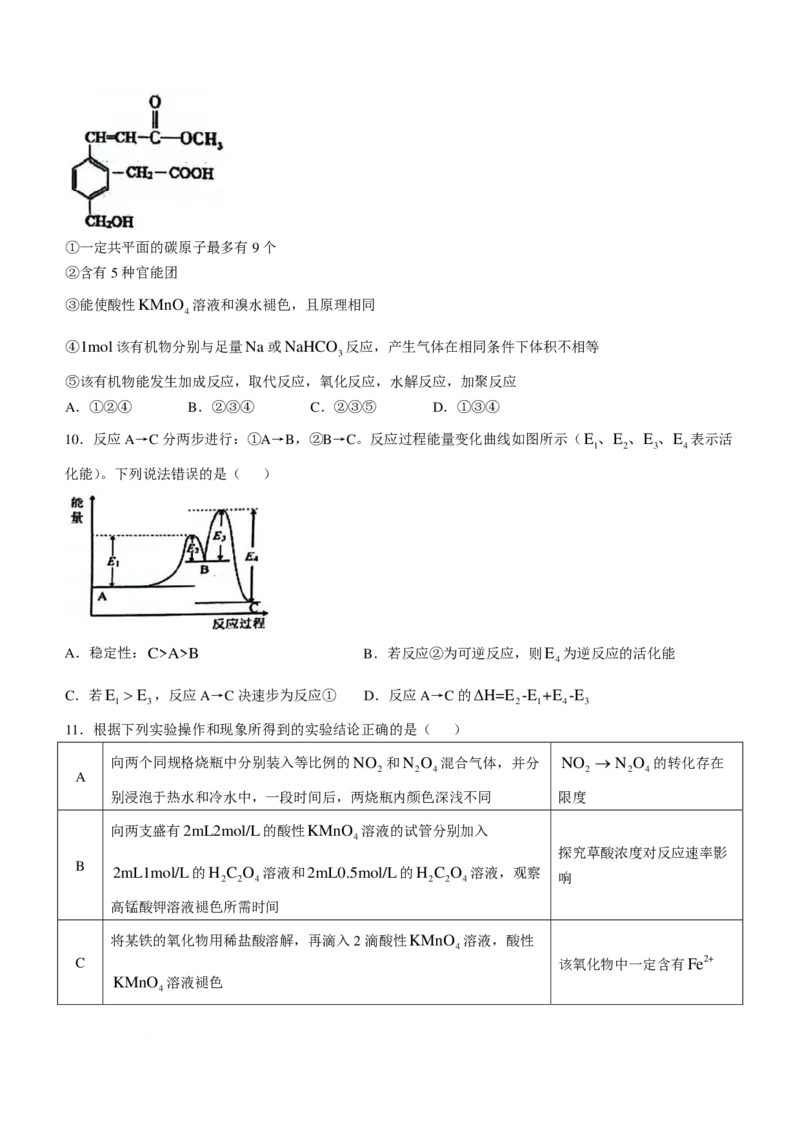
9、某有机物的结构如图所示,下列关于该有机物的说法错误的是( )
学科网(北京)股份有限公司①一定共平面的碳原子最多有9个
②含有5种官能团
③能使酸性KMnO 溶液和溴水褪色,且原理相同
4
④1mol该有机物分别与足量Na或NaHCO 反应,产生气体在相同条件下体积不相等
3
⑤该有机物能发生加成反应,取代反应,氧化反应,水解反应,加聚反应
A.①②④ B.②③④ C.②③⑤ D.①③④
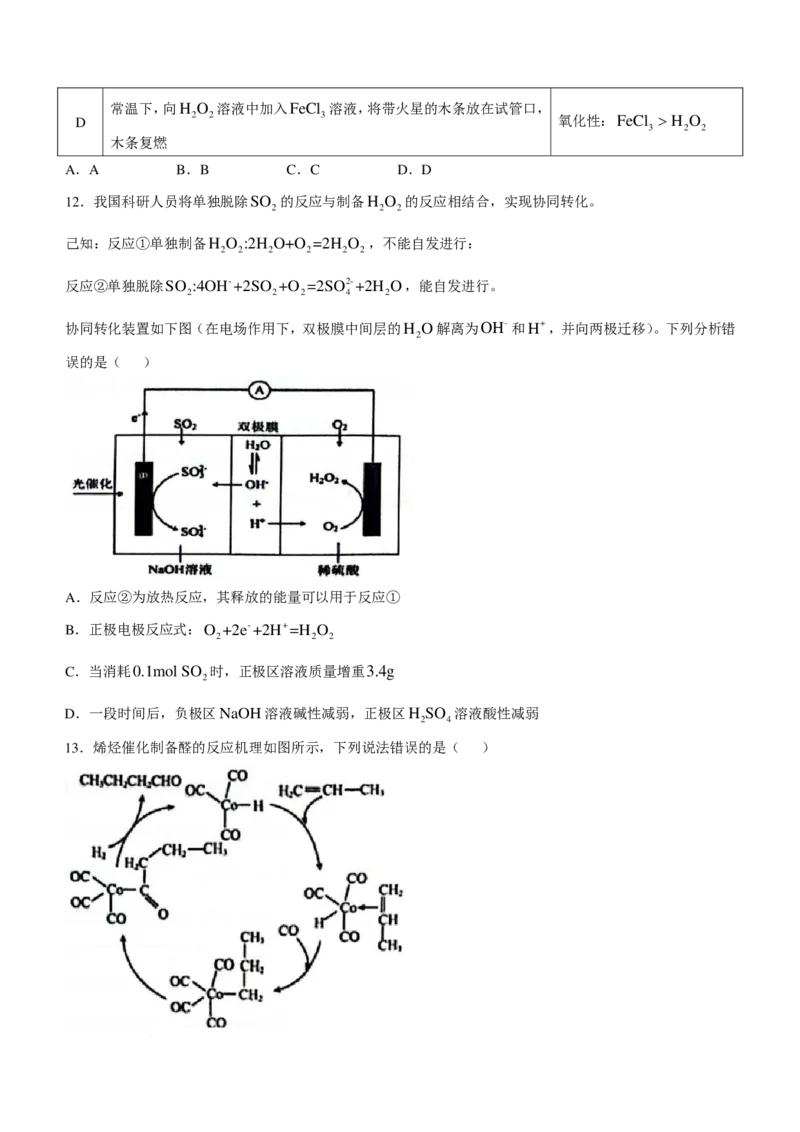
10.反应A→C分两步进行:①A→B,②B→C。反应过程能量变化曲线如图所示(E、E 、E、E 表示活
1 2 3 4
化能)。下列说法错误的是( )
A.稳定性:C>A>B B.若反应②为可逆反应,则E 为逆反应的活化能
4
C.若E >E ,反应A→C决速步为反应① D.反应A→C的ΔH=E -E +E -E
1 3 2 1 4 3
11.根据下列实验操作和现象所得到的实验结论正确的是( )
向两个同规格烧瓶中分别装入等比例的NO 和N O 混合气体,并分 NO →N O 的转化存在
2 2 4 2 2 4
A
别浸泡于热水和冷水中,一段时间后,两烧瓶内颜色深浅不同 限度
向两支盛有2mL2mol/L的酸性KMnO 溶液的试管分别加入
4
探究草酸浓度对反应速率影
B
2mL1mol/L的H
2
C
2
O
4
溶液和2mL0.5mol/L的H
2
C
2
O
4
溶液,观察
响
高锰酸钾溶液褪色所需时间
将某铁的氧化物用稀盐酸溶解,再滴入2滴酸性KMnO 溶液,酸性
4
C 该氧化物中一定含有Fe2+
KMnO 溶液褪色
4
学科网(北京)股份有限公司常温下,向H O 溶液中加入FeCl 溶液,将带火星的木条放在试管口,
D 2 2 3 氧化性:FeCl >H O
3 2 2
木条复燃
A.A B.B C.C D.D
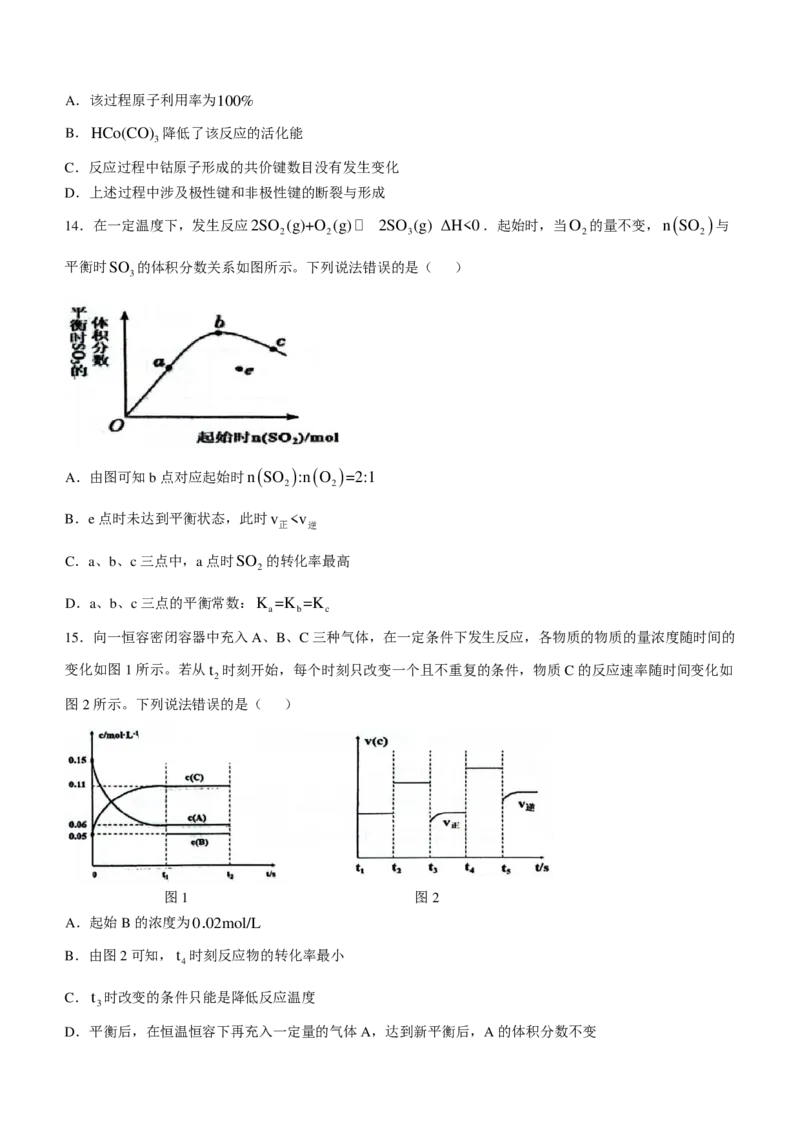
12.我国科研人员将单独脱除SO 的反应与制备H O 的反应相结合,实现协同转化。
2 2 2
己知:反应①单独制备H O :2H O+O =2H O ,不能自发进行:
2 2 2 2 2 2
反应②单独脱除SO :4OH-+2SO +O =2SO2-+2H O,能自发进行。
2 2 2 4 2
协同转化装置如下图(在电场作用下,双极膜中间层的H O解离为OH-和H+,并向两极迁移)。下列分析错
2
误的是( )
A.反应②为放热反应,其释放的能量可以用于反应①
B.正极电极反应式:O +2e-+2H+=H O
2 2 2
C.当消耗0.1mol SO 时,正极区溶液质量增重3.4g
2
D.一段时间后,负极区NaOH溶液碱性减弱,正极区H SO 溶液酸性减弱
2 4
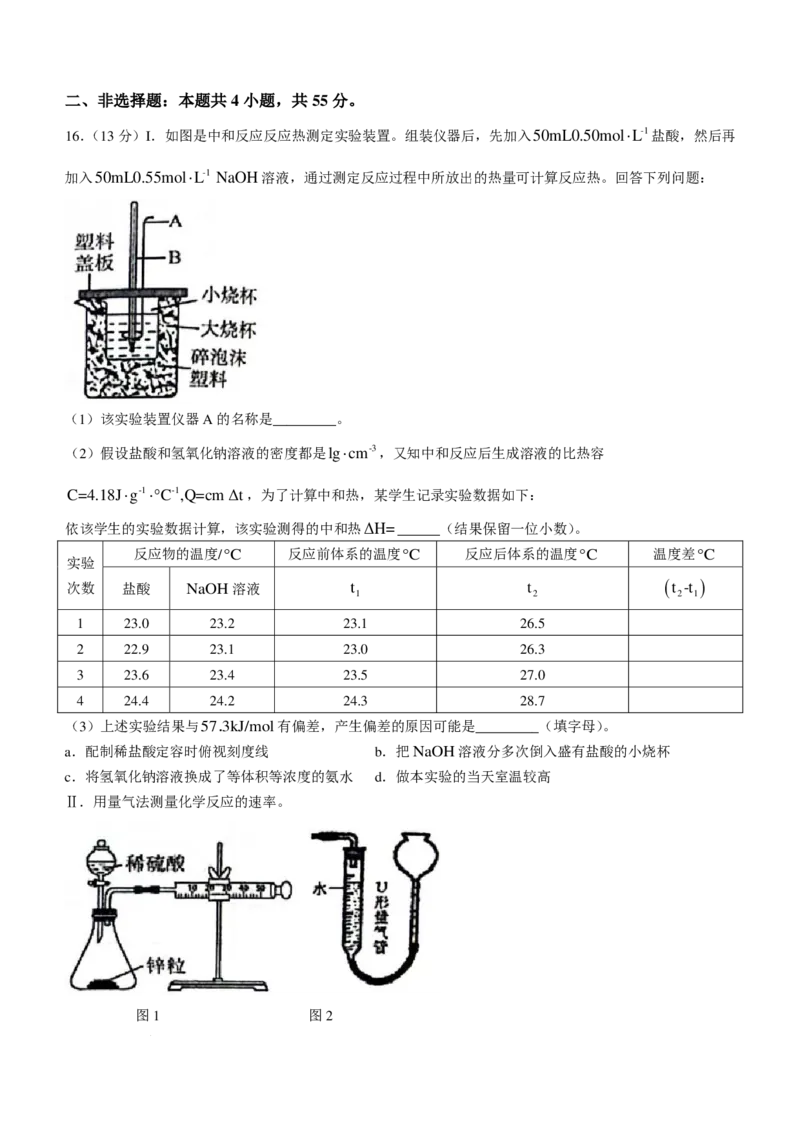
13.烯烃催化制备醛的反应机理如图所示,下列说法错误的是( )
学科网(北京)股份有限公司A.该过程原子利用率为100%
B.HCo(CO) 降低了该反应的活化能
3
C.反应过程中钴原子形成的共价键数目没有发生变化
D.上述过程中涉及极性键和非极性键的断裂与形成
14.在一定温度下,发生反应2SO (g)+O (g) 2SO (g) ΔH<0.起始时,当O 的量不变,n ( SO )与
2 2 3 2 2
平衡时SO 的体积分数关系如图所示。下列说法错误的是( )
3
A.由图可知b点对应起始时n ( SO ) :n ( O ) =2:1
2 2
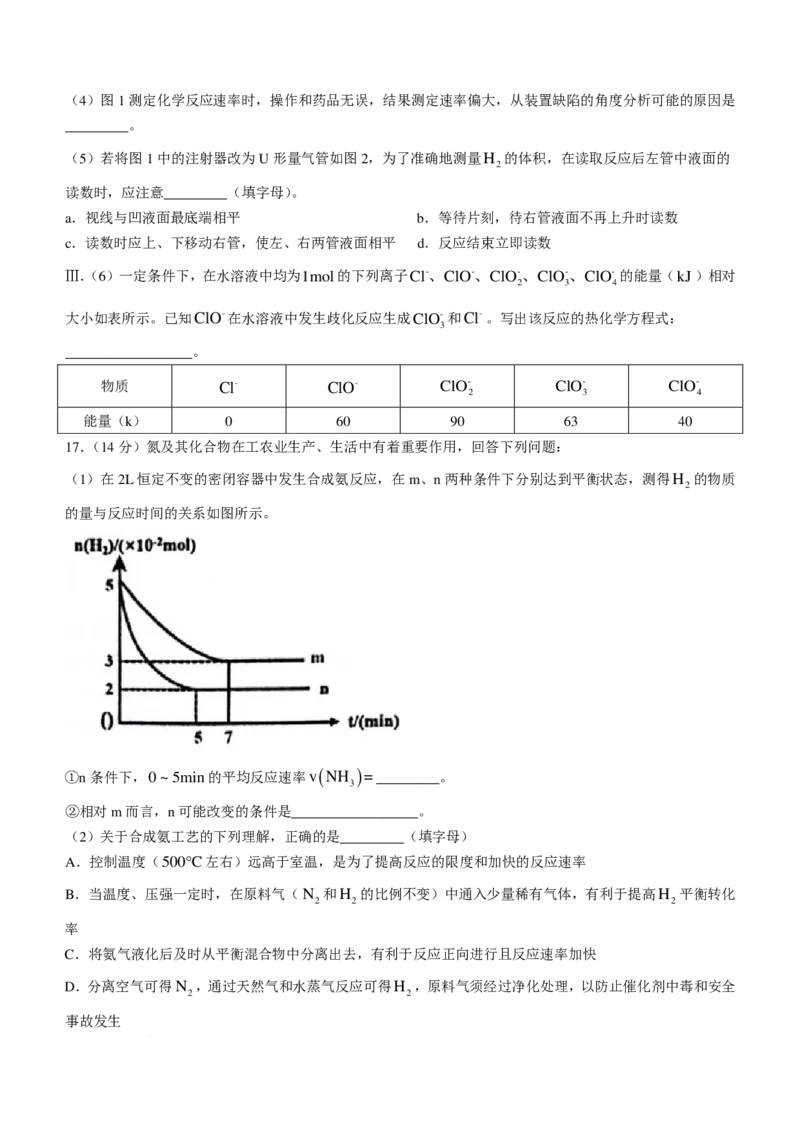
B.e点时未达到平衡状态,此时v ”“<”或“=”);一定温度下,反应②达到平衡,
测得各组分的平衡分压(即组分的物质的量分数×总压)如表中数据:
物质 CO H CO H O
2 2 2
分压(MPa) 0.25 0.25 0.75 0.75
维持相同的温度和总压,提高CO 的比例,使H 的平衡转化率提高到90%,则原料气中CO 和H 的物质
2 2 2 2
的量之比为_________.
(6)向密闭容器中分别投入一定量的CO和H 只发生反应③,其他条件相同时,测得相同时间内在某种催
2
化剂的作用下,CH OH的产率随温度的变化如图所示,当温度高于400°C时,M点后CH OH的产率降低
3 3
的原因可能是__________________.(答一条即可)
学科网(北京)股份有限公司2024 年湖北云学名校联盟高二年级 10 月联考
化学试卷评分细则
题号 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
答案 B A A D B C D C B D A D C B C/D
16【答案】(除标注外,每空2分,共13分)
(1)玻璃搅拌器(见错不得分)
(2)-56.8kJ/mol(-56.7kJ/mol或-56.9kJ/mol均给分,写成56.8kJ/mol或-56.8不得分)
(3)bc(大写不得分,漏选得1分,见错不得分)
(4)忽略加入稀硫酸排出的气体体积(合理答案亦可)
【评分细则】( )玻璃搅拌器(见错不得分,如:(环形)玻璃搅拌棒、搅拌器等均不得分)
(2)-56.8kJ/mol(-56.7kJ/mol或-56.9kJ/mol均给分,写成56.8kJ/mol或-56.8不得分)
(3)bc(大写不得分,漏选得1分,见错不得分)
(4)忽略加入稀硫酸排出的气体体积(收集到的气体中混有空气导致体积偏大、硫酸的体积影响了气体的体
积等得2分,原装置内有空气、装置漏气、反应放热等不得分)
(5)ac(大写不得分,漏选得1分,见错不得分)
【评分细则】16、(5)按照答案给分。
(6)3ClO-(aq)=ClO-(aq)+2Cl-(aq) ΔH=-117kJ/mol(3分,见错不得分)
3
【评分细则】16、(6)按照答案给分。
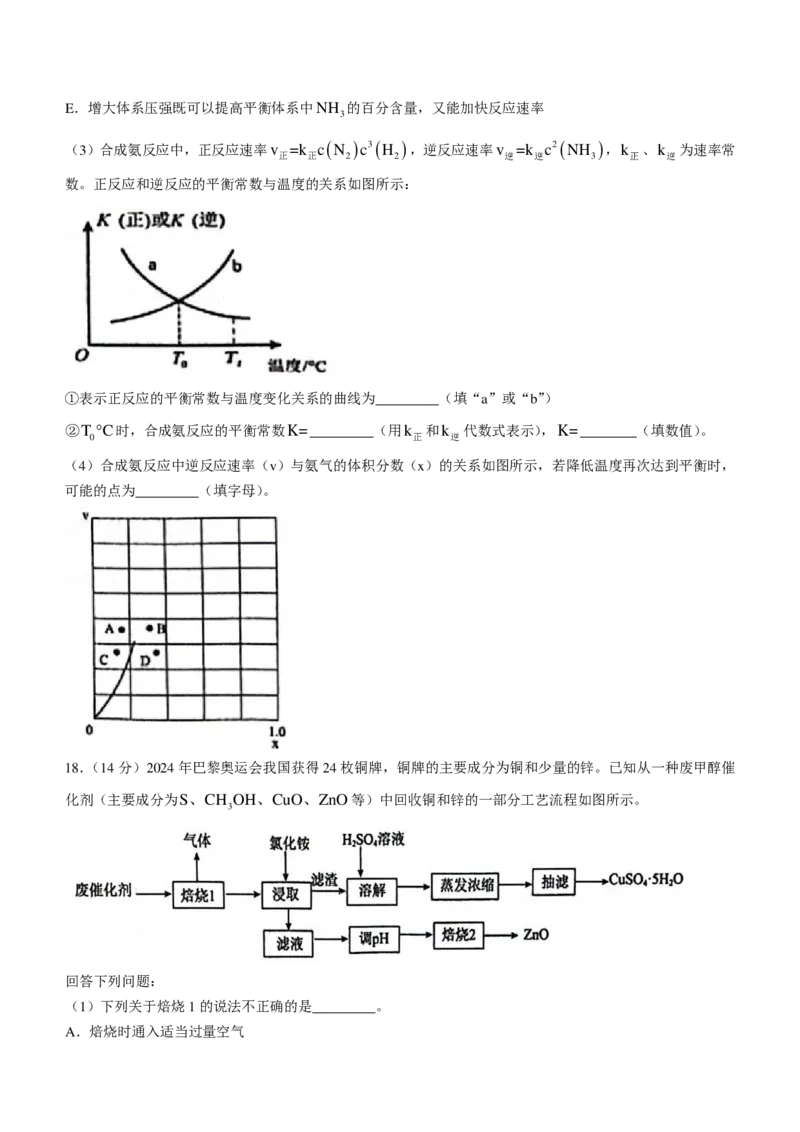
17【答案】(每空2分,共14分)
(1)①2×10-3mol⋅L-1⋅min-1(无单位或者单位错扣1分)
②增加N 的物质的量浓度(或者增加N 的物质的量也得分,答缩小体积不得分)
2 2
【评分细则】17、(1)①2×10-3mol⋅L-1⋅min-1(无单位或者单位错不给分,写0.2×10-3mol⋅L-1⋅min-1不给
分)
②增加N 的物质的量浓度(或者增加N 的物质的量也得分,答缩小体积或者增大压强不得分)
2 2
(2)DE
【评分细则】17、(2)DE(一个1分,有错0分)
正
k
(3)①a ② 正 1(4)D
k
逆
k
(4)【评分细则】17、(3)①a(写大写A不给分) ② 正 1 (4)D
k
逆
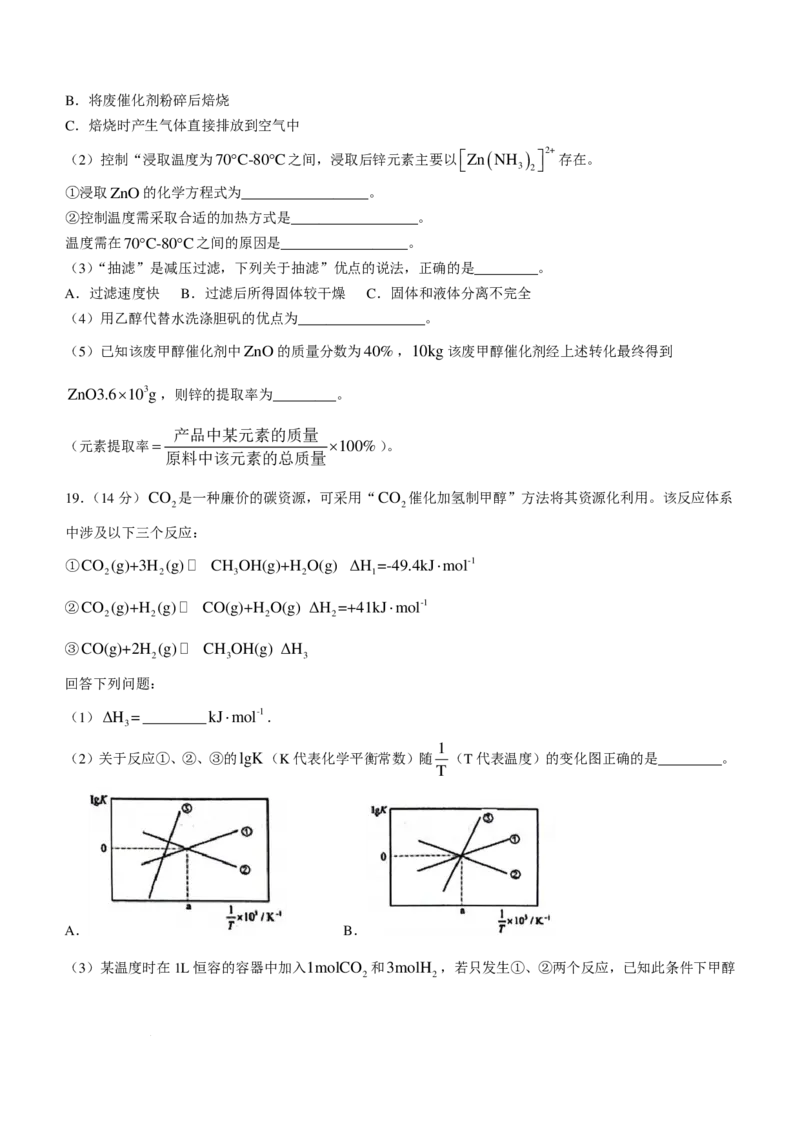
18【答案】(每空2分,共14分)
学科网(北京)股份有限公司(1)C
(2)ZnO+2NH
4
Cl=
Zn ( NH
3
)
2
Cl
2
+H
2
O
②水浴加热;温度过低,浸取慢;温度过高,NH Cl受热分解(温度过低,浸取慢,1分;温度过高,NH Cl
4 4
受热分解,1分。)
(3)AB(选A或B得1分)
(4)减少胆矾溶解损失;乙醇易挥发,有利于干燥(减少胆矾溶解损失,1分:乙醇易挥发,有利于干燥,1
分)
(5)90%
【评分细则】18、(1)C
(2)C(2分,见错不给分)
(3)①ZnO+2NH
4
Cl=
Zn ( NH
3
)
2
Cl
2
+H
2
O(离子方程式不给分,未写条件不扣分)
②水浴加热;(其他方法不给分)温度过低,浸取慢;温度过高,NH Cl受热分解
4
(温度过低,浸取慢,1分,必须达到速率快慢,答成“不反应,反应不充分”等都不给分;温度过高,NH Cl
4
受热分解,1分,答成“氨气逸出”“配合物不稳定”也可以给1分,其他答案不给分。正向答“该范围内速
率快,氯化铵稳定不分解”也可以给全分)
(3)答案不全得1分,见错不得分:
(4)减少胆矾溶解损失,1分:乙醇易挥发,有利于干燥,1分,答洗去杂质不得分:
(5)90%、90.0%均分,其它不得分。
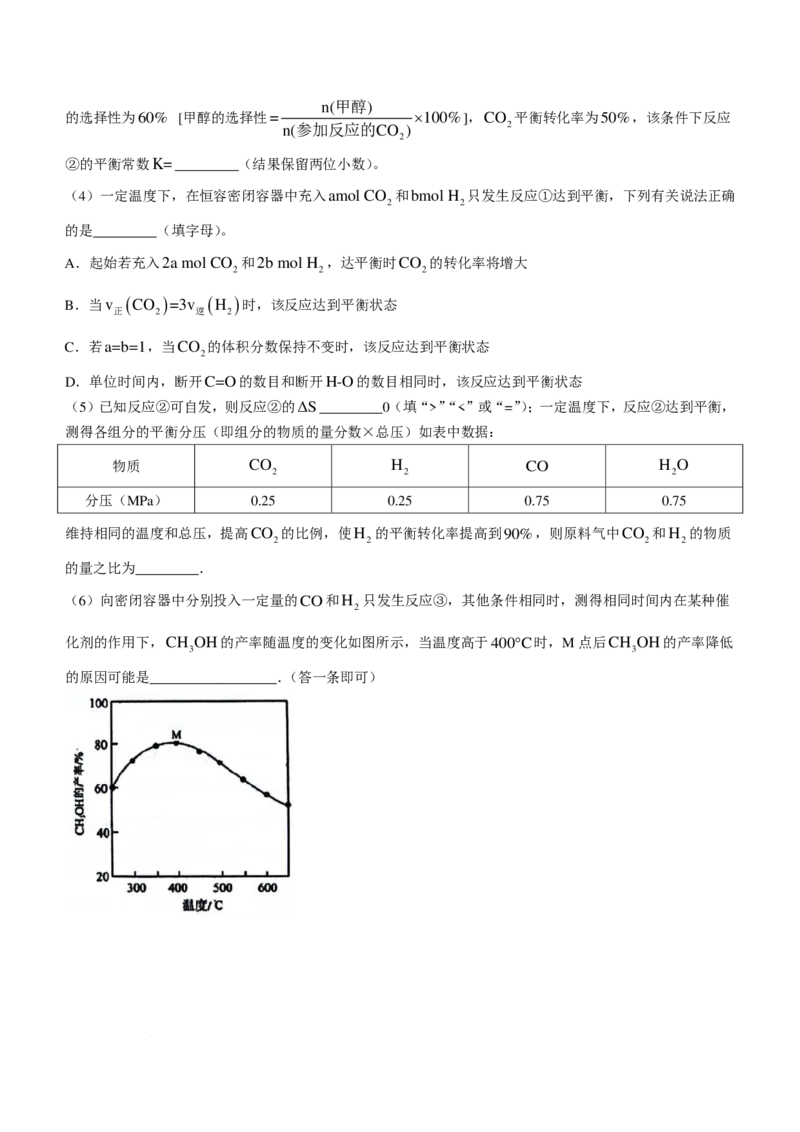
19【答案】(每空2分,共14分)
(1)−90.4 (2)B (3)0.11 (4)A (5)> 9:5
(6)催化剂活性降低或温度升高副反应增多或M点之后反应③己平衡,温度升高,平衡逆向移动,使甲醇产
量降低(其他合理答案亦可)部分答案详解
【评分细则】(1)−90.4 (2)B (3)0.11
三空按答案改,第(1)问带单位了不扣分,第(2)问写成“b”或“②”的均不给分
(4)A(多选不给分,小写“a”不给分)
(5)>(见错不给分,写“大于”不给分)
9:5(1.8:1或者1.8给分)
(6)催化剂活性降低或温度升高副反应增多或M点之后反应(3已平衡,温度升高,平衡逆向移动,使甲醇
产量降低(其他合理答案亦可)
9【详解】
定共面的碳原子最多的是苯环平面,与苯环相连的3个碳原子一定在苯环平面内,所以一定共面的碳原子最多
有9个,故①正确;
②该物质含有羟基、羧基、酯基、碳碳双键共四种官能团,故②错误;
③碳碳双键与溴水发生加成反应,与酸性KMnO 溶液发生氧化反应,故③错误;
4
学科网(北京)股份有限公司④1mol该有机物分别与足量Na或NaHCO 反应,可生成1mol氢气、1mol二氧化碳,故④错误;
3
⑤碳碳双键能发生加成反应、加聚反应,羟基、羧基、酯基能发生取代反应,羟基、碳碳双键能发生氧化反应,
酯基能发生水解反应,故⑤正确
12【详解】
A.反应②能自发反应,放出能量,反应①不能自发反应,需要吸收能量,反应②释放的能量可以用于反应①,
故A正确;
B.由电子的流向可知,右边电极为正极,电极反应式:O +2e-+2H+=H O ,故B正确;
2 2 2
C.当消耗0.1mol SO 时,根据电子得失守恒可知,必然消耗0.1mol O ,正极电极反应式为
2 2
O +2H++2e-=H O ,溶液增重的质量等于0.1molO 的质量与0.2molH+的质量之和,为3.4g故C正确;
2 2 2 2
D.负极区发生SO +2OH-=SO 2-+H O和SO 2--2e-+2OH-=SO 2-+H O,正极区发生
2 3 2 3 4 2
O +2H++2e-=H O ,当脱除1molSO 时,转移2mole-,负极区消耗4molOH-,双极膜中的水电离出
2 2 2 2
2molOH-进入负极区,负极区NaOH溶液碱性减弱,正极区消耗2molH+,双极膜中的水电离出2molH+进
入正极区,正极区H SO 溶液酸性不变,故D错误;
2 4
15【详解】
A.由图2可知,该反应是气体体积不变的反应,由图1可知从开始到平衡A减少0.09mol/L,C增加0.06mol/L,
则B为生成物且增加0.03mol/L,所以起始B的浓度为0.02mol/L,故A正确;
B.t -t 时刻,平衡逆向移动,平衡时反应物的转化率最小,故B正确;
3 4
C.t 时刻v >v ,可能是降低温度v 和v 都下降,也可能是减小反应物浓度,v 降低而v 不变,故C
3 逆 正 正 逆 正 逆
错误;
D.A、B、C为气体,只有A一种反应物且反应体积不变,但由于起始三种物质并非按计量数投料,再充入
A时,与原平衡不等效,故A的百分含量发生了改变,故D错误;
故选C、D。
16【详解】
(1)本实验装置缺少的仪器是玻璃搅拌器:
(2)四组温度差(t2-t1)/°C分别为3.4°C、3.3°C、3.5°C、4.4°C(舍去),则平均值为3.4°C;生成水的物质的
量为0.025mol,Q=CmΔT=100g×4.18×10-3kJ⋅g-1⋅°C-1⋅3.4°C=1.4212kJ;中和热
Q 1.4212kJ
ΔH=- =- =-56.8kJ/mol
n 0.025mol
(3)a.定容时俯视读数,所配盐酸浓度偏高,则盐酸的实际量偏高.放热较多,a错误;
b.把NaOH溶液分多次倒入盛有盐酸的小烧杯,有部分热量散失,测得的热量会变小,b正确;
学科网(北京)股份有限公司c.一水合氨是弱电解质,其电离的时候要吸热,故换成氨水后,测得的热量会变小,c正确;
d.本题需要的是温度差,故做本实验的当天室温较高,没有影响,d错误;
故选bc。
(4)忽略加入稀硫酸排出的气体体积
(5)为了较准确地测量氢气的体积,除了必须检查整个装置的气密性之外,在读取反应前后右管中液面的读
数,求其差值的过程中,应注意:①恢复到室温,②读数时要调节图2中左、右的液面使其同一高度;③读数
时视线要与凹液面最低处相平,据此分析解题。
a.视线与凹液面最低处相平,以保证读数准确,a符合题意:
b.等待片刻,待右管液面不再上升时读数,还需调节左、右两管液面相平再读数,b不符合题意;
c.读数时应上、下移动右管,使左、右两管液面相平,以保证内外压强一致,以保证气体的体积更加准确,c
符合题意;
d.反应结束立即读数,由于反应放热,里面气体膨胀,此时读数不准确,d不合题意;故答案为:ac;
(6)1molClO-(aq)的相对能量为63kJ,2molCl-(aq)的相对能量为0kJ,3molClO-(aq)的相对能量为
3
3×60kJ=180kJ,因此反应的焓变ΔH=63kJ/mol-180kJ/mol=-117kJ/mol。
3ClO-(aq)=ClO-(aq)+2Cl-(aq) ΔH=-117kJ/mol
3
17【详解】
3×10-2mol 2
①n条件下,0~5min的平均反应速率V ( NH ) = × =2×10-3mol.L-1⋅min-1,
3 2L×5min 3
故本题答案为:2×10-3mol⋅L-1⋅min-1;
②m、n氢气起始物质的量相同,n到达平衡的时间短,说明反应速率大,平衡时氢气的物质的量减小,说明
平衡正向移动,但容器体积恒定不变,不能是减小体积增大压强。因此,本题正确答案是:增大N 的浓度;
2
(2)A.合成氨反应放热,升高温度平衡逆向移动,不利于平衡转化率的提高,故A错误:
B.当温度、压强一定时,在原料气(N 和H 的比例不变)中添加少量惰性气体,相当于减压,平衡逆向移
2 2
动,平衡转化率降低,故B错误;
C.基于NH 有较强的分子间作用力可将其液化,不断将液氨移去,降低氨气浓度,利于反应正向进行,但
3
生成物浓度减小,化学反应速率减慢故C错误;
D.分离空气可得N ,通过天然气和水蒸气转化可得H ,原料气须经过净化处理,以防止催化剂中毒和安全
2 2
事故发生,故D正确;
E.增大体系压强,反应速率加快,同时平衡正向移动,可以提高氨气的百分含量,符合题意;选DE。
(3)①该反应为放热反应,升高温度平衡逆向移动,逆反应平衡常数增大,则b表示逆反应的平衡常数与温
度变化关系;因而a就是正反应的平衡常数与温度变化关系
学科网(北京)股份有限公司k
cx(
NH
)
②平衡时v =v ,即k ⋅c ( ?N )⋅c3( H ) =k ⋅c2( NH ), 正 = 3 =K,T °C时,K =K ,
正 逆 正 2 2 逆 3 k c ( N )⋅c3( H ) 0 逆 正
逆 2 2
又因K ⋅K =1,可得K =K =1;
逆 正 逆 正
(4)合成氨反应为放热反应,降低温度,反应速率减慢,平衡向正反应方向移动,氨气的体积分数增大,则
降低温度再次达到平衡时,符合题意的点为D,故答案为D:
18【详解】
(1)焙烧1中气体主要成分为CO 、SO 、SO、H O(g),其中SO 、SO 会污染空气不能直接排放,故
2 2 3 2 2 3
选C
(2)①根据元素守恒配平可知,浸取ZnO的化学方程式为ZnO+2NH
4
Cl=
Zn ( NH
3
)
2
Cl
2
+H
2
O
②温度控制在70°C到80°C低于100°C故采取水浴加热,采取此温度的原因是温度过低,浸取慢;温度过高,
NH Cl受热分解;
4
(3)抽滤”为减压过滤,与普通过滤相比,“抽滤的优点时过滤速度快,且所得固体较干燥;固液分离较完全。
故答案为AB;
(4)由于胆矾溶于水而不溶于乙醇,故减少了胆矾溶解损失;乙醇的沸点比水的低,故乙醇易挥发,有利于
干燥
65
(5)根据题意可知,废甲醇催化剂中Zn的质量为 ×10000×40%g,所得产品ZnO中含Zn的质量为
81
65
×3.6×103g,故Zn的提取率90%
81
19【详解】
由盖斯定律可知,反应①-②得到反应③,则反应ΔH3=-90.4kJ/mol;
K 1
(2)由反应③放热可知,升高温度,平衡常数K = 1 减小,则 增大,lgK 增大,反应①和反应②的平
3 K T 3
2
衡常数相等时,lgK =0,则反应③的lgK随的变化图为B,故选B;
3
(3)根据已知条件可知,平衡时反应的CO 为0.5mol,生成甲醇为0.5×60%=0.3mol,反应①中生成水蒸
2
气为0.3mol,消耗的H 为0.9mol,消耗的CO 为0.3mol,反应②消耗的CO 为0.2mol,消耗的H2为
2 2 2
0.2mol,生成水蒸气和CO各为0.2mol,平衡时反应②中CO 为0.5mol,H 为1.9mol,CO为0.2mol,
2 2
水蒸气为0.5mol,求得K=0.11
(4)①A.若加倍投料,恒容条件,体系压强变大,二氧化碳的平衡转化率增大,故A正确;
( )
v CO 3
B.当 正 2 = 时,不符合化学计量数之比等于速率之比,正逆反应速率不相等,反应未达到平衡状态,
( )
v H 1
逆 2
学科网(北京)股份有限公司故B错误;
C.开始等物质的量投料,CO 的体积分数始终保持不变,不能说明反应已达到平衡,故C错误;
2
D.单位时间内,断开C=O键的数目和断开H-O键的数目不相同,因CH3OH和H2O中都有H-O键,因此
不可以判断反应已经达到平衡状态,D不符合题意;
故选A;
(5)反应②可自发进行,ΔH2>0,则反应②的ΔH-TΔS<0,则ΔS>0;
p(CO)⋅p ( H O ) 0.75×0.75
根据题意,该反应平衡常数K= 2 = =9.0;假设原料气中CO 为x mol,
p ( CO )⋅p ( H ) 0.25×0.25 2
2 2
H2为1mol,由题意列三段式:
H + CO H O + CO
2 2 2
起始/mol 1 x 0 0
转化/mol 0.9 0.9 0.9 0.9
平衡/mol 0.1 x-0.9 0.9 0.9
0.9 0.9
×P × ×P
总 总
n n
则平衡常数K = 总 总 =9,解得x=1.8,故CO 与H2的物质的量之比为1.8:1=9:5。
p 0.1 x-0.9 2
×P × ×P
总 总
n n
总 总
(6)在催化剂的作用下,温度高于400°C时,M点后甲醇的产率降低可能是催化剂活性降低,反应速率减慢,
导致产率降低;也可能是温度升高副反应增多,导致产率降低。
学科网(北京)股份有限公司