文档内容
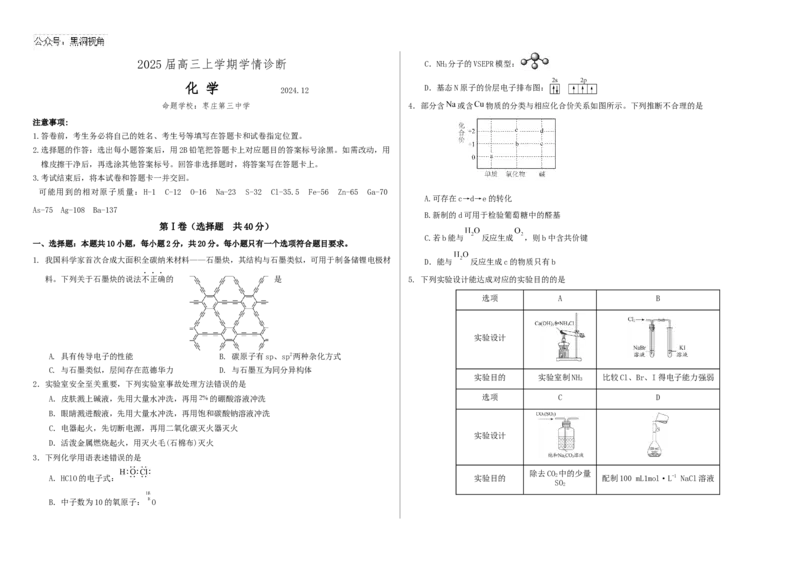
2025 届高三上学期学情诊断 C.NH 分子的VSEPR模型:
3
化 学
D.基态N原子的价层电子排布图:
2024.12
命题学校:枣庄第三中学 4.部分含 或含 物质的分类与相应化合价关系如图所示。下列推断不合理的是
注意事项:
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡和试卷指定位置。
2.选择题的作答:选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用
橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Cl-35.5 Fe-56 Zn-65 Ga-70
A.可存在c→d→e的转化
As-75 Ag-108 Ba-137
B.新制的d可用于检验葡萄糖中的醛基
第Ⅰ卷(选择题 共40分)
C.若b能与 反应生成 ,则b中含共价键
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1. 我国科学家首次合成大面积全碳纳米材料——石墨炔,其结构与石墨类似,可用于制备储锂电极材 D.能与 反应生成c的物质只有b
料。下列关于石墨炔的说法不正确的 是 5. 下列实验设计能达成对应的实验目的的是
选项 A B
实验设计
A. 具有传导电子的性能 B. 碳原子有sp、sp2两种杂化方式
C. 与石墨类似,层间存在范德华力 D. 与石墨互为同分异构体
实验目的 实验室制NH 比较Cl、Br、I得电子能力强弱
3
2.实验室安全至关重要,下列实验室事故处理方法错误的是
A.皮肤溅上碱液,先用大量水冲洗,再用 的硼酸溶液冲洗 选项 C D
B.眼睛溅进酸液,先用大量水冲洗,再用饱和碳酸钠溶液冲洗
C.电器起火,先切断电源,再用二氧化碳灭火器灭火
实验设计
D.活泼金属燃烧起火,用灭火毛(石棉布)灭火
3.下列化学用语表述错误的是
除去CO 中的少量
A.HClO的电子式: 实验目的 2 配制100 mL1mol·L-1 NaCl溶液
SO
2
B.中子数为10的氧原子: OA.A B. B C. C D. D
已知:
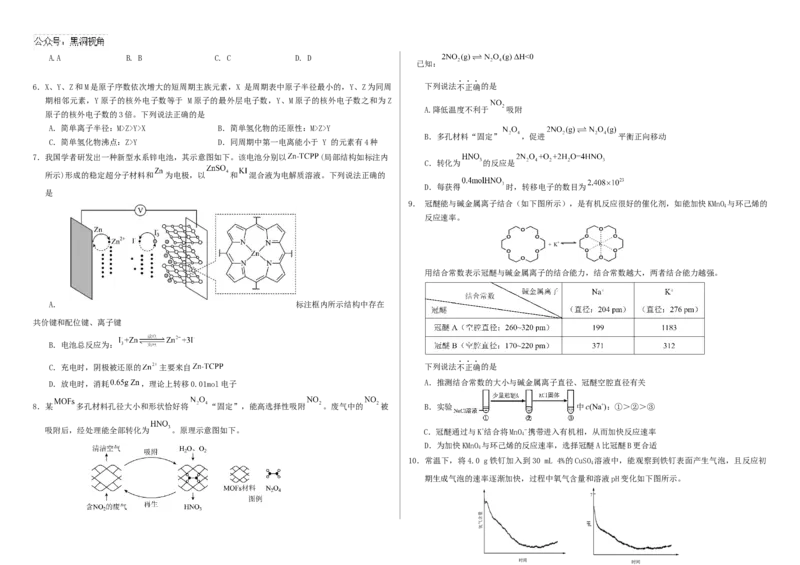
6.X、Y、Z和M是原子序数依次增大的短周期主族元素,X 是周期表中原子半径最小的,Y、Z为同周 下列说法不正确的是
期相邻元素,Y原子的核外电子数等于 M原子的最外层电子数,Y、M原子的核外电子数之和为Z
A.降低温度不利于 吸附
原子的核外电子数的3倍。下列说法正确的是
A.简单离子半径:M>Z>Y>X B.简单氢化物的还原性:M>Z>Y
B.多孔材料“固定” ,促进 平衡正向移动
C.简单氢化物沸点:Z>Y D.同周期中第一电离能小于 Y 的元素有4种
7.我国学者研发出一种新型水系锌电池,其示意图如下。该电池分别以 (局部结构如标注内
C.转化为 的反应是
所示)形成的稳定超分子材料和 为电极,以 和 混合液为电解质溶液。下列说法正确的
D.每获得 时,转移电子的数目为
是
9. 冠醚能与碱金属离子结合(如下图所示),是有机反应很好的催化剂,如能加快KMnO 与环己烯的
4
反应速率。
+ K+
用结合常数表示冠醚与碱金属离子的结合能力,结合常数越大,两者结合能力越强。
A. 标注框内所示结构中存在
共价键和配位键、离子键
B.电池总反应为:
C.充电时,阴极被还原的 主要来自 下列说法不正确的是
D.放电时,消耗 ,理论上转移0.01mol电子 A.推测结合常数的大小与碱金属离子直径、冠醚空腔直径有关
8.某 多孔材料孔径大小和形状恰好将 “固定”,能高选择性吸附 。废气中的 被 B.实验 中c(Na+):①>②>③
吸附后,经处理能全部转化为 。原理示意图如下。 C.冠醚通过与K+结合将MnO−携带进入有机相,从而加快反应速率
4
D.为加快KMnO 与环己烯的反应速率,选择冠醚A比冠醚B更合适
4
10.常温下,将4.0 g铁钉加入到30 mL 4%的CuSO 溶液中,能观察到铁钉表面产生气泡,且反应初
4
期生成气泡的速率逐渐加快,过程中氧气含量和溶液pH变化如下图所示。
量
含
气
氧
时间 时间
Hp
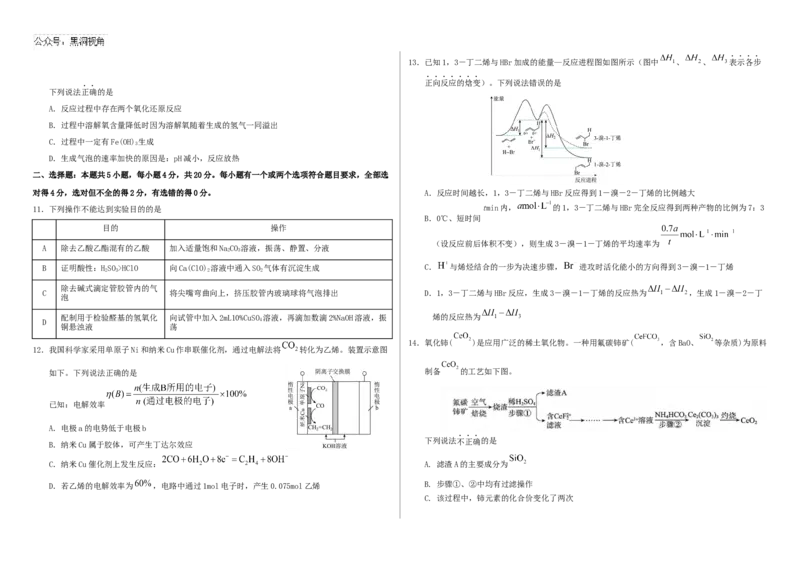
713.已知1,3-丁二烯与HBr加成的能量—反应进程图如图所示(图中 、 、 表示各步
正向反应的焓变)。下列说法错误的是
下列说法正确的是
A.反应过程中存在两个氧化还原反应
B.过程中溶解氧含量降低时因为溶解氧随着生成的氢气一同溢出
C.过程中一定有Fe(OH) 生成
3
D.生成气泡的速率加快的原因是:pH减小,反应放热
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目要求,全部选
对得4分,选对但不全的得2分,有选错的得0分。 A.反应时间越长,1,3-丁二烯与HBr反应得到1-溴-2-丁烯的比例越大
11.下列操作不能达到实验目的的是 tmin内, 的1,3-丁二烯与HBr完全反应得到两种产物的比例为7:3
B.0℃、短时间
目的 操作
(设反应前后体积不变),则生成3-溴-1-丁烯的平均速率为
A 除去乙酸乙酯混有的乙酸 加入适量饱和NaCO 溶液,振荡、静置、分液
2 3
B 证明酸性:HSO>HClO 向Ca(ClO) 溶液中通入SO 气体有沉淀生成 C. 与烯烃结合的一步为决速步骤, 进攻时活化能小的方向得到3-溴-1-丁烯
2 3 2 2
除去碱式滴定管胶管内的气
C 将尖嘴弯曲向上,挤压胶管内玻璃球将气泡排出 D.1,3-丁二烯与HBr反应,生成3-溴-1-丁烯的反应热为 ,生成1-溴-2-丁
泡
配制用于检验醛基的氢氧化 向试管中加入2mL10%CuSO 溶液,再滴加数滴2%NaOH溶液,振 烯的反应热为
D 4
铜悬浊液 荡
14.氧化铈( )是应用广泛的稀土氧化物。一种用氟碳铈矿( ,含BaO、 等杂质)为原料
12.我国科学家采用单原子Ni和纳米Cu作串联催化剂,通过电解法将 转化为乙烯。装置示意图
如下。下列说法正确的是 制备 的工艺如下图。
已知:电解效率
A.电极a的电势低于电极b
下列说法不正确的是
B.纳米Cu属于胶体,可产生丁达尔效应
C.纳米Cu催化剂上发生反应: A. 滤渣A的主要成分为
D.若乙烯的电解效率为 ,电路中通过1mol电子时,产生0.075mol乙烯 B. 步骤①、②中均有过滤操作
C. 该过程中,铈元素的化合价变化了两次(2)先将NaBH₄和BF₃溶于二乙二醇二甲醚(CH₃OCH₂CH₂OCH₂CH₂OCH₃)中,充分溶解,再加入
D. 步骤②反应的离子方程式为
四氢呋喃,反应30 min、分离提纯即得较纯净的BH₃·THF,同时还有另一种产物NaF。
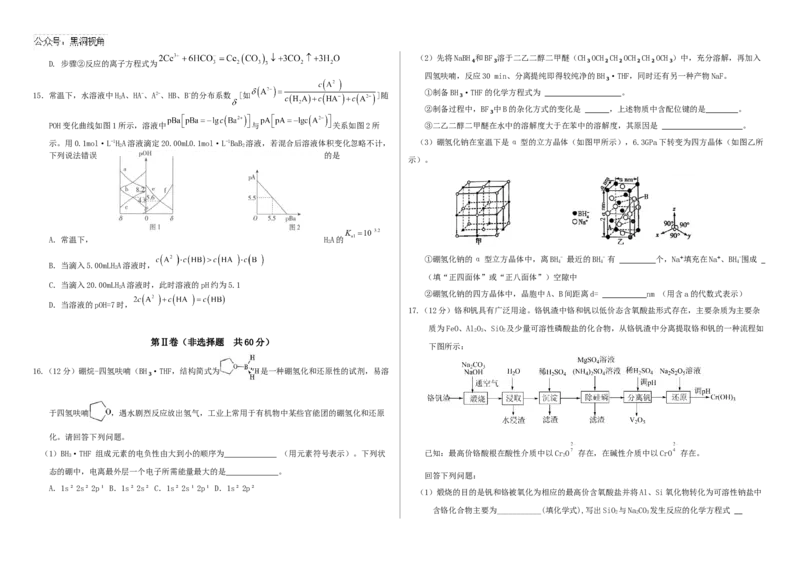
15.常温下,水溶液中HA、HA-、A2-、HB、B-的分布系数 [如 ]随
①制备BH₃·THF的化学方程式为 。
2
②制备过程中,BF₃中B的杂化方式的变化是 ,上述物质中含配位键的是 。
POH变化曲线如图1所示,溶液中 与 关系如图2所 ③二乙二醇二甲醚在水中的溶解度大于在苯中的溶解度,其原因是 。
示。用0.1mol·L-1HA溶液滴定20.00mL0.1mol·L-1BaB 溶液,若混合后溶液体积变化忽略不计, (3)硼氢化钠在室温下是α型的立方晶体(如图甲所示),6.3GPa下转变为四方晶体(如图乙所
2 2
下列说法错误 的是
示)。
A.常温下, HA的
2
①硼氢化钠的α型立方晶体中,离BH
4
- 最近的BH
4
- 有 个,Na⁺填充在Na⁺、BH
4
-围成
B.当滴入5.00mLHA溶液时,
2
(填“正四面体”或“正八面体”)空隙中
C.当滴入20.00mLHA溶液时,此时溶液的pH约为5.1
2
②硼氢化钠的四方晶体中,晶胞中A、B间距离d= nm (用含a的代数式表示)
D.当溶液的pOH=7时,
17.(12分)铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为主要杂
质为FeO、AlO、SiO 及少量可溶性磷酸盐的化合物,从铬钒渣中分离提取铬和钒的一种流程如
2 3 2
第Ⅱ卷(非选择题 共60分)
下图所示:
16.(12分)硼烷-四氢呋喃(BH₃·THF,结构简式为 是一种硼氢化和还原性的试剂,易溶
于四氢呋喃 ,遇水剧烈反应放出氢气,工业上常用于有机物中某些官能团的硼氢化和还原
化。请回答下列问题。
(1)BH·THF 组成元素的电负性由大到小的顺序为 (用元素符号表示)。下列状 已知:最高价铬酸根在酸性介质中以CrO 存在,在碱性介质中以CrO 存在。
3 2
态的硼中,电离最外层一个电子所需能量最大的是 。
回答下列问题:
A.1s²2s²2p¹ B.1s²2s² C.1s²2s¹2p¹ D.1s²2p²
(1)煅烧的目的是钒和铬被氧化为相应的最高价含氧酸盐并将Al、Si氧化物转化为可溶性钠盐中
含铬化合物主要为___________(填化学式),写出SiO 与NaCO 发生反应的化学方程式
2 2 3。 (4)二氯异氰尿酸钠缓慢水解可产生HClO消毒灭菌,通过下列实验检测二氯异氰尿酸钠样品的有
(2) 元素在_______(填操作单元的名称)过程中以 物质除去(写化学式)。第二次 效氯。准确称取mg样品,用容量瓶配成100mL溶液;取25.00mL上述溶液于碘量瓶中,加入适
酸化除了把钒元素以V 2 O 5 形式沉淀,另一主要目的是_________。 量稀硫酸和过量KI溶液,密封,在暗处静置5min;用0.1000 mol· L-1 Na 2 S 2 O 3 标准溶液滴定
(3)“沉淀”步骤调pH到弱碱性,主要除去的杂质是___________。
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO 和MgNHPO 的形式沉淀,该步需要控制溶液的 至溶液呈微黄色,加入淀粉,继续滴定至终点,消耗 溶液VmL。[
3 4 4
pH≈9以达到最好的除杂效果,若pH<9时,会导致___________;pH>9时,会导致
___________。 、 ]已知:
(5)“还原”步骤中加入焦亚硫酸钠(NaSO)溶液,反应的离子方程式为___________。
2 2 5
18.(12分)二氯异氰尿酸钠为白色固体,难溶于冷水,是一种高效、安全的氧化性消毒剂。实验室
该样品的有效氯= 。
用如图所示装置制备(夹持装置已略去)。回答下列问题:
①样品的有效氯测定值为___________%(用含m、V的代数式表示)。
②下列操作会导致样品的有效氯测定值偏高的是___________(填序号)。
A.盛装 标准溶液的滴定管未润洗
B.滴定管在滴定前无气泡,滴定后有气泡
C.碘量瓶中加入的稀硫酸偏少
D.滴定结束的时候仰视读数
19.(12分)从低品位铜镍矿(含有FeO、FeO、MgO、CuO等杂质)资源中提取镍和铜的一种工艺流
2 3
程如下:
已知:实验原理为 HSO
有机层 2 4 含Cu2+水溶液 金属铜
反萃取
(1)仪器a名称为___________,装置A中的药品不能选择___________。 O 2 /H 2 SO 4 HR(萃取剂)
铜镍矿 浸出液
研磨 浸出 萃取 黄钠铁矾固体
A. B. C. D. NaSO/MgO
2 4
水层
过滤
MgO
(2)装置B的作用是 ,用平衡原理解释30%硫酸的作用___________。 滤液 Ni(OH) 2固体 金属镍
过滤
资料:一些物质的Ksp(25 ℃)如下。
(3)当从装置C中观察到___________时,加入 溶液,实验过程中C的温度必须保持在
17~20℃,pH控制在6.5~8.5,则该实验的受热方式是___________,若温度过高,pH值过低, 物质 Fe(OH)2 Fe(OH)3 Mg(OH)2 Ni(OH)2
会生成 写出 生成 的离子方程式:___________。Ksp 4.9×10−17 2.8×10−39 5.6×10−12 2.1×10−15 ①
②
(1)上述流程中,加快反应速率的措施是________。
(2)浸出过程中通入O2的目的是________。 ③
(3)萃取时发生反应:Cu2+ + 2HR CuR2 + 2H+(HR、CuR2在有机层,Cu2+、H+在水层)。
④
① 某种HR的结构简式为 ,该分子中可能与Cu2+形成配位键的原子有______。
回答下列问题:
② 解释反萃取时H2SO4的作用:_______。
(1)已知:298K时,18g气态水转化为液态水释放出44kJ的能量;HS(g)的标准摩尔燃烧焓
(4)反萃取所得含Cu2+水溶液中加入铁粉可得粗铜,粗铜经酸浸处理,再进行电解精炼;需要保 2
持电解时用酸化的CuSO 溶液做电解液,并维持一定的c(H+)和c(Cu2+)。 (△H)为-586kJ·mol-1,则COS(g)的标准摩尔燃烧焓( )为 kJ·mol-1,反应②在
4
①电解时电解池需要保持合理的电压,电压不能过低与过高的原因是______。
(填“高温”“低温”或“任意温度”)下能自发进行。
②粗铜若未经酸浸处理,消耗相同电量时,会降低得到纯铜的量,原因是 。
(2)一定条件下,向起始压强为200kPa的恒容密闭容器中通入等物质的量的CO(g)和HS(g)混
2 2
(5)黄钠铁矾[NaFe3(OH)6(SO4)2]比Fe(OH)3更易形成沉淀。反应终点pH与Fe3+、Ni2+沉淀率的
合气体,发生上述反应,25min时,测得体系总压强为210kPa,S(g)的平均反应速率为
关系如下表。 2
kPa·min-1.达到
沉淀率/%
平 衡时,测得体系
反应终点pH
Fe3+ Ni2+
总 压强为230kPa,
1.5 94.04 0.19
2.5 99.21 0.56
3.8 99.91 3.31
①生成黄钠铁矾的离子方程式是______。
②沉淀Fe3+时最适宜选用的反应终点pH是_______。
,此时HS(g)的平衡转化率为 ,反应②的标准平衡常数
2
(已知:分压=总压×该组分物质的量分数,对于反应
20.(12分)天然气、石油钻探过程会释放出CO、HS等气体。某种将CO 和HS共活化的工艺涉及如
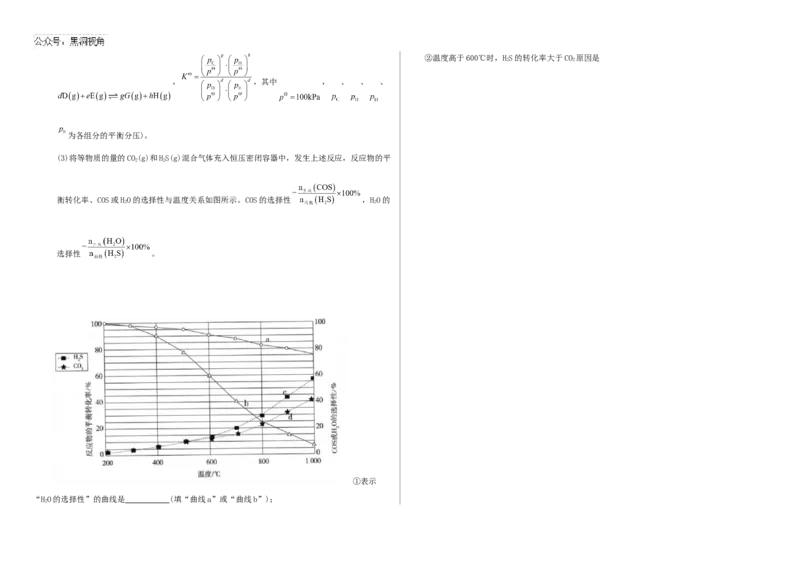
2 2 2 2
下反应:②温度高于600℃时,HS的转化率大于CO 原因是
2 2
, ,其中 , 、 、 、
为各组分的平衡分压)。
(3)将等物质的量的CO(g)和HS(g)混合气体充入恒压密闭容器中,发生上述反应,反应物的平
2 2
衡转化率、COS或HO的选择性与温度关系如图所示。COS的选择性 ,HO的
2 2
选择性 。
①表示
“HO的选择性”的曲线是 (填“曲线a”或“曲线b”);
2