文档内容
秘密★启用前
嘉陵一中高 2023 级高二上期第二次月考化学试题
(考试时间:75分钟 总分:100分)
注意事项:
1. 答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2. 回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦干
净后,再选涂其它答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷上无效。
3. 考试结束后,将答题卡交回。
可能用到的相对原子质量: H-1 C-12 N-14 O-16 Fe-56 Cu-64
一、选择题(包括14个小题,每小题3分,共42分, 每小题只有一个选项符合题意)
1.下列措施不利于实现碳达峰、碳中和的是
A.光伏发电、风力发电代替燃煤发电 B.氢氧燃料电池汽车代替燃油汽车
C.利用CO 和H 合成淀粉 D.开采可燃冰CH 代替煤作燃料
2 2 4
2. 下列方程式中,属于水解反应的是
A.HCOOH HCOO- +H+
B.CO + H O HCO - + H+
2 2 3
C.HCO -+ H O CO 2-+H O+
3 2 3 3
D.HS- + H O H S + OH-
2 2
3.常温下,将0.1molL1的NH SO 溶液加水稀释至0.01molL1的过程中,下列说法错误的是
4 2 4
A.c
NH
c
SO2
B.稀释前后,溶液中的氧元素总质量保持不变
4 4
C.n
SO2
保持不变 D.c
H
c
OH
4
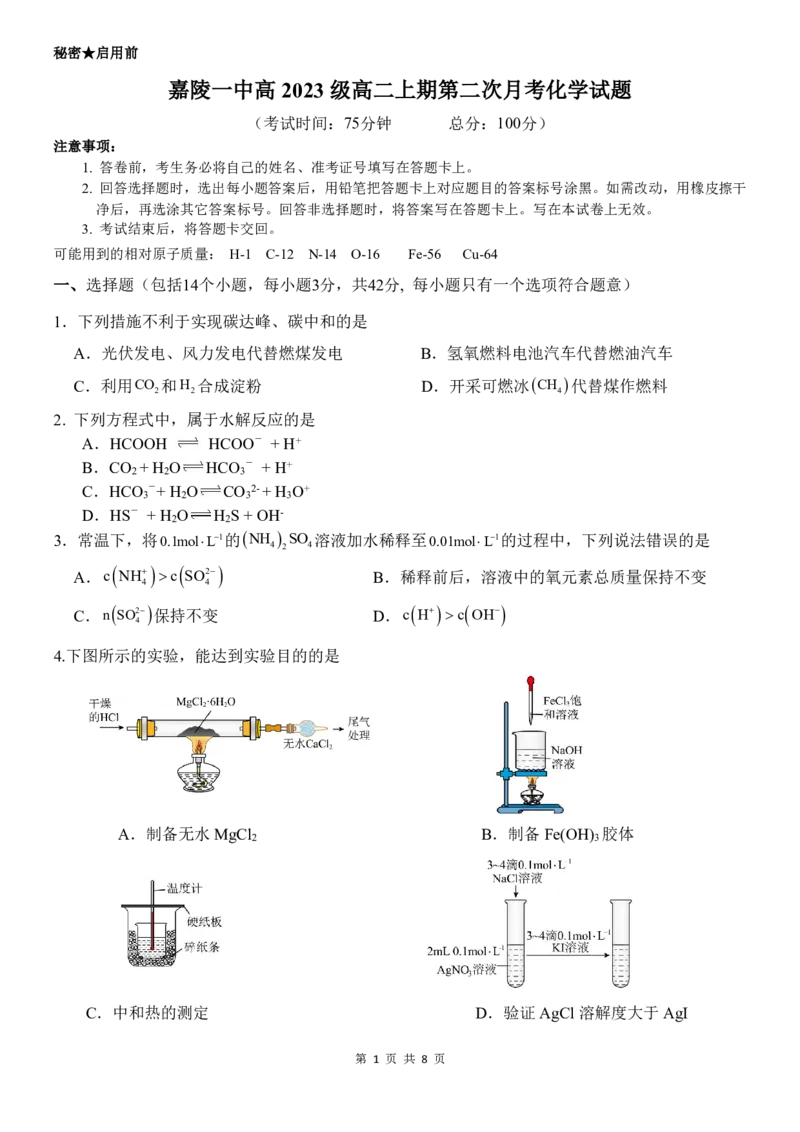
4.下图所示的实验,能达到实验目的的是
A.制备无水 MgCl B.制备Fe(OH) 胶体
2 3
C.中和热的测定 D.验证AgCl 溶解度大于AgI
第 1 页 共 8 页5.铜锌原电池(如图)工作时,下列叙述正确的是
A.正极反应为 Zn-2e-=Zn2+
B.盐桥中的K+移向ZnSO 溶液
4
C.Cu 电极发生还原反应
D.在外电路中,电流从负极流向正极
6. 设N 为阿伏加德罗常数的值。下列说法正确的是
A
A.1L0.1mol·L-1MgCl 溶液含Mg2+的数目为0.1N
2 A
B.密闭容器中2molSO 和1molO 充分反应后,容器中分子数为2N
2 2 A
C.氯碱工业中阴极产生22.4L气体(标况),则理论上转移的电子数为2N
A
D.1L1mol·L-1CH COOH溶液含有的离子总数为2N
3 A
7.常温下,下列各组离子一定能大量共存的是
A.澄清透明的溶液中:K+、Fe3+、MnO、NO
4 3
B.由水电离产生的c H+ 1012mol/L的溶液中:K+、Na 、ClO 、I
C.能使甲基橙变红的溶Al液O中、 :Na+、Al3+、SO2、CO
2-
2 4 3
c
OH
D.常温下, 11012的溶液:K+、S2、SiO2、Na+
c H 3
8.将一定量CO 和H 充入恒容密闭容器,发生反应:CO g 3H g CHOH g HO g ΔH49kJmol1
2 2 2 2 3 2
H 的物质的量随时间的变化如实线甲所示,若变为虚线乙,可能改变的条件是( )
2
A.增大CO 的浓度 B.加催化剂
2
C.充入N D.升高温度
2
第 2 页 共 8 页9. 下列关于水的电离H 2 O⇌ H++OH− ΔH>0 的说法不 . 正 . 确 . 的是
A. 将水加热至 50℃,水的电离平衡正向移动,水依然呈中性
B. 向水中加入少量NaOH,水的电离平衡逆向移动,溶液呈碱性
C. 向水中加入少量NH Cl,水的电离平衡正向移动,溶液呈酸性
4
D. 常温下,pH=2 的盐酸中,水电离的c(H+)=1.0×10−2mol·L−1
10. 向体积为Va mL0.05mol·L-1CH COOH溶液中加入体积为V mL0.05mol·L-1KOH溶液,
3 b
下列关系错误的是
A.Va>V 时:c (CH COOH) +c (CH COO-)>c (K+)
b 3 3
B.Va=V 时:c(CH COOH)+c (H+)=c (OH-)
b 3
C.Vac (K+)> c(OH-)> c(H+)
b 3
D.Va与V 任意比时:c(K+)+ c(H+) =c (OH-)+c (CH COO-)
b 3
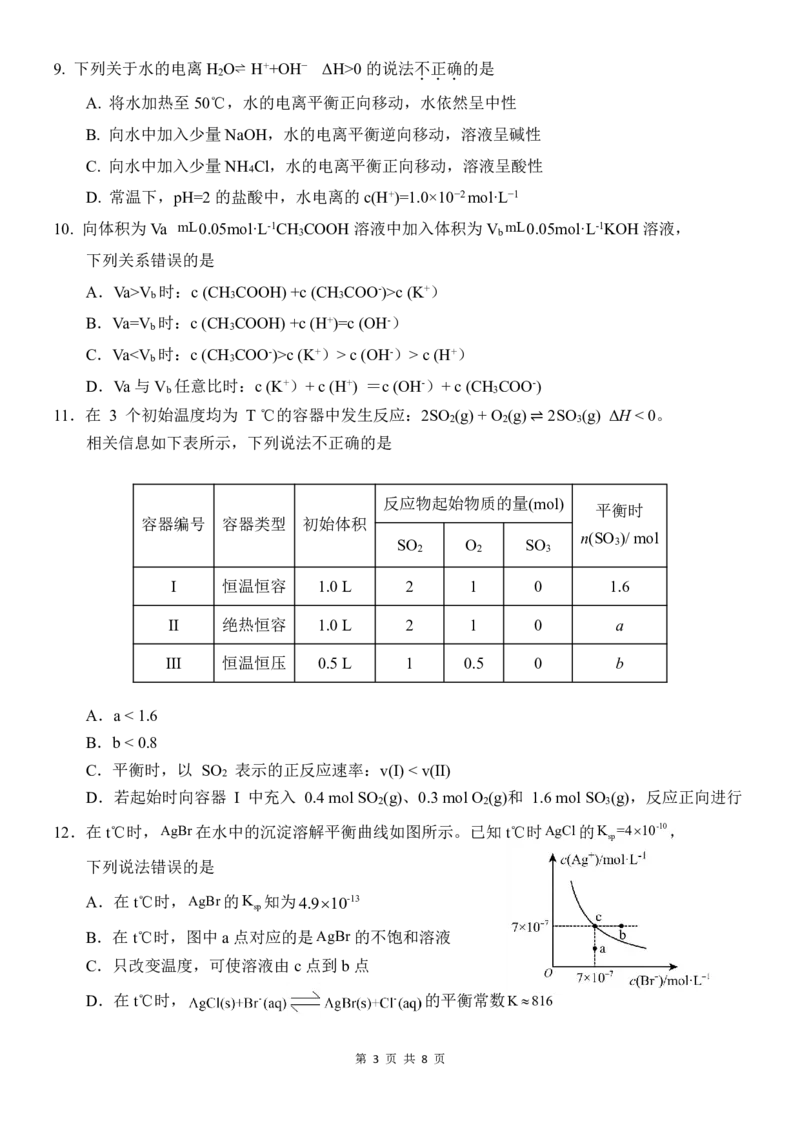
11.在 3 个初始温度均为 T℃的容器中发生反应:2SO (g) +O (g) 2SO (g) ΔH <0。
2 2 3
相关信息如下表所示,下列说法不正确的是
⇌
反应物起始物质的量(mol)
平衡时
容器编号 容器类型 初始体积
n(SO )/ mol
SO O SO 3
2 2 3
I 恒温恒容 1.0L 2 1 0 1.6
II 绝热恒容 1.0L 2 1 0 a
III 恒温恒压 0.5L 1 0.5 0 b
A.a< 1.6
B.b< 0.8
C.平衡时,以 SO 表示的正反应速率:v(I) < v(II)
2
D.若起始时向容器 I 中充入 0.4mol SO (g)、0.3mol O (g)和 1.6mol SO (g),反应正向进行
2 2 3
12.在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。已知t℃时AgCl的K =410-10,
sp
下列说法错误的是
A.在t℃时,AgBr的K 知为4.910-13
sp
B.在t℃时,图中a 点对应的是AgBr的不饱和溶液
C.只改变温度,可使溶液由c 点到b 点
D.在t℃时, 的平衡常数K816
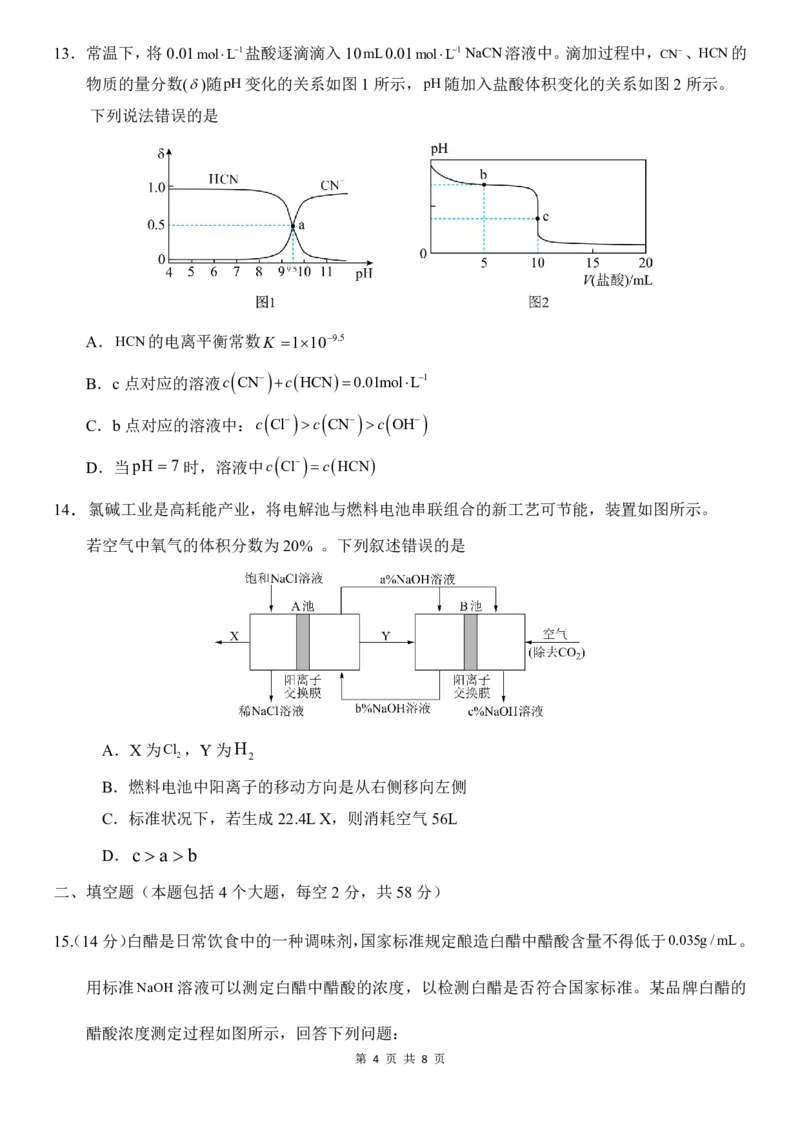
第 3 页 共 8 页13.常温下,将0.01molL1盐酸逐滴滴入10mL0.01molL1 NaCN溶液中。滴加过程中, CN、HCN的
物质的量分数()随pH变化的关系如图1所示,pH随加入盐酸体积变化的关系如图2所示。
下列说法错误的是
A.HCN的电离平衡常数K 1109.5
B.c 点对应的溶液c CN c HCN 0.01molL1
C.b点对应的溶液中:c
Cl
c
CN
c
OH
D.当pH 7 时,溶液中c Cl cHCN
14.氯碱工业是高耗能产业,将电解池与燃料电池串联组合的新工艺可节能,装置如图所示。
若空气中氧气的体积分数为20% 。下列叙述错误的是
A.X为Cl ,Y为H
2 2
B.燃料电池中阳离子的移动方向是从右侧移向左侧
C.标准状况下,若生成22.4LX,则消耗空气56L
D.c a b
二、填空题(本题包括4个大题,每空2分,共58分)
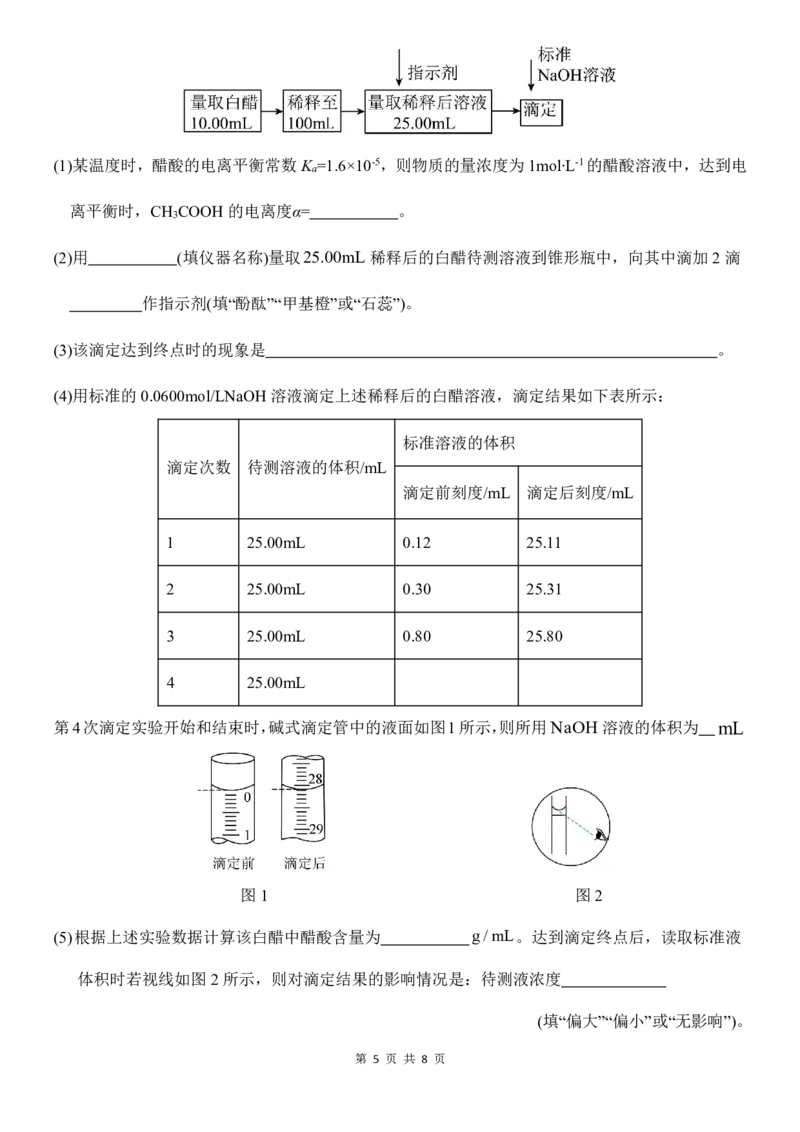
15(. 14分)白醋是日常饮食中的一种调味剂,国家标准规定酿造白醋中醋酸含量不得低于0.035g/mL。
用标准NaOH溶液可以测定白醋中醋酸的浓度,以检测白醋是否符合国家标准。某品牌白醋的
醋酸浓度测定过程如图所示,回答下列问题:
第 4 页 共 8 页(1)某温度时,醋酸的电离平衡常数K =1.6×10-5,则物质的量浓度为1mol∙L-1的醋酸溶液中,达到电
a
离平衡时,CH COOH的电离度α= 。
3
(2)用 (填仪器名称)量取25.00mL 稀释后的白醋待测溶液到锥形瓶中,向其中滴加2滴
作指示剂(填“酚酞”“甲基橙”或“石蕊”)。
(3)该滴定达到终点时的现象是 。
(4)用标准的0.0600mol/LNaOH溶液滴定上述稀释后的白醋溶液,滴定结果如下表所示:
标准溶液的体积
滴定次数 待测溶液的体积/mL
滴定前刻度/mL 滴定后刻度/mL
1 25.00mL 0.12 25.11
2 25.00mL 0.30 25.31
3 25.00mL 0.80 25.80
4 25.00mL
第4次滴定实验开始和结束时,碱式滴定管中的液面如图1所示,则所用NaOH 溶液的体积为 mL
图1 图2
(5)根据上述实验数据计算该白醋中醋酸含量为 g/mL。达到滴定终点后,读取标准液
体积时若视线如图2所示,则对滴定结果的影响情况是:待测液浓度
(填“偏大”“偏小”或“无影响”)。
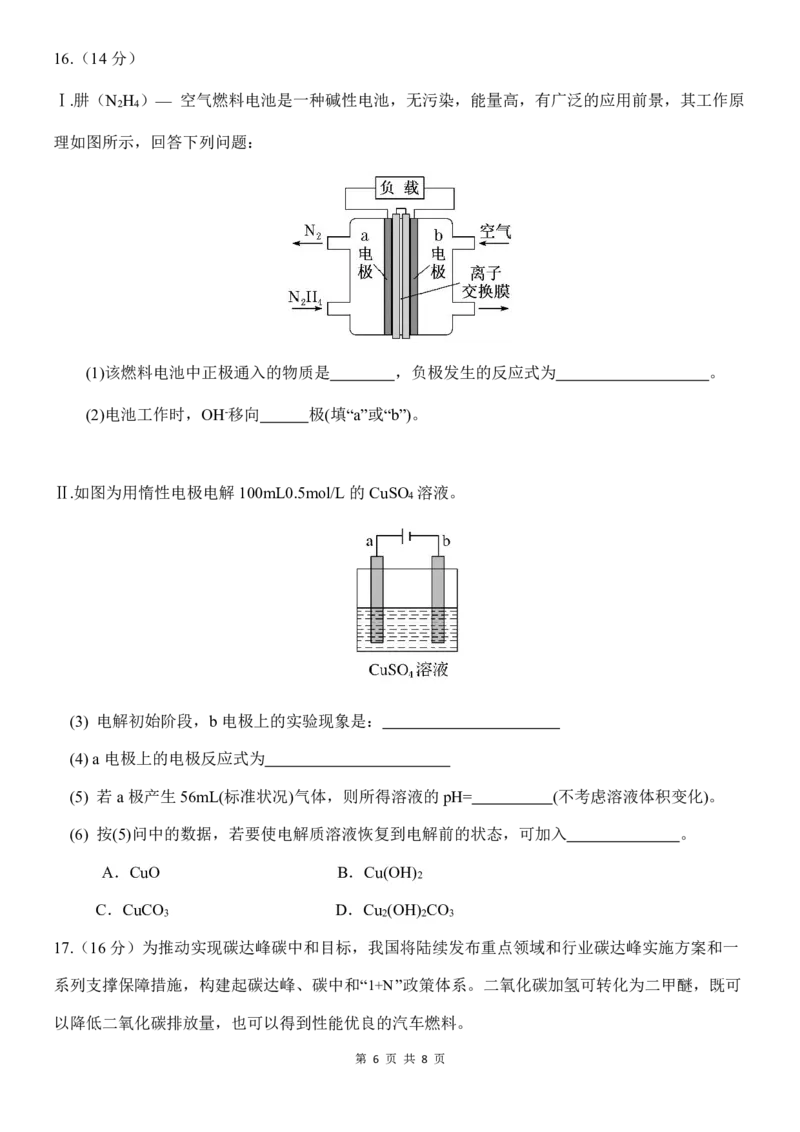
第 5 页 共 8 页16.(14分)
Ⅰ.肼(N H )— 空气燃料电池是一种碱性电池,无污染,能量高,有广泛的应用前景,其工作原
2 4
理如图所示,回答下列问题:
(1)该燃料电池中正极通入的物质是 ,负极发生的反应式为 。
(2)电池工作时,OH-移向 极(填“a”或“b”)。
Ⅱ.如图为用惰性电极电解100mL0.5mol/L 的CuSO 溶液。
4
(3) 电解初始阶段,b电极上的实验现象是:
(4)a 电极上的电极反应式为
(5) 若a 极产生56mL(标准状况)气体,则所得溶液的pH= (不考虑溶液体积变化)。
(6) 按(5)问中的数据,若要使电解质溶液恢复到电解前的状态,可加入 。
A.CuO B.Cu(OH)
2
C.CuCO D.Cu (OH) CO
3 2 2 3
17.(16分)为推动实现碳达峰碳中和目标,我国将陆续发布重点领域和行业碳达峰实施方案和一
系列支撑保障措施,构建起碳达峰、碳中和“1+N”政策体系。二氧化碳加氢可转化为二甲醚,既可
以降低二氧化碳排放量,也可以得到性能优良的汽车燃料。
第 6 页 共 8 页回答下列问题:
(1)已知:①CO (g)+3H (g) CH OH(g)+H O(g) H =-49.0kJ mol-1
2 2 3 2 1
∆ ∙
②2CH OH(g)CH OCH (g)+H O(g) H =-23.5kJ mol-1
3 3 3 2 2
∆ ∙
制取二甲醚的热化学方程式为:2CO (g)+6H (g) CH OCH (g)+3H O(g) H,
2 2 3 3 2
则 H= 。 ∆
(2)往一∆容积为2L的恒容密闭容器中通入2molCO和6molH ,一定温度下发生反应:
2
2CO (g)+6H (g) CH OCH (g)+3H O(g) ,起始总压为p ,20min时达到化学平衡状态,
2 2 3 3 2 0
测得CH OCH 的物质的量分数为12.5%。
3 3
①达到化学平衡状态时,下列有关叙述正确的是 (填字母序号)。
a.容器内气体压强不再发生改变
b.正、逆反应速率相等且均为零
c.向容器内再通入1mol CO 和3mol H ,重新达平衡后CH OCH 体积分数增大
2 2 3 3
d.向容器内通入少量氦气,则平衡向正反应方向移动
②0~20min内,用H 表示的平均反应速率vH = ,CO 的平衡转化率αCO = ;
2 2 2 2
该温度下,反应的平衡常数K =
P
(用含p 的式子表达,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
0
③升高温度,二甲醚的平衡产率 (填“增大”、“减小”或“不变”),
简述理由: 。
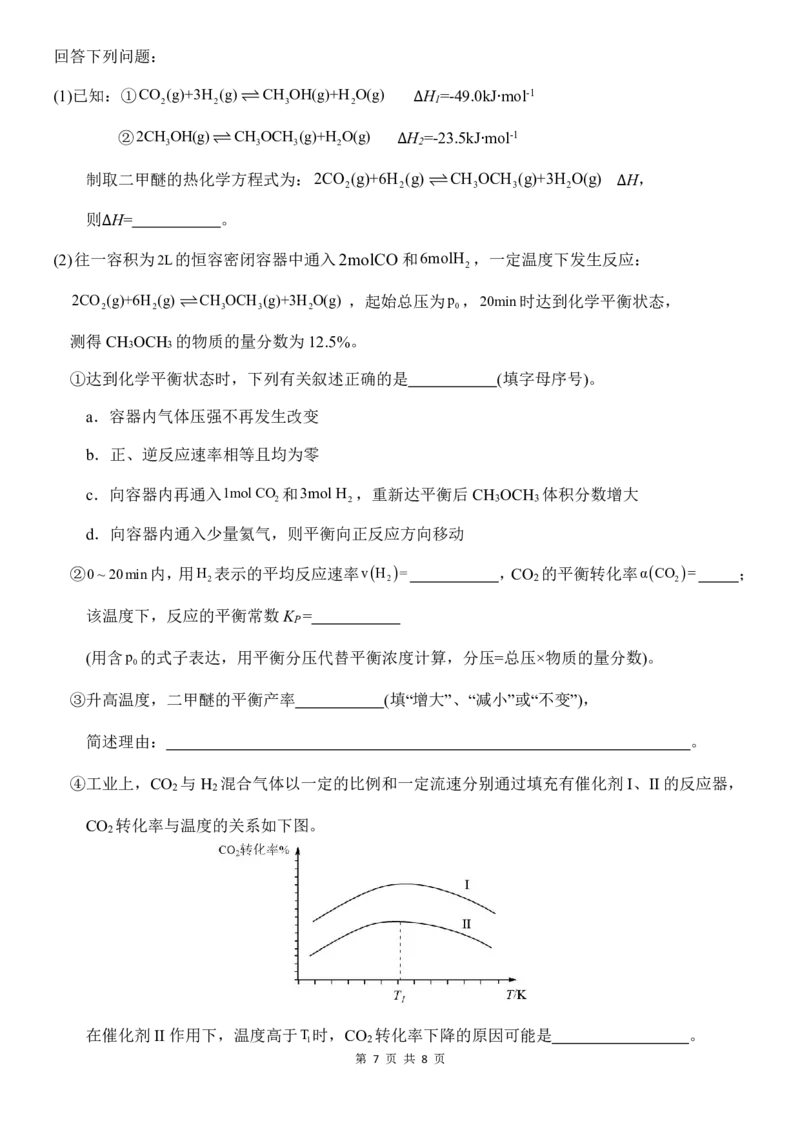
④工业上,CO 与H 混合气体以一定的比例和一定流速分别通过填充有催化剂 I、II 的反应器,
2 2
CO 转化率与温度的关系如下图。
2
在催化剂II 作用下,温度高于T时,CO 转化率下降的原因可能是 。
1 2
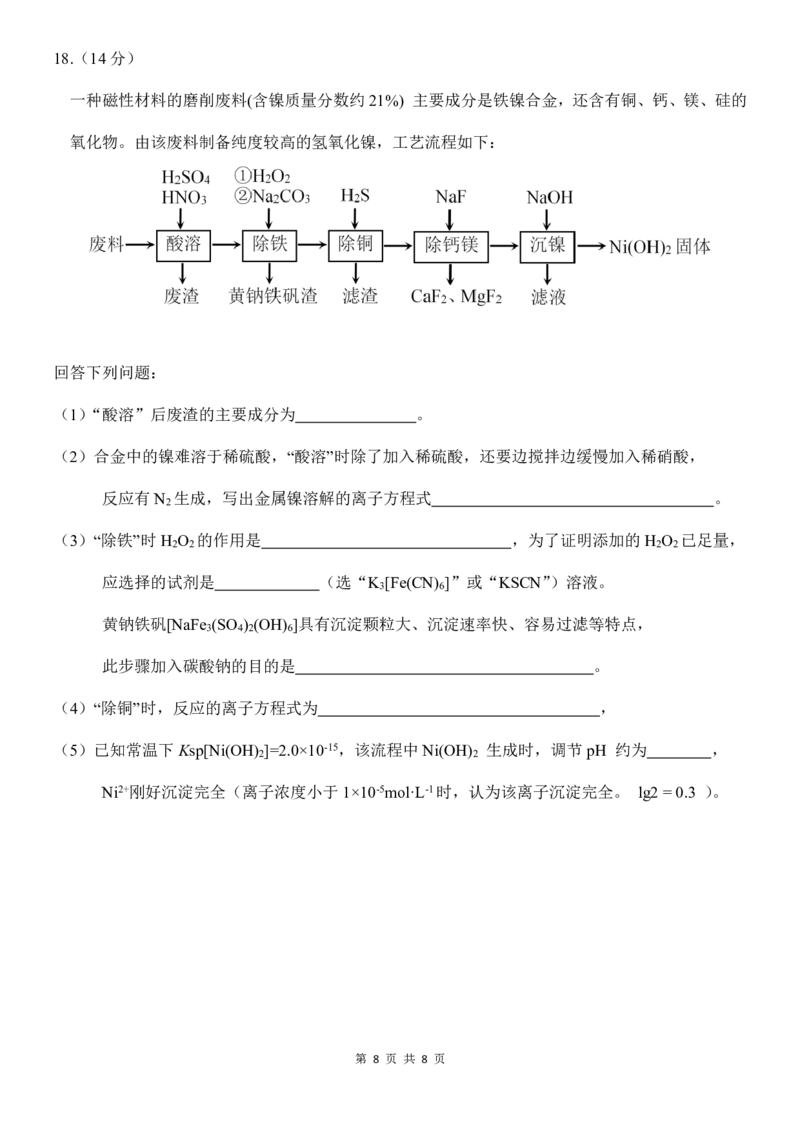
第 7 页 共 8 页18.(14分)
一种磁性材料的磨削废料(含镍质量分数约 21%) 主要成分是铁镍合金,还含有铜、钙、镁、硅的
氧化物。由该废料制备纯度较高的氢氧化镍,工艺流程如下:
回答下列问题:
(1)“酸溶”后废渣的主要成分为 。
(2)合金中的镍难溶于稀硫酸,“酸溶”时除了加入稀硫酸,还要边搅拌边缓慢加入稀硝酸,
反应有N 生成,写出金属镍溶解的离子方程式 。
2
(3)“除铁”时H O 的作用是 ,为了证明添加的H O 已足量,
2 2 2 2
应选择的试剂是 (选“K [Fe(CN) ]”或“KSCN”)溶液。
3 6
黄钠铁矾[NaFe (SO ) (OH) ]具有沉淀颗粒大、沉淀速率快、容易过滤等特点,
3 4 2 6
此步骤加入碳酸钠的目的是 。
(4)“除铜”时,反应的离子方程式为 ,
(5)已知常温下Ksp[Ni(OH) ]=2.0×10-15,该流程中Ni(OH) 生成时,调节pH 约为 ,
2 2
Ni2+刚好沉淀完全(离子浓度小于1×10-5mol·L-1时,认为该离子沉淀完全。 lg2 = 0.3 )。
第 8 页 共 8 页