文档内容
2024-2025 学年度上学期第一次月考
高二化学试题
本试卷分选择题和填空题两部分,共19题,共100分,共5页.考试时间为75分钟.考试结
束后,只交答题卡.
第Ⅰ卷 选择题
本题共15小题,每小题3分,共45分.在每小题给出的四个选项中,只有一项是符合题目要
求的.
1.我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器因受到环境腐蚀,对其进行修
复和防护具有重要意义.研究发现,腐蚀严重的青铜器表面大都存在 .下列关于 在青铜器腐蚀
过程中的催化作用的叙述错误的是( )
A.降低了反应的活化能 B.增大了反应的速率
C.增大了反应的平衡常数 D.增大了单位体积内活化分子百分数
2.下列不能用焓判据解释的自发进行的过程是( )
A.铁在潮湿空气中生锈了 B.天然气的燃烧
C.铜在潮湿空气中产生铜绿 D. 与 反应产生
3.对于工业合成氨的反应,以下分析错误的是( )
A.可以通过改变温度、压强控制合成氨的反应限度
B.高压比常压条件更有利于合成氨的反应,是高氨气的产率
C. 左右比室温更有利于合成氨的反应,提高氨气的产率
D.合成氨工业采用高压,不仅能提高转化率,还能缩短到达平衡的时间
4.下列事实中,不能用勒夏特列原理加以解释的是( )
A.夏天,打开啤酒瓶时会在瓶口逸出气体
B.浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体
C.压缩氢气与碘蒸气反应的平衡混合气体,颜色变深
D.将盛有二氧化氨和四氧化二氨混合气的密闭容器置于冷水中,混合气体颜色变浅
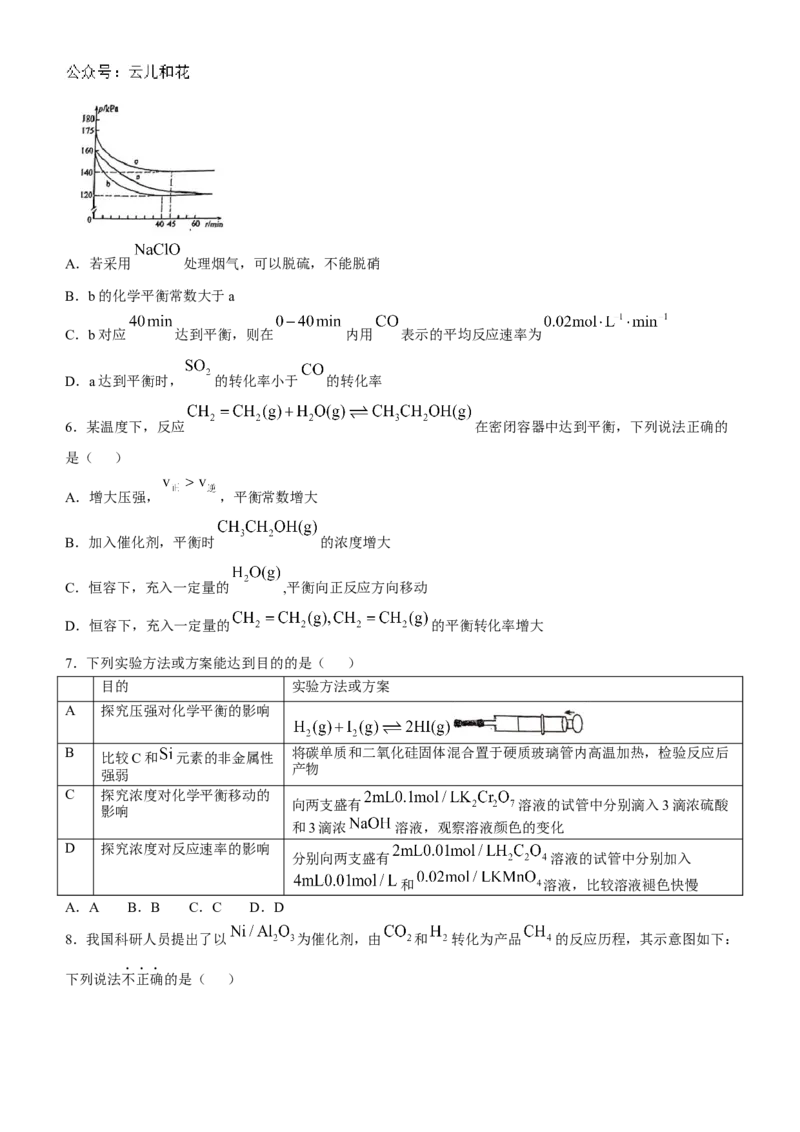
5.煤燃烧排放的烟气含有 和 ,对烟气进行脱疏、脱硝,对环境保护有着重要意义.在脱硫实验中发
生反应: ,在体积为 的恒容密闭容器中,通入
和 ,在不同条件下进行反应时体系的总压强随时间的变化如图所示.下列说法正确的是( )
学科网(北京)股份有限公司A.若采用 处理烟气,可以脱硫,不能脱硝
B.b的化学平衡常数大于a
C.b对应 达到平衡,则在 内用 表示的平均反应速率为
D.a达到平衡时, 的转化率小于 的转化率
6.某温度下,反应 在密闭容器中达到平衡,下列说法正确的
是( )
A.增大压强, ,平衡常数增大
B.加入催化剂,平衡时 的浓度增大
C.恒容下,充入一定量的 ,平衡向正反应方向移动
D.恒容下,充入一定量的 的平衡转化率增大
7.下列实验方法或方案能达到目的的是( )
目的 实验方法或方案
A 探究压强对化学平衡的影响
B 将碳单质和二氧化硅固体混合置于硬质玻璃管内高温加热,检验反应后
比较C和 元素的非金属性
产物
强弱
C 探究浓度对化学平衡移动的
向两支盛有 溶液的试管中分别滴入3滴浓硫酸
影响
和3滴浓 溶液,观察溶液颜色的变化
D 探究浓度对反应速率的影响
分别向两支盛有 溶液的试管中分别加入
和 溶液,比较溶液褪色快慢
A.A B.B C.C D.D
8.我国科研人员提出了以 为催化剂,由 和 转化为产品 的反应历程,其示意图如下:
下列说法不正确的是( )
学科网(北京)股份有限公司A.总反应方程式为:
B.催化剂可有效提高反应物的平衡转化率
C.在反应历程中, 键与 键断裂吸收能量
D.反应过程中,催化剂参与反应,改变反应路径,降低反应的活化能
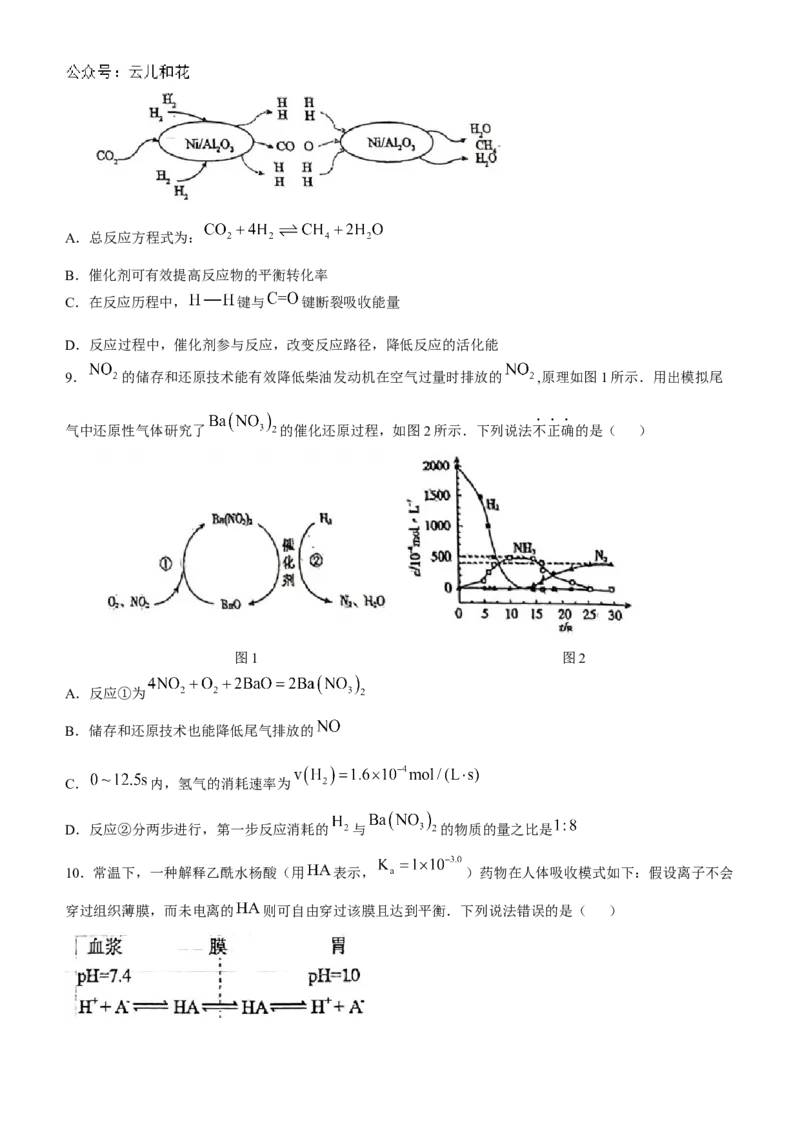
9. 的储存和还原技术能有效降低柴油发动机在空气过量时排放的 ,原理如图1所示.用出模拟尾
气中还原性气体研究了 的催化还原过程,如图2所示.下列说法不正确的是( )
图1 图2
A.反应①为
B.储存和还原技术也能降低尾气排放的
C. 内,氢气的消耗速率为
D.反应②分两步进行,第一步反应消耗的 与 的物质的量之比是
10.常温下,一种解释乙酰水杨酸(用 表示, )药物在人体吸收模式如下:假设离子不会
穿过组织薄膜,而未电离的 则可自由穿过该膜且达到平衡.下列说法错误的是( )
学科网(北京)股份有限公司A.血浆中 电离程度比胃中大 B.在胃中,
C.在血浆中, D.血浆与胃中 相同
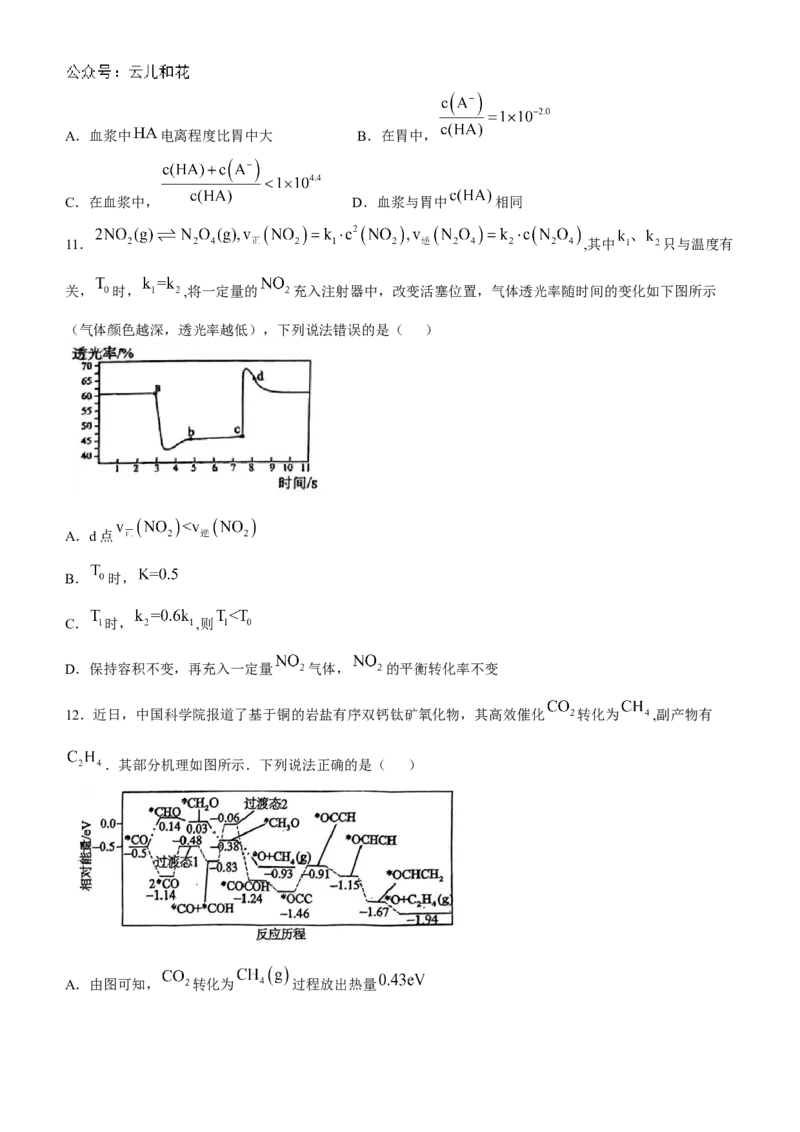
11. ,其中 只与温度有
关, 时, ,将一定量的 充入注射器中,改变活塞位置,气体透光率随时间的变化如下图所示
(气体颜色越深,透光率越低),下列说法错误的是( )
A.d点
B. 时,
C. 时, ,则
D.保持容积不变,再充入一定量 气体, 的平衡转化率不变
12.近日,中国科学院报道了基于铜的岩盐有序双钙钛矿氧化物,其高效催化 转化为 ,副产物有
.其部分机理如图所示.下列说法正确的是( )
A.由图可知, 转化为 过程放出热量
学科网(北京)股份有限公司B.由图可知, 转化为 的历程中,最大活化能为
C. 时,含碳物质结构中存在非极性键的断裂与形成
D.由图可知, 转化为 的反应速率小于 转化为 的反应速率
13.已知部分弱酸的电离平衡常数如下表,下列离子方程式正确的是( )
弱酸
A.少量的 通入 溶液中:
B. 溶液中通入少量的
C.少量的 通入 溶液中:
D.相同浓度的 溶液与 溶液等体积混合:
14.某温度下,在 的密闭容器中,充入 和 进行如下反应:
,反应一段时间达到平衡,测得生成 ,则下列说法正确的是( )
A.增大压强,平衡向逆反应方向移动
B.达平衡后B的转化率为40%
C.增加A,平衡正向移动,化学平衡常数增大
D.若升高温度,A的转化率增大,则该反应
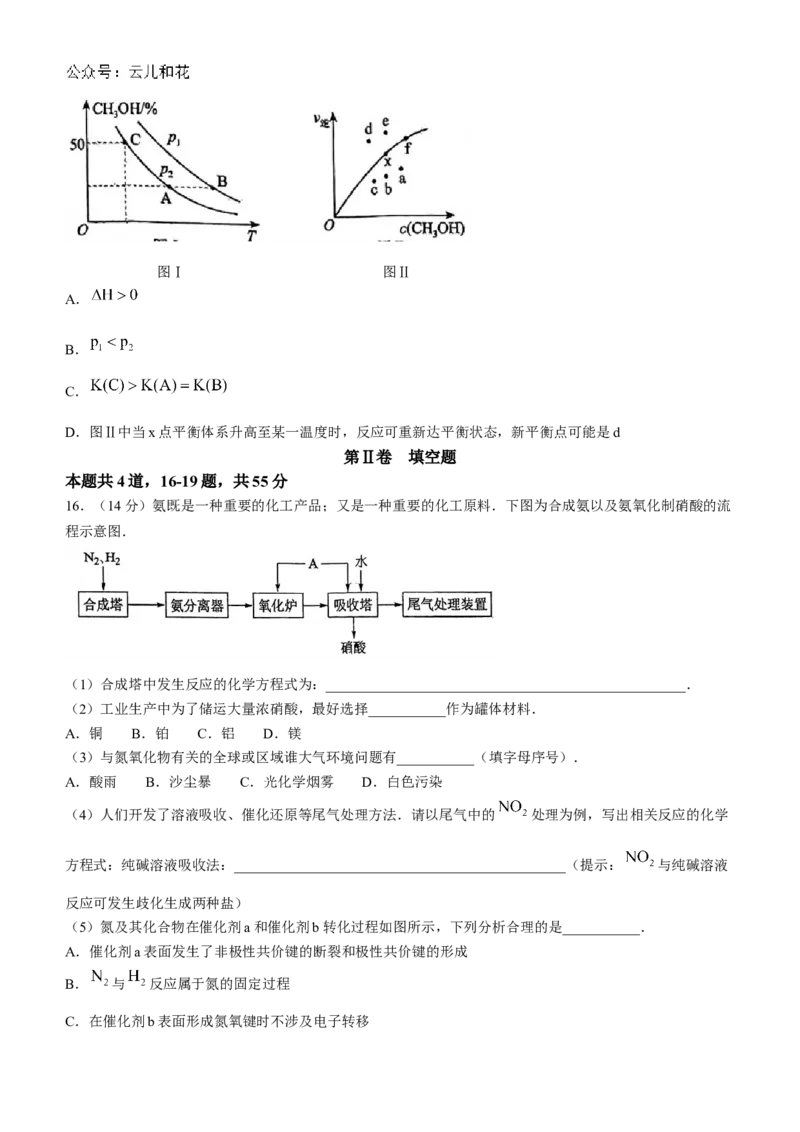
15.向 容器中充入 和 ,发生反应 ,测得
反应在不同压强、不同温度下,平衡混合物中 体积分数如图Ⅰ所示,测得反应时逆反应速率与容器
中 关系如图Ⅱ所示.下列说法正确的是( )
学科网(北京)股份有限公司图Ⅰ 图Ⅱ
A.
B.
C.
D.图Ⅱ中当x点平衡体系升高至某一温度时,反应可重新达平衡状态,新平衡点可能是d
第Ⅱ卷 填空题
本题共4道,16-19题,共55分
16.(14分)氨既是一种重要的化工产品;又是一种重要的化工原料.下图为合成氨以及氨氧化制硝酸的流
程示意图.
(1)合成塔中发生反应的化学方程式为:___________________________________________________.
(2)工业生产中为了储运大量浓硝酸,最好选择___________作为罐体材料.
A.铜 B.铂 C.铝 D.镁
(3)与氮氧化物有关的全球或区域谁大气环境问题有___________(填字母序号).
A.酸雨 B.沙尘暴 C.光化学烟雾 D.白色污染
(4)人们开发了溶液吸收、催化还原等尾气处理方法.请以尾气中的 处理为例,写出相关反应的化学
方程式:纯碱溶液吸收法:_______________________________________________(提示: 与纯碱溶液
反应可发生歧化生成两种盐)
(5)氮及其化合物在催化剂a和催化剂b转化过程如图所示,下列分析合理的是___________.
A.催化剂a表面发生了非极性共价键的断裂和极性共价键的形成
B. 与 反应属于氮的固定过程
C.在催化剂b表面形成氮氧键时不涉及电子转移
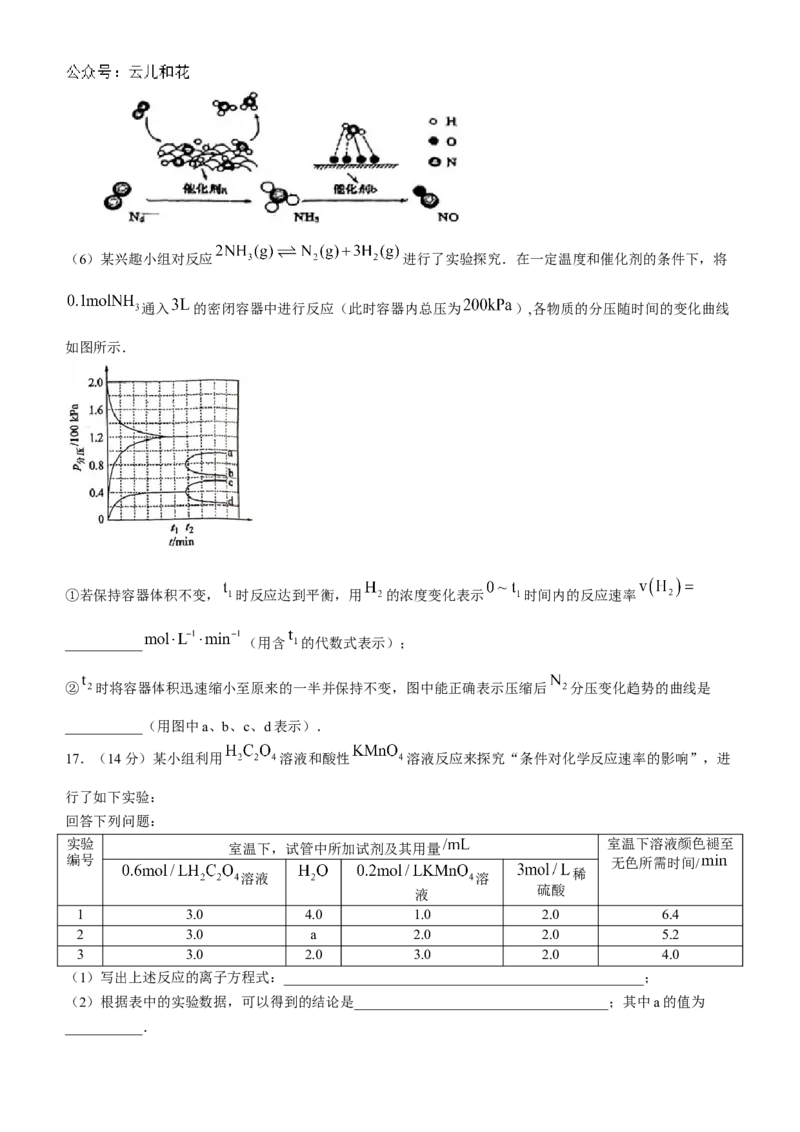
学科网(北京)股份有限公司(6)某兴趣小组对反应 进行了实验探究.在一定温度和催化剂的条件下,将
通入 的密闭容器中进行反应(此时容器内总压为 ),各物质的分压随时间的变化曲线
如图所示.
①若保持容器体积不变, 时反应达到平衡,用 的浓度变化表示 时间内的反应速率
___________ (用含 的代数式表示);
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后 分压变化趋势的曲线是
___________(用图中a、b、c、d表示).
17.(14分)某小组利用 溶液和酸性 溶液反应来探究“条件对化学反应速率的影响”,进
行了如下实验:
回答下列问题:
实验 室温下溶液颜色褪至
室温下,试管中所加试剂及其用量
编号 无色所需时间/
稀
溶液 溶
硫酸
液
1 3.0 4.0 1.0 2.0 6.4
2 3.0 a 2.0 2.0 5.2
3 3.0 2.0 3.0 2.0 4.0
(1)写出上述反应的离子方程式:___________________________________________________;
(2)根据表中的实验数据,可以得到的结论是____________________________________;其中a的值为
___________.
学科网(北京)股份有限公司(3)利用实验3中数据计算,用 的浓度变化表示的反应速率为 ___________.
(4)甲同学发现,草酸溶液与酸性高锰酸钾溶液反应时,褪色总是先慢后快.
①该组乙同学根据甲同学的实验现象提出了以下假设:
假设1:反应放热:
假设2:
②请你帮助该小组同学完成实验方案,并填写表中空白.
实验 室温下,试管中所加试剂及其用量/ 再向试管中 室温下溶液颜色
编号 加入少量固 褪至无色所需时
稀 体 间/
溶液 溶液 硫酸
4 3.0 2.0 3.0 2.0 _________ t
③若该小组同学提出的假设2成立,应观察到的现象是____________________________________.
18(13分)Ⅰ.在一定体积的密闭容器中,进行如下化学反应: ,其化
学平衡常数K和温度t的关系如表:
700 800 830 1000 1200
K 0.6 0.9 1.0 1.7 2.6
(1)该反应的化学平衡常数表达式为 ___________.
(2)该反应为___________反应(填“吸热”或“放热).
(3)能判断该反应是否达到化学平衡状态的依据是___________.
A.容器中压强不变 B.混合气体中 不变
C. D.
(4)某温度下,平衡浓度符合下式: ,试判断此时的温度为
___________℃.
Ⅱ.高炉炼铁中发生的基本反应之一如下: ,其平衡常数
,已知 时, .
(5)温度升高,化学平衡移动后达到新的平衡,高炉内 和 体积比值___________(填“增大”、
“减小”或“不变”):平衡常数K值___________(填“增大”、“减小”或“不变”).
(6) 时测得高炉中, ,在这种情况下,该反应是否处于
化学平衡状态___________(填“是”或“否”),此时 ___________ (填“>”或“=”或“<”).
学科网(北京)股份有限公司19.(14分)催化还原 是实现“碳中和”的重要途径之一、研究表明,在催化剂作用下, 和 发
生反应:
Ⅰ.
Ⅱ.
(1)已知 和 的燃烧热分别为 和 的汽化
热分别为 .则 ___________ .
(2)下列关于反应Ⅰ和反应Ⅱ的说法错误的是___________(填标号).
A.增大 与 的投料比有利于提高 的转化率
B.若 的浓度保持不变,则说明反应体系已达平衡状态
C.体系达到平衡后,若升高温度,两个反应重新建立平衡的时间相同
D.体系达到平衡后,若压缩体积,则反应Ⅰ平衡正向移动,反应如平衡不移动
E.及时将 液化分离,有利于提高反应Ⅰ的正反应速率
(3)一般认为反应Ⅰ通过如下步骤实现:
第一步: (慢)
第二步: (快)
下列示意图中能体现上述反应能量变化的是___________(填标号).
A. B. C. D.
(4)研究发现 表面脱除O原子形成的 (氧空穴)决定了 的催化效果,氧空穴越多,催
化效果越好, 催化 合成甲醇的机理如图.已知增大气体流速可带走多余的 ,从而提高
的选择性,请结合催化机理解释其原因_____________________________.
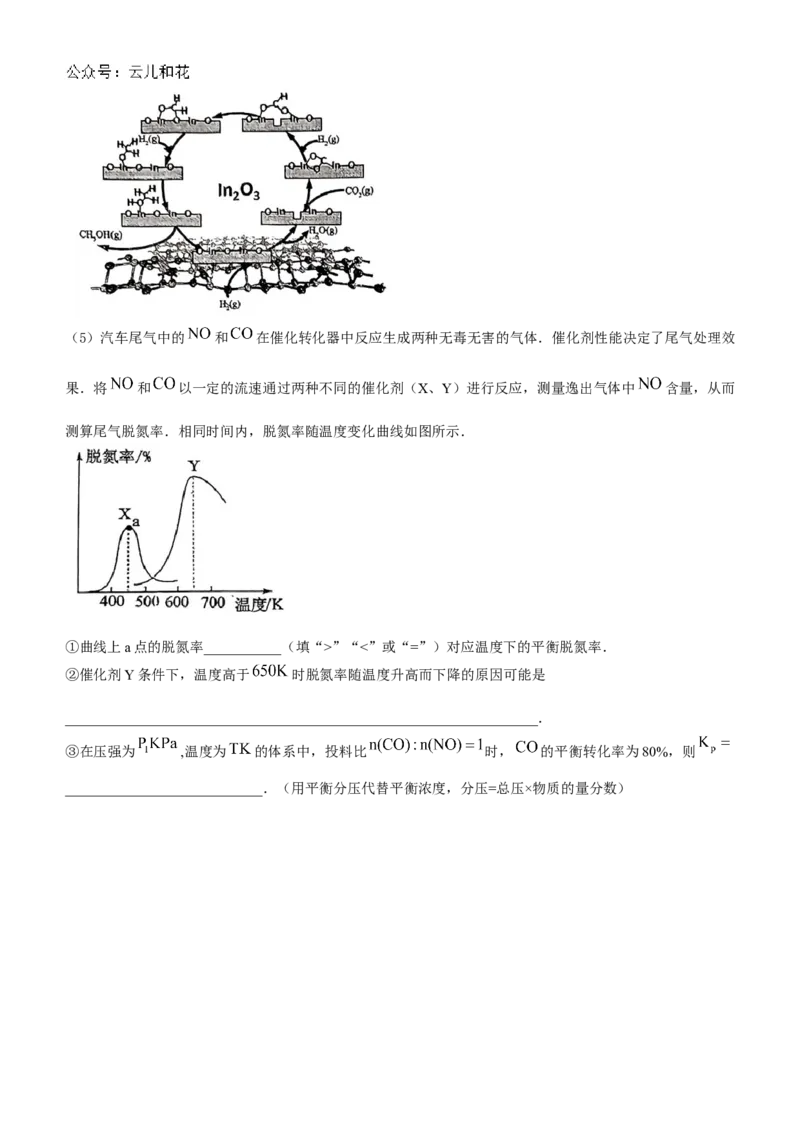
学科网(北京)股份有限公司(5)汽车尾气中的 和 在催化转化器中反应生成两种无毒无害的气体.催化剂性能决定了尾气处理效
果.将 和 以一定的流速通过两种不同的催化剂(X、Y)进行反应,测量逸出气体中 含量,从而
测算尾气脱氮率.相同时间内,脱氮率随温度变化曲线如图所示.
①曲线上a点的脱氮率___________(填“>”“<”或“=”)对应温度下的平衡脱氮率.
②催化剂Y条件下,温度高于 时脱氮率随温度升高而下降的原因可能是
___________________________________________________________________.
③在压强为 ,温度为 的体系中,投料比 时, 的平衡转化率为80%,则
____________________________.(用平衡分压代替平衡浓度,分压=总压×物质的量分数)
学科网(北京)股份有限公司2024-2025 学年度上学期第一次月考
高二化学试题答案及评分标准
一.选择题(每小题3分,共15题,共45分)
1 2 3 4 5 6 7 8
C D C C C C C B
9 10 11 12 13 14 15
D C D B A B D
16.(共14分,每空2分)
(1) (2)C (3)AC
(4) 或
(5)AB (6) b
17.(共14分,每空2分)
(1)
(2)其他条件相同时,增大 浓度反应速率增大(不写其他条件相同时扣1分)、3.0(写3不给
分)
(3) (0.0375给分)
(4)生成物中的 为该反应的催化剂(或 对该反应有催化作用)
与实验3比较,溶液褪色所需时间短或所用时间 小于 (不写与实验3比较扣1分)
18.(13分)除标注外,其它每空各2分
(1) (1分)
(2)吸热(1分) (3)BC(对一个给一分,选错不得分)
(4)830(1分) (5)增大 增大 (6)否 >
19.(14分)每空2分
(1) (2)DE(对一个给1分,错选不得分) (3)A
学科网(北京)股份有限公司(4)增大气体流速可带走多余的 ,促进反应 正向进行,从而增大氧
空穴的量
(5)< 温度超过 时,催化剂的活性降低,催化效果减弱,相同时间内脱氮率下降(或催化剂Y条
件下,反应速率增大,相同时间内反应已经平衡,随着温度超过 ,升温使反应平衡逆向移动,脱氮率
下降) (不写单位不扣分)
答案详细解析:
选项释义:
1.A.催化剂能降低反应的活化能,使更多的普通分子变为活化分子,因而增大单位体积内活化分子百分数,
使化学反应速率加快,A正确;B.催化剂能降低反应的活化能,使更多的普通分子变为活化分子,分子之
间有效碰撞次数增加,反应的速率加快,B正确;C.催化剂对正、逆反应速率影响相同,因此使用催化剂
后使化学平衡不发生移动,故化学平衡常数不变,C错误;D.催化剂不能改变反应物、生成物的能量,但
能够降低反应的活化能,使更多的普通分子变为活化分子,由于单位体积内分子总数不变,因此单位体积内
活化分子百分数增加,D正确;故合理选项是C.
2.A项、铁在潮湿空气中能自发产生铁锈,该反应的 ,是能用焓判据解释的自发过程,故A错误;
B项、天然气燃烧生成 和水,该反应的 ,是能用焓判据解释的自发过程,B错误;
C项、铜在潮湿空气中能自发产生铜绿,该反应的 ,是能用焓判据解释的自发过程,C错误;
D项、 与 反应产生 ,可以产生结冰现象,温度降低,该反应的
,是不能用焓判据解释的自发过程,D正确.故选D.
3.A.改变温度、压强,可使平衡发生移动,可改变反应的限度,故A正确;B.增大压强,反应速率增大,
且平衡正向移动,提高产率,故B正确;C.正反应为放热反应,升高温度,平衡逆向移动,不利于提高氨
气的产率,故C错误;D.增大压强,反应速率增大,且平衡正向移动,可提高反应的转化率和氨气的产率,
故D正确;故选:C.
4.A、啤酒瓶内存在平衡: ,当开启瓶盖时,体系压强降低,为了减弱这
种改变,平衡逆向移动,产生大量气泡,可用勒夏特列原理解释,故A不符合题意;B、浓氨水中存在平衡:
,加入氢氧化钠固体时, 的浓度增大,平衡会向逆向移动,
会产生较多的刺激性气味的气体,能用勒夏特列原理解释,故B不符合题意;C、氢气与碘蒸气反应的平衡
学科网(北京)股份有限公司为 ,反应前后气体系数和相等,压强对平衡无影响,压缩气体,碘单质的浓度增大,
使得颜色加深,不能用勒夏特列原理解释,故C符合题意;D、二氧化氮和四氧化二氮混合气体的密闭容器
内存在平衡: ,该反应正反应为放热反应,将密闭容器置于冷水中,温度降低,化学
平衡正向移动, 的浓度减小,颜色变浅,能用勒夏特列原理解释,故D不符合题意;综上所述,本题
应选C.
5.A.次氯酸根具有强氧化性,也能将 氧化为硝酸根,故能脱硝,A错误;B.与实验a相比,实验b
达到的平衡状态不变且所需时间缩短,改变的条件应为加入了催化剂,温度未发生改变,则平衡常数不变,
即a和b的化学平衡常数相等,B错误;
C.实验b对应 达到平衡,列三段式有 ,恒温恒容
条件下,气体压强之比等于其物质的量之比,则 ,解得 ,因此
用 表示的平均反应速率 ,C正确;
D. 与 按照化学计量数之比 投料,a达到平衡时, 的转化率应等于 的转化率,则通入
和 ,投料比大于 ,相当于增大 浓度,平衡时 转化率增大, 转化率减小,
即 的转化率大于 的转化率,D错误;故选C.
6.【详解】A.该反应是一个气体分子数减少的反应,增大压强可以加快化学反应速率,正反应速率增大的
幅度大于逆反应的,故 ,平衡向正反应方向移动,但是因为温度不变,故平衡常数不变,A不正确;
B.催化剂不影响化学平衡状态,因此,加入催化剂不影响平衡时 的浓度,B不正确;C.
恒容下,充入一定量的 , 的浓度增大,平衡向正反应方向移动,C正确;
D.恒容下,充入一定量的 ,平衡向正反应方向移动,但是 的平衡转化率减小,
D不正确;综上所述,本题选C.
学科网(北京)股份有限公司7.A. ,该反应是气体分子数不变的反应,改变压强平衡不移动,A错误;B.碳
单质和二氧化硅高温下发生反应 ,产生的二氧化碳是气体从体系中逸出,从
而使反应不断向右进行,非金属性是指氧化性,该反应中碳表现还原性,B错误;C.溶液中存在平衡
(橙红) (黄色) ,滴入3滴浓硫酸,平衡向左移动,溶液橙红色加深,滴
入3滴浓 溶液,平衡向右移动,溶液黄色加深,因而可通过观察溶液颜色的变化探究浓度对化学平衡
移动的影响,C正确;D. 与 反应探究速率是以高锰酸钾褪色快慢来比较,高锰酸钾必须
要完全反应,本实验高锰酸钾过量,D错误;故选C.
8.A.由图可知 和 转化为产品 ,还生成水,则总反应方程式为 ,A
正确;B.催化剂对平衡移动无影响,则使用催化剂时转化率不变,B错误;C.化学变化中有化学键的断裂
和生成,则反应历程中, 键与 键断裂吸收能量,C正确;D.催化剂改变反应的途径、降低反应
的活化能,则该过程中催化剂参与反应,改变反应路径,降低反应的活化能,D正确;故合理选项是B.
9.A.根据图1中反应①反应物为氧化钡、二氧化氮和氧气,生成物为硝酸钡,其反应为,故A正确;B.
根据 的储存和还原技术能有效降低柴油发动机在空气过量时排放的 , 和氧气反应生成 ,
则储存和还原技术也能降低尾气排放的 ,故B正确;C. 内,氢气的消耗速率为
,故C正确;D.第一步反应中 被氧化生成水,H元素的
化合价由0价升高到 价, 的N元素化合价由 价降低到 价,生成氨气,则
生成氨气得到 电子,参加反应的氢气的物质的量为 ,则消耗的
与 的物质的量之比是 ,故D错误;综上所述,答案为D.
10.A. 的电离方程式为 ,血浆中 ,呈弱碱性,促进 电离,胃中
,呈酸性,抑制 的电离,血浆中 的电离程度比胃中大,A项正确;
学科网(北京)股份有限公司B. ,胃中 ,则胃中 ,B项
正确;
C. ,血浆中 ,则血浆中 ,
,C项错误;
D.假设离子不会穿过组织薄膜,而未电离的
则可自由穿过该膜且达到平衡,故血浆与胃中 相同,D项正确;答案选C.
11.A.由图可知,d点后透光率减小,说明二氧化氮浓度增大,平衡向逆反应方向移动,则二氧化氮的正反
应速率小于逆反应速率,故A正确;B.由分析可知, 时,反应的平衡常数 ,故B正确;C.该
反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小, 时,速率常数 ,反应的
平衡常数 ,则温度 小于 ,故C正确;D.保持容积不变,再充入一定量二氧化
氮
气体相当于增大压强,平衡向正反应方向移动,二氧化氮的转化率增大,故D错误;故选D.
12.A.图中没有给出 的能量,则无法计算 转化为 过程放出的热量,A错误;
B.由图可知, 转化为 的历程中,最大活化能 时的需要的活化能,
则最大活化能为 ,B正确;C. 时,不存在非极性键的断裂,C错误;
D.由图可知, 转化为 的最大活化能为 ,结合选项B可知, 转化为 的最
大活化能较小,反应速率较快,D错误;故选B.
13.A.根据前面分析酸强弱为: ,则少量的 通入 溶液中:
,故A正确;B.根据前面分析酸强弱为: ,
则 溶液中通入少量的 ,故B错误;C.少量的 通入
学科网(北京)股份有限公司溶液中,次氯酸根将二氧化硫氧化为硫酸根并与钙离子生硫酸钙沉淀,生成的氢离子结合多余次
氯酸根生成次氯酸,其离子方程式为: ,故C错误;
D.根据前面分析酸强弱为: ,相同浓度的 溶液与 溶液等体积
混合,两者不反应,故D错误.综上所述,答案为A.
14.A.该反应正方向为气体系数减小的反应,增大压强,平衡向正反应方向移动,A项错误;
B.反应一段时间达到平衡,测得生成 ,根据化学计量数关系,B应该反应了 ,所以B的转
化率为 ,B项正确;C.化学平衡常数只和温度有关,增加A,平衡正向移动,化学
平衡常数不变,C项错误;D.升高温度,平衡向吸热方向移动,若A的转化率增大,则该反应 ,D
项错误;故选B.
15.A.根据图1可知升高温度甲醇的含量降低,说明温度升高平衡逆向进行,反应为放热反应, ,A
错误;B.正反应体积减小,温度不变时增大压强平衡正向进行,甲醇含量增大,所以 ,B错误;
C.升高温度,平衡向逆反应方向移动,化学平衡常数减小,由图可知,反应温度: ,则A、B、C
三点对应的平衡常数 由大到小的顺序排列为 ,C错误;D.升高温
度,正、逆反均应速率增大,反应为放热反应,平衡向逆反应方向移动,甲醇的浓度减小,则新平衡点可能
是图中d点,D正确;故答案为D.
16.【详解】(1)合成塔中发生反应的化学方程式为: ;
(2)铝遇浓硝酸会钝化,故工业生产中为了储运大量浓硝酸,最好选择铝作为罐体材料;
(3)与氮氧化物有关的全球或区域性大气环境问题有酸雨和光化学烟雾;
(4)根据提示可知, 反应后生成的两种盐分别为 和 ,故相关反应的化学方程式为:
或
;
(5)A.催化剂a表面有 键的断裂和 键的形成,A项正确;
学科网(北京)股份有限公司B. 与 反应属于氮的固定过程,B项正确;
C.在催化剂b表面形成氮氧键时N元素由 价升高为 价,有电子转移,C项错误;
答案选AB;
(6) 对应压强为 ,平衡时 分压为 ,则此时 为
,消耗 ,则
体积缩小, 分压瞬间增大,由于平衡逆移动, 分压增大后又减小,故
能正确表示压缩后 分压变化趋势的曲线是b.
17.【详解】(1)根据氧化还原反应的规律, 和 反应的离子方程式为:
;
(2)根据表格数据,其他条件相同时,增大 浓度反应速率增大;探究某一条件对反应速率的影响时,
保证其他条件不变,在此溶液中保证溶液的总体积为 ,所以 ;
(3)根据 ,
;
(4)①草酸溶液与酸性高锰酸钾溶液反应时,褪色总是先慢后快,可能的原因是反应放热,或者生成物中的
为该反应的催化剂;
②要验证是不是催化剂的作用,在对照实验中加入 ;
③若是催化剂影响的反应速率,该实验数据与实验3相同,所以与实验3相比,溶液褪色所需时间短或所用
时间 小于 ;
18.【详解】(1)由反应 知,该反应的化学平衡常数表达式
学科网(北京)股份有限公司.
(2)由表中数据可知,升高温度化学平衡常数K增大,说明升高温度,平衡向正反应方向移动,则该反应
为吸热反应.
(3)A.该反应反应前后气体分子数不变,建立平衡的过程气体分子总物质的量不变,在一定体积的密闭容
器中,容器内压强不变,故容器内压强不变不能说明反应达到化学平衡状态,A项不选;
B.建立平衡的过程中 是变量,混合气体中 不变是该反应达到平衡状态的特征标志,B项选;
C. 说明正、逆反应速率相等,是该反应达到平衡状态的本质标志,C项选;
D.达到化学平衡状态时各物质的浓度保持不变,但不一定相等,即 时反应不一定达到化
学平衡状态,D项不选;
答案选BC.
(4)某温度下,平衡浓度符合下式: ,则 ,即该温
度下反应的化学平衡常数等于1,查表知,该温度为 .
(5)反应 的正反应为吸热反应,温度升高,平衡向正反应方向移动,
达到新平衡时高炉内 和 的体积比值增大,化学平衡常数增大.
(6)此时浓度商 ,在这种情况下,反应不处于化学平衡状态,
反应正向进行,此时 .
19.【详解】(1)已知 和 的燃烧热分别为 ,则有:①
、②
. 和 的汽化热分别为
,则有:③ 、④
学科网(北京)股份有限公司.根据盖斯定律,反应Ⅰ ,则
.
(2)A.增大 与 的投料比, 的转化率降低, 的转化率升高,A正确;
B. 的浓度在反应过程中是变量,当其保持不变时说明反应体系已达到平衡状态,B正确;
C.因为两个反应有共同的反应物和共同的产物,所以升高温度,两个反应重新建立平衡的时间相同,C正
确:
D.体系达到平衡后,若压缩体积反应Ⅰ向气体分子数减小的方向移动,即平衡正向移动,则 和 的
物质的量减少, 的物质的量增大,根据勒夏特列原理,反应Ⅱ会向逆反应方向移动,D错误;
E.及时将 液化分离,有利于反应I平衡正向移动,但不能提高正反应速率,E错误;
故选DE.
(3)根据题意,第一步为慢反应,慢反应决定总反应的反应速率,则第一步反应的活化能大于第二步反应的
活化能,第十步为吸热反应,第二步为放热反应,而总反应为放热反应,所以,最终生成物的相对能量低于
反应物的相对能量.
(4)从催化机理图中能看出 与 中的O结合生成 ,而使催化剂出现氧空穴,由题意可知,氧
空穴越多,催化效果越好,所以增大气体流速可带走多余的 ,可以促进反应
正向进行,可以增加氧空穴的量.
(5)①由图知,在催化剂Y作用下,Y时,脱氮率达到最大,而催化剂不影响平衡移即不影响平衡脱氮率,
而曲线上a点的脱氮率远低于催化剂Y条件下脱氮率最大值,故曲线上a点的脱氮率<对应温度下的平衡脱氮
率,
故答案为:<;
②催化剂Y条件下, 后,反应速率增大,相同时间内反应可能已经达到平衡,升温使放热反应平向移
动,脱氮率下降;或温度超过 时催化剂的活性可能降低,催化效果减弱,相同时间内脱氮率下降;
故答案为:随着温度超过 ,反应速率增大,相间时间内反应可能已经达到平衡,升温使放热反应逆向
移动,脱氨率下降;或温度超过 时催化剂的活性可能降低,催化效果减弱,相同时间内脱氮率下降;
③设 起始物质的量为 ,列三段式,
学科网(北京)股份有限公司,平衡时混合气体总物质的量为
, ;
故答案为:
学科网(北京)股份有限公司