文档内容
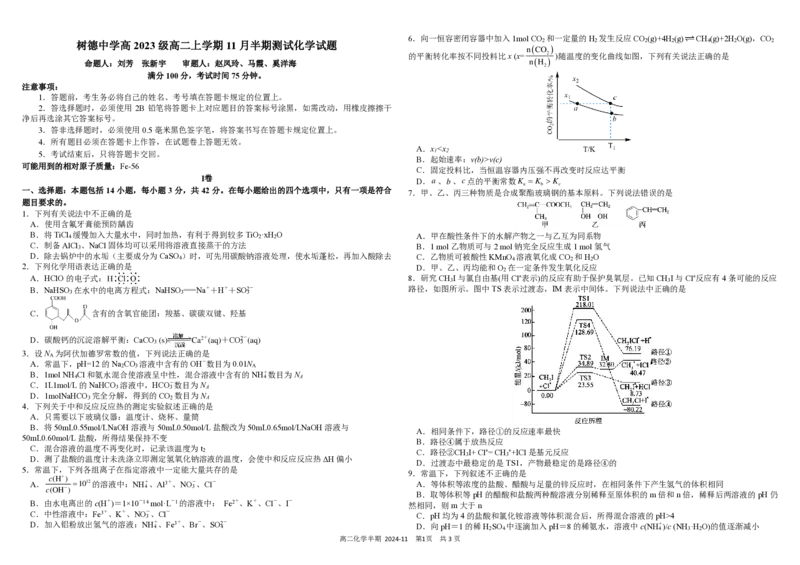
6.向一恒容密闭容器中加入1mol CO 和一定量的H 发生反应CO (g)+4H (g) CH (g)+2H O(g),CO
树德中学高 2023 级高二上学期 11 月半期测试化学试题 2 2 2 2 4 2 2
的平衡转化率按不同投料比x (x=
命题人:刘芳 张新宇 审题人:赵凤玲、马霞、奚洋海
满分100分,考试时间75分钟。
注意事项:
1.答题前,考生务必将自己的姓名、考号填在答题卡规定的位置上。
2.答选择题时,必须使用 2B 铅笔将答题卡上对应题目的答案标号涂黑,如需改动,用橡皮擦擦干
净后再选涂其它答案标号。
3.答非选择题时,必须使用0.5毫米黑色签字笔,将答案书写在答题卡规定位置上。
4.所有题目必须在答题卡上作答,在试题卷上答题无效。
5.考试结束后,只将答题卡交回。
可能用到的相对原子质量:Fe-56
Ⅰ卷
一、选择题:本题包括 14小题,每小题 3分,共 42分。在每小题给出的四个选项中,只有一项是符合
题目要求的。
1.下列有关说法中不正确的是
A.使用含氟牙膏能预防龋齿
B.将TiCl 缓慢加入大量水中,同时加热,有利于得到较多TiO ·xH O 4 2 2
C.制备AlCl 、NaCl固体均可以采用将溶液直接蒸干的方法
3
D.除去锅炉中的水垢(主要成分为CaSO )时,可先用碳酸钠溶液处理,使水垢蓬松,再加入酸除去 4
2.下列化学用语表达正确的是
A.HClO的电子式:
B.NaHSO 在水中的电离方程式:NaHSO ===Na++H++SO2-
3 3 3
C. 含有的含氧官能团:羧基、碳碳双键、羟基
D.碳酸钙的沉淀溶解平衡:CaCO (s) Ca2+(aq)+CO2-(aq)
3 3
3.设N 为阿伏加德罗常数的值,下列说法正确的是
A
A.常温下,pH=12的Na CO 溶液中含有的OH-数目为0.01N
2 3 A
B.1mol NH Cl和氨水混合使溶液呈中性,混合溶液中含有的NH+数目为N
4 4 A
C.1L1mol/L的NaHCO 溶液中,HCO-数目为N
3 3 A
D.1molNaHCO 完全分解,得到的CO 数目为N
3 2 A
4.下列关于中和反应反应热的测定实验叙述正确的是
A.只需要以下玻璃仪器:温度计、烧杯、量筒
B.将50mL0.55mol/LNaOH溶液与50mL0.50mol/L盐酸改为50mL0.65mol/LNaOH溶液与
50mL0.60mol/L盐酸,所得结果保持不变
C.混合溶液的温度不再变化时,记录该温度为t
2
D.测了盐酸的温度计未洗涤立即测定氢氧化钠溶液的温度,会使中和反应反应热ΔH偏小
5.常温下,下列各组离子在指定溶液中一定能大量共存的是
c(H+)
A. =1012的溶液中:NH+、Al3+、NO-、Cl-
c(OH−) 4 3
B.由水电离出的c(H+)=1×10-14 mol·L-1的溶液中: Fe2+、K+、Cl-、I-
C.中性溶液中:Fe3+、K+、NO-、Cl-
3
D.加入铝粉放出氢气的溶液:NH+、Fe3+、Br-、SO2- 4 4
高二化学半期 2024-11 第1页 共3页
n
n
( C
( H
O
2
2)
)
)随温度的变化曲线如图,下列有关说法正确的是
A.x v(c)
C.固定投料比,当恒温容器内压强不再改变时反应达平衡
D. a 、 b 、 c 点的平衡常数 K
a
= K
b
K
c
7.甲、乙、丙三种物质是合成聚酯玻璃钢的基本原料。下列说法错误的是
A.甲在酸性条件下的水解产物之一与乙互为同系物
B.1 mol乙物质可与2 mol钠完全反应生成1 mol氢气
C.乙物质可被酸性KMnO 溶液氧化成CO 和H O 4 2 2
D.甲、乙、丙均能和O 在一定条件发生氧化反应
2
8.研究CH I与氯自由基(用Cl∗表示)的反应有助于保护臭氧层。已知CH I与Cl∗反应有4条可能的反应
3 3
路径,如图所示。图中TS表示过渡态,IM表示中间体。下列说法中正确的是
A.相同条件下,路径①的反应速率最快
B.路径④属于放热反应
C.路径②CH I+ Cl∗= CH ∗+ICl是基元反应
3 3
D.过渡态中最稳定的是TS1,产物最稳定的是路径④的
9.常温下,下列叙述不正确的是
A.等体积等浓度的盐酸、醋酸与足量的锌反应时,在相同条件下产生氢气的体积相同
B.取等体积等pH的醋酸和盐酸两种酸溶液分别稀释至原体积的m倍和n倍,稀释后两溶液的pH仍
然相同,则m大于n
C.pH均为4的盐酸和氯化铵溶液等体积混合后,所得混合溶液的pH>4
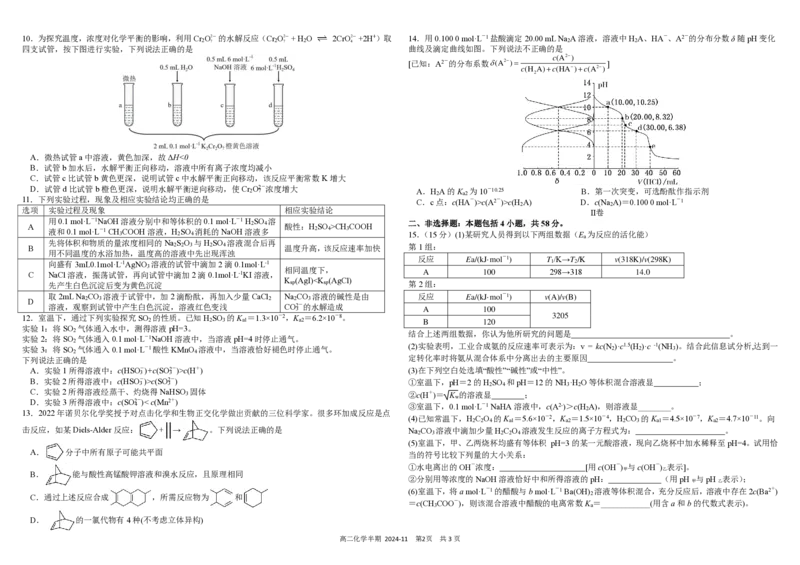
D.向pH=1的稀H SO 中逐滴加入pH=8的稀氨水,溶液中c(NH+)/c (NH ·H O)的值逐渐减小 2 4 4 3 210.为探究温度,浓度对化学平衡的影响,利用Cr O2- 的水解反应(Cr O2- + H O 2CrO2- +2H+)取 14.用0.100 0 mol·L-1盐酸滴定20.00 mL Na A溶液,溶液中H A、HA-、A2-的分布分数δ随pH变化
2 7 2 7 2 4 2 2
四支试管,按下图进行实验,下列说法正确的是 曲线及滴定曲线如图。下列说法不正确的是
[已知:A2-的分布系数
A.微热试管a中溶液,黄色加深,故ΔH<0
B.试管b加水后,水解平衡正向移动,溶液中所有离子浓度均减小
C.试管c比试管b黄色更深,说明试管c中水解平衡正向移动,该反应平衡常数K增大
D.试管d比试管b橙色更深,说明水解平衡逆向移动,使Cr O2-浓度增大 2 7
11.下列实验过程,现象及相应实验结论均正确的是
选项 实验过程及现象 相应实验结论
用0.1 mol·L-1NaOH溶液分别中和等体积的0.1 mol·L-1 H SO 溶 A 2 4 酸性:H SO >CH COOH
液和0.1 mol·L-1 CH COOH溶液,H SO 消耗的NaOH溶液多 2 4 3 3 2 4
先将体积和物质的量浓度相同的Na S O 与H SO 溶液混合后再
B 2 2 3 2 4 温度升高,该反应速率加快
用不同温度的水浴加热,温度高的溶液中先出现浑浊
向盛有3mL0.1mol·L-1AgNO 溶液的试管中滴加2滴0.1mol·L-1
3
相同温度下,
C NaCl溶液,振荡试管,再向试管中滴加2滴0.1mol·L-1KI溶液,
K (AgI)c(H+)
3 3
B.实验2所得溶液中:c(HSO-)>c(SO2-) 3 3
C.实验2所得溶液经蒸干、灼烧得NaHSO 固体 3
D.实验3所得溶液中:c(SO2-)< c(Mn2+)
4
13.2022年诺贝尔化学奖授予对点击化学和生物正交化学做出贡献的三位科学家。很多环加成反应是点
击反应,如某Diels-Alder反应: + → 。下列说法正确的是
A. 分子中所有原子可能共平面
B. 能与酸性高锰酸钾溶液和溴水反应,且原理相同
C.通过上述反应合成 ,所需反应物为 和
D. 的一氯代物有4种(不考虑立体异构)
高二化学半期 2024-11 第2页 共3页
( A 2 )
c ( H
2
A )
c
c
(
(
A
H
2
A
)
) c ( A 2 )
− =
+
−
− + −
]
A.H A的K 为10-10.25 B.第一次突变,可选酚酞作指示剂
2 a2
C.c点:c(HA-)>c(A2-)>c(H A) D.c(Na A)=0.100 0 mol·L-1
2 2
Ⅱ卷
二、非选择题:本题包括4小题,共58分。
15.(15分)(1)某研究人员得到以下两组数据(E 为反应的活化能)
a
第1组:
反应 Ea/(kJ·mol-1) T /K→T /K v(318K)/v(298K)
1 2
A 100 298→318 14.0
第2组:
反应 Ea/(kJ·mol-1) v(A)/v(B)
A 100
3205
B 120
结合上述两组数据,你认为他所研究的问题是 。
(2)实验表明,工业合成氨的反应速率可表示为:v = kc(N )·c1.5(H )·c -1(NH )。结合此信息试分析,达到一 2 2 3
定转化率时将氨从混合体系中分离出去的主要原因 。
(3)在下列空白处选填“酸性”“碱性”或“中性”。
①室温下,pH=2的H SO 和pH=12的NH ·H O等体积混合溶液显 ; 2 4 3 2
②c(H+)= K 的溶液显 ;
w
③室温下,0.1 mol·L-1 NaHA溶液中,c(A2-)>c(H A),则溶液显________。
2
(4)已知常温下,H C O 的K =5.6×10-2,K =1.5×10-4,H CO 的K =4.5×10-7,K =4.7×10-11。向
2 2 4 a1 a2 2 3 a1 a2
Na CO 溶液中滴加少量H C O 溶液发生反应的离子方程式为: 。
2 3 2 2 4
(5)室温下,甲、乙两烧杯均盛有等体积 pH=3的某一元酸溶液,现向乙烧杯中加水稀释至pH=4。试用恰
当的符号比较下列量的大小关系:
①水电离出的OH-浓度: [用c(OH-) 与c(OH-) 表示]。
甲 乙
②分别用等浓度的NaOH溶液恰好中和所得溶液的pH: (用pH 与pH 表示);
甲 乙
(6)室温下,将a mol·L-1的醋酸与b mol·L-1 Ba(OH) 溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)
2
=c(CH COO-),则该混合溶液中醋酸的电离常数K =____________(用含a和b的代数式表示)。
3 an(C)
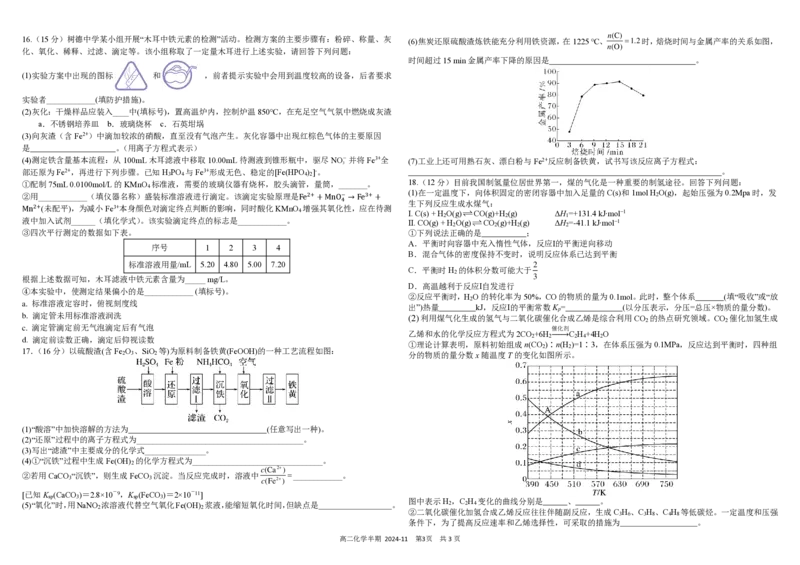
16.(15分)树德中学某小组开展“木耳中铁元素的检测”活动。检测方案的主要步骤有:粉碎、称量、灰 (6)焦炭还原硫酸渣炼铁能充分利用铁资源,在1225 ℃、 =1.2时,焙烧时间与金属产率的关系如图,
n(O)
化、氧化、稀释、过滤、滴定等。该小组称取了一定量木耳进行上述实验,请回答下列问题:
时间超过15 min金属产率下降的原因是 。
(1)实验方案中出现的图标 和 ,前者提示实验中会用到温度较高的设备,后者要求
实验者____________(填防护措施)。
(2)灰化:干燥样品应装入____中(填标号),置高温炉内,控制炉温850℃,在充足空气气氛中燃烧成灰渣
a.不锈钢培养皿 b.玻璃烧杯 c.石英坩埚
(3)向灰渣(含Fe2+)中滴加较浓的硝酸,直至没有气泡产生。灰化容器中出现红棕色气体的主要原因
是 。(用离子方程式表示)
(4)测定铁含量基本流程:从100mL木耳滤液中移取10.00mL待测液到锥形瓶中,驱尽NO- 并将Fe3+全 (7)工业上还可用熟石灰、漂白粉与Fe2+反应制备铁黄,试书写该反应离子方程式:
3
部还原为Fe2+,再进行下列步骤。已知H PO 与Fe3+形成无色、稳定的[Fe(HPO ) ]-。 。
3 4 4 2
①配制75mL 0.0100mol/L的KMnO 标准液,需要的玻璃仪器有烧杯,胶头滴管,量筒,_______。 18.(12分)目前我国制氢量位居世界第一,煤的气化是一种重要的制氢途径。回答下列问题:
4
(1)在一定温度下,向体积固定的密闭容器中加入足量的C(s)和1mol H O(g),起始压强为0.2Mpa时,发
②用____________(填仪器名称)盛装标准溶液进行滴定。该滴定实验原理是Fe2++MnO− →Fe3++ 2
4
生下列反应生成水煤气:
Mn2+(未配平),为减小Fe3+本身颜色对滴定终点判断的影响,同时酸化KMnO 增强其氧化性,应在待测
4 Ⅰ. C(s) + H O(g) CO(g)+H (g) ΔH =+131.4 kJ∙mol−1
2 2 1
液中加入试剂______(填化学式)。该实验滴定终点的标志是____________。 Ⅱ. CO(g) + H O(g) CO (g)+H (g) ΔH =-41.1 kJ∙mol−1
2 2 2 2
③四次平行测定的数据如下表。 ①下列说法正确的是 ;
A.平衡时向容器中充入惰性气体,反应Ⅰ的平衡逆向移动
序号 1 2 3 4
B.混合气体的密度保持不变时,说明反应体系已达到平衡
标准溶液用量/mL 5.20 4.80 5.00 7.20
C.平衡时H 的体积分数可能大于
2
根据上述数据可知,木耳滤液中铁元素含量为_____ mg/L。
④本实验中,使测定结果偏小的是____________ (填标号)。
a. 标准溶液定容时,俯视刻度线
b. 滴定管未用标准溶液润洗
c. 滴定管滴定前无气泡滴定后有气泡
d. 滴定前读数正确,滴定后仰视读数
17.(16分)以硫酸渣(含Fe O 、SiO 等)为原料制备铁黄(FeOOH)的一种工艺流程如图:
2 3 2
(1)“酸溶”中加快溶解的方法为 (任意写出一种)。
(2)“还原”过程中的离子方程式为_________________________________________。
(3)写出“滤渣”中主要成分的化学式_______________。
(4)①“沉铁”过程中生成Fe(OH) 的化学方程式为________________________________。
2
c(Ca2+)
②若用CaCO “沉铁”,则生成FeCO 沉淀。当反应完成时,溶液中 =____________。
3 3 c(Fe2+)
[已知K (CaCO )=2.8×10-9,K (FeCO )=2×10-11]
sp 3 sp 3
(5)“氧化”时,用NaNO 浓溶液代替空气氧化Fe(OH) 浆液,能缩短氧化时间,但缺点是 。
2 2
高二化学半期 2024-11 第3页 共3页
2
3
D.高温越利于反应Ⅰ自发进行
②反应平衡时,H O的转化率为50%,CO的物质的量为0.1mol。此时,整个体系 (填“吸收”或“放
2
出”)热量 kJ,反应Ⅰ的平衡常数K = (以分压表示,分压=总压×物质的量分数)。
p
(2) 利用煤气化生成的氢气与二氧化碳催化合成乙烯是综合利用CO 的热点研究领域。CO 催化加氢生成
2 2
催化剂
乙烯和水的化学反应方程式为2CO +6H → C H +4H O
2 2 2 4 2
①理论计算表明,原料初始组成n(CO )∶n(H )=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组
2 2
分的物质的量分数x随温度T的变化如图所示。
图中表示H ,C H 变化的曲线分别是 、 。
2 2 4
②二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C H 、C H 、C H 等低碳烃。一定温度和压强
3 6 3 8 4 8
条件下,为了提高反应速率和乙烯选择性,可采取的措施为 。树德中学高2023级高二上学期11月半期测试化学试题参考答案
1 2 3 4 5 6 7
C D B B A C A
8 9 10 11 12 13 14
B C D D B D C
15.(15分)
(1)对比温度和催化剂对化学反应速率的影响程度;
(2)加快化学反应速率;
(3)碱性、中性、酸性;
(4)2CO 2- + H C O = 2HCO - +C O 2-
3 2 2 4 3 2 4
(5)10c(OH-) = c(OH-) (若为c(OH-) c(OH-) 得1分) pH ≥pH
甲 乙 甲 < 乙 甲 乙
2b·10-7
(6)
a-2b
16.(15分)
(1)佩戴护目镜(1分)
(2)c(1分)
(3)Fe2++2H++NO− =Fe3++NO ↑+H O
3 2 2
(4)①100mL容量瓶、玻璃棒 ②酸式滴定管(1分)(酸碱通用滴定管也给分) H PO 加入最后
3 4
半滴KMnO 标准液,溶液变为紫红色,且半分钟内不变色 ③1400 ④ac
4
17.(16分)
(1)加热;搅拌;适当增大硫酸的浓度等
(2)Fe + 2Fe3+ = 3Fe2+ (Fe + 2H+ = Fe2+ +H ↑)
2
(3)SiO 、Fe
2
(4)FeSO + 2NH HCO = Fe(OH) ↓+ (NH ) SO + 2CO ↑ (离子方程式也给分) 140
4 4 3 2 4 2 4 2
(5)NaNO 被还原为氮氧化合物,污染空气
2
(6)还原剂消耗完,空气进入使铁再次被氧化
(7)2Fe2+ + ClO- + 4OH- = 2FeOOH↓ + Cl- + H O (Ca(OH) 不拆也给分)
2 2
18.(12分)
(1)①BD ②吸收 31.2 0.02Mpa
(2)① a,d ②选择合适的催化剂
高二化学半期 2024-11 第4页 共3页