文档内容
泸州市龙马潭区高 2023 级高二上期半期考试
化学试题
注意事项:
1.答卷前考生务必把自己的姓名、准考证号填写在答题卡上。
2.回答选择题时用2B铅笔将答题卡上对应题目的答案标号涂黑;回答非选择题时,用
0.5毫米黑色墨迹签字笔将答案写在答题卡上,写在本试卷上无效。
3.试卷满分100分,考试时间75分钟,考试结束后将本试卷和答题卡一并交回。
第I卷(选择题)
一、单选题(共42分)
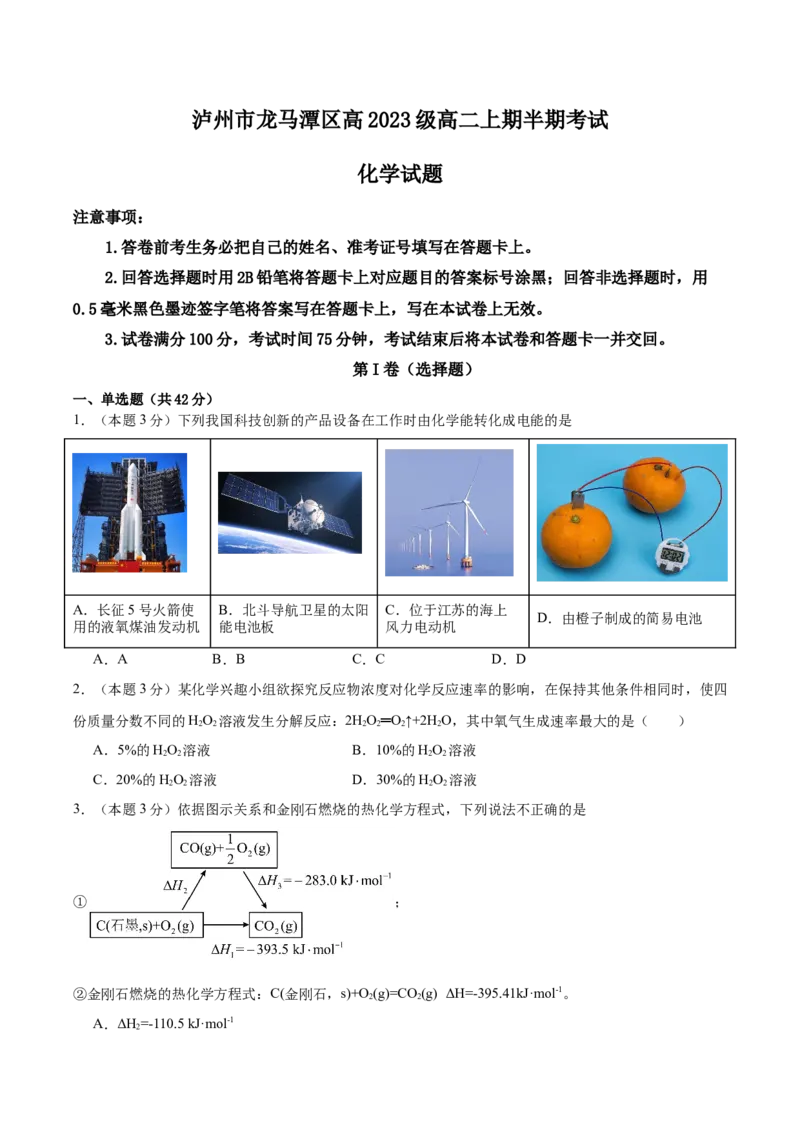
1.(本题3分)下列我国科技创新的产品设备在工作时由化学能转化成电能的是
A.长征5号火箭使 B.北斗导航卫星的太阳 C.位于江苏的海上
D.由橙子制成的简易电池
用的液氧煤油发动机 能电池板 风力电动机
A.A B.B C.C D.D
2.(本题3分)某化学兴趣小组欲探究反应物浓度对化学反应速率的影响,在保持其他条件相同时,使四
份质量分数不同的HO 溶液发生分解反应:2HO═O ↑+2H O,其中氧气生成速率最大的是( )
2 2 2 2 2 2
A.5%的HO 溶液 B.10%的HO 溶液
2 2 2 2
C.20%的HO 溶液 D.30%的HO 溶液
2 2 2 2
3.(本题3分)依据图示关系和金刚石燃烧的热化学方程式,下列说法不正确的是
① ;
②金刚石燃烧的热化学方程式:C(金刚石,s)+O(g)=CO (g) ΔH=-395.41kJ·mol-1。
2 2
A.ΔH=-110.5 kJ·mol-1
2B.C(石墨, s)+CO(g)=2CO(g) ΔH=ΔH-ΔH
2 2 3
C.金刚石比石墨稳定
D.化学反应的ΔH,只与反应体系的始态和终态有关,与反应途径无关
4.(本题3分)已知热化学反应方程式:
①C(石墨,s)+ O(g)=CO(g) ΔH
2 1
②CO (g)=C(石墨,s)+O(g) ΔH
2 2 2
③H(g)+ O(g)=HO(g) ΔH
2 2 2 3
④CO(g)+H O(g=CO(g)+H(g) ΔH
2 2 2 4
下列说法正确的是
A.ΔH>0 B.反应②的活化能为ΔH
1 2
C.H 的燃烧热是ΔH D.ΔH=-(ΔH+ΔH +ΔH )
2 3 4 1 2 3
5.(本题3分)下列实验操作对应的现象和结论均正确的是
选
实验操作 实验现象 实验结论
项
向FeCl 和KSCN混合溶液中加入少量KCl 平衡FeCl +3KSCN
A 3 溶液颜色变浅 3
固体 Fe(SCN) +3KCl向逆反应方向移动
3
等体积pH=2的HX和HY两种酸分别与足 HX放出的氢气
B 酸性:HX<HY
量的铁反应,用排水法收集气体 多且反应速率快
将0.1mol/L的氨水稀释为0.01mol/L,测量
C 稀释后pH减小 稀释后氨水的电离程度减小
稀释前后溶液pH
向浓度均为0.1mol•L-1的NaCl与NaI的混
D 先出现黄色沉淀 K (AgCl)<K (AgI)
合溶液中滴加少量AgNO 溶液 sp sp
3
A.A B.B C.C D.D
6.(本题3分) 可用作高压发电系统的绝缘气体,分子呈正八面体结构,如图所示:已知:断开1mol
S-F键需要327kJ,断开1mol F-F键需要159kJ。则对于反应 ,下列说法正确的是A.形成1mol S-F键需吸收327kJ的能量
B.该反应的反应物总能量大于生成物总能量
C.反应消耗22.4L (g)时,共转移2mol电子
D.该反应是一个吸热反应
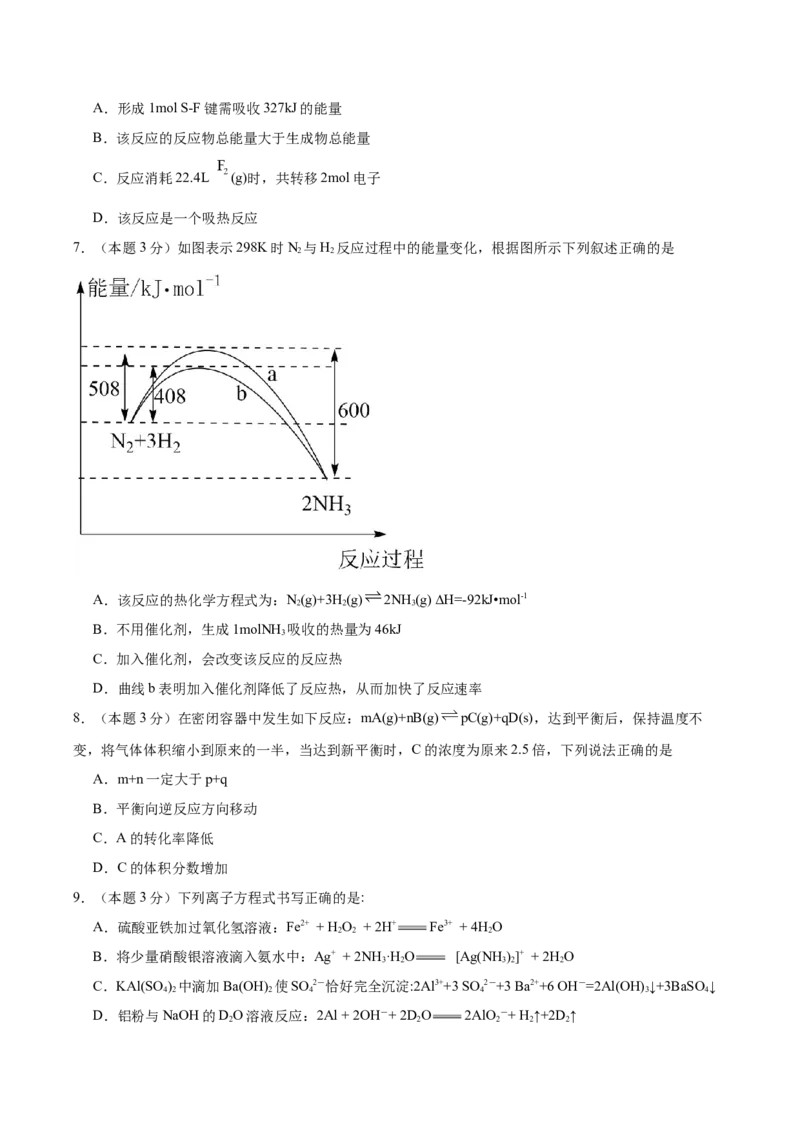
7.(本题3分)如图表示298K时N 与H 反应过程中的能量变化,根据图所示下列叙述正确的是
2 2
A.该反应的热化学方程式为:N(g)+3H(g) 2NH (g) ∆H=-92kJ•mol-1
2 2 3
B.不用催化剂,生成1molNH 吸收的热量为46kJ
3
C.加入催化剂,会改变该反应的反应热
D.曲线b表明加入催化剂降低了反应热,从而加快了反应速率
8.(本题3分)在密闭容器中发生如下反应:mA(g)+nB(g) pC(g)+qD(s),达到平衡后,保持温度不
变,将气体体积缩小到原来的一半,当达到新平衡时,C的浓度为原来2.5倍,下列说法正确的是
A.m+n一定大于p+q
B.平衡向逆反应方向移动
C.A的转化率降低
D.C的体积分数增加
9.(本题3分)下列离子方程式书写正确的是:
A.硫酸亚铁加过氧化氢溶液:Fe2+ + H O + 2H+ Fe3+ + 4H O
2 2 2
B.将少量硝酸银溶液滴入氨水中:Ag+ + 2NH ·H O [Ag(NH)]+ + 2H O
3 2 3 2 2
C.KAl(SO ) 中滴加Ba(OH) 使SO 2-恰好完全沉淀:2Al3++3 SO 2-+3 Ba2++6 OH-=2Al(OH) ↓+3BaSO ↓
4 2 2 4 4 3 4
D.铝粉与NaOH的DO溶液反应:2Al + 2OH-+ 2D O 2AlO-+ H ↑+2D ↑
2 2 2 2 210.(本题3分)恒温恒容密闭容器中进行反应 ,若 的浓度由 降到
需 ,那么 的浓度由 降到 反应所需时间为
A.等于 B.等于 C.大于 D.小于
11.(本题3分)常温下,下列各组离子一定能大量共存的是
A.由水电离产生的c(H+)=10-12mol/L的溶液中:K+、Na+、ClO-、I-
B.c(H+)= mol/L的溶液中:K+、Fe3+、Cl-、
C. 、Na+、Al3+、
D.常温下, =1×10-12的溶液:K+、S2-、 、Na+
12.(本题3分) 是一种重要的催化剂。以 为原料制备 的反应方程式为:
。已知室温下: 、 。下
列说法正确的是
A.为获得纯度较高的 ,可向 溶液中滴加 溶液
B.为确认 已完全沉淀,将反应后溶液静置,向上层清液中加 溶液,观察是否有沉淀
C.室温下, 溶液中存在
D.室温下,加水稀释一定 的 溶液,溶液中的 值逐渐增大
13.(本题3分)下列叙述不正确的是
A.常温下,将pH=3的盐酸溶液稀释到原体积的10倍,稀释后溶液的pH=4
B.25℃时Ksp(AgCl)=1.8×10-10,向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度可能
减小
C.浓度均为0.1mol·L-1的下列溶液,pH由大到小的排列顺序为:
NaOH>Na CO>NaHCO>(NH)SO >NHCl
2 3 3 4 2 4 4D.为确定HA是强酸还是弱酸,可测0.1mol·L-1NaHA溶液的pH,若pH>1,则HA是弱酸;若
2 2
pH=1,则HA是强酸
2
14.(本题3分)氨水中存在电离平衡NH ·H O NH ++OH-,下列叙述不正确的是( )
3 2 4
A.氨水中离子浓度的关系满足:c(OH-)=c(H+)+c(NH +)
4
B.0.10mol/L的NH ·H O溶液加水稀释,溶液中c(H+)减小
3 2
C.NH ·H O溶液中加少量的NH Cl固体,平衡逆向移动
3 2 4
D.常温下pH=2的盐酸溶液与pH=12的NH ·H O溶液等体积混合后,溶液的pH>7
3 2
第II卷(非选择题)
二、解答题(共58分)
15.(本题8分)利用中和滴定的原理,在工业生产中还可以进行氧化还原滴定测定物质含量。
制备纳米TiO 的方法之一是TiCl 水解生成TiO·xH O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去
2 4 2 2
水分得到粉状TiO。
2
用现代分析仪器测定TiO 粒子的大小。用氧化还原滴定法测定TiO 的质量分数:一定条件下,将TiO 溶
2 2 2
解并还原为Ti3+,再以KSCN溶液作指示剂,用NH Fe(SO ) 标准溶液滴定Ti3+至全部生成Ti4+。
4 4 2
请回答下列问题:
(1)下列操作会引起实验结果偏大的是 (填编号)
A.酸式滴定管未润洗
B.滴定前,滴定管尖嘴无气泡,滴定后有气泡
C.锥形瓶先用蒸馏水洗涤后,未用待测液润洗
D.滴定结束时仰视滴定管,并记录数据
E.滴定过程中有一滴标准液飞溅出锥形瓶
(2)滴定时,左手控制滴定管,右手摇动锥形瓶,眼睛注视 。
(3)TiCl 水解生成TiO·xH O的化学方程式为 。
4 2 2
(4)滴定终点的现象是 。
16.(本题12分)Ⅰ.今有两个氢气燃烧生成水的热化学方程式:
H(g)+1/2O (g)=HO(g) ΔH=a kJ/mol
2 2 2
2H(g)+O (g)=2HO(l) ΔH=b kJ/mol
2 2 2
请回答下列问题:
(1)反应热的关系:2a (填“>”、“<”或“=”)b。
(2)若已知H(g)+1/2O (g)=HO(g) ΔH=-242 kJ/mol,且氧气中1 mol氧氧键完全断裂时吸收
2 2 2
热量496 kJ,水蒸气中1 mol H-O键形成时放出热量463 kJ,则氢气中1 mol H-H键断裂时吸收的热量
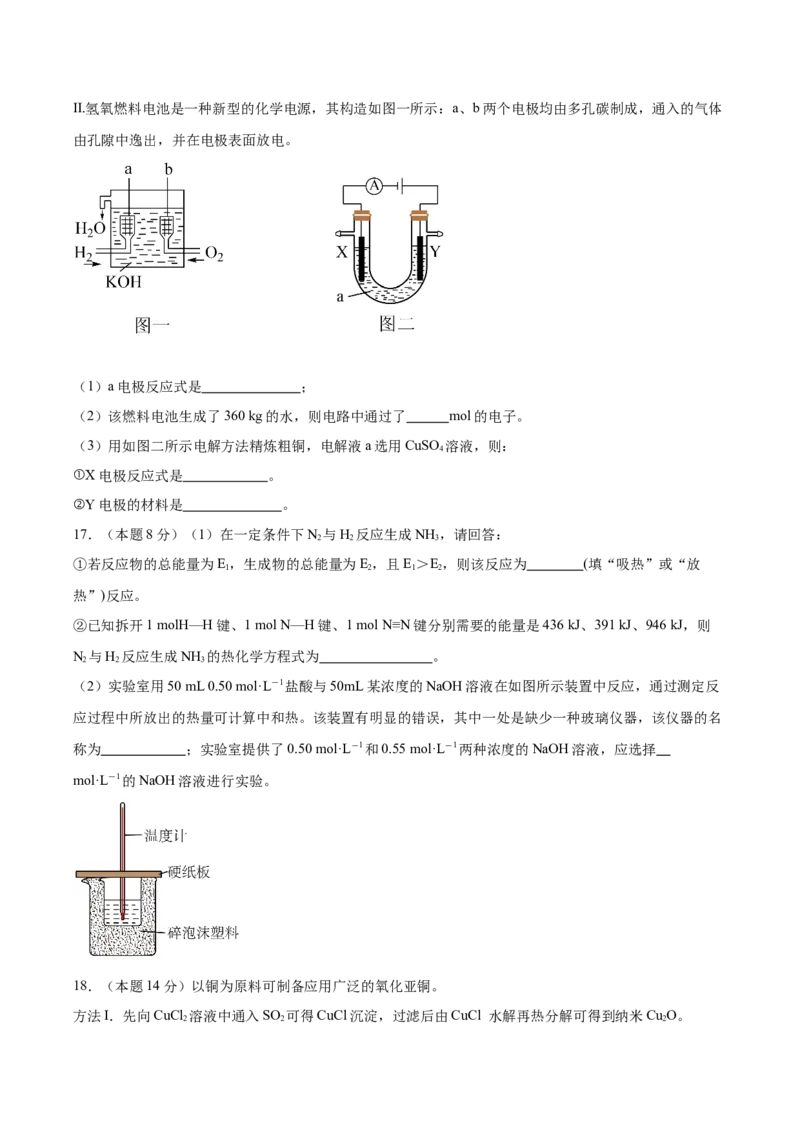
为 。Ⅱ.氢氧燃料电池是一种新型的化学电源,其构造如图一所示:a、b两个电极均由多孔碳制成,通入的气体
由孔隙中逸出,并在电极表面放电。
(1)a电极反应式是 ;
(2)该燃料电池生成了360 kg的水,则电路中通过了 mol的电子。
(3)用如图二所示电解方法精炼粗铜,电解液a选用CuSO 溶液,则:
4
①X电极反应式是 。
②Y电极的材料是 。
17.(本题8分)(1)在一定条件下N 与H 反应生成NH ,请回答:
2 2 3
①若反应物的总能量为E,生成物的总能量为E,且E>E,则该反应为 (填“吸热”或“放
1 2 1 2
热”)反应。
②已知拆开1 molH—H键、1 mol N—H键、1 mol N≡N键分别需要的能量是436 kJ、391 kJ、946 kJ,则
N 与H 反应生成NH 的热化学方程式为 。
2 2 3
(2)实验室用50 mL 0.50 mol·L-1盐酸与50mL某浓度的NaOH溶液在如图所示装置中反应,通过测定反
应过程中所放出的热量可计算中和热。该装置有明显的错误,其中一处是缺少一种玻璃仪器,该仪器的名
称为 ;实验室提供了0.50 mol·L-1和0.55 mol·L-1两种浓度的NaOH溶液,应选择
mol·L-1的NaOH溶液进行实验。
18.(本题14分)以铜为原料可制备应用广泛的氧化亚铜。
方法I.先向CuCl 溶液中通入SO 可得CuCl沉淀,过滤后由CuCl 水解再热分解可得到纳米Cu O。
2 2 2(1)向CuCl 溶液中通入SO 可得CuCl 沉淀,该反应的氧化剂与还原剂的物质的量之比为 。
2 2
(2)CuCl水解为: CuCl (s) +H O(1) CuOH (s) +Cl-(aq) +H+ (aq)。该反应的平衡常数K与此温度下
2
K 、K (CuOH)、 K (CuCl) 的关系为K= 。
w sp sp
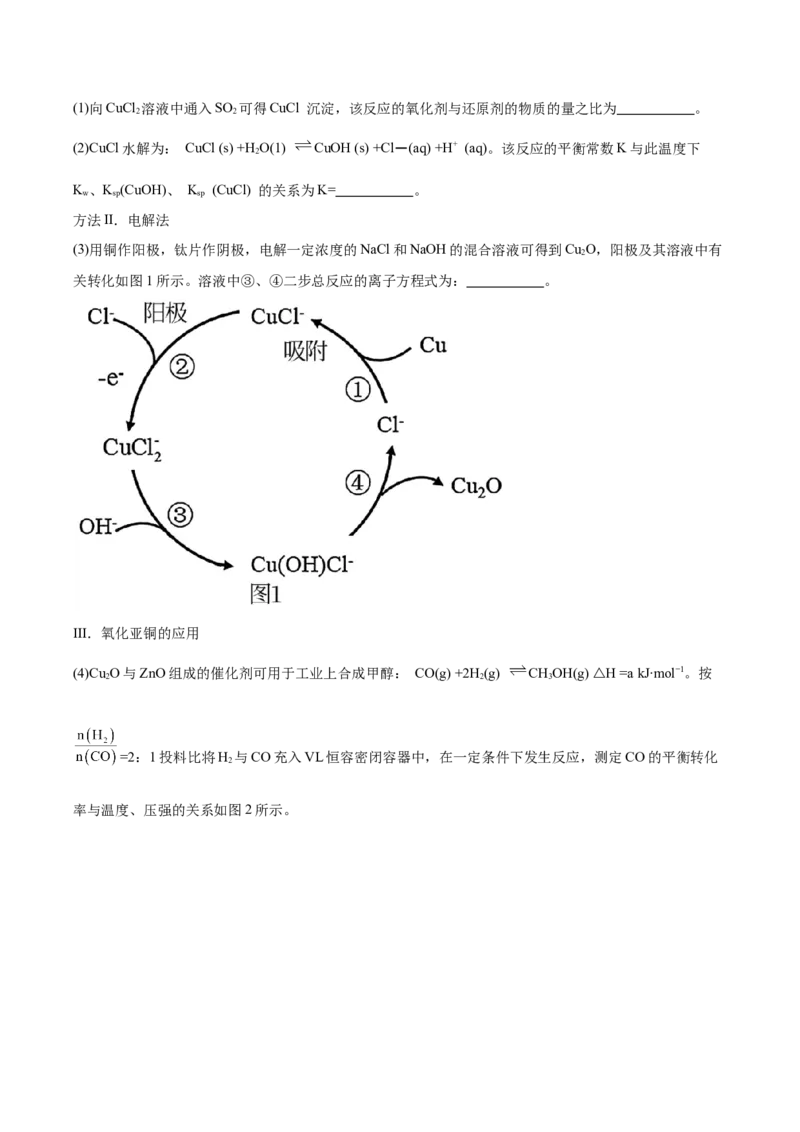
方法II.电解法
(3)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu O,阳极及其溶液中有
2
关转化如图1所示。溶液中③、④二步总反应的离子方程式为: 。
III.氧化亚铜的应用
(4)Cu O与ZnO组成的催化剂可用于工业上合成甲醇: CO(g) +2H (g) CHOH(g) △H =a kJ∙mol−1。按
2 2 3
=2:1投料比将H 与CO充入VL恒容密闭容器中,在一定条件下发生反应,测定CO的平衡转化
2
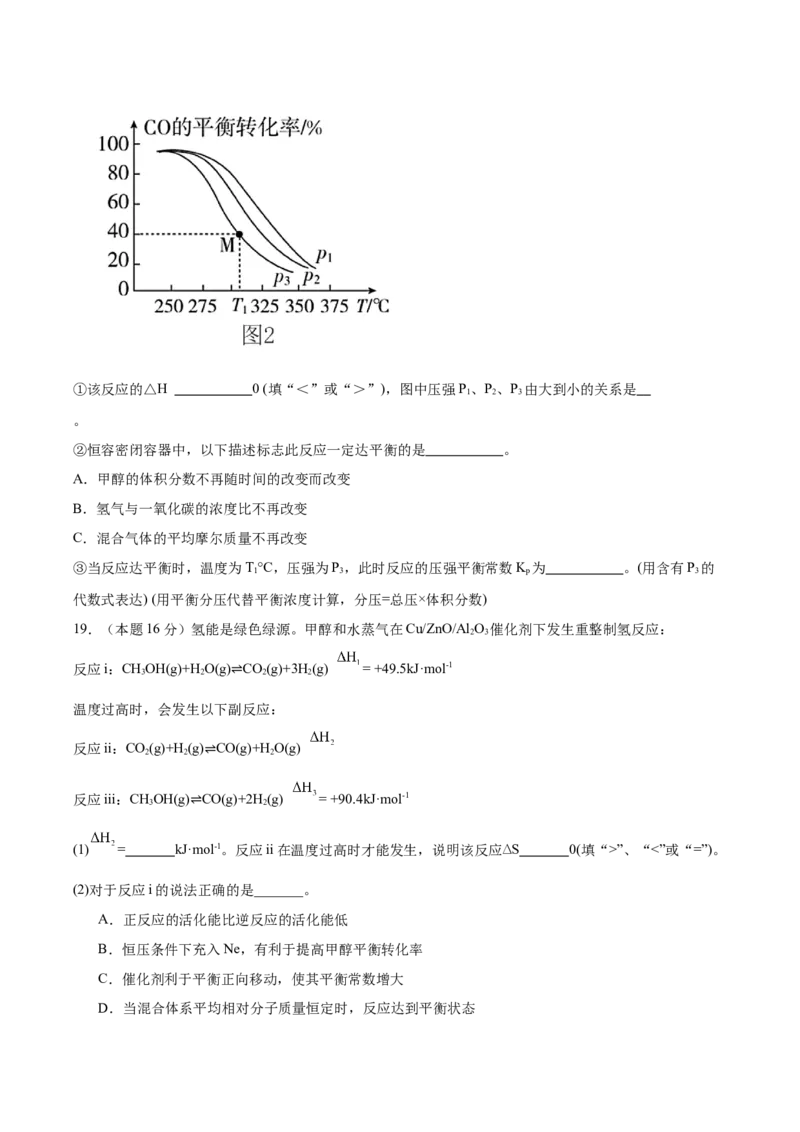
率与温度、压强的关系如图2所示。①该反应的△H 0 (填“<”或“>”),图中压强P、P、P 由大到小的关系是
1 2 3
。
②恒容密闭容器中,以下描述标志此反应一定达平衡的是 。
A.甲醇的体积分数不再随时间的改变而改变
B.氢气与一氧化碳的浓度比不再改变
C.混合气体的平均摩尔质量不再改变
③当反应达平衡时,温度为T°C,压强为P,此时反应的压强平衡常数K 为 。(用含有P 的
1 3 p 3
代数式表达) (用平衡分压代替平衡浓度计算,分压=总压×体积分数)
19.(本题16分)氢能是绿色绿源。甲醇和水蒸气在Cu/ZnO/Al O 催化剂下发生重整制氢反应:
2 3
反应i:CHOH(g)+H O(g) CO(g)+3H(g) = +49.5kJ·mol-1
3 2 2 2
⇌
温度过高时,会发生以下副反应:
反应ii:CO(g)+H(g) CO(g)+HO(g)
2 2 2
⇌
反应iii:CHOH(g) CO(g)+2H(g) = +90.4kJ·mol-1
3 2
⇌
(1) = kJ·mol-1。反应ii在温度过高时才能发生,说明该反应∆S 0(填“>”、“<”或“=”)。
(2)对于反应i的说法正确的是_______。
A.正反应的活化能比逆反应的活化能低
B.恒压条件下充入Ne,有利于提高甲醇平衡转化率
C.催化剂利于平衡正向移动,使其平衡常数增大
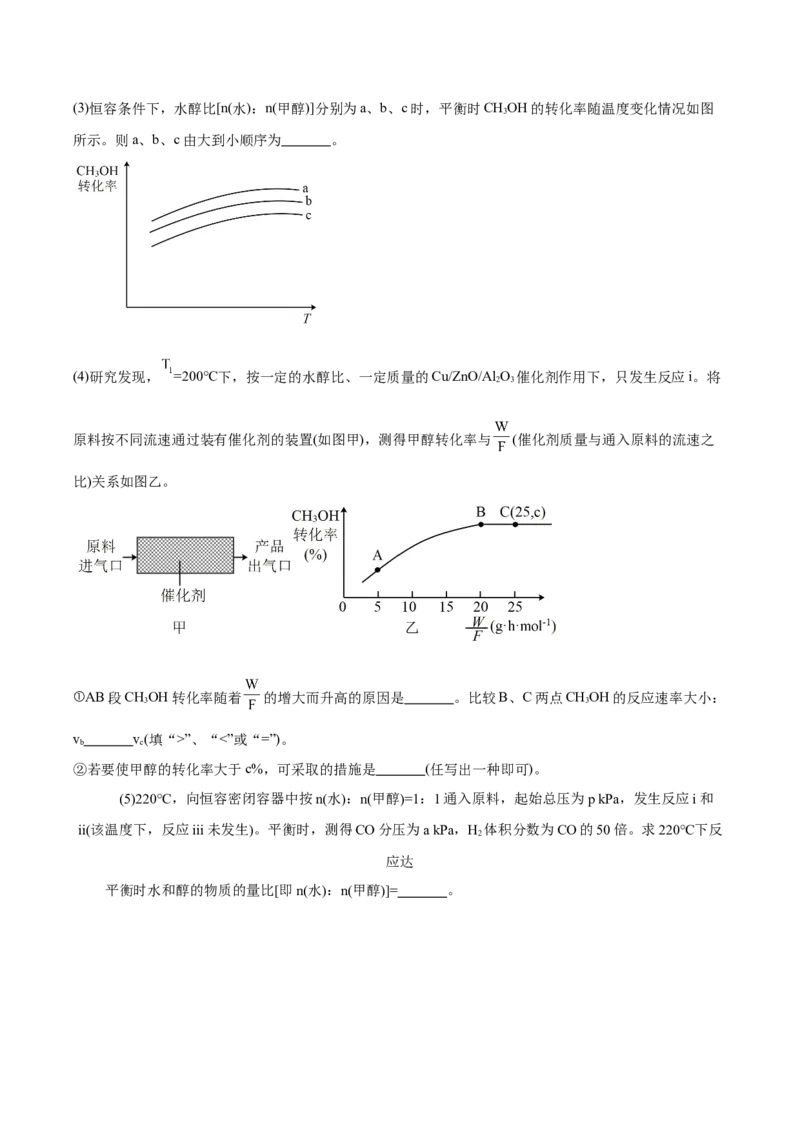
D.当混合体系平均相对分子质量恒定时,反应达到平衡状态(3)恒容条件下,水醇比[n(水):n(甲醇)]分别为a、b、c时,平衡时CHOH的转化率随温度变化情况如图
3
所示。则a、b、c由大到小顺序为 。
(4)研究发现, =200℃下,按一定的水醇比、一定质量的Cu/ZnO/Al O 催化剂作用下,只发生反应i。将
2 3
原料按不同流速通过装有催化剂的装置(如图甲),测得甲醇转化率与 (催化剂质量与通入原料的流速之
比)关系如图乙。
①AB段CHOH转化率随着 的增大而升高的原因是 。比较B、C两点CHOH的反应速率大小:
3 3
v v(填“>”、“<”或“=”)。
b c
②若要使甲醇的转化率大于c%,可采取的措施是 (任写出一种即可)。
(5)220℃,向恒容密闭容器中按n(水):n(甲醇)=1:1通入原料,起始总压为p kPa,发生反应i和
ii(该温度下,反应iii未发生)。平衡时,测得CO分压为a kPa,H 体积分数为CO的50倍。求220℃下反
2
应达
平衡时水和醇的物质的量比[即n(水):n(甲醇)]= 。参考答案:
题号 1 2 3 4 5 6 7 8 9 10
答案 D D C D B B A D B C
题号 11 12 13 14
答案 D A C B
15.(1)ADE
(2)锥形瓶内溶液颜色变化
(3)TiCl +(x+2)H O⇌TiO•xH O+4HCl
4 2 2 2
(4)滴入最后一滴标准液后,锥形瓶内溶液由无色变为(血)红色,且半分钟不褪色
16. > 436 kJ 2H+4OH--4e-=4HO 4×104 Cu2++2e-=Cu 粗铜
2 2
17. 放热 N(g)+3H(g) 2NH (g) ΔH=-92 kJ·mol-1 环形玻璃搅拌棒 0.55
2 2 3
18.(1)2:1
(2)
(3)2 +2OH-=Cu O+4Cl-+HO
2 2
(4) < P>P>P AC
1 2 3
19.(1) +40.9 >
(2)BD
(3)a>b>c
(4) AB段未达到平衡,由A到B气体流速减慢,向右反应程度更大 < 温度高于200℃;提
高水醇比
(5)(0.5p-16a):(0.5p-17a)