文档内容
高二化学答案第!
! 页!共"页"
化学试题参考答案及解析
!##答案$$
#命题意图$本题考查常见的化学反应中的热效应问题%意在考查学生对生产&生活中常见的吸
热和放热反应的关注程度'
#解析$木材燃烧属放热反应%% 错误(锌置换铜%典型的金属置换金属属放热反应%& 错误(石
油的裂化是分解反应属吸热反应%$ 正确(氢氧化钠溶液和盐酸的反应是酸碱中和反应%典型
的放热反应%' 错误'
(##答案$&
#命题意图$本题考查影响化学反应速率因素%意在考查对影响化学反应速率的外界因素的掌
握情况'
#解析$在铁制品表面刷油漆目的是隔绝空气%减慢铁的腐蚀速率%% 错误(在糖果制作过程中
添加着色剂%是添加食品添加剂%增加食品的色香味等%& 正确(将焦炭粉碎以增大接触面积%
加快反应速率%$错误(用涡轮增压是增大气体压强%加快反应速率%' 错误'
)##答案$'
#命题意图$本题考查电化学基础问题%意在考查对原电池&电解池&金属的电化学腐蚀知识的
理解能力'
#解析$生铁中含有碳%易形成原电池使铁腐蚀%% 错误(原电池工作时%阴离子移向负极%& 错
误(电镀铜的电镀液应选与镀层金属相同的阳离子%$ 错误(二次电池又叫可充电电池%
' 正确'
*##答案$&
#命题意图$本题考查化学反应中的平衡问题%意在考查从平衡状态的特征&平衡的移动%辨识
常见平衡问题能力'
#解析$不是所有反应都是可逆反应%非可逆反应就不存在化学平衡%% 错误(人体内酸碱平衡
对人体健康至关重要%&正确(化学反应达到平衡状态时%正逆速率相等%但不为零%$ 错误(加
入铁粉使+,$-
)减少%从而使平衡逆向移动%' 错误'
"##答案$&
#命题意图$本题考查原子结构与性质问题%意在考查对电子排布式&简单原子离子半径比较&
第一电离能和洪特规则&泡利原理的理解和应用能力'
#解析$根据电子排布式可推出)!.("/(#.0(据此作答'
高二化学答案第(
! 页!共"页"
1##答案$'
#命题意图$本题考查反应热的计算问题%意在考查依据对键能反应热的计算&熵变的掌握
水平'
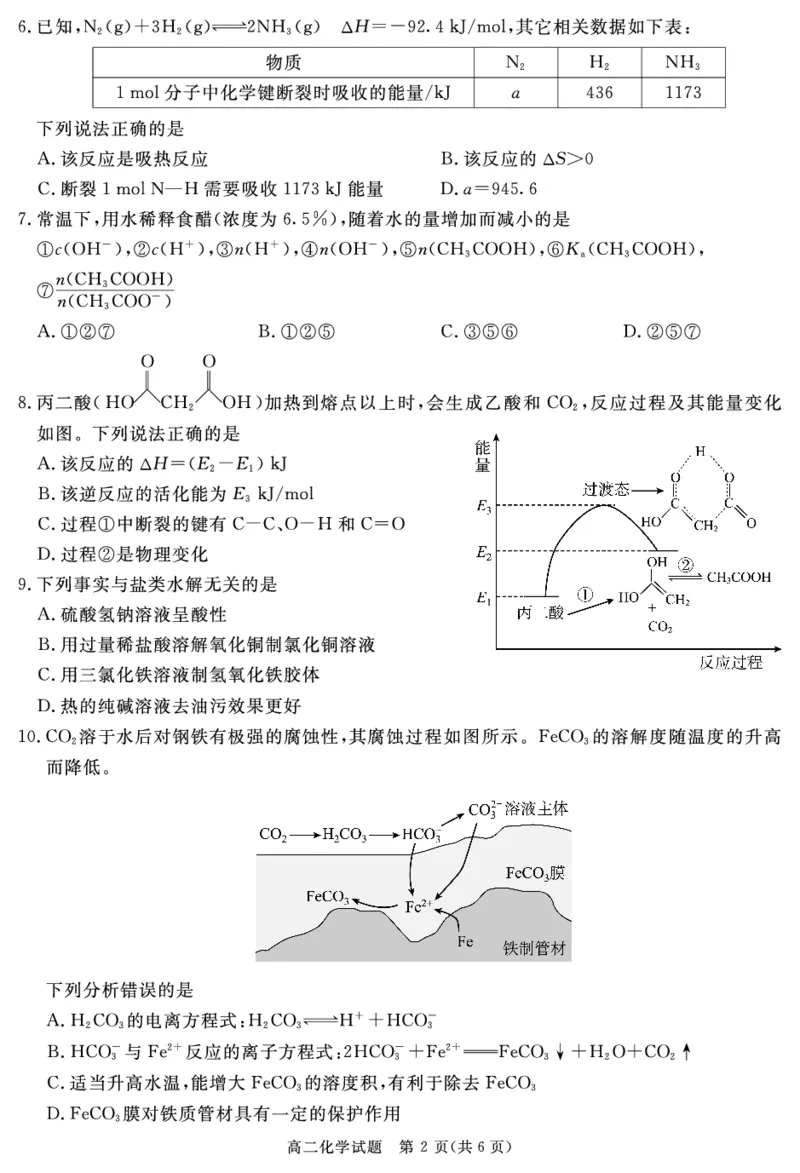
#解析$$! "2%反应是放热反应%% 错误(该反应正反应是气体分子数减少的反应%$""2%
&错误(根据键能计算反应热%可知%断裂!34-.*5 需要吸收)6!78能量%#96*":1%$ 错
误(' 正确'
;##答案$'
#命题意图$本题考查影响电离平衡问题%意在考查加水稀释对电离平衡的影响及各物理量的
变化趋势的理解及应用能力'
#解析$水稀释食醋%醋酸电离平衡右移%$!5
< "&$!/5
= "&$!$5)$//
= "&%!/5
= "增加%
$!$5)$//5"&
%!5
< "减少(&0!$5)$//5"只与温度有关%不变(综上所述%' 正确'
>##答案$$
#命题意图$本题考查化学反应历程中的相关问题%意在分析对反应过程与能量图的分析%有关
$!&活化能&断键分析%考查识图能力'
#解析$该反应的$!9!'(='!"78+34-%% 错误(该逆反应的活化能为!')='("78+34-%&错
误(分析过程!的反应物和生成物可知%$正确(有新物质生成%属化学变化%' 错误'
6##答案$%
#命题意图$本题考查盐类水解的应用问题%意在考查对盐类水解在生产&生活中的应用'
#解析$硫酸氢钠溶液呈酸性是硫酸氢钠的电离%% 正确(过量稀盐酸可以抑制铜离子的水解%
&错误(利用铁离子水解制氢氧化铁胶体%$错误(加热%促进纯碱水解%碱性更强%使油污水解
更彻底%' 错误'
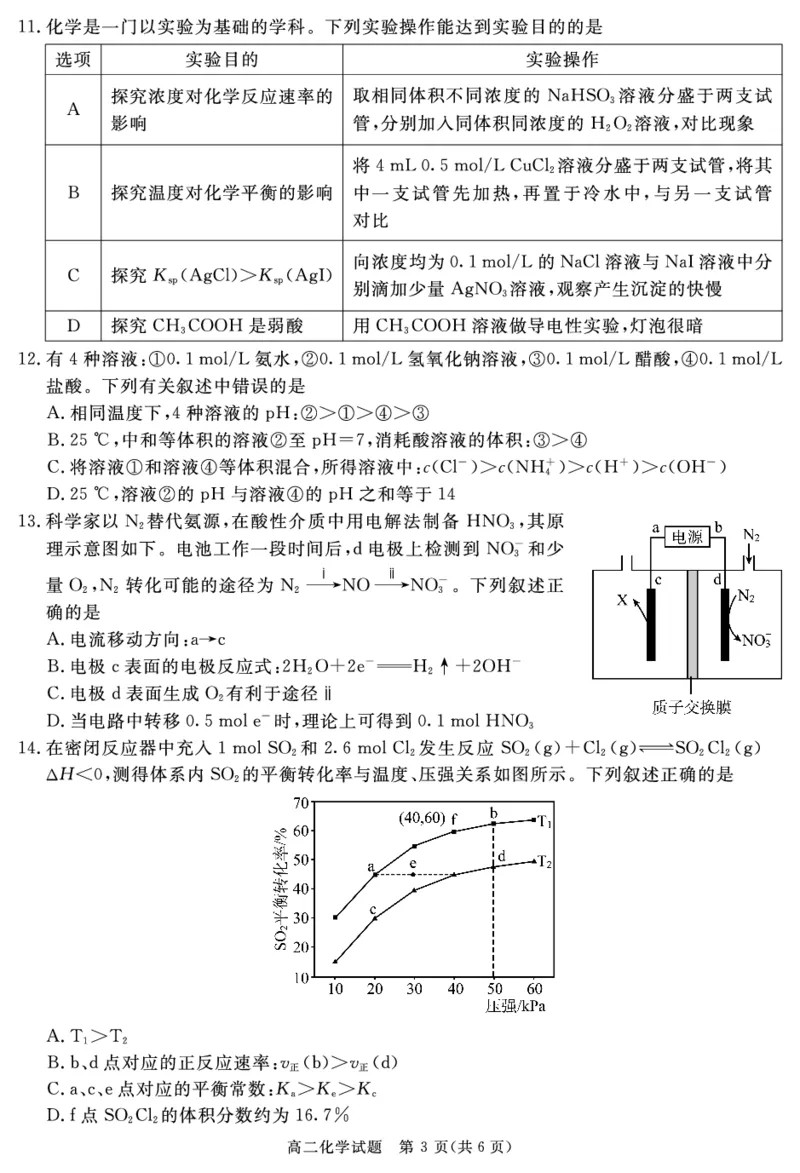
!2##答案$$
#命题意图$本题考查钢铁腐蚀问题%意在考查信息加工能力'
#解析$碳酸为二元弱酸%分布电离%% 错误(结合图示书写离子方程式%&错误(由题干信息)
+,$/)的溶解度随温度的升高而降低%$正确(形成+,$/)膜后%可以有效阻止铁与水溶液接
触%起到保护铁的作用%' 错误'
!!##答案$&
#命题意图$本题考查实验基本目的问题%意在考查不同实验的操作&现象&可行性等方面的识
别能力'
#解析$.05?/)溶液与5(/(溶液反应无明显现象%不利于观察%% 错误(通过颜色变化探究
温度对化学平衡的影响%&正确(.0$-溶液与.0@溶液中与%A./)溶液反应%产生沉淀的快
慢不利于观察%$错误(导电性强弱与电解质强弱无关%' 错误'
高二化学答案第)
! 页!共"页"
!(##答案$%
#命题意图$本题考查溶液中的B5 问题%意在考查B5 的定义&酸碱中和后溶液酸碱性判断&
溶液中离子浓度大小比较等知识的掌握情况'
#解析$,由B5 定义即可计算!B5"!)%"B59!)%#B5#!%%B59!%% 正确(醋酸是弱
酸%与氢氧化钠恰好中和时%溶液呈碱性%盐酸是强酸%与氢氧化钠恰好中和时%溶液呈中性%
中和等体积的氢氧化钠溶液至B59;%所需醋酸体积大%&错误(将溶液!和溶液%等体积混
合后%溶质为氯化铵%铵根水解%
%!$-
= "#%!.5
<
* "#%!5
< "#%!/5
= "%$ 错误(溶液"B59
!)%溶液%B59!%B5 之和等于!*%' 错误'
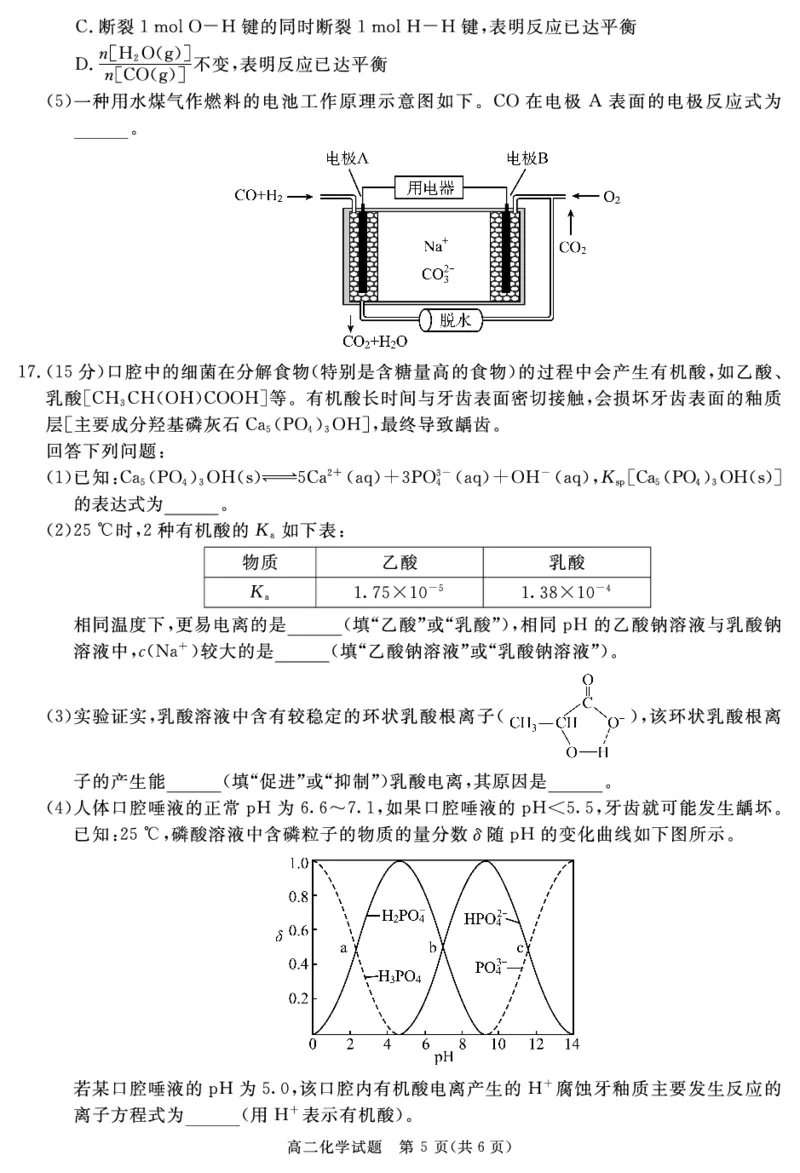
!)##答案$$
#命题意图$本题考查用电化学知识解决工业生产中的实际问题%意在考察对电解池的基本原
理&有关计算&电极方程式书写的掌握水平'
#解析$C电极上检测到./
=
) 和少量/(%C电极上的反应有).(:!78-34-
=!
!("高温!!分"!!反应!!!分"
!)"!(>:>+)!!2:!)!!"9
!*"&'
!""$/=(,
= <$/
(= $$$
)
($/(
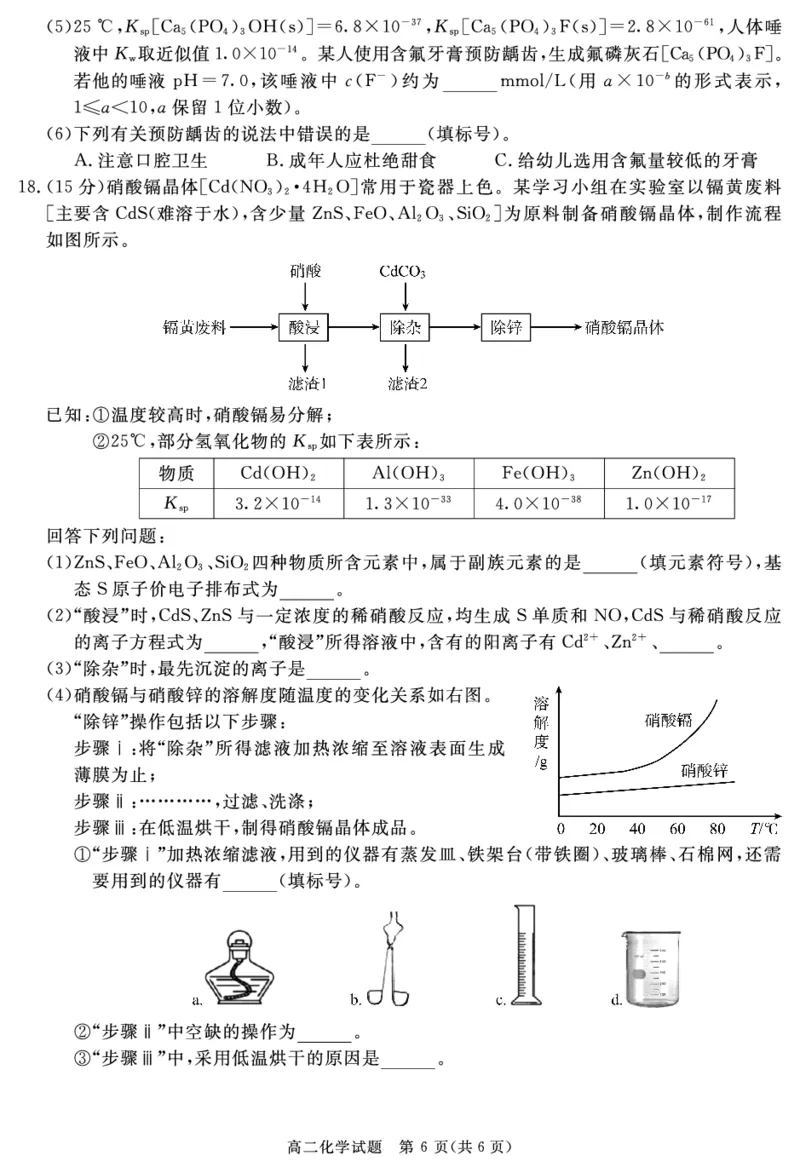
!命题意图"本题考查化学反应中的能量变化问题!化学反应速率和化学平衡"化学反应方向
问题!电极方程式的书写#意在考察盖斯定律的应用能力!平衡状态判断"改变某一条件对化
学反应速率和化学平衡的影响"计算化学反应速率和平衡常数#运用复合判据判断反应进行
的方向及电极方程式的书写#
!解析"%!&由盖斯定律可知!$!9$!!<$!(=($!)9:!78'34-
=!#
%(&$!=*$""2!反应自发进行!反应!的$!#2!$"#2!高温自发进行#反应(的$!"2!
$"92!任何温度自发进行#所以与图像相符的是反应!#
%)&!反应的水蒸气的质量是";:1A!所以!2')3OP内!(%5(/&9(>:>()A(%Q'3OP&#
* R!反应碳粒(!:1A!即!:>34-!则反应! 生成$/!:>34-"消耗水!:>34-!总反应水
):(34-!则反应(消耗水!:*34-!则消耗$/!:*34-#所以!反应达平衡时!体系中有水
*:>34-"$/2:*34-"5():(34-"$/(!:*34-!带入反应! 的平衡常数表达式可得&9
2:!)34-(Q#
"将碳粒粉碎!不影响平衡!所以!剩余水的质量相等#
%*&加压!(%正&和(%逆&均增大!% 错误)升高温度!(%正&和(%逆&均增大!平衡逆向移动!逆反应速
率增大的程度较多#&正确#断裂(34-/=5 键的同时断裂!34-5=5 键!表明反应已达
平衡!$错误#$*5(/%A&+
$*$/%A&+不变!说明$*5(/%A&+"$%$/&均不变!表明反应已达平衡#'
正确#
%"&由图可知!$/ 在电极上转化为$/(!失去电子!熔融碳酸钠为电解液!所以电极反应为$
$/=(,
= <$/
(= $$$
)
($/(#
!;##答案$!!"分%除标注外%每空(分"
!!"
%
"!$0
(< "-%
)!S/
)=
* "-%!/5
= "
!("乳酸!!乳酸钠溶液
!)"促进!!分"!!生成较稳定的环状乳酸根离子%降低了溶液中乳酸根离子的浓度%平衡向
高二化学答案第"
! 页!共"页"
电离方向移动
!*"$0"!S/*"
)/5<;5 $$$
<
"$0
(< <)5(S/
=
* <5(/
!""*:!T!2
=(6
!1"&$
!命题意图"本题考查水溶液中的离子平衡!意在考查溶度积的定义"表达式及计算!利用电离
常数判断酸的强弱及盐类水解规律!影响电离平衡的外界因素!根据题设环境陌生离子方程
式的书写能力#
!解析"%!&溶度积常数定义可得表达式#
%(&温度相同时!&0 越小!酸越难电离!对应弱酸根的水解程度越大#
%)&形成稳定的环状离子!可降低乳酸根离子浓度!促进乳酸电离平衡正向移动#
%*&根据图示!B59":2时!含磷微粒是5(S/
=
* !即可书写离子方程式#
%"&根据方程式的平衡常数与羟基磷灰石和氟磷灰石的溶度积关系即可计算#
%1&略
!>##答案$!!"分%除标注外%每空(分"
!!"LP&+,!!)I
()B
*!!分"
!(")$C?<>5
< <(./
= $$$
)
)$C
(< <)?<(./%<*5(/!!5
< &+,
)< &%-
)<
!)"+,
)<
!*"!0E!!"冷却结晶
#避免温度过高%失去部分结晶水(温度过高%硝酸镉受热分解
!命题意图"本题考查工艺流程中的相关知识!意在考查元素化合物知识"元素周期表结构"电
子排布式"流程的分析"陌生离子方程式的书写"基本实验中的仪器"实验操作"实验分析
能力#
!解析"%!&熟悉元素周期中!')1号元素在周期表中位置#LP"+,分别在(&")族!?在*%
族!所以?的价电子排布式为)I
()B
*#
%(&根据氧化还原反应方程式书写规律!方程式为)$C?<>5
< <(./
= '(
)
)$C
(< <)?<
(./%<*5(/)酸浸时!$C?"LP?"+,/"%-
(/) 均溶解!所以阳离子有$$C
(< "LP
(< "5
< "
+,
)< "%-
)< #
%)&氢氧化铁的溶度积最小!所以最先沉淀的是+,
)< #
%*&!加热溶液需要的仪器还有$酒精灯"坩埚钳)"蒸发浓缩"冷却结晶)#根据信息!硝酸镉
温度较高时!易分解#