文档内容
三明市 2024 届高中毕业班适应性练习
化学试题
2024.3
本试卷共8页,总分100分,考试时间75分钟。
注意事项:
1.答卷前、考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,逃出每题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,
用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。写在本试卷
上无效。
3.考试结束后,将答题卡交回。
可能用到的相对原子质量:H-1 B-11 C-12 N-14 O-16 C1-35.5
Fe-56 Ag-108 Bi-209
一、选择题(本题共10小题,每小题4分,共40分。在每小题给出的四个选项中,只有一项
是符合题目要求的)
1.三明市围绕萤石(CaF )资源打造全产业链,把氟化工作为未来重要的支柱产业培育。下列叙述错误的是(
2
)
A.萤石悬浊液中含有氟离子 B.萤石夜晚发光与电子跃迁有关
C.氟化氢的水溶液中存在电离平衡 D.锂电池中的六氟磷酸锂是非电解质
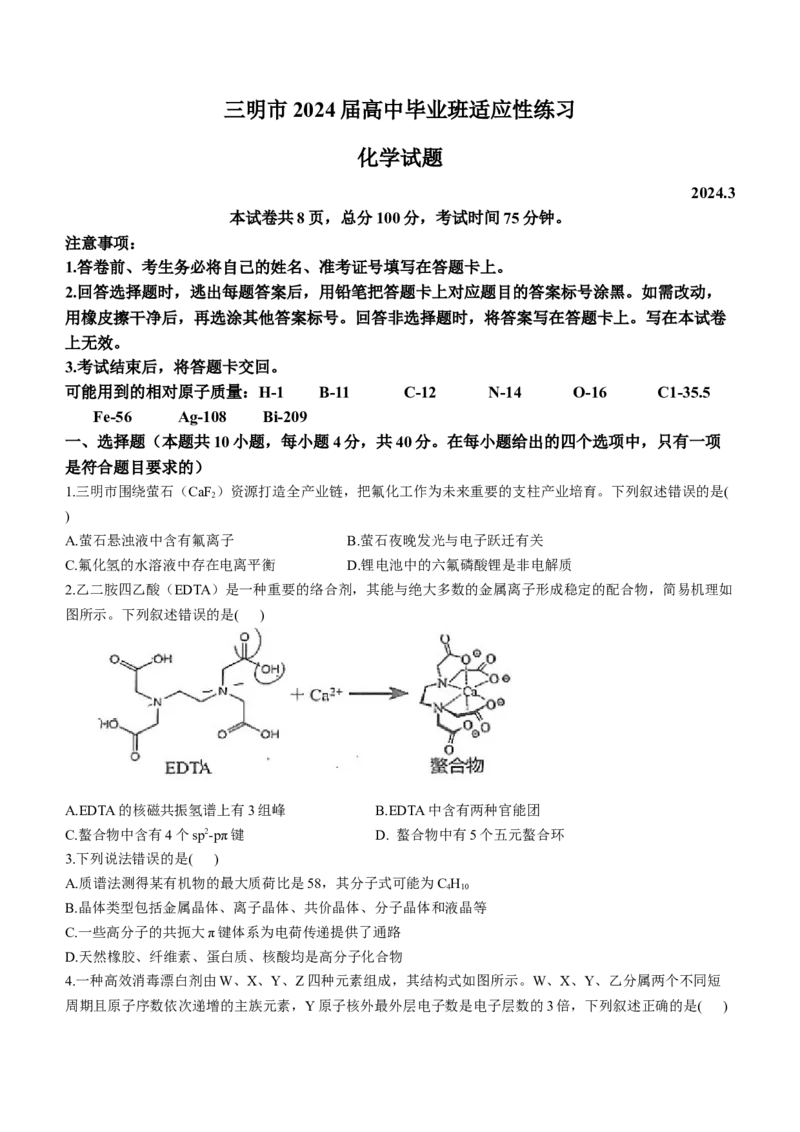
2.乙二胺四乙酸(EDTA)是一种重要的络合剂,其能与绝大多数的金属离子形成稳定的配合物,简易机理如
图所示。下列叙述错误的是( )
A.EDTA的核磁共振氢谱上有3组峰 B.EDTA中含有两种官能团
C.螯合物中含有4个sp2-pπ键 D. 螯合物中有5个五元螯合环
3.下列说法错误的是( )
A.质谱法测得某有机物的最大质荷比是58,其分子式可能为C H
4 10
B.晶体类型包括金属晶体、离子晶体、共价晶体、分子晶体和液晶等
C.一些高分子的共扼大π键体系为电荷传递提供了通路
D.天然橡胶、纤维素、蛋白质、核酸均是高分子化合物
4.一种高效消毒漂白剂由W、X、Y、Z四种元素组成,其结构式如图所示。W、X、Y、乙分属两个不同短
周期且原子序数依次递增的主族元素,Y原子核外最外层电子数是电子层数的3倍,下列叙述正确的是( )
学科网(北京)股份有限公司A.原子半径(r):XW D.氢化物的沸点:X0
C.将Mg(HCO ) 溶液与过的NaOH溶液混合:
3 2
D.铅蓄电池充电时阴极反应:
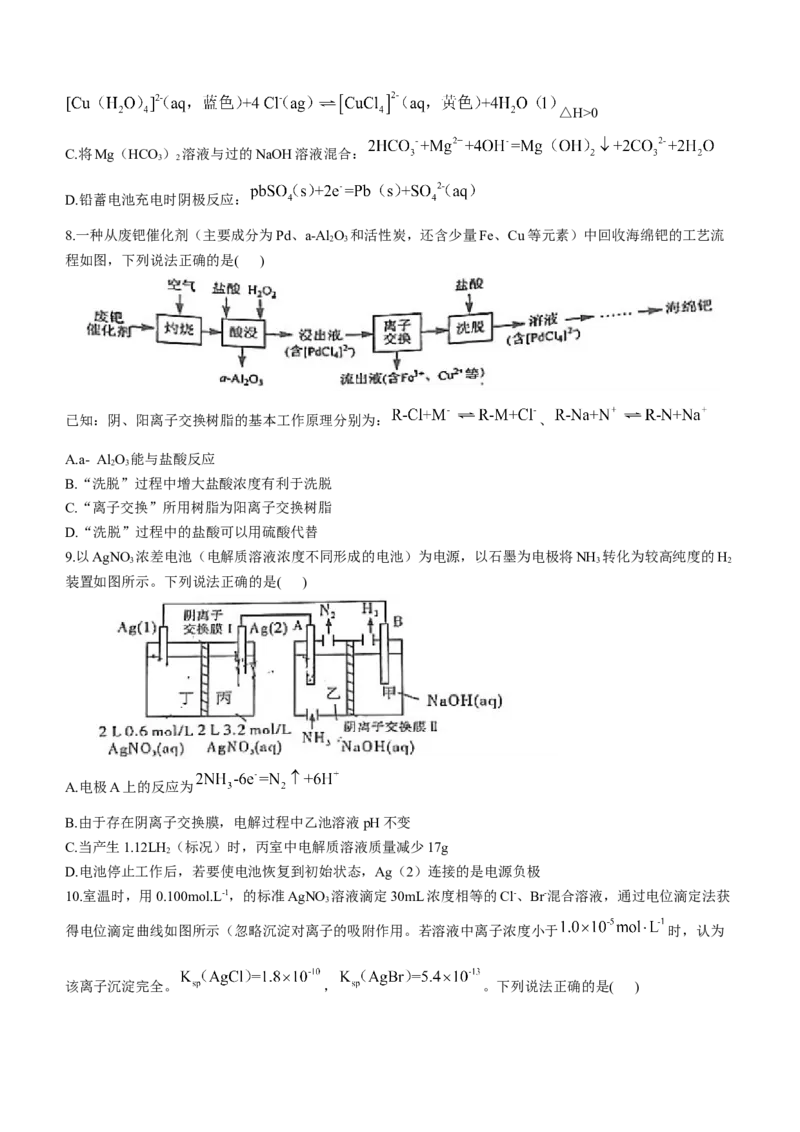
8.一种从废钯催化剂(主要成分为Pd、a-Al O 和活性炭,还含少量Fe、Cu等元素)中回收海绵钯的工艺流
2 3
程如图,下列说法正确的是( )
已知:阴、阳离子交换树脂的基本工作原理分别为: 、
A.a- Al O 能与盐酸反应
2 3
B.“洗脱”过程中增大盐酸浓度有利于洗脱
C.“离子交换”所用树脂为阳离子交换树脂
D.“洗脱”过程中的盐酸可以用硫酸代替
9.以AgNO 浓差电池(电解质溶液浓度不同形成的电池)为电源,以石墨为电极将NH 转化为较高纯度的H
3 3 2
装置如图所示。下列说法正确的是( )
A.电极A上的反应为
B.由于存在阴离子交换膜,电解过程中乙池溶液pH不变
C.当产生1.12LH (标况)时,丙室中电解质溶液质量减少17g
2
D.电池停止工作后,若要使电池恢复到初始状态,Ag(2)连接的是电源负极
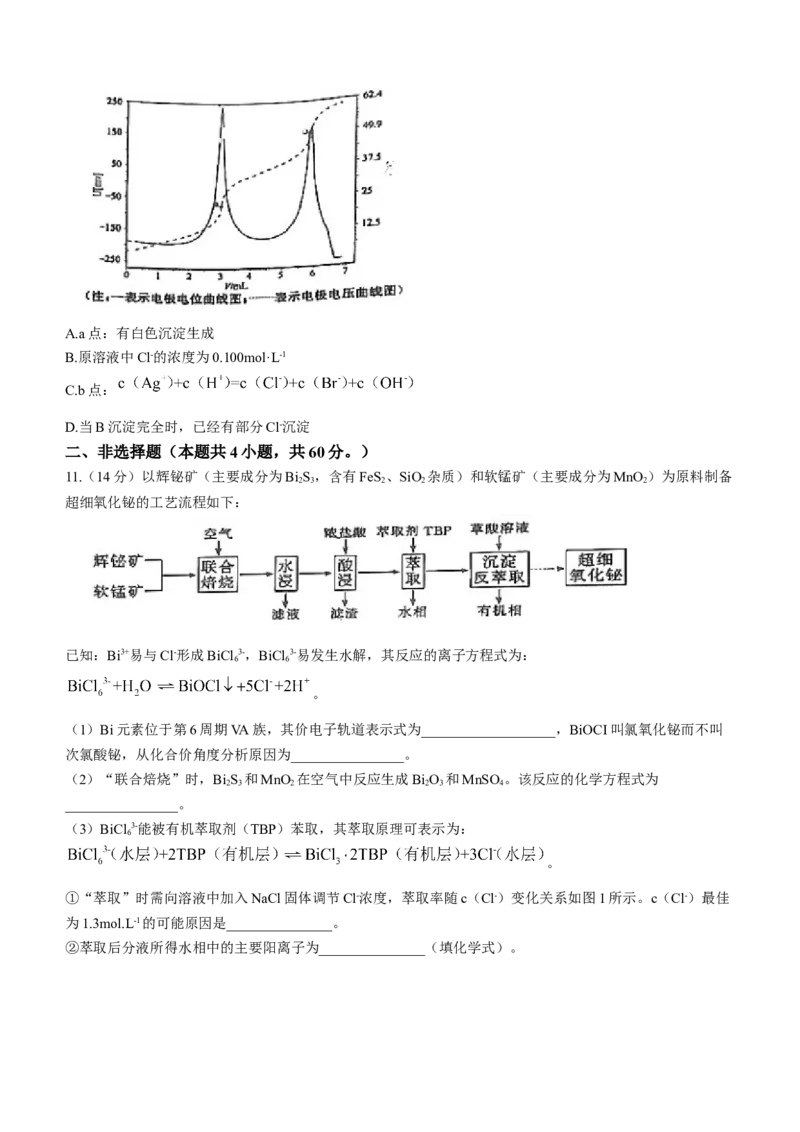
10.室温时,用0.100mol.L-1,的标准AgNO 溶液滴定30mL浓度相等的Cl-、Br-混合溶液,通过电位滴定法获
3
得电位滴定曲线如图所示(忽略沉淀对离子的吸附作用。若溶液中离子浓度小于 时,认为
该离子沉淀完全。 , 。下列说法正确的是( )
学科网(北京)股份有限公司A.a点:有白色沉淀生成
B.原溶液中Cl-的浓度为0.100mol·L-1
C.b点:
D.当B沉淀完全时,已经有部分Cl-沉淀
二、非选择题(本题共4小题,共60分。)
11.(14分)以辉铋矿(主要成分为BiS,含有FeS、SiO 杂质)和软锰矿(主要成分为MnO )为原料制备
2 3 2 2 2
超细氧化铋的工艺流程如下:
已知:Bi3+易与Cl-形成BiCl3-,BiCl 3-易发生水解,其反应的离子方程式为:
6 6
。
(1)Bi元素位于第6周期VA族,其价电子轨道表示式为___________________,BiOCI叫氯氧化铋而不叫
次氯酸铋,从化合价角度分析原因为________________。
(2)“联合焙烧”时,BiS 和MnO 在空气中反应生成BiO 和MnSO 。该反应的化学方程式为
2 3 2 2 3 4
________________。
(3)BiCl3-能被有机萃取剂(TBP)苯取,其萃取原理可表示为:
6
。
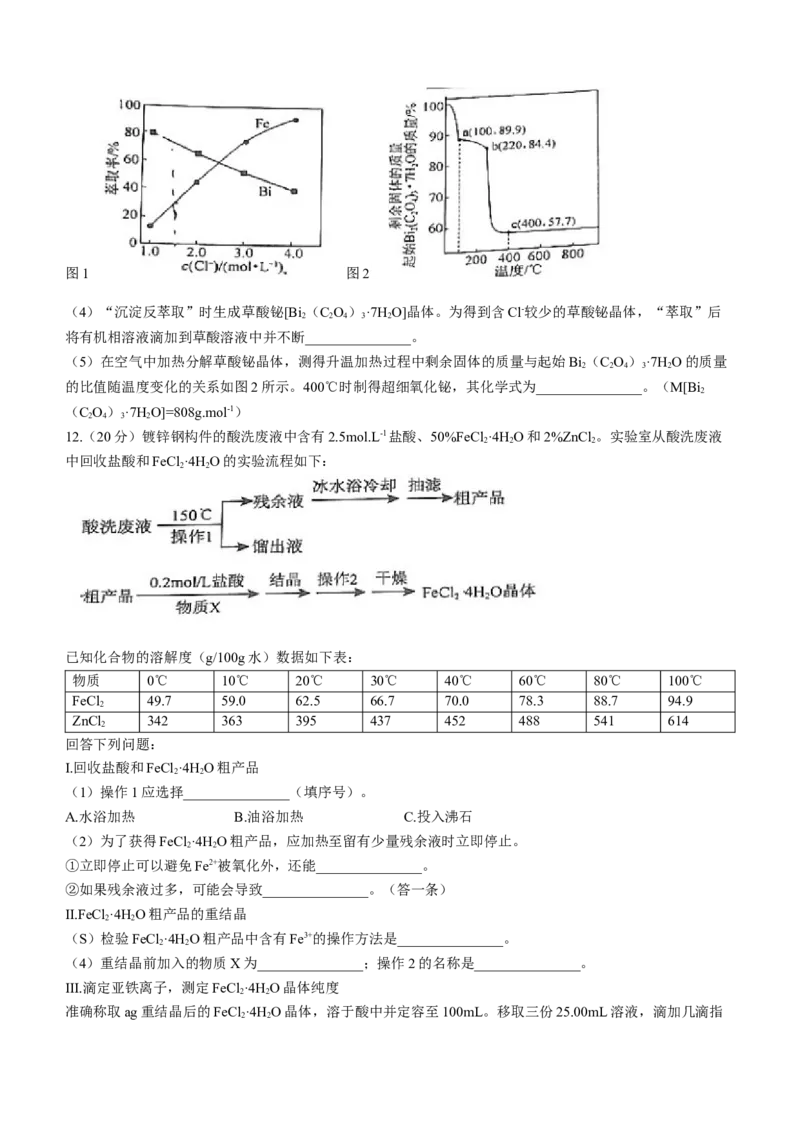
①“萃取”时需向溶液中加入NaCl固体调节Cl-浓度,萃取率随c(Cl-)变化关系如图1所示。c(Cl-)最佳
为1.3mol.L-1的可能原因是_______________。
②萃取后分液所得水相中的主要阳离子为_______________(填化学式)。
学科网(北京)股份有限公司图1 图2
(4)“沉淀反萃取”时生成草酸铋[Bi (C O)·7H O]晶体。为得到含Cl-较少的草酸铋晶体,“萃取”后
2 2 4 3 2
将有机相溶液滴加到草酸溶液中并不断_______________。
(5)在空气中加热分解草酸铋晶体,测得升温加热过程中剩余固体的质量与起始Bi(C O)·7H O的质量
2 2 4 3 2
的比值随温度变化的关系如图2所示。400℃时制得超细氧化铋,其化学式为_______________。(M[Bi
2
(C O)·7H O]=808g.mol-1)
2 4 3 2
12.(20分)镀锌钢构件的酸洗废液中含有2.5mol.L-1盐酸、50%FeCl·4H O和2%ZnCl 。实验室从酸洗废液
2 2 2
中回收盐酸和FeCl ·4H O的实验流程如下:
2 2
已知化合物的溶解度(g/100g水)数据如下表:
物质 0℃ 10℃ 20℃ 30℃ 40℃ 60℃ 80℃ 100℃
FeCl 49.7 59.0 62.5 66.7 70.0 78.3 88.7 94.9
2
ZnCl 342 363 395 437 452 488 541 614
2
回答下列问题:
I.回收盐酸和FeCl ·4H O粗产品
2 2
(1)操作1应选择_______________(填序号)。
A.水浴加热 B.油浴加热 C.投入沸石
(2)为了获得FeCl ·4H O粗产品,应加热至留有少量残余液时立即停止。
2 2
①立即停止可以避免Fe2+被氧化外,还能_______________。
②如果残余液过多,可能会导致_______________。(答一条)
II.FeCl ·4H O粗产品的重结晶
2 2
(S)检验FeCl ·4H O粗产品中含有Fe3+的操作方法是_______________。
2 2
(4)重结晶前加入的物质X为_______________;操作2的名称是_______________。
III.滴定亚铁离子,测定FeCl ·4H O晶体纯度
2 2
准确称取ag重结晶后的FeCl ·4H O晶体,溶于酸中并定容至100mL。移取三份25.00mL溶液,滴加几滴指
2 2
学科网(北京)股份有限公司示剂,用cmol.L-1KCr O 标准溶液滴定至终点,半分钟内不恢复原色,消耗KCr O 标准溶液平均体积为
2 2 7 2 2 7
VmL(此时Cl-不被氧化)。(M【FeCl ·4H O】=199 g.mol-1)
2 2
(5)计算FeCl ·4H O晶体的纯度为_______________%(用含a、c的最简代数式表示)。
2 2
(6)亚甲基蓝可用作以上指示剂,其结构式如下图。MB可用N,N-二甲基苯胺(DMA)为原料制得。
亚甲基蓝(MB)的结构式
N,N-二甲基苯胺(DMA)的结构简式
①亚甲基蓝阳离子中各元素的电负性从大到小的顺序为_______________。
②亚甲基蓝中N原子的杂化方式有_______________。
③DMA的碱性比苯胺强,说明理由_______________。
13.(14分)甲醇水蒸气重整制氢已经成为工业上制取氢气的重要工艺,甲醇水蒸气重整过程中可能出现以下
反应。
反应I:
反应Ⅱ: △H
2
反应III:
回答下列问题:
(1)△H=_______________kJ.mol-1,反应Ⅲ可在_______________(填“高温”或“低温”或“任意温
2
度”)下可自发进行。
(2)一定温度下,将1mol甲醇与3mol水蒸气投入密闭容器中发生反应,一段时间后达到平衡,测得甲醇的
转化率为80%,水蒸气体积分数为3/7,则:
①该反应中水蒸气的转化率为_______________。
②反应I的压强平衡常数K=_______________。(保留3位有效数字)
p
③若对体系增大压强,反应I平衡_______________(填“移动”或“不移动”)。
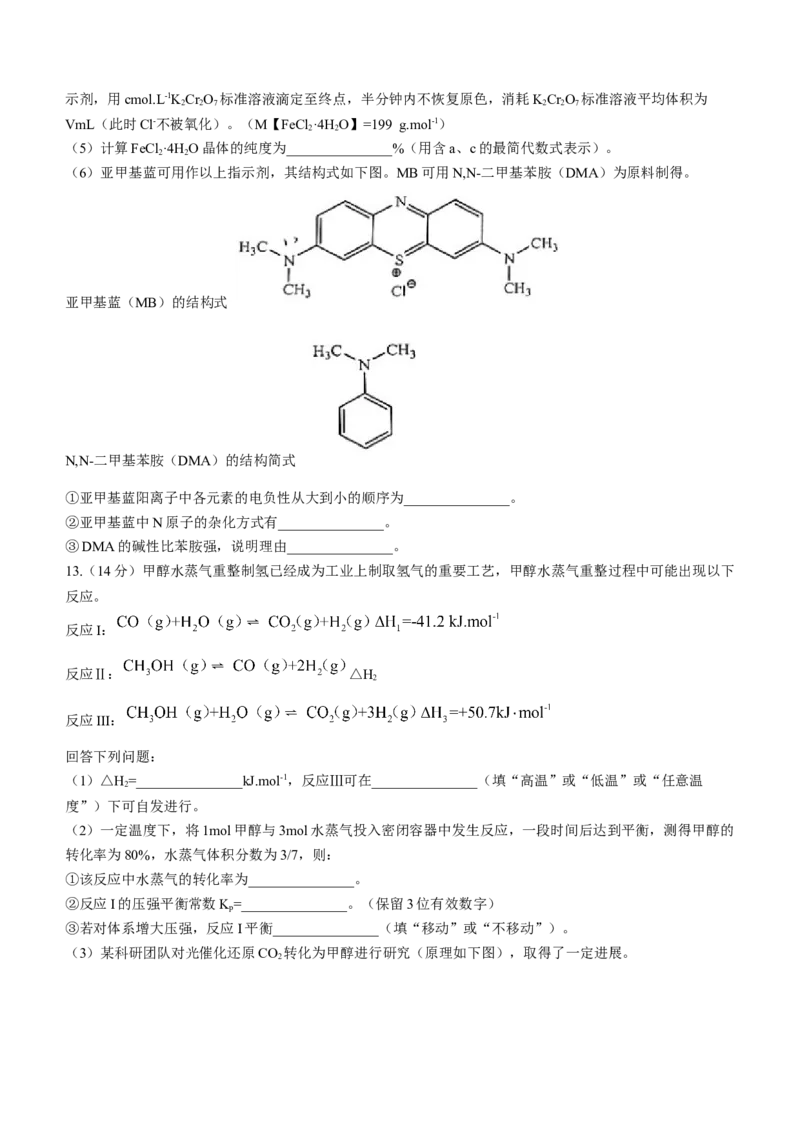
(3)某科研团队对光催化还原CO 转化为甲醇进行研究(原理如下图),取得了一定进展。
2
学科网(北京)股份有限公司①电极1的电势______________(填“高于”或“低于”)电极2的电势。
②该光催化过程的总反应方程式为_______________。
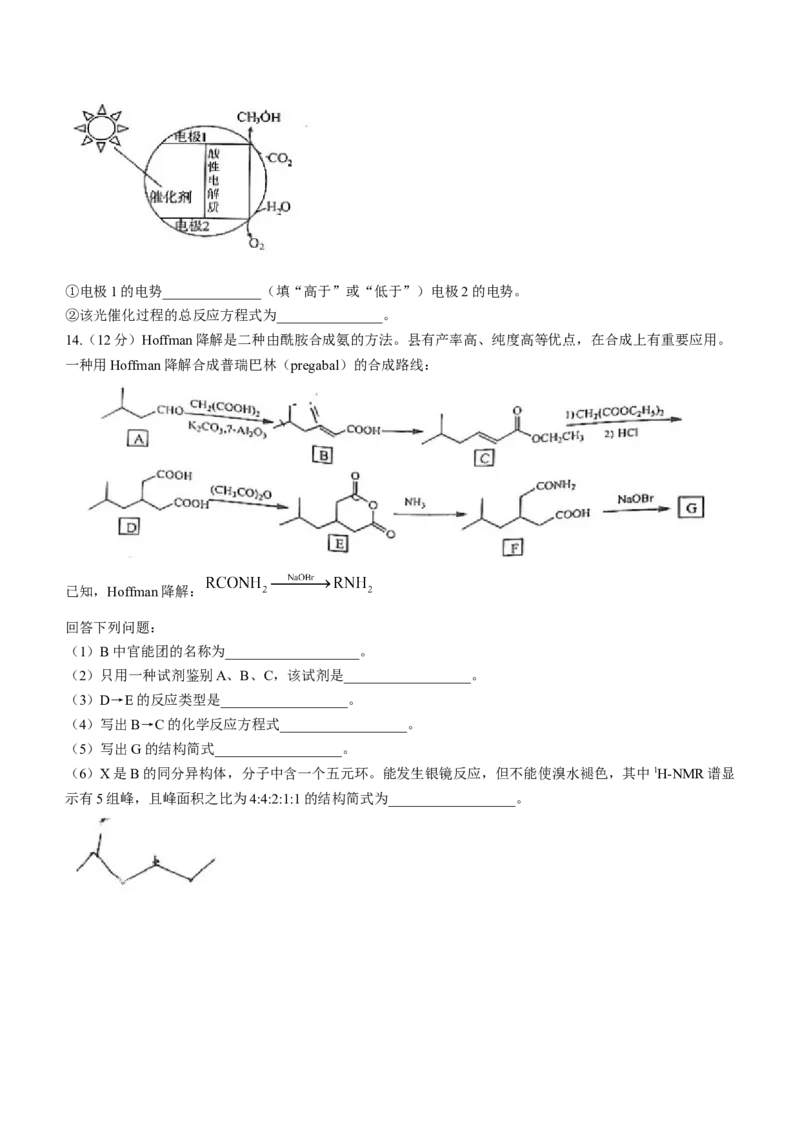
14.(12分)Hoffman降解是二种由酰胺合成氨的方法。县有产率高、纯度高等优点,在合成上有重要应用。
一种用Hoffman降解合成普瑞巴林(pregabal)的合成路线:
已知,Hoffman降解:
回答下列问题:
(1)B中官能团的名称为___________________。
(2)只用一种试剂鉴别A、B、C,该试剂是__________________。
(3)D→E的反应类型是__________________。
(4)写出B→C的化学反应方程式__________________。
(5)写出G的结构简式__________________。
(6)X是B的同分异构体,分子中含一个五元环。能发生银镜反应,但不能使溴水褪色,其中1H-NMR谱显
示有5组峰,且峰面积之比为4:4:2:1:1的结构简式为__________________。
学科网(北京)股份有限公司