文档内容
人大附中 2025 届高三 10 月检测练习
化学
说明:本试卷 19 道题,共 100 分;考试时间90 分钟;请在答题卡上填写个人信息,并将
条 形码贴在答题卡的相应位置上。
可能用到的相对原子质量:H:1 Li:7 C :12 O :16
一、选择题(本大题共 14 小题,每小题 3 分,共 42 分。在每小题所给出的四个选项中,只
有 一项是符合题目要求的,请将正确答案填涂在答题纸的相应位置上)
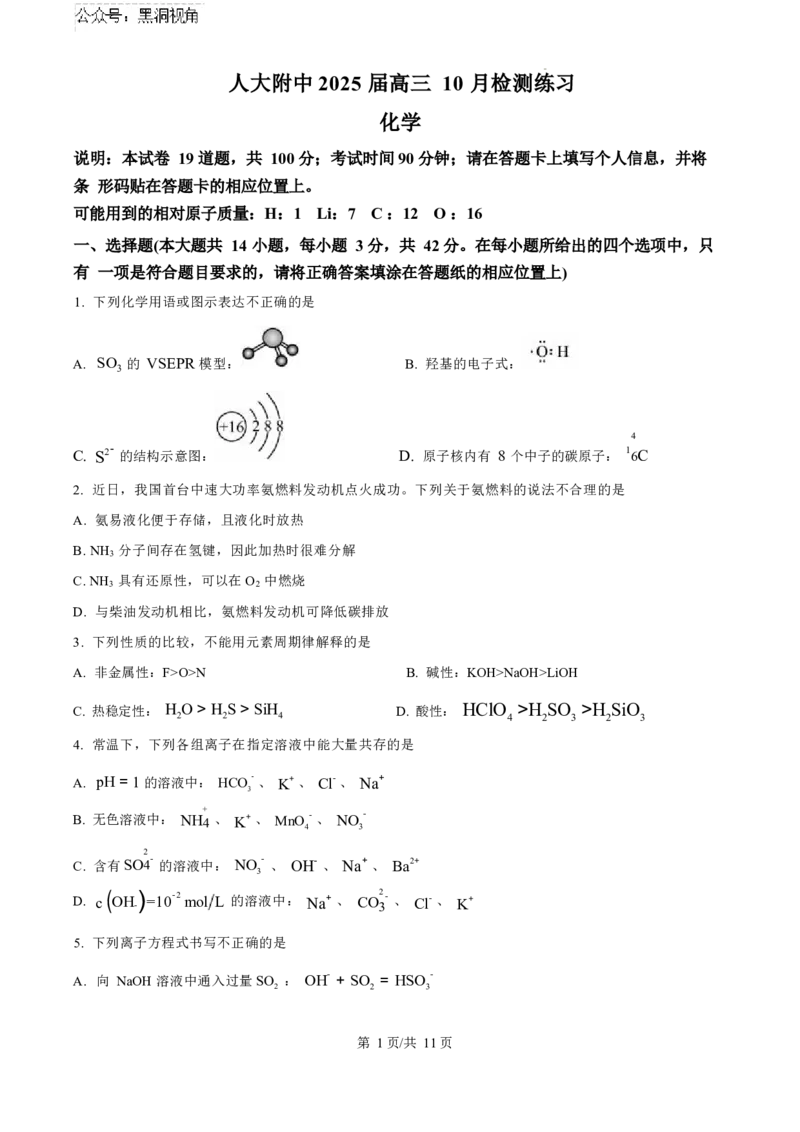
1. 下列化学用语或图示表达不正确的是
A. SO 的 VSEPR 模型: B. 羟基的电子式:
3
4
C. S2- 的结构示意图: D. 原子核内有 8 个中子的碳原子: 1 6C
2. 近日,我国首台中速大功率氨燃料发动机点火成功。下列关于氨燃料的说法不合理的是
A. 氨易液化便于存储,且液化时放热
B. NH 分子间存在氢键,因此加热时很难分解
3
C. NH 具有还原性,可以在O 中燃烧
3 2
D. 与柴油发动机相比,氨燃料发动机可降低碳排放
3. 下列性质的比较,不能用元素周期律解释的是
A. 非金属性:F>O>N B. 碱性:KOH>NaOH>LiOH
C. 热稳定性: H O > H S > SiH D. 酸性: HClO >H SO >H SiO
2 2 4 4 2 3 2 3
4. 常温下,下列各组离子在指定溶液中能大量共存的是
A. pH = 1 的溶液中: HCO- 、 K+ 、 Cl- 、 Na+
3
+
B. 无色溶液中: NH4 、 K+ 、 MnO - 、 NO -
4 3
2
C. 含有SO4 - 的溶液中: NO - 、 OH- 、 Na+ 、 Ba2+
3
D. c ( OH
-
) =10-2 mol L 的溶液中: Na+ 、 CO 2
3
- 、 Cl- 、 K+
5. 下列离子方程式书写不正确的是
A. 向 NaOH 溶液中通入过量SO : OH- + SO = HSO -
2 2 3
第 1页/共 11页B. 向 KI 溶液中通入少量Cl : 2I- + Cl = 2Cl- + I ; I + I- ≈ I -
2 2 2 2 3
C. 向Ba (OH) 2 溶液中滴加少量 NaHSO 4 溶液: Ba2+ + OH- + H+ + SO 2 4 - = BaSO 4 ↓ +H 2 O
D. 向Ca ( OH ) 2 溶液中滴加过量 NaHCO 3 溶液: 2H+ + CO 2 3 - + 2OH- + Ca 2+ = CaCO 3 ↓
+2H O
2
6. 已知 N 是阿伏加德罗常数的值,下列说法中正确的是
A
A. 标准状况下, 22.4LN 中含有7N 个中子
2 A
B. 60g 富勒烯(C )中含有 N 个碳原子
60 A
C. 1mol K Cr O 被还原为 Cr3+ 转移的电子数为6N
2 2 7 A
D. 密闭容器中, 2mol SO 和1mol O 催化反应后分子总数为2N
2 2 A
7. 下列物质混合后,因发生氧化还原反应使溶液 pH 增大的是
A. 向酸性 KMnO 溶液中加入 FeSO 溶液,紫色褪去
4 4
B. 向 NaHSO 溶液中加入 Ba(OH) 溶液,产生白色沉淀
3 2
C. 向 BaCl 溶液中先通入 SO ,后通入 O ,产生白色沉淀
2 2 2
D. 向饱和 NaCl 溶液中先通入 NH ,后通入 CO ,产生白色沉淀
3 2
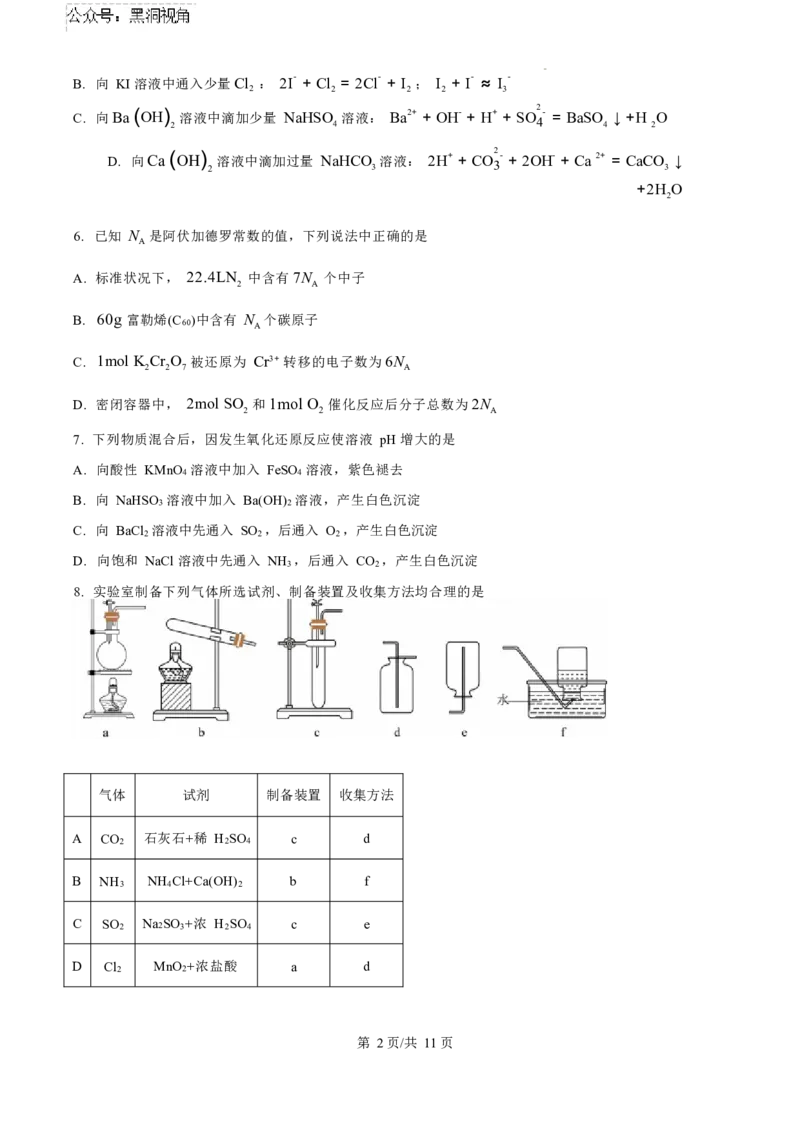
8. 实验室制备下列气体所选试剂、制备装置及收集方法均合理的是
气体 试剂 制备装置 收集方法
A CO 2 石灰石+稀 H 2 SO 4 c d
B NH NH Cl+Ca(OH) b f
3 4 2
C SO 2 Na2SO 3 +浓 H 2 SO 4 c e
D Cl 2 MnO 2 +浓盐酸 a d
第 2页/共 11页A. A B. B C. C D. D
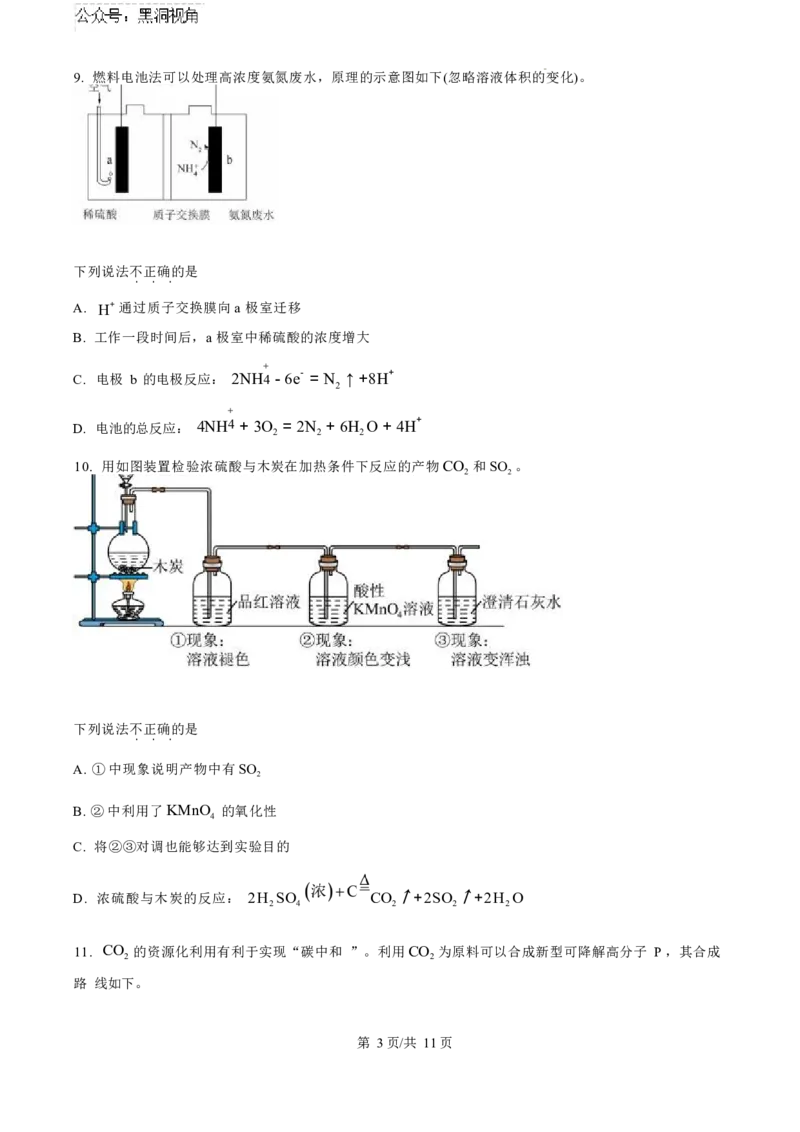
第 2页/共 11页9. 燃料电池法可以处理高浓度氨氮废水,原理的示意图如下(忽略溶液体积的变化)。
下列说法不正确的是
. . .
A. H+ 通过质子交换膜向a 极室迁移
B. 工作一段时间后,a 极室中稀硫酸的浓度增大
+
C. 电极 b 的电极反应: 2NH4 - 6e- = N ↑ +8H+
2
+
D. 电池的总反应: 4NH4 + 3O = 2N + 6H O + 4H+
2 2 2
10. 用如图装置检验浓硫酸与木炭在加热条件下反应的产物CO 和SO 。
2 2
下列说法不正确的是
. . .
A. ①中现象说明产物中有SO
2
B. ②中利用了KMnO 的氧化性
4
C. 将②③对调也能够达到实验目的
D. 浓硫酸与木炭的反应: 2H SO CO ↑ +2SO ↑ +2H O
2 4 2 2 2
11. CO 的资源化利用有利于实现“碳中和 ”。利用CO 为原料可以合成新型可降解高分子 P ,其合成
2 2
路 线如下。
第 3页/共 11页已知:反应①中无其他产物生成。下列说法不正确的是
A. CO 与 X 的化学计量比为1:2
2
B. P 完全水解得到的产物的分子式和 Y 的分子式相同
C. P 可以利用碳碳双键进一步交联形成网状结构
D. Y 通过碳碳双键的加聚反应生成的高分子难以降解
12. H 、C 、O 、Na 四种元素之间(二种、三种或四种)可组成多种无机化合物,选用其中某些化合物,利用
下 图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置 V 中收集到一种无色气体。下列
说法
不正确的是
. . .
A. 装置 I 中的化合物有多种可能
B. 装置Ⅱ中发生氧化还原反应
C. 装置Ⅲ中反应的离子方程式为 CO + 2OH− + Ba2+ = BaCO ↓ + H O
2 3 2
D. 装置 V 中收集的气体含有极性共价键,是非极性分子
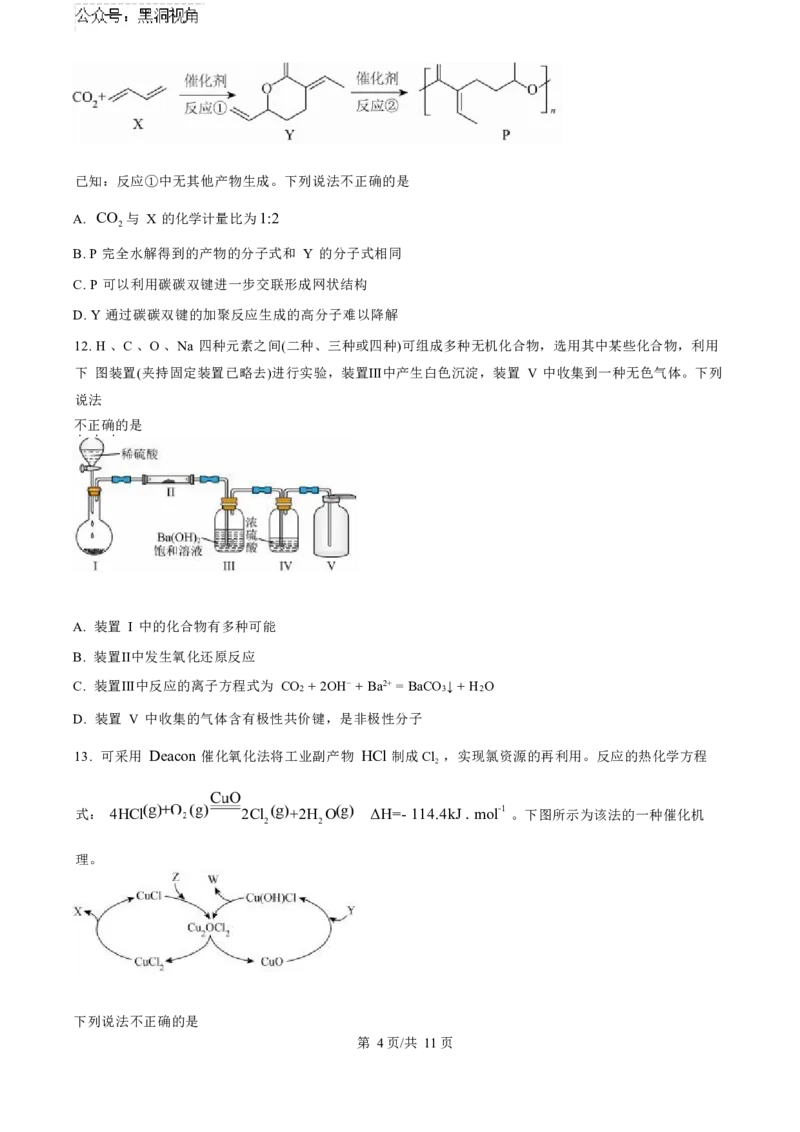
13. 可采用 Deacon 催化氧化法将工业副产物 HCl 制成Cl ,实现氯资源的再利用。反应的热化学方程
2
式: 4HCl 2Cl +2H O ΔH=- 114.4kJ . mol-1 。下图所示为该法的一种催化机
2 2
理。
下列说法不正确的是
第 4页/共 11页A. Y 为反应物 HCl ,W 为生成物H O
2
第 4页/共 11页B. 反应制得1mol Cl ,须投入 2molCuO
2
C. 升高反应温度, HCl 被O 氧化制Cl 的反应平衡常数减小
2 2
D. 图中转化涉及的反应中有两个属于氧化还原反应
14. 某实验小组探究 KMnO 溶液与 NH 以及铵盐溶液的反应。
4 3
已知: MnO - 的氧化性随溶液酸性增强而增强;MnO 为棕黑色,Mn2+接近无色。
4 2
序
实验
第 5页/共 11页
试剂 a 实验现象
号
紫色变浅,底部有棕黑色沉
Ⅰ 8mol·L-1 氨水(pH≈ 13)
淀
Ⅱ 0. 1mol·L-1NaOH 溶液 无明显变化
紫色略变浅,底部有少量棕
Ⅲ 4mol·L-1(NH 4 ) 2 SO 4 溶液(pH≈6)
黑色沉淀
硫酸酸化的 4mol·L-1(NH ) SO 溶
4 2 4
Ⅳ 紫色变浅
液(pH≈ 1)
硫 酸 酸 化 的 4mol·L-1NH Cl 溶
4
Ⅴ 紫色褪去
液 (pH≈ 1)
下列说法不正确的是
. . .
A. 由Ⅱ可知,pH= 13 时,OH- 不能还原 MnO
4
-
+
B. 由Ⅰ 、 Ⅱ 、Ⅲ可知,与 NH4相比,NH 更易还原
3
+
MnO - C. 由Ⅲ 、Ⅳ可探究溶液 pH 对 NH4与 MnO - 反
4 4
应的影响
+
D. 由Ⅳ 、Ⅴ可知, NH4浓度降低,其还原性增强
二、非选择题(本部分共 5 小题,共 58 分)
15. 自然界中的局部氮循环如下图。(1)上图含氮物质的各步转化中,属于氮的固定的是 ( 填数字序号)。
(2) NH 是氮循环中的重要物质,工业合成氨反应的化学方程式为 。
3
(3)某化工厂出现泄漏,大量氨水进入循环水系统,使循环水中含氯杀菌剂(有效成分为 Cl )的杀菌
2
效 果降低、硝化作用增强,导致循环水的 pH 发生波动,最终造成设备腐蚀。
①下列有关氨对循环水影响的说法中,正确的是_____ ( 填字母序号)。
a.过量氨进入循环水后,水中 NO - 和 NO - 含量会升高
2 3
b.过量氨进入循环水后,不会导致水体富营养化
c.循环水 pH 的波动中,pH 的上升与氨水的碱性有关
d.为减少氨对杀菌剂杀菌效果的影响,可以改用非氧化性杀菌剂
②通过检测循环水中的 c(NO - )可判断循环水的水质是否恶化,c(NO - )检测利用的是酸性条件下 I-
2 2
被 NO - 氧化为 I 的反应,该反应的历程如下:
2 2
I. NO - +2H+= NO++H O
2 2
II. … …
III.2ONI= I +2NO
2
II 的离子方程式为 。
(4)含 NO - 的废水可用二硫化亚铁(FeS )处理,在反硝化细菌的作用下发生以下反应,请将离子方程
3 2
反硝化细菌
式补充完整:14NO 3 - + 5FeS 2 + H+ 7N 2 ↑+10SO 2 - +__________
[ ]
16. 某钠离子电池以 NaClO
4
的碳酸丙烯酯溶液作电解质溶 Na
x
MnFe(CN)
6
作正极材料,Na 作负
液, 材料。
(1)CO 与环氧丙烷在一定条件下反应制得碳酸丙烯酯。
2
①CO 是 (填“极性”或“非极性”)分子。
2
②环氧丙烷中,O 原子的杂化轨道类型是 杂化。
③沸点:环氧丙烷 CO (填“>”或“<”)。
2
第 6页/共 11页[ ]
(2) i i
MnCl 溶液与 溶液混合可制备 Na MnFe(CN) 晶
2 x 6
①一个基态 Mn 原子中的
Na
未4 成
Fe
对
(C
电
N)
子6 数是 。
②CN- 的性质与卤素离子相近,被称为拟卤离子,(CN)
2
被称为拟卤素。
i .(CN) 与 H O 反应的生成物的结构式分别是 H - C 三 N 、 。
2 2
ⅱ . HCN 有酸性但乙炔无明显酸性,HCN 的酸性比乙炔的强的原因是 。
[ ]
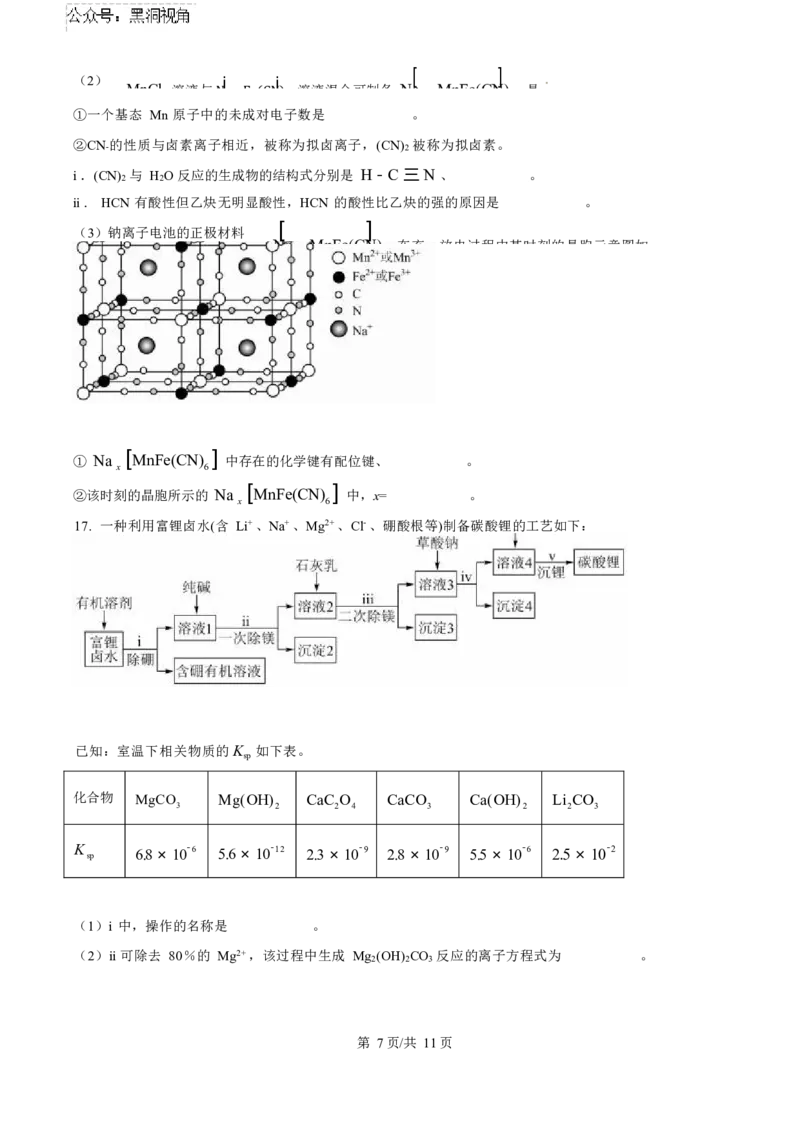
(3)钠离子电池的正极材料
Na MnFe(CN) 在充、放电过程中某时刻的晶胞示意图如
x 6
① Na [MnFe(CN) ] 中存在的化学键有配位键、 。
x 6
②该时刻的晶胞所示的 Na [MnFe(CN) ] 中,x= 。
x 6
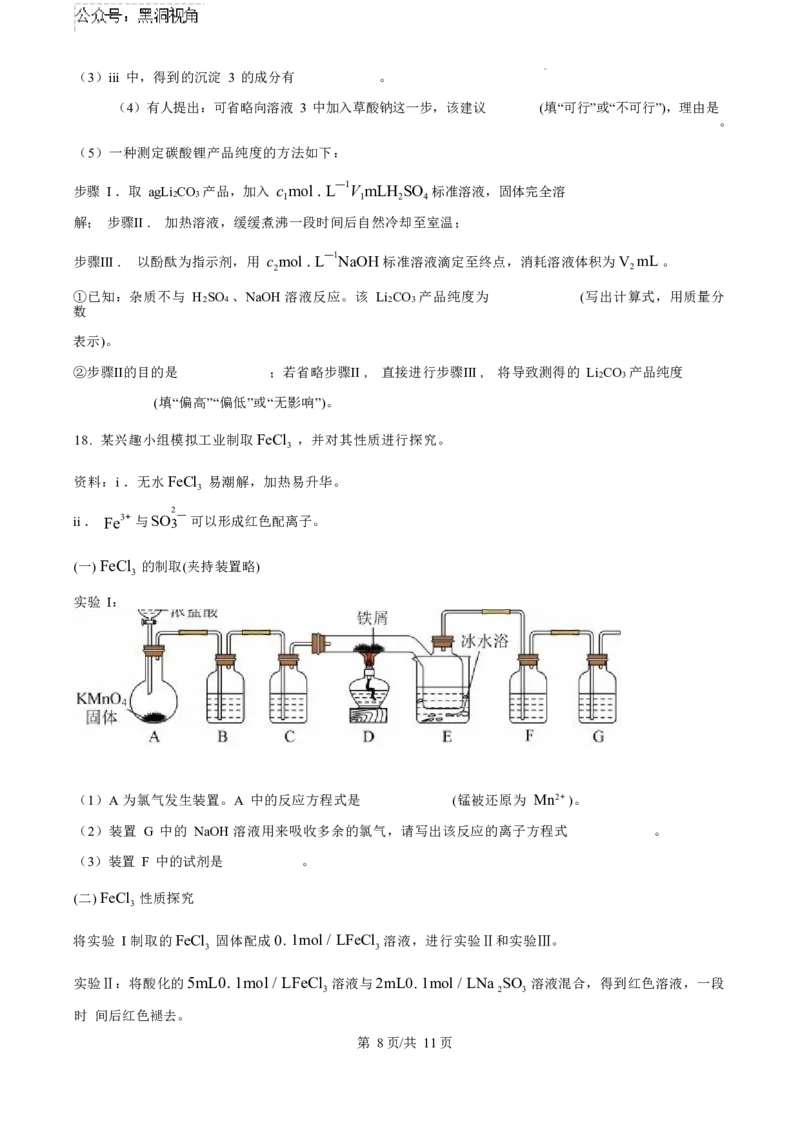
17. 一种利用富锂卤水(含 Li+ 、Na+ 、Mg2+ 、Cl- 、硼酸根等)制备碳酸锂的工艺如下:
已知:室温下相关物质的K 如下表。
sp
化合物 MgCO Mg(OH) CaC O CaCO Ca(OH) Li CO
3 2 2 4 3 2 2 3
K sp 6.8 × 10-6 5.6 × 10-12 2.3 × 10-9 2.8 × 10-9 5.5 × 10-6 2.5 × 10-2
(1)i 中,操作的名称是 。
(2)ii 可除去 80%的 Mg2+ ,该过程中生成 Mg (OH) CO 反应的离子方程式为 。
2 2 3
第 7页/共 11页(3)iii 中,得到的沉淀 3 的成分有 。
(4)有人提出:可省略向溶液 3 中加入草酸钠这一步,该建议 (填“可行”或“不可行”),理由是
。
(5)一种测定碳酸锂产品纯度的方法如下:
步骤 I .取 agLi CO 产品,加入 c mol . L—1V mLH SO 标准溶液,固体完全溶
2 3 1 1 2 4
解; 步骤Ⅱ . 加热溶液,缓缓煮沸一段时间后自然冷却至室温;
步骤Ⅲ . 以酚酞为指示剂,用 c mol . L—1NaOH 标准溶液滴定至终点,消耗溶液体积为V mL 。
2 2
①已知:杂质不与 H SO 、NaOH 溶液反应。该 Li CO 产品纯度为 (写出计算式,用质量分
2 4 2 3
数
表示)。
②步骤Ⅱ的目的是 ;若省略步骤Ⅱ , 直接进行步骤Ⅲ , 将导致测得的 Li CO 产品纯度
2 3
(填“偏高”“偏低”或“无影响”)。
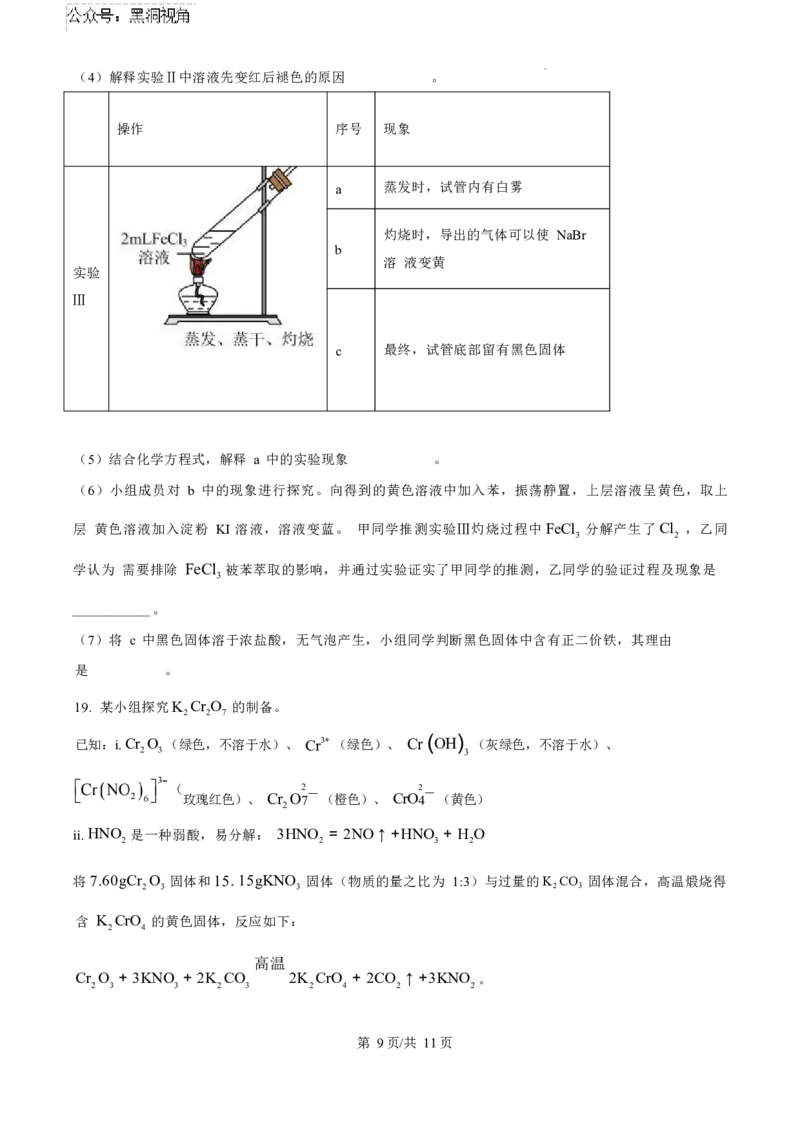
18. 某兴趣小组模拟工业制取FeCl ,并对其性质进行探究。
3
资料:i .无水FeCl 易潮解,加热易升华。
3
2
ii . Fe3+ 与SO3 — 可以形成红色配离子。
(一) FeCl 的制取(夹持装置略)
3
实验 I:
(1)A 为氯气发生装置。A 中的反应方程式是 (锰被还原为 Mn2+ )。
(2)装置 G 中的 NaOH 溶液用来吸收多余的氯气,请写出该反应的离子方程式 。
(3)装置 F 中的试剂是 。
(二) FeCl 性质探究
3
将实验 I 制取的FeCl 固体配成0. 1mol / LFeCl 溶液,进行实验Ⅱ和实验Ⅲ。
3 3
实验Ⅱ:将酸化的5mL0. 1mol / LFeCl 溶液与2mL0. 1mol / LNa SO 溶液混合,得到红色溶液,一段
3 2 3
时 间后红色褪去。
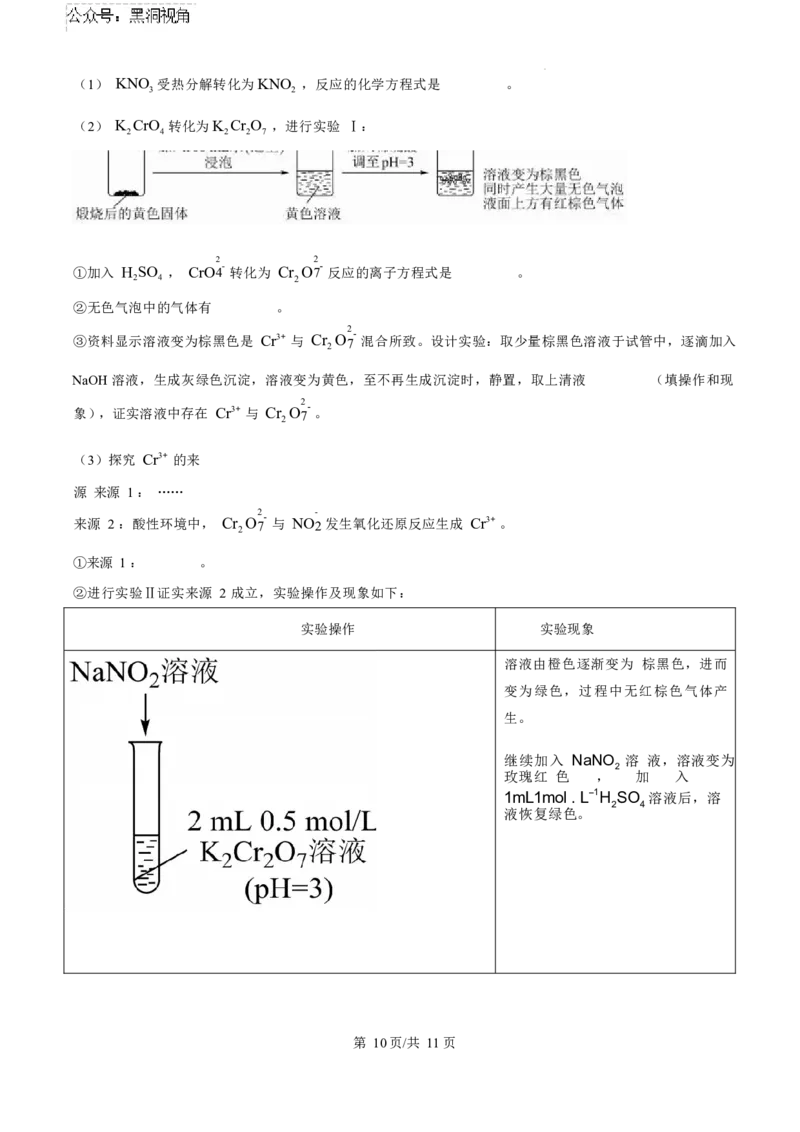
第 8页/共 11页(4)解释实验Ⅱ中溶液先变红后褪色的原因 。
操作 序号 现象
a 蒸发时,试管内有白雾
灼烧时,导出的气体可以使 NaBr
b
溶 液变黄
实验
Ⅲ
c 最终,试管底部留有黑色固体
(5)结合化学方程式,解释 a 中的实验现象 。
(6)小组成员对 b 中的现象进行探究。向得到的黄色溶液中加入苯,振荡静置,上层溶液呈黄色,取上
层 黄色溶液加入淀粉 KI 溶液,溶液变蓝。 甲同学推测实验Ⅲ灼烧过程中FeCl 分解产生了Cl ,乙同
3 2
学认为 需要排除 FeCl 被苯萃取的影响,并通过实验证实了甲同学的推测,乙同学的验证过程及现象是
3
____________。
(7)将 c 中黑色固体溶于浓盐酸,无气泡产生,小组同学判断黑色固体中含有正二价铁,其理由
是 。
19. 某小组探究K Cr O 的制备。
2 2 7
已知:i. Cr O (绿色,不溶于水)、 Cr3+ (绿色)、 Cr (OH) (灰绿色,不溶于水)、
2 3 3
2 2
玫瑰红色)、 Cr O7 — (橙色)、 CrO4 — (黄色)
2
ii. HNO 是一种弱酸,易分解: 3HNO = 2NO ↑ +HNO + H O
2 2 3 2
将7.60gCr O 固体和15. 15gKNO 固体(物质的量之比为 1:3)与过量的K CO 固体混合,高温煅烧得
2 3 3 2 3
含 K CrO 的黄色固体,反应如下:
2 4
高温
Cr O + 3KNO + 2K CO 2K CrO + 2CO ↑ +3KNO 。
2 3 3 2 3 2 4 2 2
第 9页/共 11页(1) KNO 受热分解转化为KNO ,反应的化学方程式是 。
3 2
(2) K CrO 转化为K Cr O ,进行实验 Ⅰ:
2 4 2 2 7
2 2
①加入 H SO , CrO4 - 转化为 Cr O7 - 反应的离子方程式是 。
2 4 2
②无色气泡中的气体有 。
2
③资料显示溶液变为棕黑色是 Cr3+ 与 Cr O 7 - 混合所致。设计实验:取少量棕黑色溶液于试管中,逐滴加入
2
NaOH 溶液,生成灰绿色沉淀,溶液变为黄色,至不再生成沉淀时,静置,取上清液 (填操作和现
2
象),证实溶液中存在 Cr3+ 与 Cr O 7 - 。
2
(3)探究 Cr3+ 的来
源 来源 1 : ……
2 -
来源 2 :酸性环境中, Cr O 7 - 与 NO2 发生氧化还原反应生成 Cr3+ 。
2
①来源 1 : 。
②进行实验Ⅱ证实来源 2 成立,实验操作及现象如下:
实验操作 实验现象
溶液由橙色逐渐变为 棕黑色,进而
变为绿色,过程中无红棕色气体产
生。
继续加入 NaNO 溶 液,溶液变为
2
玫瑰红 色 , 加 入
1mL1mol . L—1H SO 溶液后,溶
2 4
液恢复绿色。
第 10页/共 11页溶液由橙色变为绿色、绿色变为玫瑰红色的反应的离子方程式: 、 。
从平衡移动的角度解释溶液由玫瑰红色变为绿色的原因: 。
(4)为避免K CrO 转化为K Cr O 的过程中产生 Cr3+ ,进行实验Ⅲ。
2 4 2 2 7
将煅烧后的黄色固体浸泡于 100mL 水中,过滤后向滤液中加入醋酸溶液,调至 pH =5 ,溶液变为橙色。
实验Ⅲ中溶液的颜色与实验 Ⅰ 中的不同的原因可能是 。
第 11页/共 11页