文档内容
机密★启用前(新高考卷)
华大新高考联盟 2025 届高三 11 月教学质量测评
化学
注意事项:
1.答题前,先将自己的姓名、准考证号填写在试卷和答题卡上,并将准考证号条形码贴在答题
卡上的指定位置。
2.选择题的作答:每小题选出答案后,用 2B 铅笔把答题卡上对应题目的答案标号涂黑。写在
试卷、草稿纸和答题卡上的非答题区域均无效。
3.非选择题的作答:用黑色签字笔直接答在答题卡上对应的答题区域内。写在试卷、草稿纸和
答题卡上的非答题区域均无效。
4.考试结束后,请将本试卷和答题卡一并上交。
可能用到的相对原子质量:H 1 C12 O 16 Na23 Cl 35.5 Ca 40
一、选择题:本题共 14小题,每小题 3分,共42分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
1.化学推动了社会的进步,使我们的生活绚丽多彩。下列转化不属于化学变化的是( )
A.石油的分馏 B.煤的气化
C.油脂的氢化 D.纤维素的水解
2.生产分离膜的材料主要是有机高分子材料。下列物质不属于有机高分子材料的是( )
A.聚丙烯 B.醋酸纤维 C.聚四氟乙烯 D.光导纤维
3.化学处处呈现美。下列叙述错误的是( )
A.颜色美:靛蓝可作食品着色剂 B.现象美:苯酚溶液遇铁离子显紫色
C.结构美:富勒烯是一种烯烃 D.味道美:谷氨酸钠可作食品增味剂
4.化学用语可以表达化学过程。下列化学用语表达错误的是( )
A.氢氟酸溶蚀石英玻璃:4HFSiO SiF 2H O
2 4 2
B.用电子云轮廓图示意ClCl的pp键的形成:
C.NaH用作生氢剂时的化学反应原理:NaHH ONaOHH
2 2
D.苯酚与甲醛在酸的催化下制备酚醛树脂:
5.利用下列实验装置及实验操作完成相应实验,能达到实验目的的是( )
学科网(北京)股份有限公司A.实验室制取氨气 B.制备甲酸 C.分离Fe OH 胶体 D.蒸馏的接收装置
3
6.NH 是一种重要的化工原料。1898年德国弗兰克等人研究了N 与CaC 、H O反应制备氨的方法,其
3 2 2 2
高温
反应原理为N CaC CaCN C 、CaCN 3H O 2NH CaCO 。N 为阿伏加德罗常数的
2 2 2 2 2 3 3 A
值。下列叙述错误的是( )
A.3.2gCaC 理论上能产生NH 的数目为0.1N
2 3 A
B.1molCaCN 中含有离子的总数为2N
2 A
C.标准状况下,22.4LN 中所含键的数目为3N
2 A
D.每生产10gCaCO ,反应转移电子的总数为0.6N
3 A
7.基本概念和理论是化学思维的基石。下列叙述错误的是( )
A.测定晶体结构最常用的仪器是X射线衍射仪
B.原子光谱的谱线是连续的而不是离散的
C.洪特规则是针对电子填入简并轨道而言的
D.可以用有无自范性来区分晶体与非晶体
8.指甲花醌存在于指甲花植物的叶子中,具有抑菌、抗氧化等活性,其结构简式如图所示。下列关于指甲花
醌的叙述,错误的是( )
A.分子式为C H O B.所有的原子不可能共面
10 6 3
C.能使酸性KMnO 溶液褪色 D.1mol该物质可以消耗6molH
4 2
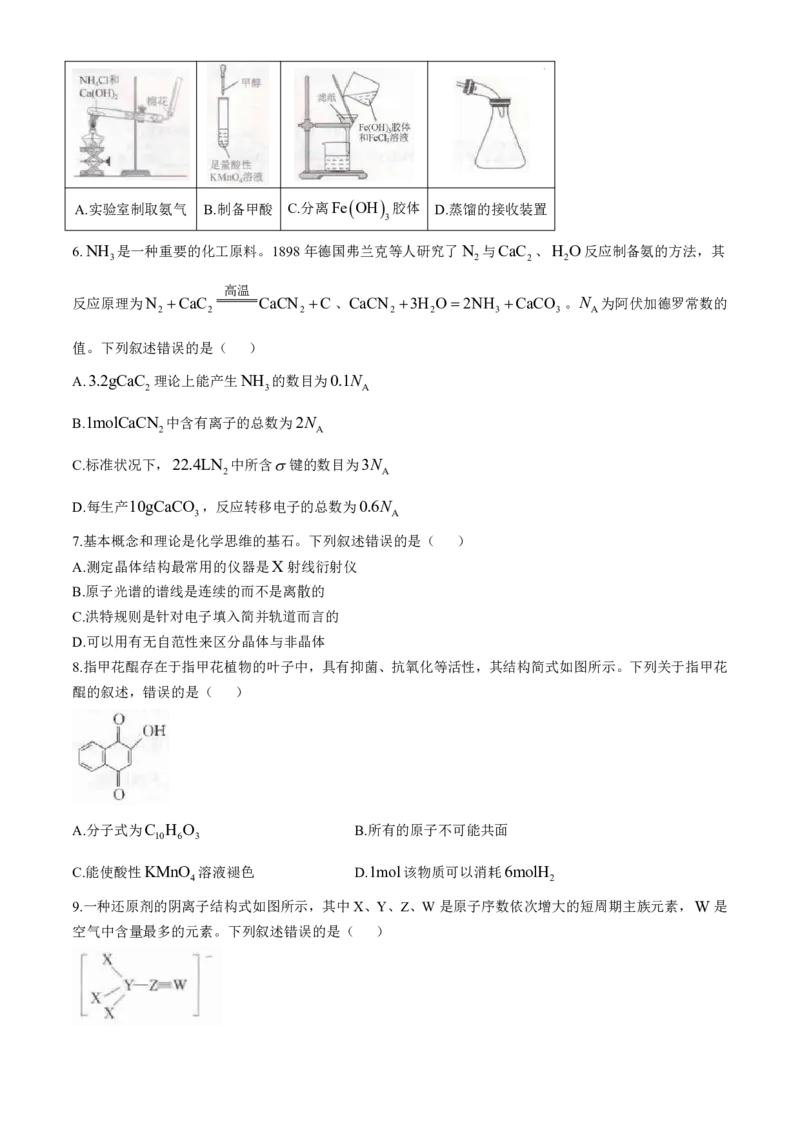
9.一种还原剂的阴离子结构式如图所示,其中X、Y、Z、W是原子序数依次增大的短周期主族元素,W是
空气中含量最多的元素。下列叙述错误的是( )
学科网(北京)股份有限公司A.原子半径:Y W B.分子极性:W X Z X
2 4 2 4
C.第一电离能:W ZX D.该阴离子中除X外,其他原子均满足8电子结构
10.下列实验方案、现象或目的对应正确的是( )
选项 实验方案 现象或目的
比较HF与HClO的酸性
A 利用pH计分别测量等浓度的NaClO溶液和NaF溶液的pH
强弱
B 向苯和苯酚混合溶液中加入饱和溴水再过滤 除去苯中混有的苯酚
向乙醇中加入浓硫酸和沸石,迅速升温到170℃,并将生成的气体导
C 验证生成的气体为乙烯
入酸性KMnO 溶液
4
先向试管中加入2mL0.1molL1K Cr O 溶液,再滴入510滴
2 2 7
D 溶液由黄色变为橙色
6molL1NaOH 溶液
11.某含Ir催化剂可以催化醚与CO反应生成酯,反应机理如图所示。下列叙述错误的是( )
A.物质甲是该反应的催化剂 B.该反应机理涉及非极性键的断裂和形成
C.反应过程中Ir元素的成键数目会改变 D.若CH OC H 参与反应会生成乙酸乙酯
3 2 5
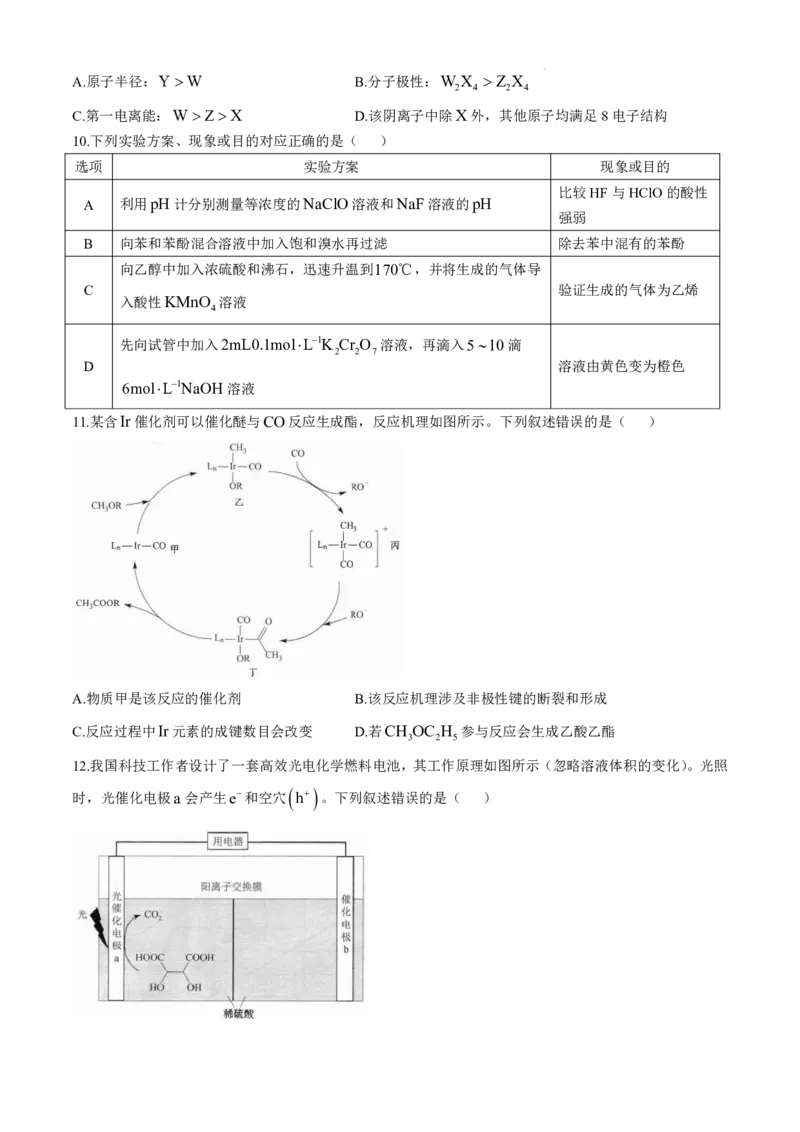
12.我国科技工作者设计了一套高效光电化学燃料电池,其工作原理如图所示(忽略溶液体积的变化)。光照
时,光催化电极a 会产生e和空穴 h 。下列叙述错误的是( )
学科网(北京)股份有限公司A.该装置实现了光能和化学能到电能的转化
B.电池工作时,溶液中的H会从左向右迁移
C.电池工作时,光催化电极a 的电势高于催化电极b的电势
D.用空穴表示的负极反应为
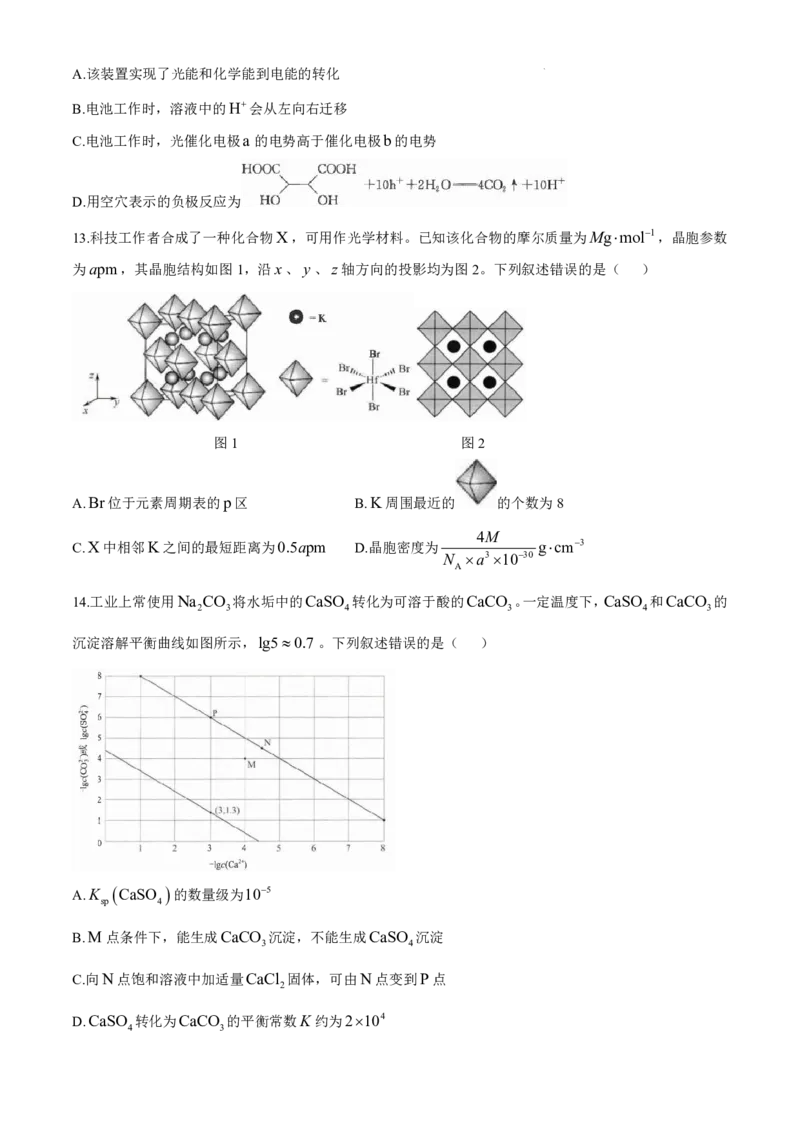
13.科技工作者合成了一种化合物X,可用作光学材料。已知该化合物的摩尔质量为Mgmol1,晶胞参数
为apm,其晶胞结构如图1,沿x、 y、z轴方向的投影均为图2。下列叙述错误的是( )
图1 图2
A.Br位于元素周期表的p区 B.K周围最近的 的个数为8
4M
C.X中相邻K之间的最短距离为0.5apm D.晶胞密度为 gcm3
N a31030
A
14.工业上常使用Na CO 将水垢中的CaSO 转化为可溶于酸的CaCO 。一定温度下,CaSO 和CaCO 的
2 3 4 3 4 3
沉淀溶解平衡曲线如图所示,lg50.7。下列叙述错误的是( )
A.K
CaSO
的数量级为105
sp 4
B.M点条件下,能生成CaCO 沉淀,不能生成CaSO 沉淀
3 4
C.向N点饱和溶液中加适量CaCl 固体,可由N点变到P点
2
D.CaSO 转化为CaCO 的平衡常数K约为2104
4 3
学科网(北京)股份有限公司二、非选择题:本题共4小题,共 58分。
15.(15分)
锑白(Sb O ,两性氧化物)可用作白色颜料和阻燃剂。一种从含锑工业废渣(主要成分为Sb O 、Sb O ,
2 3 2 3 2 5
含有CuO、Fe O 、Al O 等杂质)中制取Sb O 的工艺流程如图所示。
2 3 2 3 2 3
已知:该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见表。
金属离子 Fe3 Fe2 Al3 Cu2
开始沉淀 1.5 6.3 3.5 4.5
完全沉淀 2.8 8.3 4.7 6.5
回答下列问题:
(1)基态Sb原子的简化电子排布式为 Kr 4d105s25p3,Sb位于元素周期表的第______周期______族。(2)
“溶解”温度应控制在80℃,原因为________________________。
(3)“还原”过程中被还原的金属离子为______(填化学符号)。
(4)滤饼的主要成分是Sb O Cl ,“水解”过程中主要发生反应的离子方程式为__________________。“水
4 5 2
解”过程的pH要适中,pH______(填数字)。
(5)检验“洗涤”过程中是否将Fe2洗净的操作为____________。
(6)含锑工业废渣可以通过煅烧“废氟催化剂SbCl ”得到,SbCl 的空间结构为三角双锥形
5 5
( )。
①SbCl 中Sb的杂化方式为______(填标号)。
5
A.sp B.sp2 C.sp3 D.sp3d
②同主族的N元素______(填“能”或“不能”)形成NCl 。
5
16.(14分)
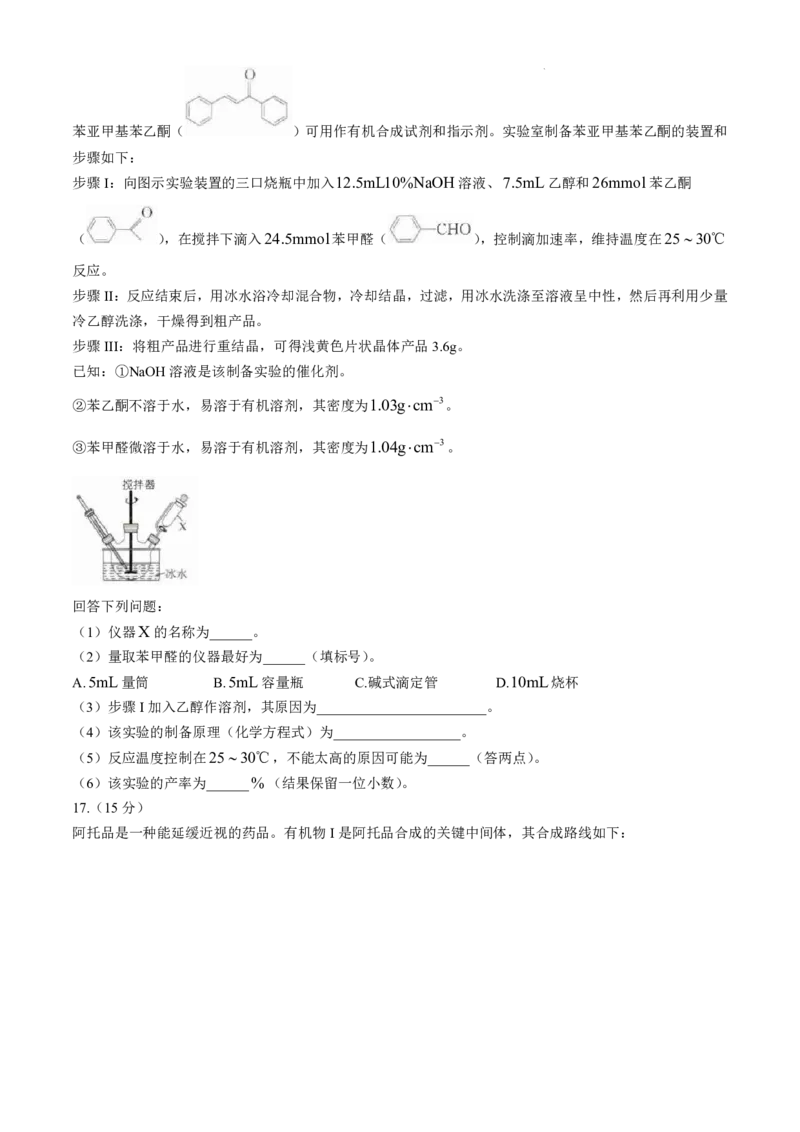
学科网(北京)股份有限公司苯亚甲基苯乙酮( )可用作有机合成试剂和指示剂。实验室制备苯亚甲基苯乙酮的装置和
步骤如下:
步骤I:向图示实验装置的三口烧瓶中加入12.5mL10%NaOH溶液、7.5mL乙醇和26mmol苯乙酮
( ),在搅拌下滴入24.5mmol苯甲醛( ),控制滴加速率,维持温度在2530℃
反应。
步骤II:反应结束后,用冰水浴冷却混合物,冷却结晶,过滤,用冰水洗涤至溶液呈中性,然后再利用少量
冷乙醇洗涤,干燥得到粗产品。
步骤III:将粗产品进行重结晶,可得浅黄色片状晶体产品3.6g。
已知:①NaOH溶液是该制备实验的催化剂。
②苯乙酮不溶于水,易溶于有机溶剂,其密度为1.03gcm3。
③苯甲醛微溶于水,易溶于有机溶剂,其密度为1.04gcm3。
回答下列问题:
(1)仪器X的名称为______。
(2)量取苯甲醛的仪器最好为______(填标号)。
A.5mL量筒 B.5mL容量瓶 C.碱式滴定管 D.10mL烧杯
(3)步骤I加入乙醇作溶剂,其原因为________________________。
(4)该实验的制备原理(化学方程式)为__________________。
(5)反应温度控制在2530℃,不能太高的原因可能为______(答两点)。
(6)该实验的产率为______%(结果保留一位小数)。
17.(15分)
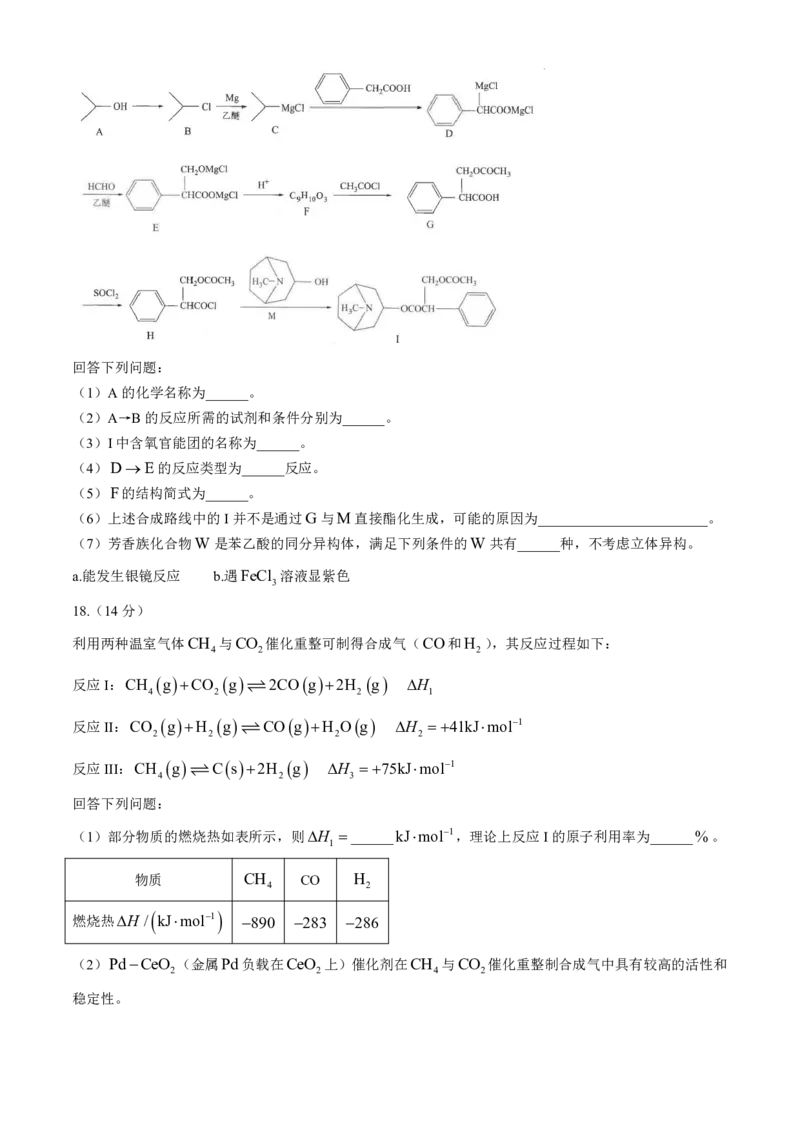
阿托品是一种能延缓近视的药品。有机物I是阿托品合成的关键中间体,其合成路线如下:
学科网(北京)股份有限公司回答下列问题:
(1)A的化学名称为______。
(2)A→B的反应所需的试剂和条件分别为______。
(3)I中含氧官能团的名称为______。
(4)DE的反应类型为______反应。
(5)F的结构简式为______。
(6)上述合成路线中的I并不是通过G与M直接酯化生成,可能的原因为________________________。
(7)芳香族化合物W是苯乙酸的同分异构体,满足下列条件的W共有______种,不考虑立体异构。
a.能发生银镜反应 b.遇FeCl 溶液显紫色
3
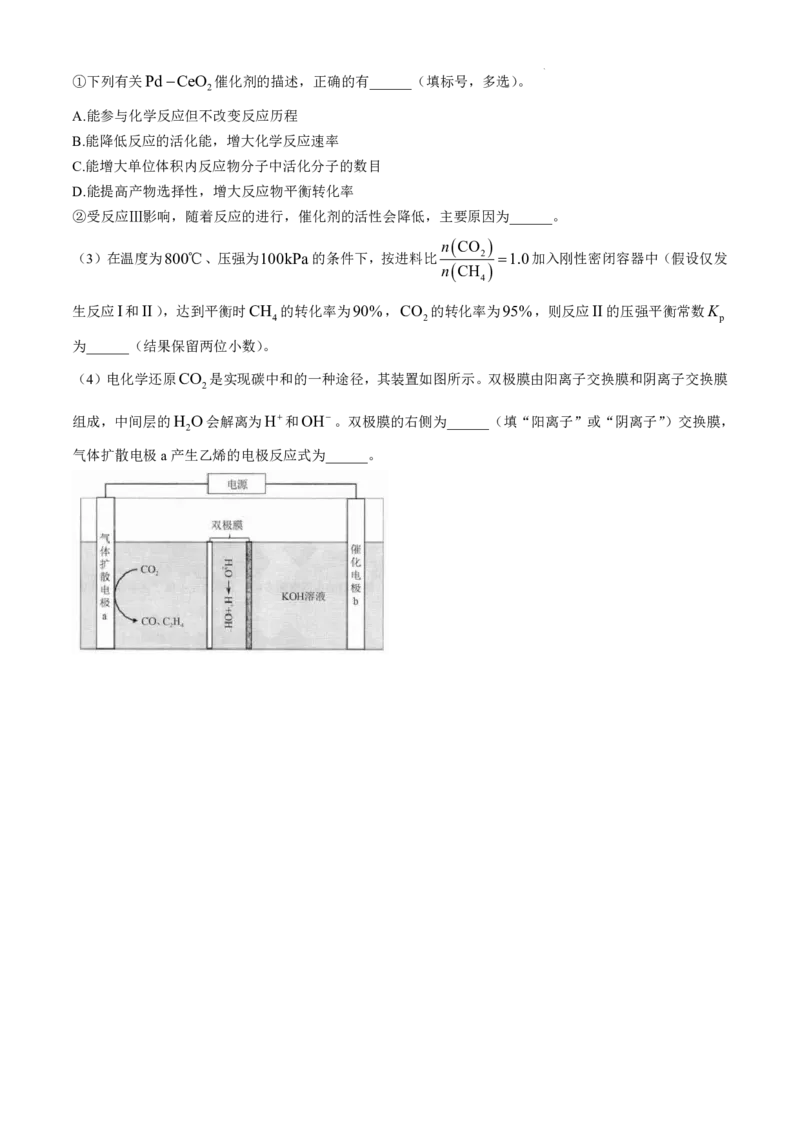
18.(14分)
利用两种温室气体CH 与CO 催化重整可制得合成气(CO和H ),其反应过程如下:
4 2 2
反应I:CH g CO g 2CO g 2H g H
4 2 2 1
反应II:CO g H g CO g H O g H 41kJmol1
2 2 2 2
反应III:CH g C s 2H g H 75kJmol1
4 2 3
回答下列问题:
(1)部分物质的燃烧热如表所示,则H ______kJmol1,理论上反应I的原子利用率为______%。
1
物质 CH CO H
4 2
燃烧热H /
kJmol1
890 283 286
(2)PdCeO (金属Pd负载在CeO 上)催化剂在CH 与CO 催化重整制合成气中具有较高的活性和
2 2 4 2
稳定性。
学科网(北京)股份有限公司①下列有关PdCeO 催化剂的描述,正确的有______(填标号,多选)。
2
A.能参与化学反应但不改变反应历程
B.能降低反应的活化能,增大化学反应速率
C.能增大单位体积内反应物分子中活化分子的数目
D.能提高产物选择性,增大反应物平衡转化率
②受反应Ⅲ影响,随着反应的进行,催化剂的活性会降低,主要原因为______。
n CO
(3)在温度为800℃、压强为100kPa的条件下,按进料比 2 1.0加入刚性密闭容器中(假设仅发
n CH
4
生反应I和II),达到平衡时CH 的转化率为90%,CO 的转化率为95%,则反应II的压强平衡常数K
4 2 p
为______(结果保留两位小数)。
(4)电化学还原CO 是实现碳中和的一种途径,其装置如图所示。双极膜由阳离子交换膜和阴离子交换膜
2
组成,中间层的H O会解离为H和OH。双极膜的右侧为______(填“阳离子”或“阴离子”)交换膜,
2
气体扩散电极a产生乙烯的电极反应式为______。
学科网(北京)股份有限公司机密★启用前(新高考卷)
华大新高考联盟 2025 届高三 11 月教学质量测评
化学参考答案和评分标准
题号 1 2 3 4 5 6 7 8
答案 A D C B A C B B
题号 9 10 11 12 13 14
答案 C A B C B D
1.【答案】A
【解析】石油的分馏是利用原油中各成分的沸点不同进行分离的过程,属于物理变化,A正确;煤的气化
是将煤转化为可燃性气体的过程,如碳与水蒸气反应生成水煤气,属于化学变化,B错误;油脂的氢化是液
态植物油在一定条件下与氢气发生加成反应,属于化学变化,C错误;纤维素水解最终生成葡萄糖,属于化
学变化,D错误。
2.【答案】D
【解析】光导纤维属于无机非金属材料,聚丙烯、醋酸纤维、聚四氟乙烯属于有机高分子材料,D正确。
3.【答案】C
【解析】合成色素的着色力强,稳定性好,成本较低,常见的有苋菜红、柠檬黄、靛蓝等,靛蓝可作食品
着色剂,A正确;苯酚中有酚羟基,苯酚溶液遇铁离子显紫色,B正确;富勒烯为碳单质,C错误;味精的
主要成分是谷氨酸钠,能增加食品的鲜味,是一种常用的增味剂,D正确。
4.【答案】B
【解析】 为ppπ键的形成示意图,而ClCl的pp键的形成示
意图为 ,B错误。
5.【答案】A
【解析】图示是实验室制取氨气的实验装置,A正确;足量酸性高锰酸钾溶液将甲醇氧化为二氧化碳和水,
B错误;Fe OH 胶体和FeCl 溶液均可透过滤纸,无法起到分离的作用,可用半透膜进行分离,C错误;
3 3
整个接收装置为密闭体系,馏分无法顺利流下,且压强过大易导致实验事故,D错误。
6.【答案】C
【解析】由化学方程式可知,0.05molCaC 产生0.1molNH ,NH 数目为0.1N ,A正确;CaCN 中含
2 3 3 A 2
有的离子为Ca2和CN2,1molCaCN 中含有离子的总数为2N ,B正确;标准状况下,22.4LN 为1mol,
2 2 A 2
N 的结构式为N N,1molN 中所含键的数目为1N ,C错误;第一步反应为氧化还原反应,第二步
2 2 A
为非氧化还原反应,生成1molCaCO 消耗1molCaCN ,根据第一步反应可知生成1molCaCN 转移6mol
3 2 2
电子,因此每生产0.1molCaCO ,反应转移电子的总数为0.6N ,D正确。
3 A
7.【答案】B
学科网(北京)股份有限公司【解析】通过晶体的X射线衍射实验获得衍射图后,经过计算可以获得键长、键角等分子结构信息,测定
晶体结构最常用的仪器是X射线衍射仪,A正确;原子光谱的谱线是不同定态的电子发生跃迁产生的,因
而是离散的而不是连续的谱线;B错误;基态原子中,填入简并轨道的电子总是先单独分占,且自旋平行,
称为洪特规则,C正确;晶体的自范性是晶体中粒子在微观空间里呈现周期性的有序排列的宏观表象,相反
非晶体中粒子的排列则相对无序,因而无自范性,D正确。
8.【答案】B
【解析】指甲花醌的分子式为C H O ,A正确;所有的原子可能共面,B错误;分子结构中含有碳碳双
10 6 3
键,能使酸性KMnO 溶液褪色,C正确;1mol该物质可以消耗6molH (苯环消耗3mol,酮羰基和碳
4 2
碳双键消耗3mol),D正确。
9.【答案】C
【解析】X为H,Y为B,Z为C,W为N。原子半径B N,A正确;N H 是极性分子,C H 是非
2 4 2 4
极性分子,故分子极性N H C H ,B正确;第一电离能N H C,C错误;该阴离子中除氢原子外,
2 4 2 4
其他原子均满足8电子结构,D正确。
10.【答案】A
【解析】NaClO、NaF都是强碱弱酸盐,水解使溶液显碱性,对应弱酸的酸性越强,该盐水解的碱性就越弱,
溶液pH就越小,用pH计测量相同浓度的NaClO溶液和NaF溶液的pH,可以比较HF与HClO的酸性
强弱,A正确;苯酚和饱和溴水反应生成的2,4,6-三溴苯酚会溶于苯中,过滤不能除去苯中混有的苯酚,
B错误;挥发的乙醇也可使酸性高锰酸钾溶液褪色,C错误;K Cr O 溶液中存在如下平衡:
2 2 7
Cr O2H O 2CrO22H,加入NaOH溶液,平衡正移,溶液由橙色变为黄色,D错误。
2 7 2 4
橙色 黄色
11.【答案】B
【解析】由反应机理图可知,物质甲为催化剂,A正确;该反应机理未涉及非极性键的断裂,B错误;反应
过程中Ir元素的成键数目会改变,C正确;若CH OC H 参与反应,会生成CH COOC H ,D正确。
3 2 5 3 2 5
12.【答案】C
【解析】光催化电极a为负极,催化电极b为正极。由图可知,该装置实现了光能和化学能到电能的转化,
A正确;溶液中H通过阳离子交换膜向正极移动,B正确;电池工作时,催化电极b的电势高于光催化电
极a 的电势,C错误;用空穴表示的负极反应为 ,
D正确。
13.【答案】B
【解析】Br位于元素周期表的p区,A正确;K周围最近的 的个数为4,B错误;X中相邻K之间
学科网(北京)股份有限公司NM 4M
的最短距离为棱长的一半,为0.5apm,C正确;晶胞密度 gcm3,D正确。
N V N a31030
A A
14.【答案】D
【解析】K CaSO 104.3,数量级为105,A正确;K CaCO 109,M点Q 108,Q K
sp 4 sp 3
可生成沉淀,因此M点条件下,能生成CaCO 沉淀,不能生成CaSO 沉淀,B正确;向N点饱和溶液中
3 4
加适量CaCl 固体,c
Ca2
增大,lgc
Ca2
减小,沉淀溶解平衡逆移,c
CO2
减小,lgc
CO2
2 3 3
增大,由N点向P点移动,C正确;CaSO s CO2 aq CaCO s SO2 aq ,
4 3 3 4
c SO2 K CaSO 104.3
K 4 sp 4 104.7104100.7 5104,D错误。
c CO2 K CaCO 109
3 sp 3
15.【答案】(15分)
(1)五(1分);VA(1分)。
(2)温度低于80℃,反应速率较慢;温度高于80℃,HCl易挥发(金属阳离子易水解)(共2分,各1分,
合理即可)。
(3)Sb5、Cu2、Fe3(共2分,填不全的得1分,有填错的得0分)。
(4)4Sb3 2Cl 5H OSb O Cl 10H (2分);3.5(2分)。
2 4 5 2
(5)取最后一次洗涤液于试管中,加入K
3
Fe CN
6
(铁氰化钾)溶液,无明显现象则洗净(或取最后
一次洗涤液于试管中,滴加KSCN溶液,溶液未变红,再滴加氯水,溶液变红)(2分,合理即可)。
(6)①D(1分)。②不能(2分)。
【解析】(1)根据Sb的价层电子排布为5s25p3,可推断Sb位于元素周期表的第五周期VA族。
(2)温度低于80℃,反应速率较慢;温度高于80℃,HCl易挥发(金属阳离子易水解)。
(3)铁粉可以还原的离子有铜离子和铁离子,由题意可知Sb5最后转化为Sb O ,故铁粉还能还原Sb5。
2 3
(4)滤饼的成分是Sb O Cl ,水解的离子为Sb3,根据元素守恒和电荷守恒即可配得离子方程式:
4 5 2
4Sb3 2Cl 5H OSb O Cl 10H ;由后面的流程可知滤饼不能含有其他的沉淀,即不能含有氢
2 4 5 2
氧化铝和氢氧化亚铁,故pH3.5。
(5)操作为取最后一次洗涤液于试管中,加入铁氰化钾溶液,无明显现象则洗净(或取最后一次洗涤液于
试管中,滴加KSCN溶液,溶液未变红,再滴加氯水,溶液变红)。
(6)①由题意可知Sb的价电子数为5,不可能是sp、sp2、sp3,答案选D(拓展学生的思路,类似于PCl )。
5
②N原子中无d轨道,不能形成sp3d杂化,故不能形成NCl 。
5
学科网(北京)股份有限公司16.【答案】(14分)
(1)恒压滴液漏斗(2分)。
(2)A(2分)。
(3)可以增大反应物在水中的溶解度,使反应物充分接触反应(或使反应物与NaOH溶液充分接触,加快
反应速率)(2分,合理即可)。
(4) (2分,合理即可)。
(5)反应温度过高,有机物易挥发、副产物较多(共4分,各2分,合理即可)。
(6)70.6(2分)。
【解析】(1)仪器X的名称为恒压滴液漏斗。
(2)通过计算,苯甲醛的体积为24.51031061.042.5mL ,量取苯甲醛的仪器最好为5mL量筒。
苯甲醛是有机物,会溶解腐蚀碱式滴定管的橡胶管。
(3)反应物在NaOH溶液中的溶解度均不大,加入乙醇可以增大反应物在水中的溶解度,使反应物充分接
触反应。
(4)制备原理即为“羟醛缩合”原理,其反应为先加成再消去,化学方程式为
。
(5)有机反应复杂,温度过高时有机物易挥发、容易产生副产物(比如苯乙酮与苯乙酮之间发生羟醛缩合)。
(6)由题干信息可知苯甲醛少量,利用苯甲醛计算出理论产量约为24.51032085.1g,产率实际
产量理论产量3.65.1100%70.6% 。
17.【答案】(15分)
(1)2-丙醇(或异丙醇)(2-分,合理即可)。
(2)浓盐酸、加热(共2分,各1分,合理即可)。
(3)酯基(2分)。
(4)加成(2分)。
(5) (2分)。
(6)G有酸性、M有碱性,二者直接酯化容易发生“中和”副反应(或酰氯的反应活性高,先生成酰氯,
更利于反应的进行)(3分,合理即可)。
(7)13(2分)。
【解析】(1)A的化学名称为2-丙醇(或异丙醇)。
(2)“醇”转变为“氯代烃”的反应所需的试剂和条件分别为浓盐酸、加热。
(3)I中含氧官能团的名称为酯基。
(4)DE的反应类型为加成反应。
学科网(北京)股份有限公司(5)EF的反应类型为水解反应,根据F的分子式即可推出其结构简式为 。
(6)可能的原因为G有酸性、M有碱性,二者直接酯化容易发生“中和”副反应(或酰氯的反应活性高,
先生成酰氯,更利于反应的进行)。
(7)“能发生银镜反应”说明W中含有醛基,“遇FeCl 溶液显紫色”说明W中含有酚羟基。假设苯环上
3
有2个取代基(OH和CH CHO),有3种结构(邻间对);假设苯环上有3个不同的取代基(一CH 、
2 3
OH、CHO),有10种结构,共有13种。
18.【答案】(14分)
(1)248(2分);100(2分)。
(2)①BC(2分,有填错的或填不全的均得0分)。②反应III会产生积碳,覆盖在催化剂表面(2分,合
理即可)。
(3)1.06(2分)。
(4)阴离子(2分);2CO 12e 12H C H 4H O (2分)。
2 2 4 2
【解析】(1)根据盖斯定律可知,H 890
283 2286 2
248 ;反应的生成物CO和
1
H 均为目标产物,则理论上反应I的原子利用率为100%。
2
(2)①催化剂会改变反应历程,A错误;催化剂能降低反应的活化能,增大化学反应速率,B正确;催化
剂能降低反应的活化能,增大单位体积内反应物分子中活化分子的数目,C正确;催化剂会改变反应历程,
但不影响平衡移动,反应物平衡转化率不变,D错误,故选BC。②受反应III影响,随着反应的进行,反
应III会产生积碳,覆盖在催化剂的表面,催化剂的活性会降低。
(3)设投料n CO 为1mol,n CH 为1mol,列“三段式”:
2 4
CH g CO g 2CO g 2H g
4 2 2
初始 1mol 1mol 0 0
反应I:
转化 0.9mol 0.9mol 1.8mol 1.8mol
平衡 0.1mol 0.1mol 1.8mol 1.8mol
CO g H g CO g H O g
2 2 2
初始 0.1mol 1.8mol 1.8mol 0
反应II:
转化 0.05mol 0.05mol 0.05mol 0.05mol
平衡 0.05mol 1.75mol 1.85mol 0.05mol
0.051.85
反应II是气体分子数不变的反应,则K K 1.06。
p c 0.051.75
(4)催化电极b为阳极,其电极反应式为4OH 4e O 2H O ,消耗OH,双极膜产生的OH会
2 2
移动到阳极区补充,故双极膜右侧为阴离子交换膜。阴极区产生乙烯的电极反应式为
2CO 12e 12H C H 4H O 。
2 2 4 2
学科网(北京)股份有限公司学科网(北京)股份有限公司