文档内容
2023 年下学期期中考试试卷
三化学
高
本试卷分为问卷和答卷。考试时量为75分钟,满分100分。请将答案写在答题卡上。
可能用到的相对原子质量:H-1 N-14 O-16 Na-23 P-31 Cl-35.5 Fe-56 Zn-65
第I卷(选择题)
一、选择题:本题共 14小题,每小题3分,共42分。在每小题给出的四个
选项中,只有一项是符合题目要求的。
1.陶瓷、青铜器、书画作品等都是中华文化的瑰宝,其中蕴藏丰富的化学知识。下列
说法不正确的是( )
A.商代后期铸造出工艺精湛的青铜器司母戊鼎,其材质属于合金
B.“素纱单衣”所用的蚕丝的主要成分是纤维素,属于天然高分子化合物
C.宋,王希孟《千里江山图》卷中的绿色颜料铜绿的主要成分是碱式碳酸铜
D.王羲之的《兰亭集序》保存完好的原因是墨的主要成分是碳,在常温下化学性质稳
定
2.下列化学用语或图示表达正确的是( )
A.氯离子的结构示意图: B.基态O的电子排布式为1s22s12p5
C.CO 的电子式: D.CH 的空间充填(比例)模型:
2 4
3.茶叶中铁元素的检验可经过以下四步完成:灼烧灰化→6mol∙L-¹硝酸溶解→过滤→
检测滤液中的铁元素。下列说法正确的是( )
A.“灼烧灰化”选用的玻璃仪器有①②③
B.④用于配制6mol∙L-¹硝酸时需洗净并烘干
C.“过滤”时需沿②向⑤中转移液体并小心搅拌
D.检测铁元素时,⑥悬垂于⑦的上方滴加KSCN溶液
4.下列对分子的性质的解释中,正确的是( )
A . 碘易溶于四氯化碳, 难溶于水都可用“相似相溶”原理解释
B. 在水中的溶解度很小,是由于 属于极性分子
C.乳酸( )分子中含有一个手性碳原子,该碳原子是 杂化
2023年下学期期中考试试卷 高三化学 第 1 页 共 9 页
学科网(北京)股份有限公司D.甲烷可以形成甲烷水合物,是因为甲烷分子与水分子之间形成了氢键
5.下列实验对应的反应方程式书写正确的是( )
A.泡沫灭火器原理:AlO +HCO +HO=Al(OH)↓+CO
2 3
B.用白醋除铁锈:Fe O·xHO+6H+=(3+x)HO+2Fe3+
2 3 2 2
C.吸有NO 的注射器,堵住针头增大容积红棕色先变浅后变深:2NO (g)
2 2
NO(g)
2 4
D.Fe (SO ) 溶液中加入足量Ba(OH) 溶液:Fe3++SO +Ba2++3OH-
2 4 3 2
=Fe(OH)↓+BaSO↓
3 4
6.中医药是中华民族的传统瑰宝,化合物Z是一种药物成分的中间体,可由有机物X
和Y一定条件下合成,反应如下:
下列说法中正确的是( )
A.一定条件下Z能发生消去反应,生成的有机物存在顺反异构体
B.Y分子中碳原子和氧原子的杂化方式相同,可以用高锰酸钾溶液鉴别X和Y
C.Y有多种同分异构体,其中属于酚类且能发生水解的结构有18种
D.1 mol Z最多能与4 mol NaOH溶液反应
7.二氧化氯是国际上公认的最新一代广谱、高效、安全、环保的杀菌消毒剂。综合法
制备ClO 包括制备氯酸钠、盐酸合成和ClO 制取,其主要工艺流程如下图所示。
2 2
则下列分析错误的是( )
A.“电解”产物是氯酸钠和氢气
B.“发生器”中每生成40.5gClO 转移0.5mol电子
2
C.流程中可循环利用的物质是氯化钠、氯气和水
D.系统的副产品全都可循环使用,原料利用率高,成本低
8.某锂盐的结构如下图所示,其阴离子是由原子序数依次增大的短周期主族元素X、
Y、Z、W形成,X、Y与Z同一周期,Y与W同族。下列说法正确的是( )
A.元素的电负性:
2023年下学期期中考试试卷 高三化学 第 2 页 共 9 页
学科网(北京)股份有限公司B.第一电离能:
C.简单气态氢化物的热稳定性:
D.简单离子的半径:
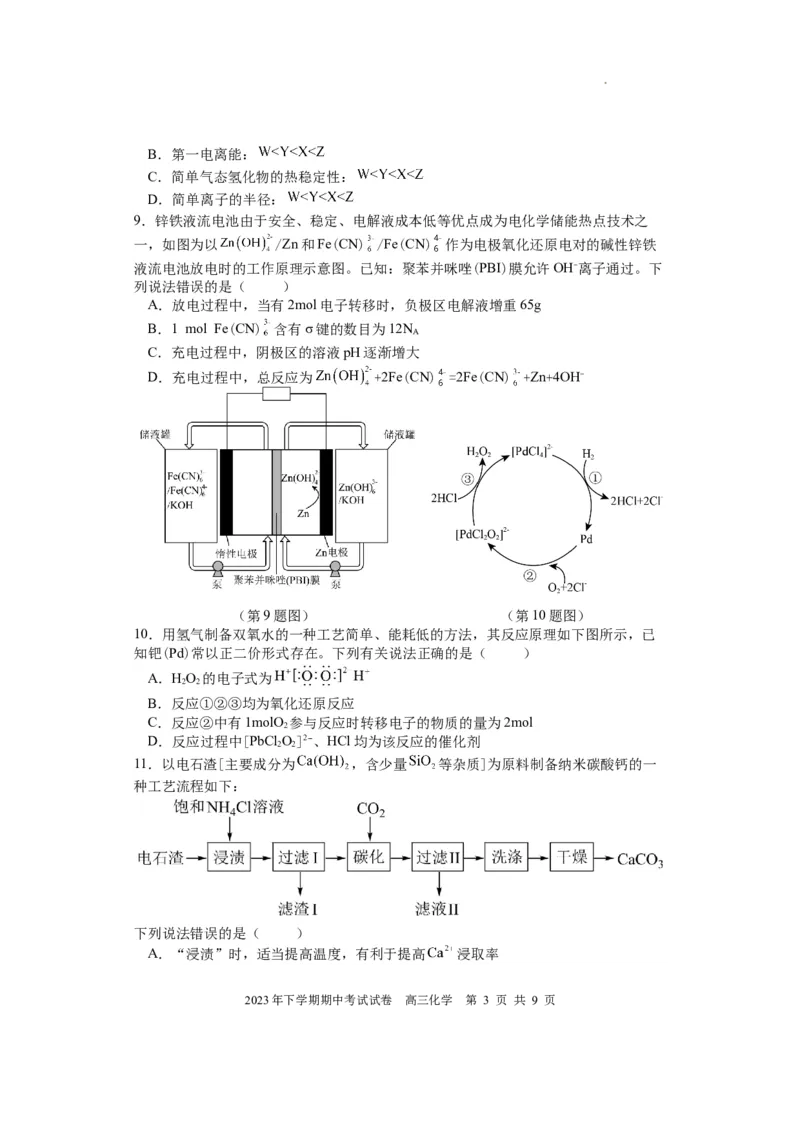
9.锌铁液流电池由于安全、稳定、电解液成本低等优点成为电化学储能热点技术之
一,如图为以 /Zn和Fe(CN) /Fe(CN) 作为电极氧化还原电对的碱性锌铁
液流电池放电时的工作原理示意图。已知:聚苯并咪唑(PBI)膜允许OH-离子通过。下
列说法错误的是( )
A.放电过程中,当有2mol电子转移时,负极区电解液增重65g
B.1 mol Fe(CN) 含有σ键的数目为12N
A
C.充电过程中,阴极区的溶液pH逐渐增大
D.充电过程中,总反应为 +2Fe(CN) =2Fe(CN) +Zn+4OH-
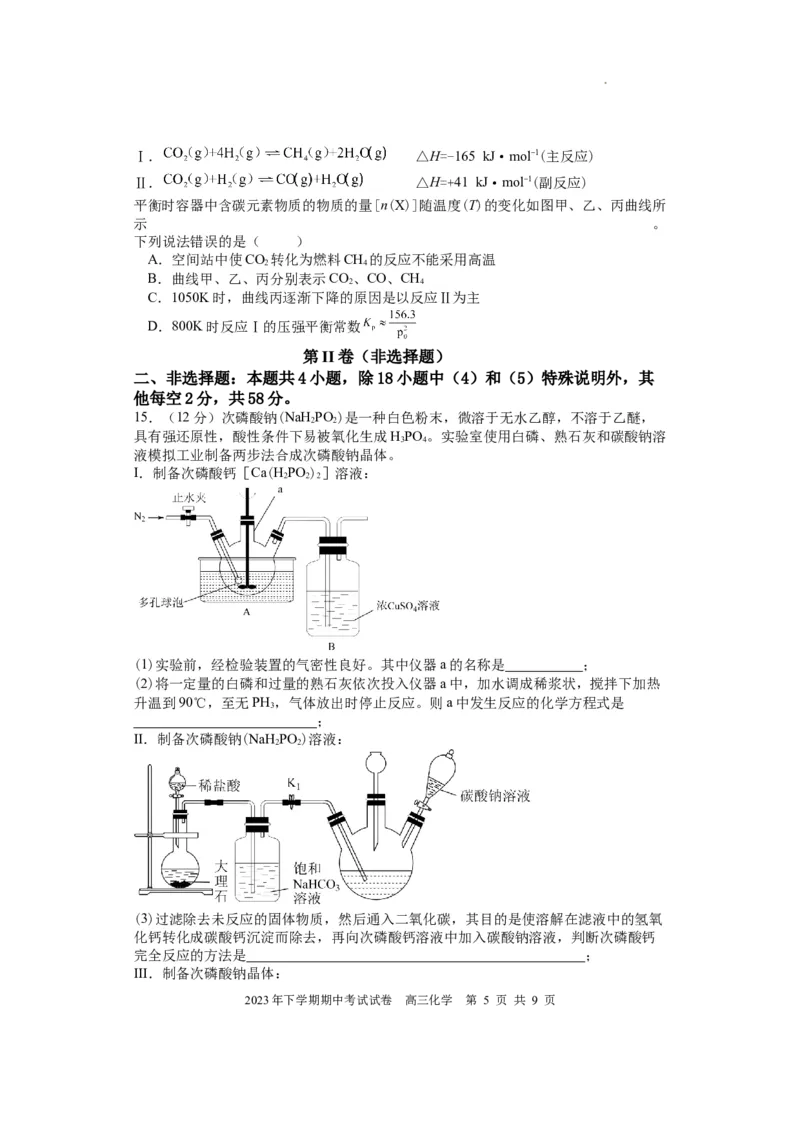
(第9题图) (第10题图)
10.用氢气制备双氧水的一种工艺简单、能耗低的方法,其反应原理如下图所示,已
知钯(Pd)常以正二价形式存在。下列有关说法正确的是( )
A.HO 的电子式为
2 2
B.反应①②③均为氧化还原反应
C.反应②中有1molO 参与反应时转移电子的物质的量为2mol
2
D.反应过程中[PbCl O]2−、HCl均为该反应的催化剂
2 2
11.以电石渣[主要成分为 ,含少量 等杂质]为原料制备纳米碳酸钙的一
种工艺流程如下:
下列说法错误的是( )
A.“浸渍”时,适当提高温度,有利于提高 浸取率
2023年下学期期中考试试卷 高三化学 第 3 页 共 9 页
学科网(北京)股份有限公司B.滤液II中主要成分是 ,可以循环使用
C.“碳化”中反应的离子方程式为
D.已知 ,则滤液 II 中 沉淀完全时, 小于
12.根据实验目的,设计相关实验,下列实验操作、现象解释及结论都正确的是(
)
序号 操作 现象 解释或结论
溶液中先有白色沉淀
在含0.1mol的AgNO 溶液中依 K (AgCl)>
A 3 生成,后来又变成黄 sp
次加入NaCl溶液和KI溶液 K (AgI)
色 sp
B 向酸性KMnO 溶液中滴加乙醇 溶液紫色褪去 乙醇具有还原性
4
在Ca(ClO) 溶液中通入SO 气 酸性:HSO >
C 2 2 有沉淀生成 2 3
体 HClO
向溴水中加入苯,充分振荡,静 苯与溴发生了反
D 水层几乎无色
置 应
A.A B.B C.C D.D
13.草酸(HC O)为二元弱酸,其电离过程为: ,
2 2 4
。常温下向 溶液中逐滴加入
溶液,混合溶液中HC O、 和 的物质的量分数(δ)随pH
2 2 4
变化关系如图所示,下列说法正确的是( )
A.草酸的一级电离平衡常数的数量级为
B.曲线I表示 的物质的量分数
C.当加入NaOH溶液的体积为20 mL时,溶液中存在如下关系:
D.曲线II和曲线III交点处对应的溶液中存在关系:
(第13题图) (第14题图)
14.中国旅美教授JingjieWu及其学生利用石墨烯量子点为催化剂,将CO 转化为燃料
2
甲烷,空间站基于该反应将宇航员呼出的CO 转化为火箭燃料。将5 mol CO 和20
2 2
mol H 通入某恒压(压强为P)密闭容器中,发生如下反应:
2 0
2023年下学期期中考试试卷 高三化学 第 4 页 共 9 页
学科网(北京)股份有限公司Ⅰ. △H=-165 kJ·mol-1(主反应)
Ⅱ. △H=+41 kJ·mol-1(副反应)
平衡时容器中含碳元素物质的物质的量[n(X)]随温度(T)的变化如图甲、乙、丙曲线所
示 。
下列说法错误的是( )
A.空间站中使CO 转化为燃料CH 的反应不能采用高温
2 4
B.曲线甲、乙、丙分别表示CO、CO、CH
2 4
C.1050K时,曲线丙逐渐下降的原因是以反应Ⅱ为主
D.800K时反应Ⅰ的压强平衡常数
第II卷(非选择题)
二、非选择题:本题共4小题,除18小题中(4)和(5)特殊说明外,其
他每空2分,共58分。
15.(12分)次磷酸钠(NaH PO )是一种白色粉末,微溶于无水乙醇,不溶于乙醚,
2 2
具有强还原性,酸性条件下易被氧化生成HPO 。实验室使用白磷、熟石灰和碳酸钠溶
3 4
液模拟工业制备两步法合成次磷酸钠晶体。
I.制备次磷酸钙[Ca(HPO )]溶液:
2 2 2
(1)实验前,经检验装置的气密性良好。其中仪器a的名称是 ;
(2)将一定量的白磷和过量的熟石灰依次投入仪器a中,加水调成稀浆状,搅拌下加热
升温到90℃,至无PH ,气体放出时停止反应。则a中发生反应的化学方程式是
3
;
II.制备次磷酸钠(NaH PO )溶液:
2 2
(3)过滤除去未反应的固体物质,然后通入二氧化碳,其目的是使溶解在滤液中的氢氧
化钙转化成碳酸钙沉淀而除去,再向次磷酸钙溶液中加入碳酸钠溶液,判断次磷酸钙
完全反应的方法是 ;
III.制备次磷酸钠晶体:
2023年下学期期中考试试卷 高三化学 第 5 页 共 9 页
学科网(北京)股份有限公司(4) 过滤除去碳酸钙后将滤液蒸发浓缩,该操作需在 条件下进行,再经过
冷却结晶,制得次磷酸钠晶体。
IV.测定次磷酸钠纯度:
(5) 测量步骤:称取8.8 g样品溶于水配成25 mL溶液置于锥形瓶中,再加盐酸25
mL,准确加入c mol∙L-1碘标准溶液V mL,盖好瓶塞,放在暗处30 min。打开瓶
1 1
塞,用少量蒸馏水洗瓶颈及瓶塞后,以淀粉溶液作指示剂,用c mol∙L-1硫代硫酸钠标
2
准溶液进行滴定,消耗硫代硫酸钠溶液的体积为V mL(已知I+2NaSO=NaSO+
2 2 2 2 3 2 4 6
2NaI)。
① 判断达到滴定终点的现象是 ;
② 晶体中NaH PO 的质量分数是 (列出表达式)。
2 2
16.(16分)优化的NaFePO 复合材料作钠离子电池的正极材料时表现出优异的循环
4
稳定性。以黄铁矿(主要成分是FeS,含少量SiO 等杂质)为原料制备NaFePO 的流程
2 2 4
如图所示。
已知:“滤渣2”中不含硫单质。涉及离子的氢氧化物常温下的溶度积常数如表。(当
离子的物质的量浓度≤10-5mol·L-1时,认为沉淀完全。)
离子 Fe2+ Fe3+
K 8×10-16 4×10-38
sp
回答下列问题:
(1)常温下,“酸浸”时,加入过量50%的硫酸的目的为 (答一条即可);
(2)“浸渣1”的主要成分是 (填化学式);
(3)“还原”中FeS 与Fe3+反应的离子方程式是 ;通入空气的条件下,“溶
2
液1”可在“还原”步骤中循环利用,则通入空气的目的是 ;
(4)“一系列操作”包括 、 、过滤、 洗涤和低温干燥;
(5) 铁和氨气在640 ℃可发生置换反应,产物之一的晶胞结构如图所示。
该物质的化学式是 。若两个最近的Fe原子间的距离为a nm,则该晶
体的密度是 g/cm3(设阿伏加德罗常数的值为N )。
A
17.(14分)我国力争于2030年前做到碳达峰,2060年前实现碳中和。“碳中和”是
指二氧化碳的排放总量和减少总量相当,这对于改善环境,实现绿色发展至关重要。
回答下列问题:
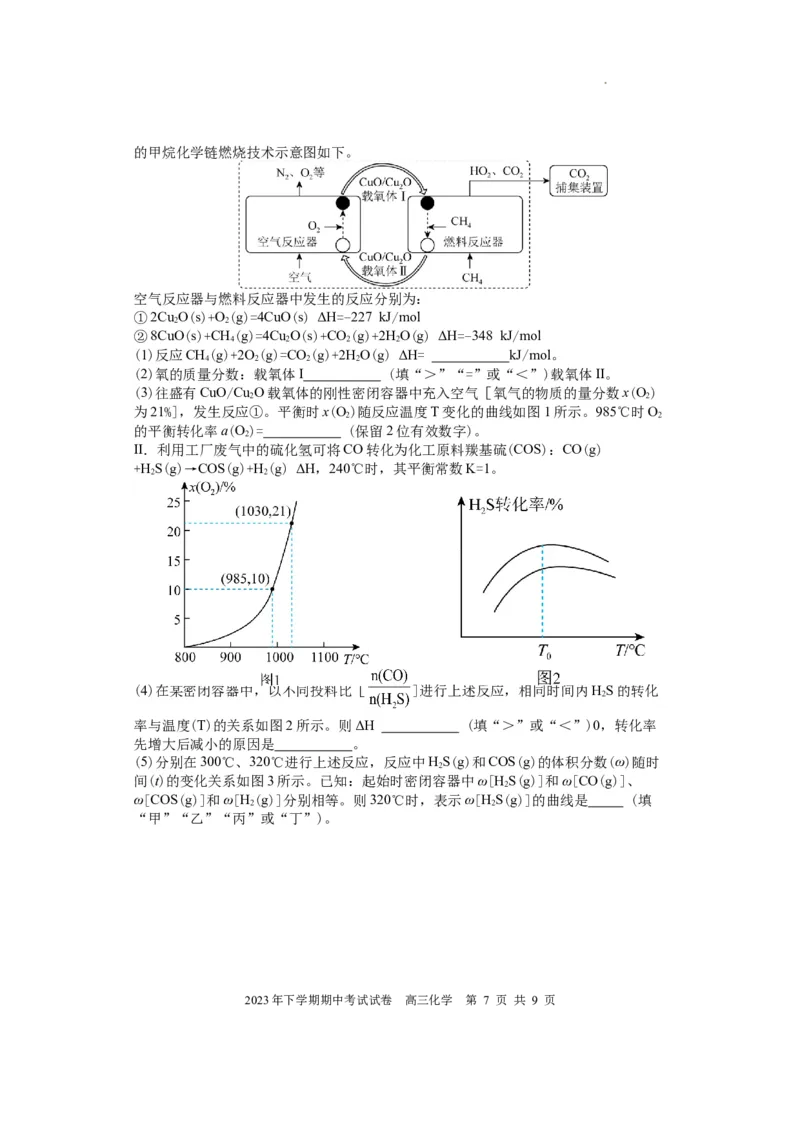
I.化学链燃烧(CLC)是利用载氧体将空气中的氧传输至燃料的新技术,与传统燃烧方
式相比,避免了空气和燃料的直接接触,有利于高效捕集CO 基于CuO/Cu O载氧体
2. 2
2023年下学期期中考试试卷 高三化学 第 6 页 共 9 页
学科网(北京)股份有限公司的甲烷化学链燃烧技术示意图如下。
空气反应器与燃料反应器中发生的反应分别为:
①2Cu O(s)+O(g)=4CuO(s) ΔH=-227 kJ/mol
2 2
②8CuO(s)+CH(g)=4Cu O(s)+CO(g)+2HO(g) ΔH=-348 kJ/mol
4 2 2 2
(1)反应CH(g)+2O(g)=CO(g)+2HO(g) ΔH= kJ/mol。
4 2 2 2
(2)氧的质量分数:载氧体I (填“>”“=”或“<”)载氧体II。
(3)往盛有CuO/Cu O载氧体的刚性密闭容器中充入空气[氧气的物质的量分数x(O)
2 2
为21%],发生反应①。平衡时x(O)随反应温度T变化的曲线如图1所示。985℃时O
2 2
的平衡转化率a(O)= (保留2位有效数字)。
2
II.利用工厂废气中的硫化氢可将CO转化为化工原料羰基硫(COS):CO(g)
+HS(g)→COS(g)+H(g) ΔH,240℃时,其平衡常数K=1。
2 2
(4)在某密闭容器中,以不同投料比[ ]进行上述反应,相同时间内HS的转化
2
率与温度(T)的关系如图2所示。则ΔH (填“>”或“<”)0,转化率
先增大后减小的原因是 。
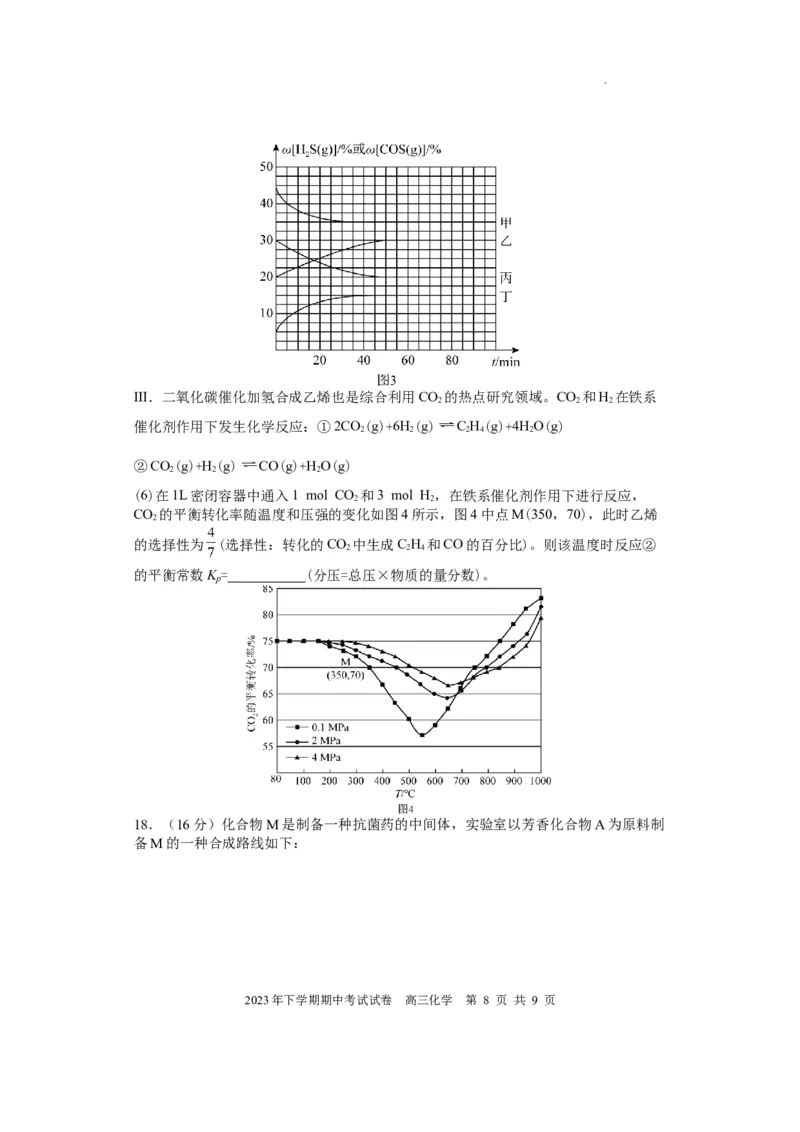
(5)分别在300℃、320℃进行上述反应,反应中HS(g)和COS(g)的体积分数(ω)随时
2
间(t)的变化关系如图3所示。已知:起始时密闭容器中ω[HS(g)]和ω[CO(g)]、
2
ω[COS(g)]和ω[H(g)]分别相等。则320℃时,表示ω[HS(g)]的曲线是 (填
2 2
“甲”“乙”“丙”或“丁”)。
2023年下学期期中考试试卷 高三化学 第 7 页 共 9 页
学科网(北京)股份有限公司III.二氧化碳催化加氢合成乙烯也是综合利用CO 的热点研究领域。CO 和H 在铁系
2 2 2
催化剂作用下发生化学反应:①2CO(g)+6H(g) C H(g)+4HO(g)
2 2 2 4 2
②CO(g)+H(g) CO(g)+HO(g)
2 2 2
(6)在1L密闭容器中通入1 mol CO 和3 mol H,在铁系催化剂作用下进行反应,
2 2
CO 的平衡转化率随温度和压强的变化如图4所示,图4中点M(350,70),此时乙烯
2
的选择性为 (选择性:转化的CO 中生成C H 和CO的百分比)。则该温度时反应②
2 2 4
的平衡常数K = (分压=总压×物质的量分数)。
p
18.(16分)化合物M是制备一种抗菌药的中间体,实验室以芳香化合物A为原料制
备M的一种合成路线如下:
2023年下学期期中考试试卷 高三化学 第 8 页 共 9 页
学科网(北京)股份有限公司已知:
回答下列问题:
(1)E中官能团的名称是 ;
(2)由C生成D所需的条件是 ,F→M的反应类型是 ;
(3)由E生成F的化学方程式是 ;
(4)E的同分异构体中,满足下列条件的有 种,写出其中核磁共振氢谱有4组吸
收峰的结构简式: ;
①含苯环 ② 的该物质与足量的银氨溶液反应,可制得
(5)参照上述合成路线和信息,以乙烯和乙醛为原料(无机试剂任选),设计制备聚2-丁
烯的合成路线: 。
2023年下学期期中考试试卷 高三化学 第 9 页 共 9 页
学科网(北京)股份有限公司