文档内容
南宁三中 2024~2025 学年度上学期 2026 届高二月考(一)
化学试题
命题人:高二化学备课组 审题人:高二化学备课组
可能用到的相对原子质量:O-16 S-32 As-75
一、选择题(本题共14小题,每题只有一个正确选项。每小题3分,共42分。)
1.化学与生活、生产息息相关,下列有关说法正确的是
A.工业上常用电解熔融MgO的方法冶炼镁
B.煤的干馏、煤的气化、煤的液化均属于化学变化
C.漂粉精能用于游泳池消毒,漂粉精的主要成分为NaClO
D.亚硝酸钠具有一定的毒性,不能用于食品(如腊肉、香肠等)的生产
2.化学与生产、生活关系密切,下列做法与调控化学反应速率无关的是
A.煤炭工业向燃煤中添加CaO脱硫
B.医院采用高压氧疗法治疗难愈合的伤口
C.太空食品利用冷冻干燥技术延长食物保质期
D.汽车排气系统中安装催化转化器减少尾气污染
3.下列化学用语或图示表达正确的是
A. 的电子式: B. 分子的空间填充模型:
C. 的结构示意图: D.次氯酸的结构式:
4.在下列可逆反应中,增大压强或降低温度,均可使平衡正向移动的是( )
A.SO (g)+NO (g) SO (g)+NO(g) ΔH<0
2 2 3
B.4NH (g)+5O(g) 4NO(g)+6HO(g) ΔH<0
3 2 2
C.2NH (g) N(g)+3H(g) ΔH>0
3 2 2
D.2SO (g)+O(g) 2SO (g) ΔH<0
2 2 3
5.硫及其化合物部分转化关系如图。设N 为阿伏加德罗常数的值,下列说法不正确的是
A
A.标准状况下,11.2L HS中含有的质子数为9N
2 A
B. 溶液中,Na+原子数目为0.02N
A
C.反应①每消耗6.4g SO ,生成物中硫原子数目为0.3N
2 A
D.反应②每生成1mol氧化产物,转移电子数目为2N
A
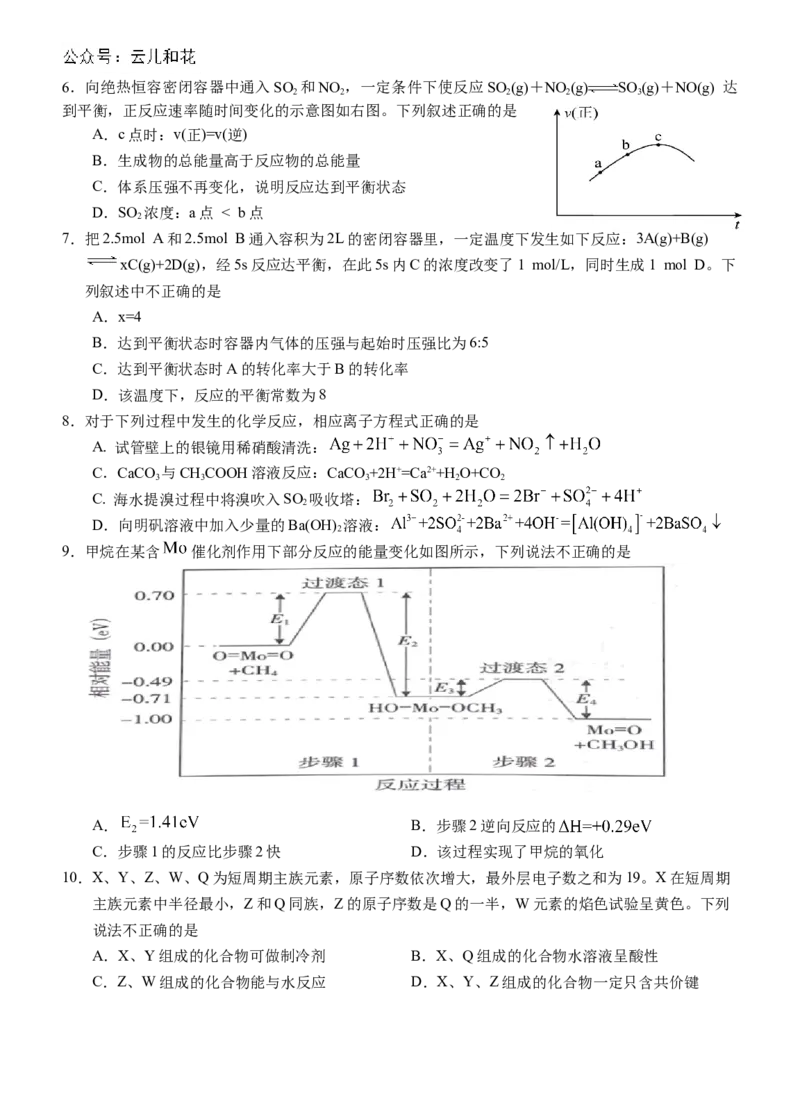
学科网(北京)股份有限公司学科网(北京)股份有限公司6.向绝热恒容密闭容器中通入SO 和NO ,一定条件下使反应SO (g)+NO (g) SO (g)+NO(g) 达
2 2 2 2 3
到平衡,正反应速率随时间变化的示意图如右图。下列叙述正确的是
A.c点时:v(正)=v(逆)
B.生成物的总能量高于反应物的总能量
C.体系压强不再变化,说明反应达到平衡状态
D.SO 浓度:a点 < b点
2
7.把2.5mol A和2.5mol B通入容积为2L的密闭容器里,一定温度下发生如下反应:3A(g)+B(g)
xC(g)+2D(g),经5s反应达平衡,在此5s内C的浓度改变了1 mol/L,同时生成1 mol D。下
列叙述中不正确的是
A.x=4
B.达到平衡状态时容器内气体的压强与起始时压强比为6:5
C.达到平衡状态时A的转化率大于B的转化率
D.该温度下,反应的平衡常数为8
8.对于下列过程中发生的化学反应,相应离子方程式正确的是
A. 试管壁上的银镜用稀硝酸清洗:
C.CaCO 与CHCOOH溶液反应:CaCO +2H+=Ca2++H O+CO
3 3 3 2 2
C. 海水提溴过程中将溴吹入SO 吸收塔:
2
D.向明矾溶液中加入少量的Ba(OH) 溶液:
2
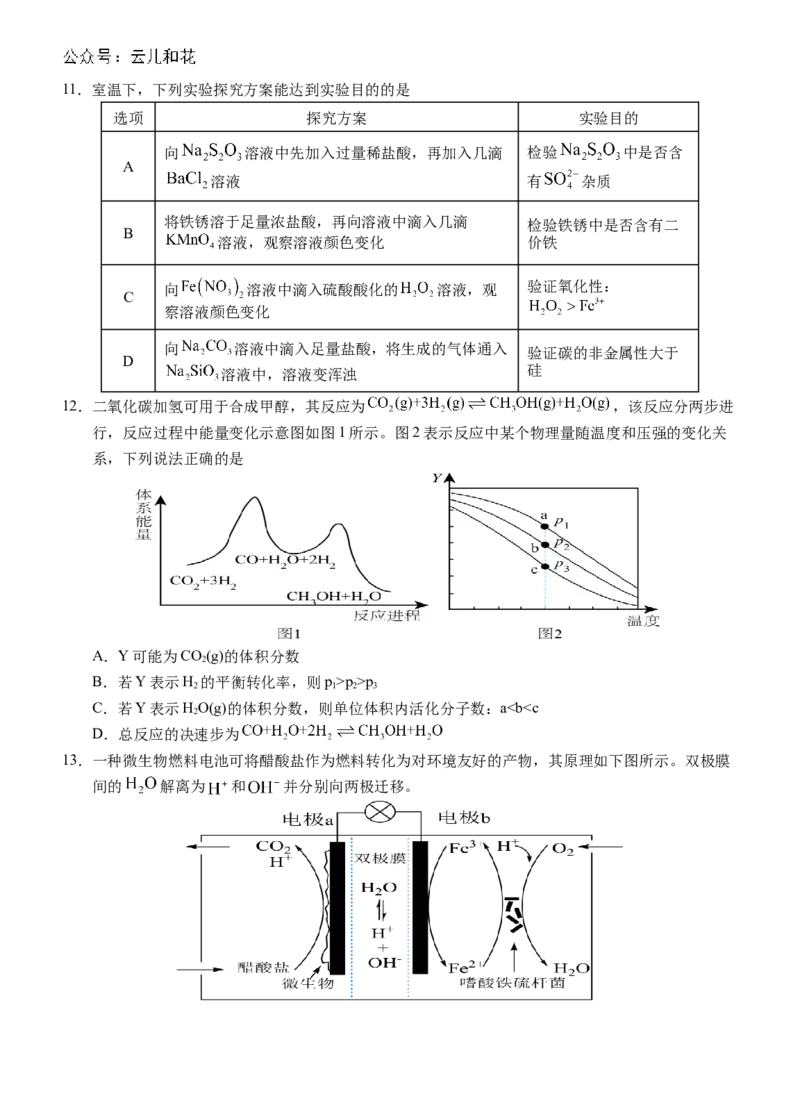
9.甲烷在某含 催化剂作用下部分反应的能量变化如图所示,下列说法不正确的是
A. B.步骤2逆向反应的
C.步骤1的反应比步骤2快 D.该过程实现了甲烷的氧化
10.X、Y、Z、W、Q为短周期主族元素,原子序数依次增大,最外层电子数之和为19。X在短周期
主族元素中半径最小,Z和Q同族,Z的原子序数是Q的一半,W元素的焰色试验呈黄色。下列
说法不正确的是
A.X、Y组成的化合物可做制冷剂 B.X、Q组成的化合物水溶液呈酸性
C.Z、W组成的化合物能与水反应 D.X、Y、Z组成的化合物一定只含共价键
学科网(北京)股份有限公司11.室温下,下列实验探究方案能达到实验目的的是
选项 探究方案 实验目的
向 溶液中先加入过量稀盐酸,再加入几滴 检验 中是否含
A
溶液 有 杂质
将铁锈溶于足量浓盐酸,再向溶液中滴入几滴 检验铁锈中是否含有二
B
溶液,观察溶液颜色变化 价铁
向 溶液中滴入硫酸酸化的 溶液,观 验证氧化性:
C
察溶液颜色变化
向 溶液中滴入足量盐酸,将生成的气体通入 验证碳的非金属性大于
D
溶液中,溶液变浑浊 硅
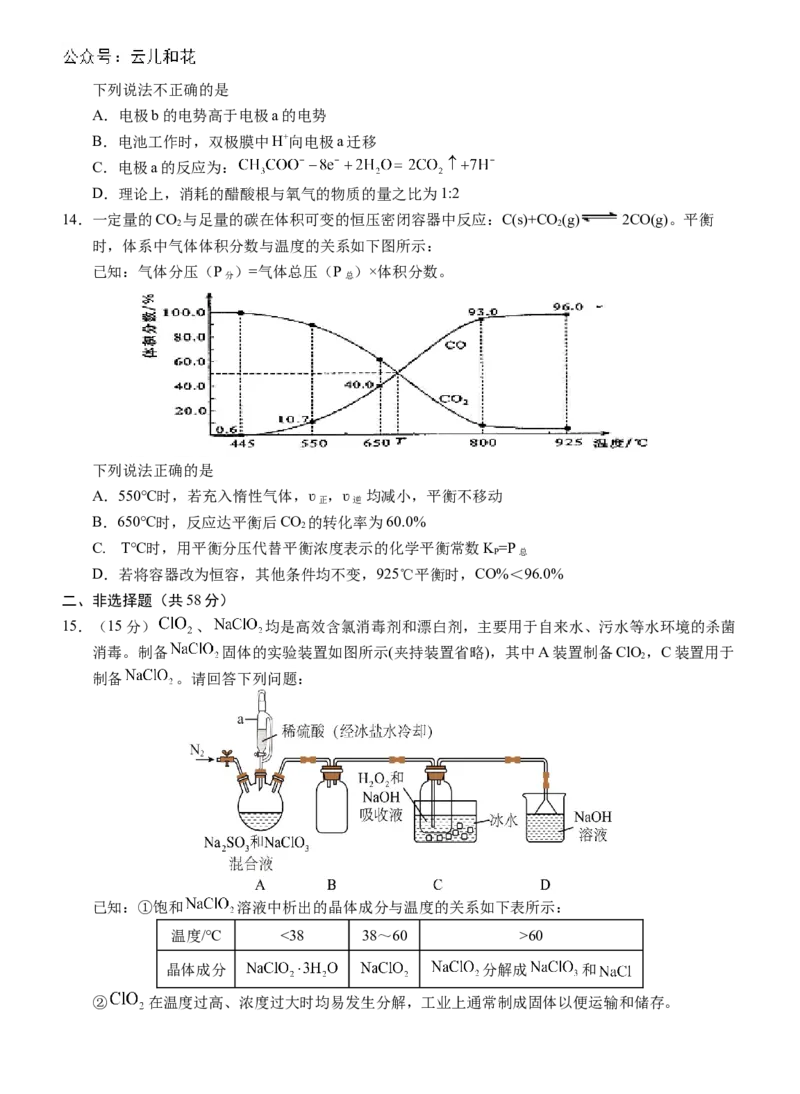
12.二氧化碳加氢可用于合成甲醇,其反应为 ,该反应分两步进
行,反应过程中能量变化示意图如图1所示。图2表示反应中某个物理量随温度和压强的变化关
系,下列说法正确的是
A.Y可能为CO(g)的体积分数
2
B.若Y表示H 的平衡转化率,则p>p>p
2 1 2 3
C.若Y表示HO(g)的体积分数,则单位体积内活化分子数:a60
晶体成分 分解成 和
② 在温度过高、浓度过大时均易发生分解,工业上通常制成固体以便运输和储存。
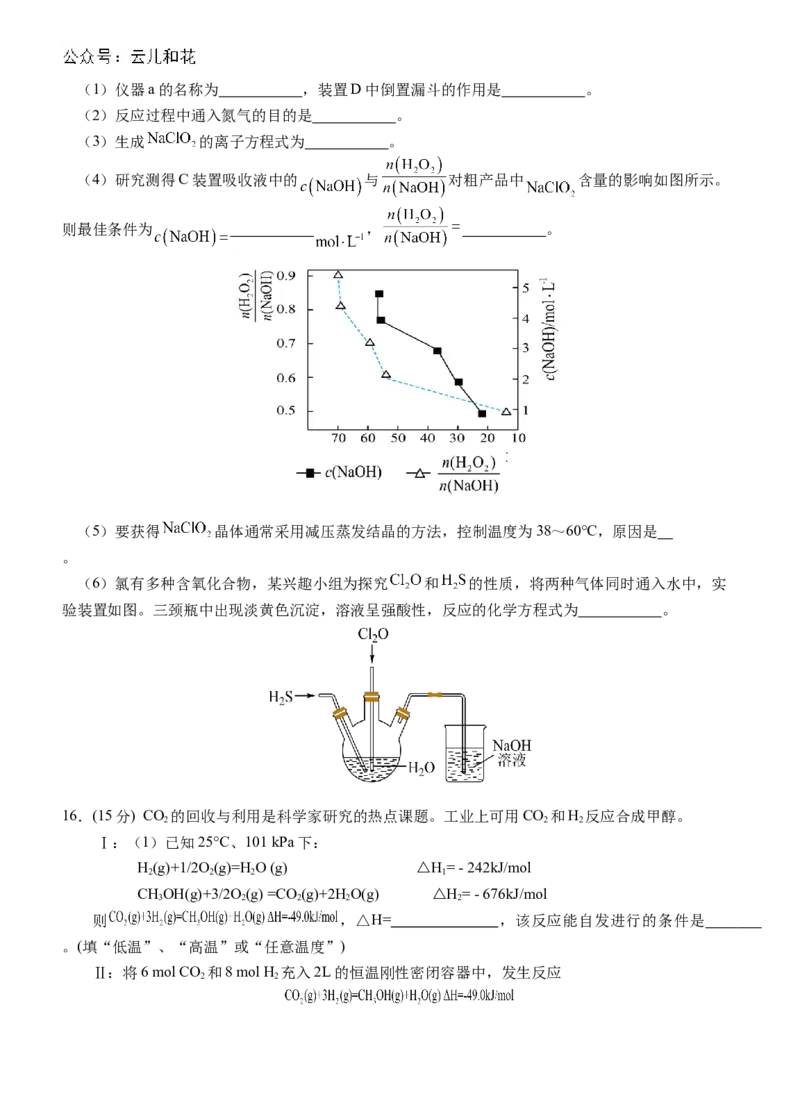
学科网(北京)股份有限公司(1)仪器a的名称为 ,装置D中倒置漏斗的作用是 。
(2)反应过程中通入氮气的目的是 。
(3)生成 的离子方程式为 。
(4)研究测得C装置吸收液中的 与 对粗产品中 含量的影响如图所示。
则最佳条件为 , 。
NaClO 含量
2
(5)要获得 晶体通常采用减压蒸发结晶的方法,控制温度为38~60℃,原因是
。
(6)氯有多种含氧化合物,某兴趣小组为探究 和 的性质,将两种气体同时通入水中,实
验装置如图。三颈瓶中出现淡黄色沉淀,溶液呈强酸性,反应的化学方程式为 。
16.(15分) CO 的回收与利用是科学家研究的热点课题。工业上可用CO 和H 反应合成甲醇。
2 2 2
Ⅰ:(1)已知25°C、101 kPa下:
H(g)+1/2O (g)=HO (g) △H= - 242kJ/mol
2 2 2 1
CHOH(g)+3/2O (g) =CO (g)+2HO(g) △H = - 676kJ/mol
3 2 2 2 2
则 ,△H= ,该反应能自发进行的条件是
。(填“低温”、“高温”或“任意温度”)
Ⅱ:将6 mol CO 和8 mol H 充入2L的恒温刚性密闭容器中,发生反应
2 2
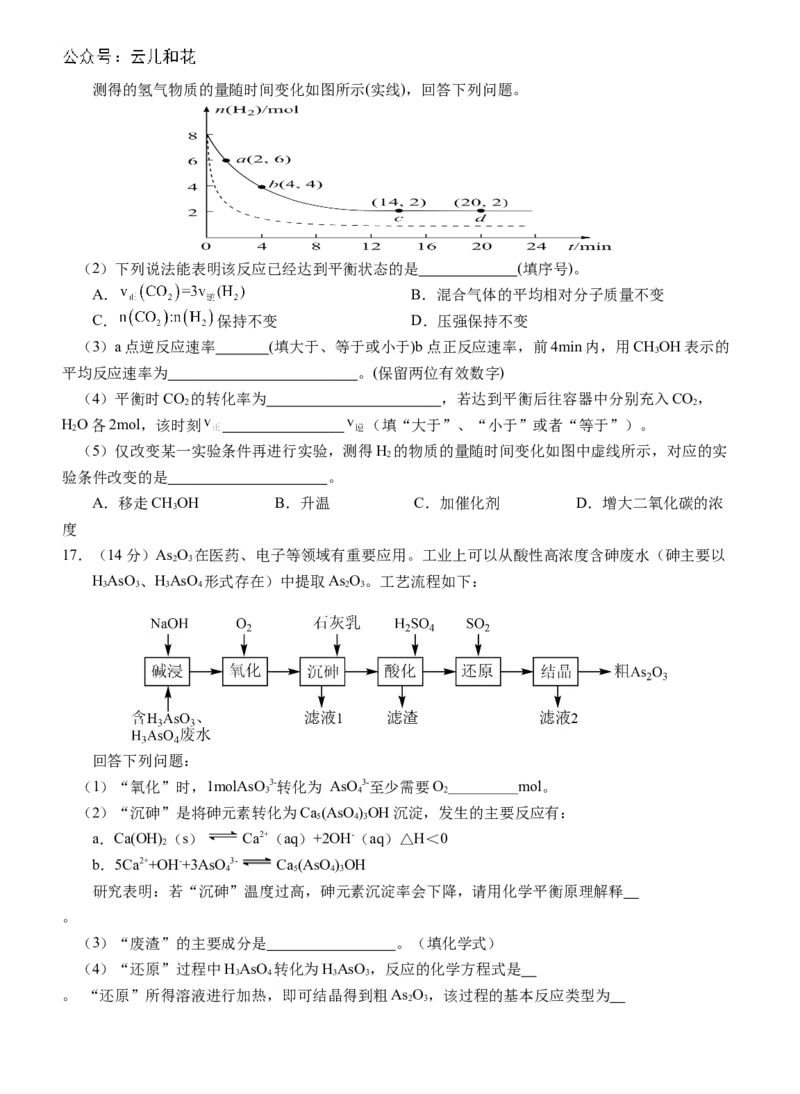
学科网(北京)股份有限公司测得的氢气物质的量随时间变化如图所示(实线),回答下列问题。
(2)下列说法能表明该反应已经达到平衡状态的是 (填序号)。
A. B.混合气体的平均相对分子质量不变
C. 保持不变 D.压强保持不变
(3)a点逆反应速率 (填大于、等于或小于)b点正反应速率,前4min内,用CHOH表示的
3
平均反应速率为 。(保留两位有效数字)
(4)平衡时CO 的转化率为 ,若达到平衡后往容器中分别充入CO,
2 2
HO各2mol,该时刻 (填“大于”、“小于”或者“等于”)。
2
(5)仅改变某一实验条件再进行实验,测得H 的物质的量随时间变化如图中虚线所示,对应的实
2
验条件改变的是 。
A.移走CHOH B.升温 C.加催化剂 D.增大二氧化碳的浓
3
度
17.(14分)As O 在医药、电子等领域有重要应用。工业上可以从酸性高浓度含砷废水(砷主要以
2 3
HAsO 、HAsO 形式存在)中提取As O。工艺流程如下:
3 3 3 4 2 3
回答下列问题:
(1)“氧化”时,1molAsO 3-转化为 AsO 3-至少需要O mol。
3 4 2
(2)“沉砷”是将砷元素转化为Ca (AsO)OH沉淀,发生的主要反应有:
5 4 3
a.Ca(OH) (s) Ca2+(aq)+2OH-(aq)△H<0
2
b.5Ca2++OH-+3AsO 3- Ca (AsO)OH
4 5 4 3
研究表明:若“沉砷”温度过高,砷元素沉淀率会下降,请用化学平衡原理解释
。
(3)“废渣”的主要成分是 。(填化学式)
(4)“还原”过程中HAsO 转化为HAsO ,反应的化学方程式是
3 4 3 3
。 “还原”所得溶液进行加热,即可结晶得到粗As O,该过程的基本反应类型为
2 3
学科网(北京)股份有限公司。
(5)该工艺可以循环使用的物质有 。(填化学式)
(6)若a kg砷含量为ω的含砷废水,通过该工艺处理,最终得到b kg As O,则砷的回收率为
2 3
%。
18.(14分)研究氮的化合物具有重要意义。
(一)一种工业制硝酸的方法经历下列几个步骤:
△H<0
1
△H<0
2
△H<0
3
已知:NO在1000℃以上会发生分解反应。
(1)工业生产中未直接在一个设备中将NH 催化氧化至NO ,而设计了两步氧化,中间经过热交换
3 2
器降温,这样做的目的除了节约能源,还有 目的。
(2)实验发现,单位时间内NH 的氧化率[ ]会随着温度的升高先增大后减小(如图所
3
示),分析1000℃后NH 的氧化率减小的可能原因 。
3
(3)对于反应2NO(g)+O (g) 2NO (g)的反应历程如下:
2 2
第一步:2NO(g) NO(g)(快速平衡) 第二步:NO(g)+O(g) 2NO (g)(慢反应)
2 2 2 2 2 2
其中可近似认为第二步反应不影响第一步的平衡,第一步反应中:υ =k ·c2(NO),υ =k
正 1 正 逆 1
·c(N O),k 、k 为速率常数,仅受温度影响。下列叙述正确的是 。
逆 2 2 1正 1 逆
A.整个反应的速率由第一步反应速率决定
B.第二步反应活化能比第一步反应的活化能高
C.第二步反应速率慢,因而平衡转化率也低
D.同一温度下,平衡时第一步反应的 越大,反应正向程度越大
(二)工业上也可以直接由NO 合成HNO,其中最关键的步骤为 ,利用现代手持技
2 4 3
术传感器可以探究压强对该平衡的影响。
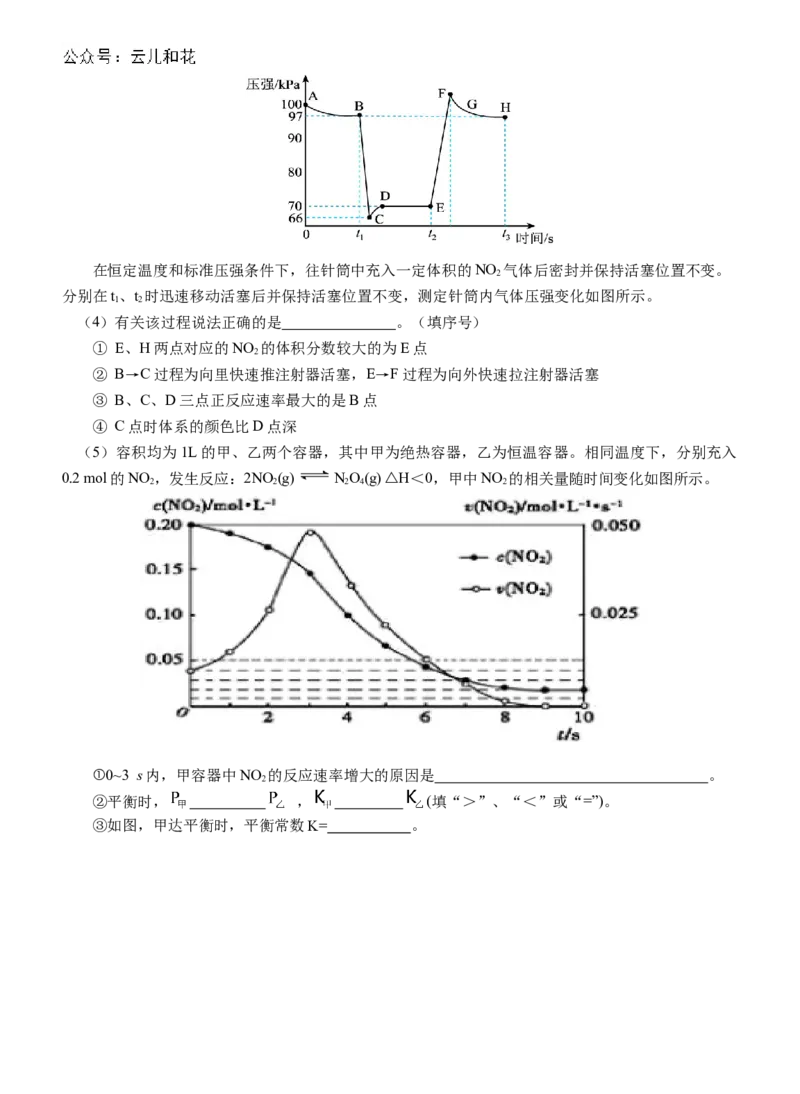
学科网(北京)股份有限公司在恒定温度和标准压强条件下,往针筒中充入一定体积的NO 气体后密封并保持活塞位置不变。
2
分别在t、t 时迅速移动活塞后并保持活塞位置不变,测定针筒内气体压强变化如图所示。
1 2
(4)有关该过程说法正确的是 。(填序号)
① E、H两点对应的NO 的体积分数较大的为E点
2
② B→C过程为向里快速推注射器活塞,E→F过程为向外快速拉注射器活塞
③ B、C、D三点正反应速率最大的是B点
④ C点时体系的颜色比D点深
(5)容积均为1L的甲、乙两个容器,其中甲为绝热容器,乙为恒温容器。相同温度下,分别充入
0.2 mol的NO ,发生反应:2NO (g) NO(g) △H<0,甲中NO 的相关量随时间变化如图所示。
2 2 2 4 2
①0~3 s内,甲容器中NO 的反应速率增大的原因是 。
2
②平衡时, , (填“>”、“<”或“=”)。
③如图,甲达平衡时,平衡常数K= 。
学科网(北京)股份有限公司