文档内容
绝密★启用前
吴忠市 2025 届高三学业水平适应性测试卷试
化 学
考试时间:75分钟 满分:100分
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Si-28 P-31 S-32 Cl-35.5 Co-59
一、选择题(本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有
一项是符合题目要求的。)
1.改革开放40年,我国取得了很多世界瞩目的科技成果,下列说法不正确的是( )
A.蛟龙号潜水器用到钛合金,22号钛元素属于过渡元素
B.港珠澳大桥用到的合金材料,具有强度大、密度小、耐腐蚀等性能
C.国产C919飞机用到的氮化硅陶瓷是新型无机非金属材料
D.中国天眼传输信息用的光纤材料是硅
2.下列化学用语表述错误的是( )
A.NaOH的电子式:
B.异丙基的结构简式:
C.NaCl溶液中的水合离子:
D.Cl 分子中σ键的形成:
2
3.实验室根据化学试剂性质的不同采用不同的保存方法,下列说法错误的是( )
A.浓硝酸保存在棕色试剂瓶中
B.氢氧化钠溶液保存在带磨口玻璃塞的细口瓶中
C.高锰酸钾和乙醇不能同时保存在同一药品柜中
D.金属钠保存在煤油中
4.白磷易自燃,国际上明令禁止使用白磷弹,工业上白磷可用来生产磷酸。白磷制备反
应为:2Ca (PO ) +6SiO +10C
1373-1713K
6CaSiO +P +10CO↑。设N 为阿伏加德罗
3 4 2 2 3 4 A
常数。下列有关说法正确的是( )
A.62gP 中含P-P键数目为2N
4 A
B.30gSiO 中分子数目为0.5N
2 A
C.1mol/LCa (PO ) 溶液中含有PO 3-数目为2N
3 4 2 4 A
D.上述反应每生成1molCO时转移电子数目为2N
A
化学试卷 · 第 1 页 · 共 6 页
{#{QQABAYAAggiAABIAAQhCQQ3SCEMQkgGCCYgORAAMoAAAyAFABCA=}#}5
.下列说法正确的是( )
A.硫在纯氧中燃烧可生成三氧化硫
B.亚硝酸钠是一种食品添加剂,用作食品防腐剂和肉类食品的发色剂
C.浓盐酸、浓硝酸、浓硫酸均可用铝罐车运输
D.将氯气通入紫色石蕊溶液中,溶液先变红后褪色,说明氯气具有漂白性和酸性
6.能正确表示下列反应的离子方程式为( )
A.向FeBr 溶液中通入过量Cl :2Fe2++Cl =2Fe3++2Cl-
2 2 2
B.向饱和碳酸钠溶液中通入足量CO :CO 2-+CO +H O=2HCO -
2 3 2 2 3
C.向碘化钾溶液中加入少量双氧水:3H O +I-=IO -+3H O
2 2 3 2
D.向硫化钠溶液中通入过量SO :2S2-+5SO +2H O=3S↓+4HSO -
2 2 2 3
7
.名医华佗创制的用于外科手术的麻醉药“麻沸散”中含有东莨菪碱,
其结构简式如图。下列关于该物质的说法不正确的是( )
...
A.含有3种含氧官能团 B.N的杂化方式为sp3
C.不能发生消去反应 D.具有碱性,能与强酸反应
8
.下列方案设计、现象和结论都正确的是
目 的 方案设计和现象 结 论
将KCl固体溶于水,进行导电性
A 判断KCl的化学键类型 KCl中含有离子键
实验,KCl溶液可导电
向0.1mol·L-1H O 溶液中滴加
2 2
B 验证H O 具有氧化性 0.1mol·L-1KMnO 溶液,KMnO H O 具有氧化性
2 2 4 4 2 2
褪色
探究浓HNO 受热易分 向盛有浓HNO 试管中中加入红
C 3 3 浓HNO 受热易分解
解 热的木炭,产生红棕色气体 3
鉴别Na CO 与 取适量固体于试管,插入温度计,
D 2 3 该固体是Na CO
NaHCO 加少量水,温度升高 2 3
3
9.锑白(Sb O )为白色粉末,不溶于水,溶于酸和强碱,主要用于制备白色颜料、油漆
2 3
等。一种利用锑矿粉(主要成分为Sb S 、SiO )制取锑白的流程如下。
2 3 2
已知:浸出液中的阳离子主要为Sb3+、Fe3+、Fe2+。
下列说法错误的是( )
A.“浸出”时发生的反应为Sb S +6Fe3+=2Sb3++6Fe2++3S
2 3
B.可以用KSCN溶液检验“还原”反应是否完全
C.“滤液”中通入Cl 后可返回“浸出”工序循环使用
2
D.“中和”时可用过量的NaOH溶液代替氨水
化学试卷 · 第 2 页 · 共 6 页
{#{QQABAYAAggiAABIAAQhCQQ3SCEMQkgGCCYgORAAMoAAAyAFABCA=}#}10.我国科学家合成一种比硫酸酸性强的超强酸催化剂,广泛应用于有
机合成,它的结构式如图所示。短周期主族元素R、X、Y、Z、W
的原子序数依次增大,Y和W位于同族。下列说法正确的是( )
A.简单氢化物的沸点:Z>Y>W
B.X、W分别与Y形成的化合物中,X原子和W原子的杂化类型相同
C.简单离子半径:W>Y>Z
D.R、Y、W只能组成一种三元化合物
11.我国科学家在天然气脱硫研究方面取得了新进展,
利用如图装置可进行脱硫,将硫化氢气体转化成硫
沉淀。已知甲、乙池中发生的反应如图所示,其中
全氟磺酸膜允许H+通过。下列说法正确的是( )
A.该装置只存在光能和化学能的转化
B.H+穿过全氟磺酸膜从左往右移动,导致甲池中H+浓度减小
C.电路中每转移0.1mol电子,理论上甲池溶液中生成H O 的质量为1.7g
2 2
D.光照时,乙池N型半导体电极上发生的反应为:H S+I -=3I-+S+2H+
2 3
12.储氢材料多为易与氢起作用的的某些过渡金属、合金或金属化合物。某种新型储氢材
料的晶胞如图,八面体中心为亚铁离子,顶点均为 NH 配体;四面体中心为硼原子,
3
顶点均为氢原子。下列说法错误的是( )
A.Fe元素位于周期表中的ds区
B.该化合物中配位体NH 中N是sp3杂化
3
C.晶体最简化学式为[Fe(NH ) ](BH )
3 6 4 2
D.晶体中阳离子的配位数为8
13.光催化剂在紫外线照射下产生光生电子(e-)和光生空穴(h+),h+具有强氧化性,
留在VB端,e-跃迁到CB端。科学家利用
乙腈(CH CN)光催化脱氢偶联高选择性制
3
丁二腈( ),反应历程如下图
所示。下列说法错误的是( )
A.VB端上发生的反应为:H O-h+=·OH+H+
2
B.反应过程中·CH CN为中间产物
2
C.单位时间内产生“空穴”数越多,反应a、c速率越快
D.提高丁二腈选择性的关键是抑制反应a、降低反应c的活化能
14.湿法提银工艺中,浸出的Ag+需加入Cl-进行沉淀。25℃时,平衡体系中含Ag微粒的
分布系数δ[如δ(AgCl )= n(AgCl 2 -) ]随lgc(Cl-)
2 n (含Ag微粒)
总
的变化曲线如图所示。已知:lg[K(AgCl)]=-9.75。
sp
下列叙述错误的是( )
A.沉淀最彻底时,溶液中c(Ag+)=10-7.21mol·L-1
B.当c(Cl-)=10-2.54mol·L-1时,溶液中c(Ag+)>c(AgCl -)>c(AgCl 2-)
2 3
C.25℃时,AgCl -+Cl-⇌ AgCl 2-的平衡常数K=100.2
2 3
D.25℃时,AgCl的溶解度随c(Cl-)增大而不断减小
化学试卷 · 第 3 页 · 共 6 页
{#{QQABAYAAggiAABIAAQhCQQ3SCEMQkgGCCYgORAAMoAAAyAFABCA=}#}二、填空题(本题共4小题,共58分)
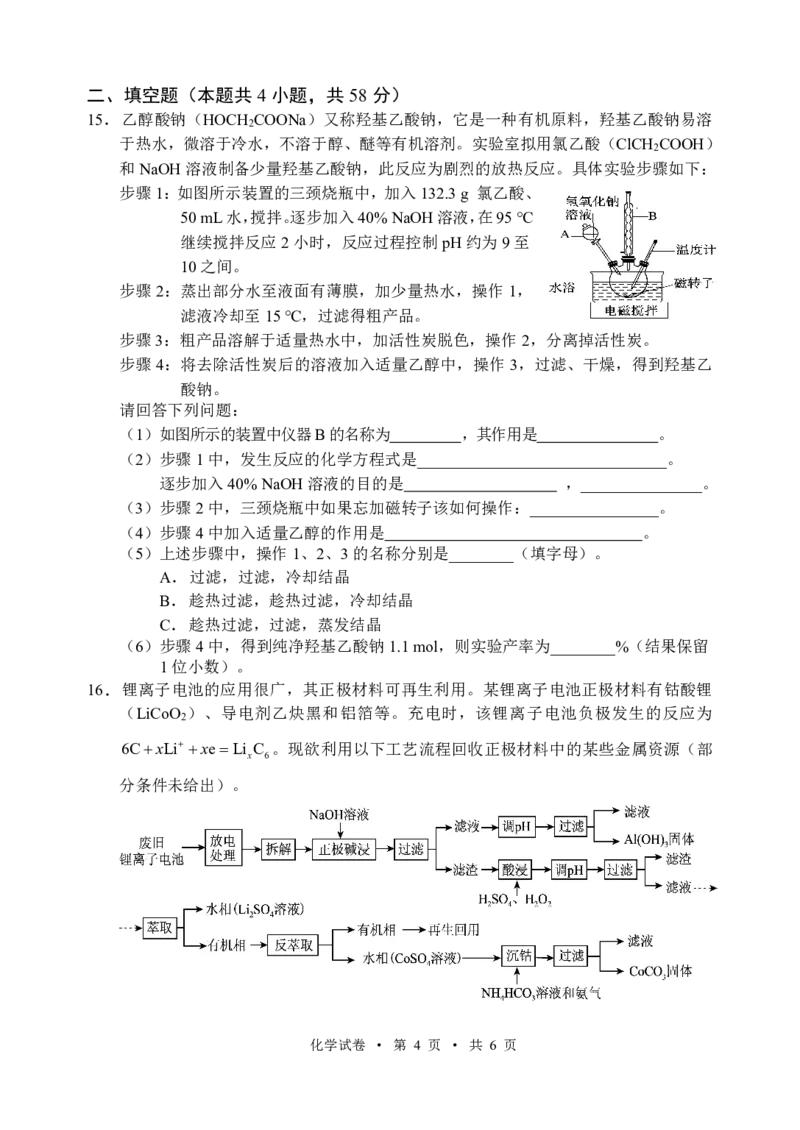
15 .乙醇酸钠(HOCH COONa)又称羟基乙酸钠,它是一种有机原料,羟基乙酸钠易溶
2
于热水,微溶于冷水,不溶于醇、醚等有机溶剂。实验室拟用氯乙酸(ClCH COOH)
2
和NaOH溶液制备少量羟基乙酸钠,此反应为剧烈的放热反应。具体实验步骤如下:
步骤1:如图所示装置的三颈烧瓶中,加入132.3g 氯乙酸、
50mL水,搅拌。逐步加入40%NaOH溶液,在95℃
继续搅拌反应2小时,反应过程控制pH约为9至
10之间。
步骤2:蒸出部分水至液面有薄膜,加少量热水,操作1,
滤液冷却至15℃,过滤得粗产品。
步骤3:粗产品溶解于适量热水中,加活性炭脱色,操作2,分离掉活性炭。
步骤4:将去除活性炭后的溶液加入适量乙醇中,操作3,过滤、干燥,得到羟基乙
酸钠。
请回答下列问题:
(1)如图所示的装置中仪器B的名称为 ,其作用是 。
(2)步骤1中,发生反应的化学方程式是_______________________________。
逐步加入40%NaOH溶液的目的是 ,_______________。
(3)步骤2中,三颈烧瓶中如果忘加磁转子该如何操作:________________。
(4)步骤4中加入适量乙醇的作用是 。
(5)上述步骤中,操作1、2、3的名称分别是________(填字母)。
A
.过滤,过滤,冷却结晶
B.趁热过滤,趁热过滤,冷却结晶
C.趁热过滤,过滤,蒸发结晶
(6)步骤4中,得到纯净羟基乙酸钠1.1mol,则实验产率为________%(结果保留
1位小数)。
16.锂离子电池的应用很广,其正极材料可再生利用。某锂离子电池正极材料有钴酸锂
(LiCoO )、导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为
2
6CxLi xeLi C 。现欲利用以下工艺流程回收正极材料中的某些金属资源(部
x 6
分条件未给出)。
化学试卷 · 第 4 页 · 共 6 页
{#{QQABAYAAggiAABIAAQhCQQ3SCEMQkgGCCYgORAAMoAAAyAFABCA=}#}回答下列问题:
(1)“拆解”废旧锂离子电池前需进行“放电处理”,具体操作是先将其浸入NaCl溶液
中,使电池短路而放电。“放电处理”有利于锂在正极回收,其主要原因是______。
(2)“正极碱浸”时。提高碱浸效率的措施有___________(写两项);“正极碱浸”反
应中作氧化剂的物质是___________(写化学式)。
(3)“酸浸”时,过氧化氢的主要作用是
。
(4)过滤后的滤液,调pH生成Al(OH) 的
3
过程中往往需要加热并不断搅拌,其
主要目的是 。
(5)“沉钴”时的离子方程式为__________。
(6)工业上,有些工艺中“沉钴”的产物可能是CoC O ,CoC O 是制备钴的氧化物的
2 4 2 4
重要原料。二水合草酸钴(CoC O ·2H O)在空气中受热的质量变化曲线如图所
2 4 2
示,曲线中300℃及以上所得固体均为钴的氧化物。
通过计算确定C点的化学式 ,以及由B到C的化学方程式 。
17.我国提出2060年前实现碳中和,降低大气中CO 含量是当今世界重要科研课题之一,
2
以CO 为原料制备甲烷、戊烷、甲醇等能源物质具有较好的发展前景。问答下列问题:
2
(1)CO 在固体催化表面加氢合成甲烷过程中发生以下两个反应:
2
主反应:CO (g)+4H (g)⇌ CH (g)+2H O(g) ΔH =-156.9kJ·mol-1
2 2 4 2 1
副反应:CO (g)+H (g)⇌ CO(g)+H O(g) ΔH =+41.1kJ·mol-1
2 2 2 2
①已知2H (g)+O (g)=2H O(g) ΔH =-395.6kJ·mol-1,则CH 燃烧的热化学方
2 2 2 3 4
程式CH (g)+2O (g)=CO (g)+2H O(g) ΔH=___________。
4 2 2 2
②加氢合成甲烷时,通常控制温度为500℃左右,其原因为该温度下有较高的化
学反应速率和___________。
③500℃时,向1L恒容密闭容器中充入4molCO 和12molH ,初始压强为p,
2 2
3
20min时主、副反应都达到平衡状态,测得c(H O)=5mol·L-1,体系压强为 p,
2
4
则0~20min内v(CH )=___________mol·L-lmin-1,平衡时CH 选择性
4 4
CH 平衡浓度
=___________(CH 选择性= 4 ×100%)。
4 CO 转化浓度
2
(2)我国科研人员将CO 和H 在Na-Fe O
2 2 3 4
/HZSM-5催化下转变为汽油(C ~C
5 11
的烃),反应过程如右图所示。
化学试卷 · 第 5 页 · 共 6 页
{#{QQABAYAAggiAABIAAQhCQQ3SCEMQkgGCCYgORAAMoAAAyAFABCA=}#}①若CO 在该条件下转化为戊烷(C H ),则该反应的化学方程式为 。
2 5 12
②催化剂中的Fe O 可用电解法制备。电解时以Fe做电极,电解质溶液为稀硫酸,
3 4
其阳极反应式为 。
(3)甲醇催化制取乙烯的过程中发生如下反应:
反应1:3CH OH⇌ C H (g)+H O(g);
3 3 6 2
反应2:2CH OH(g)⇌ C H (g)+2H O(g)
3 2 4 2
反应I的Arrhenius经验公式的实验数据如图中曲
E
线a所示,已知Arhenius经验公式Rlnk=- a +C
T
(E 为活化能,k为速率常数,R和C为常数)。
a
则该反应的活化能E =___________kJ·mol-1。当改
a
变外界条件时,实验数据如图中的曲线b所示,
则实验可能改变的外界条件是___________。
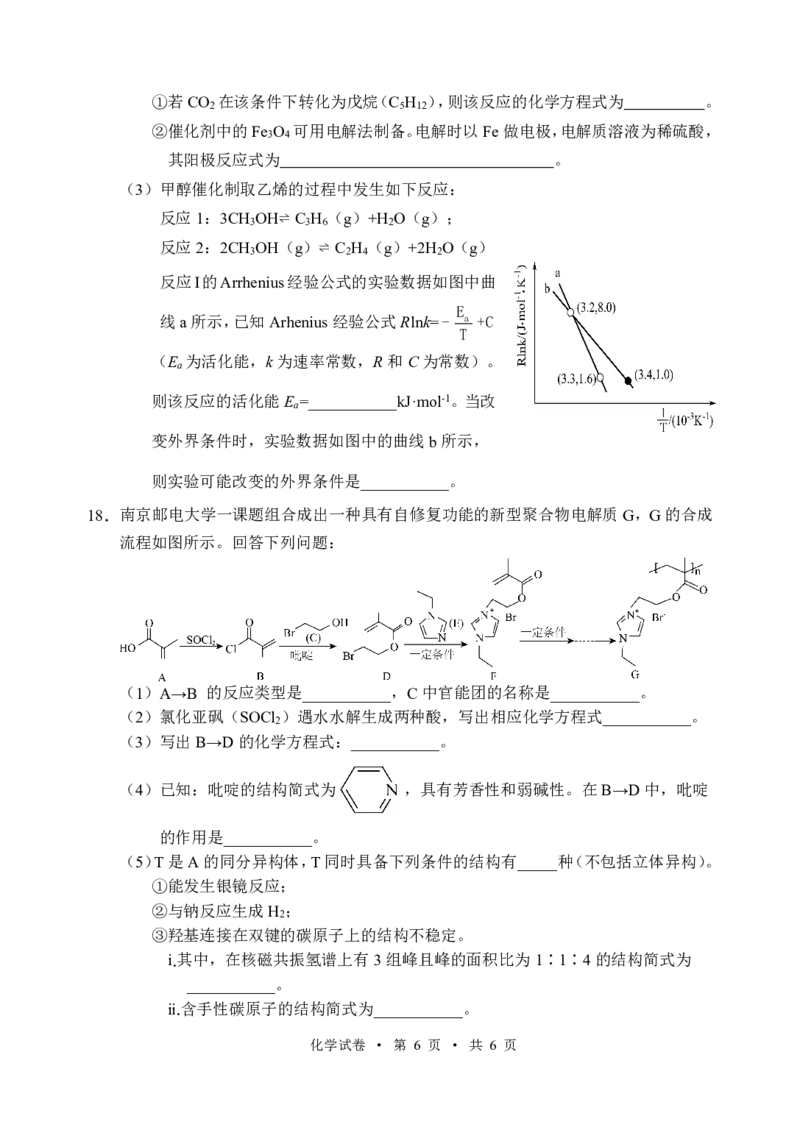
18.南京邮电大学一课题组合成出一种具有自修复功能的新型聚合物电解质G,G的合成
流程如图所示。回答下列问题:
(1)A→B 的反应类型是___________,C中官能团的名称是___________。
(2)氯化亚砜(SOCl )遇水水解生成两种酸,写出相应化学方程式___________。
2
(3)写出B→D的化学方程式:___________。
(4)已知:吡啶的结构简式为 ,具有芳香性和弱碱性。在B→D中,吡啶
的作用是___________。
(5)T是A的同分异构体,T同时具备下列条件的结构有_____种(不包括立体异构)。
①能发生银镜反应;
②与钠反应生成H ;
2
③羟基连接在双键的碳原子上的结构不稳定。
ⅰ.其中,在核磁共振氢谱上有3组峰且峰的面积比为1∶1∶4的结构简式为
___________。
ⅱ.含手性碳原子的结构简式为___________。
化学试卷 · 第 6 页 · 共 6 页
{#{QQABAYAAggiAABIAAQhCQQ3SCEMQkgGCCYgORAAMoAAAyAFABCA=}#}