文档内容
区县高中学校25届高三一诊模拟联考
化学试卷
考试时间:75分钟 满分:100分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Cu-64 Zn-65 Se-79 Fe-56 P-31 I-127
S-32 Cl-35.5
一、选择题(本大题共14个小题,每小题3分,共42分。每小题只有一个选项符合题意。)
1.化学与生活、科技、社会发展息息相关。下列说法正确的是( )
A.含增塑剂的聚氯乙烯薄膜能用于生产食品包装袋
B.“神舟”系列飞船外壳中含有硬铝,硬铝属于合金材料
C.我国芯片产业发展迅猛,芯片的主要成分为高纯度二氧化硅
D.巴黎奥运会火炬燃料的主要成分丙烷属于有机高分子材料
2.下列化学用语表达正确的是( )
A.次氯酸钠的电子式: B. 分子中共价键电子云轮廓图:
C.2-丁烯的键线式: D. 分子的空间填充模型:
3.用 表示阿伏加德罗常数的值,下列叙述正确的是( )
A.1mol 中含有的离子数为4
B.将0.3mol 水解形成 胶体粒子数为0.3
C.标准状况下,22.4L HF中所含原子数目大于2
D.加热条件下,含0.2mol 的浓硫酸与足量铜充分反应,产生 分子数为0.1
4.下列离子方程式书写正确的是( )
A.向 溶液中滴加 溶液:
B.向NaOH溶液中滴加 溶液:
C.向 溶液中通入少量 :
D. 通入 溶液:
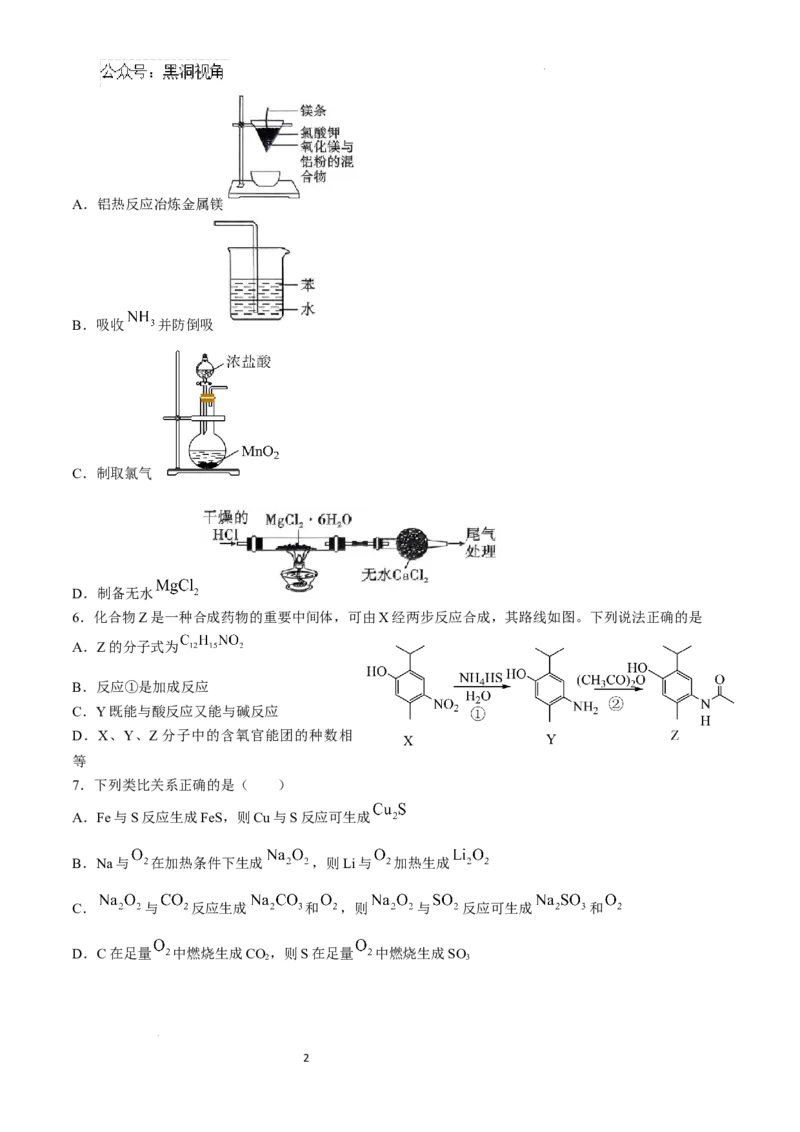
5.下列实验装置能达到实验目的的是( )
1
学科网(北京)股份有限公司A.铝热反应冶炼金属镁
B.吸收 并防倒吸
C.制取氯气
D.制备无水
6.化合物Z是一种合成药物的重要中间体,可由X经两步反应合成,其路线如图。下列说法正确的是
A.Z的分子式为
B.反应①是加成反应
C.Y既能与酸反应又能与碱反应
D.X、Y、Z分子中的含氧官能团的种数相
等
7.下列类比关系正确的是( )
A.Fe与S反应生成FeS,则Cu与S反应可生成
B.Na与 在加热条件下生成 ,则Li与 加热生成
C. 与 反应生成 和 ,则 与 反应可生成 和
D.C在足量 中燃烧生成CO,则S在足量 中燃烧生成SO
2 3
2
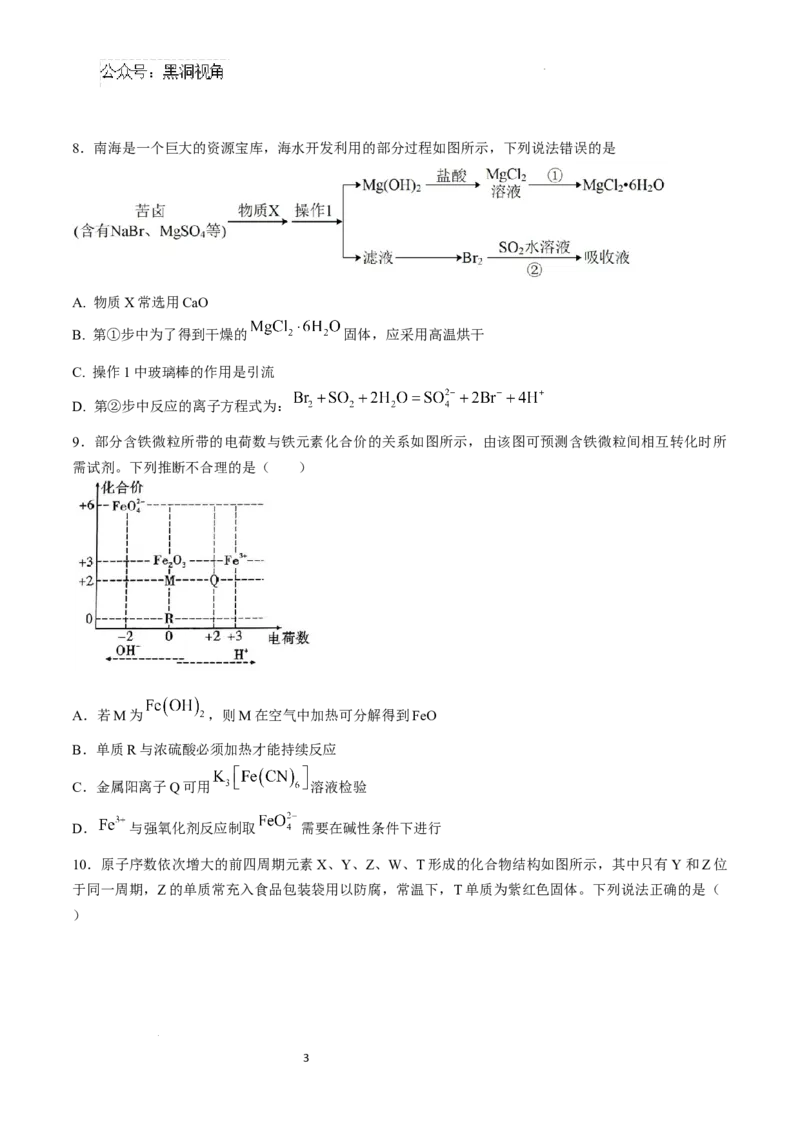
学科网(北京)股份有限公司8.南海是一个巨大的资源宝库,海水开发利用的部分过程如图所示,下列说法错误的是
A. 物质X常选用CaO
B. 第①步中为了得到干燥的 固体,应采用高温烘干
C. 操作1中玻璃棒的作用是引流
D. 第②步中反应的离子方程式为:
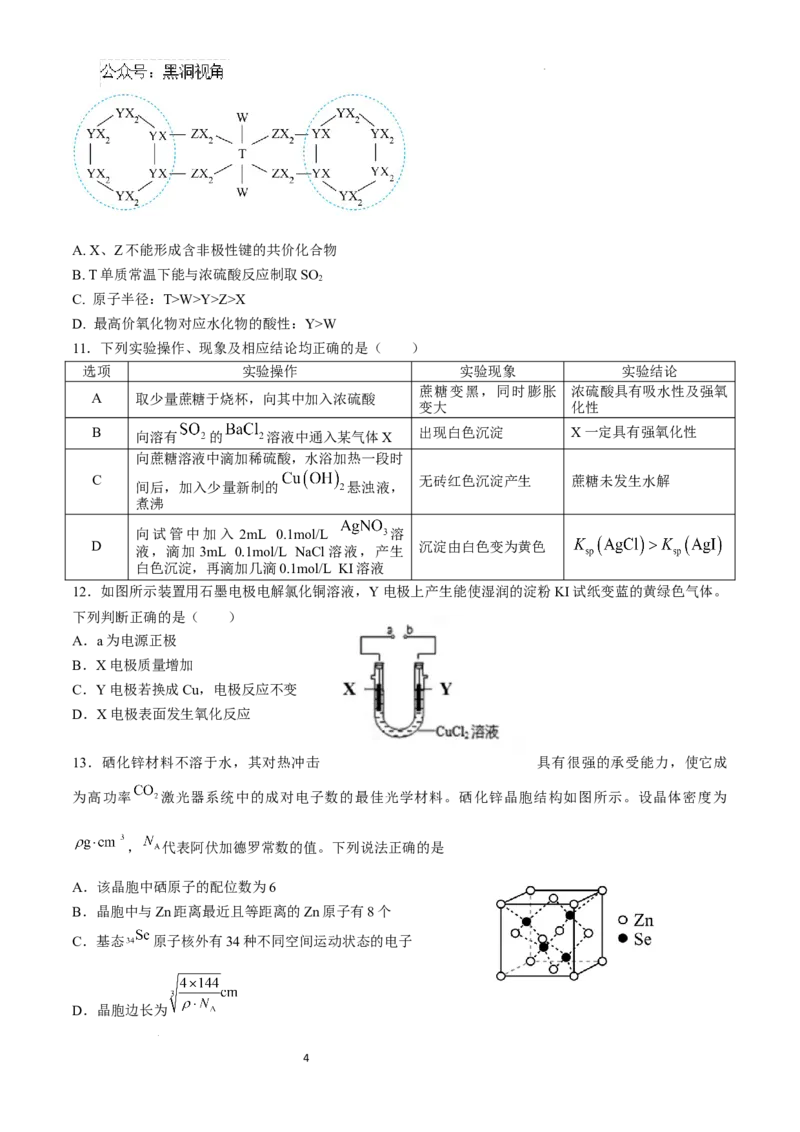
9.部分含铁微粒所带的电荷数与铁元素化合价的关系如图所示,由该图可预测含铁微粒间相互转化时所
需试剂。下列推断不合理的是( )
A.若M为 ,则M在空气中加热可分解得到FeO
B.单质R与浓硫酸必须加热才能持续反应
C.金属阳离子Q可用 溶液检验
D. 与强氧化剂反应制取 需要在碱性条件下进行
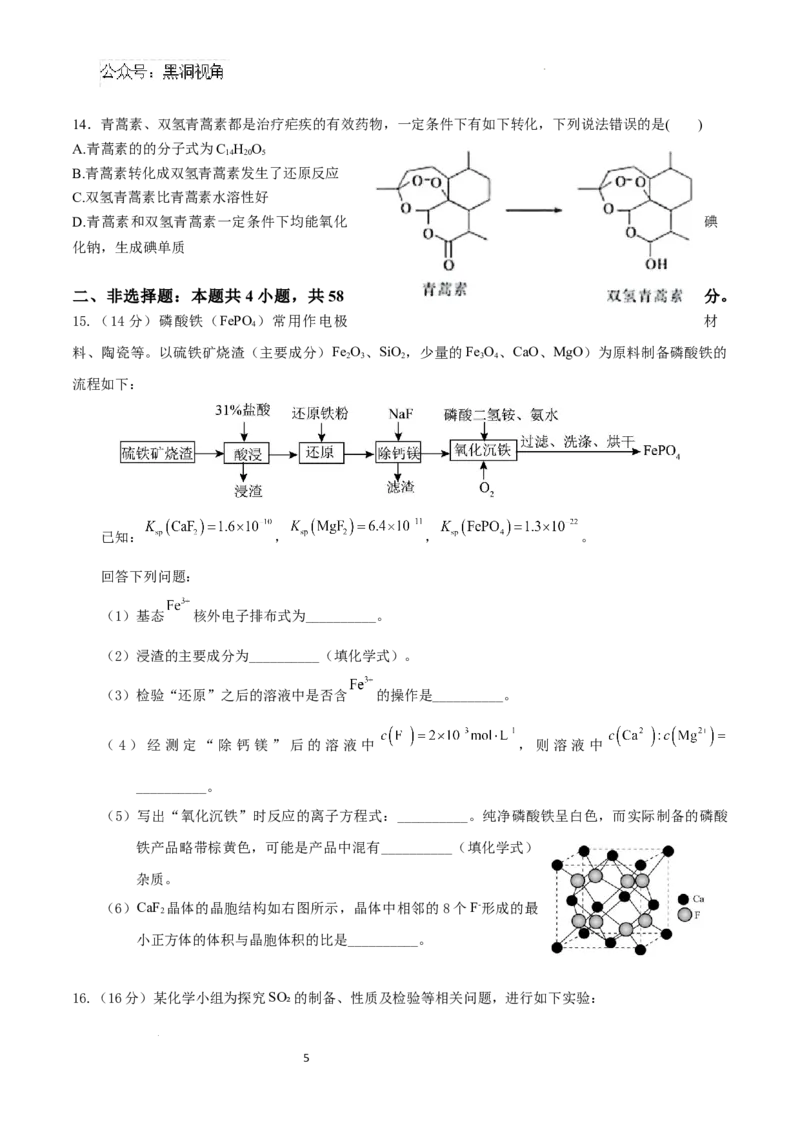
10.原子序数依次增大的前四周期元素X、Y、Z、W、T形成的化合物结构如图所示,其中只有Y和Z位
于同一周期,Z的单质常充入食品包装袋用以防腐,常温下,T单质为紫红色固体。下列说法正确的是(
)
3
学科网(北京)股份有限公司A. X、Z不能形成含非极性键的共价化合物
B. T单质常温下能与浓硫酸反应制取SO
2
C. 原子半径:T>W>Y>Z>X
D. 最高价氧化物对应水化物的酸性:Y>W
11.下列实验操作、现象及相应结论均正确的是( )
选项 实验操作 实验现象 实验结论
蔗糖变黑,同时膨胀 浓硫酸具有吸水性及强氧
A 取少量蔗糖于烧杯,向其中加入浓硫酸
变大 化性
B
向溶有 的 溶液中通入某气体X
出现白色沉淀 X一定具有强氧化性
向蔗糖溶液中滴加稀硫酸,水浴加热一段时
C 无砖红色沉淀产生 蔗糖未发生水解
间后,加入少量新制的 悬浊液,
煮沸
向试管中加入 2mL 0.1mol/L 溶
D 沉淀由白色变为黄色
液,滴加 3mL 0.1mol/L NaCl 溶液,产生
白色沉淀,再滴加几滴0.1mol/L KI溶液
12.如图所示装置用石墨电极电解氯化铜溶液,Y电极上产生能使湿润的淀粉KI试纸变蓝的黄绿色气体。
下列判断正确的是( )
A.a为电源正极
B.X电极质量增加
C.Y电极若换成Cu,电极反应不变
D.X电极表面发生氧化反应
13.硒化锌材料不溶于水,其对热冲击 具有很强的承受能力,使它成
为高功率 激光器系统中的成对电子数的最佳光学材料。硒化锌晶胞结构如图所示。设晶体密度为
, 代表阿伏加德罗常数的值。下列说法正确的是
A.该晶胞中硒原子的配位数为6
B.晶胞中与Zn距离最近且等距离的Zn原子有8个
C.基态 原子核外有34种不同空间运动状态的电子
D.晶胞边长为
4
学科网(北京)股份有限公司14.青蒿素、双氢青蒿素都是治疗疟疾的有效药物,一定条件下有如下转化,下列说法错误的是( )
A.青蒿素的的分子式为C H O
14 20 5
B.青蒿素转化成双氢青蒿素发生了还原反应
C.双氢青蒿素比青蒿素水溶性好
D.青蒿素和双氢青蒿素一定条件下均能氧化 碘
化钠,生成碘单质
二、非选择题:本题共 4小题,共 58 分。
15.(14分)磷酸铁(FePO )常用作电极 材
4
料、陶瓷等。以硫铁矿烧渣(主要成分)Fe O 、SiO ,少量的Fe O 、CaO、MgO)为原料制备磷酸铁的
2 3 2 3 4
流程如下:
已知: , , 。
回答下列问题:
(1)基态 核外电子排布式为__________。
(2)浸渣的主要成分为__________(填化学式)。
(3)检验“还原”之后的溶液中是否含 的操作是__________。
(4)经测定“除钙镁”后的溶液中 ,则溶液中
__________。
(5)写出“氧化沉铁”时反应的离子方程式:__________。纯净磷酸铁呈白色,而实际制备的磷酸
铁产品略带棕黄色,可能是产品中混有__________(填化学式)
杂质。
(6)CaF 晶体的晶胞结构如右图所示,晶体中相邻的8个F-形成的最
2
小正方体的体积与晶胞体积的比是__________。
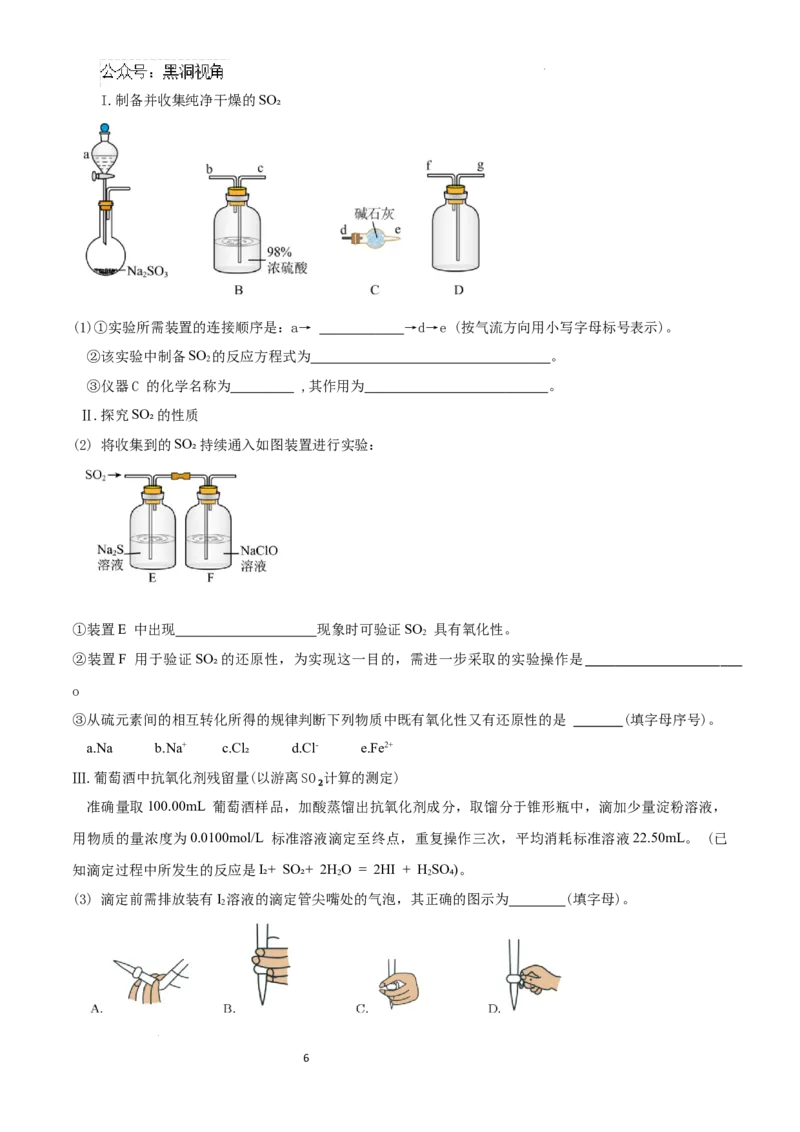
16.(16分)某化学小组为探究SO₂的制备、性质及检验等相关问题,进行如下实验:
5
学科网(北京)股份有限公司I.制备并收集纯净干燥的SO₂
(1)①实验所需装置的连接顺序是:a→ →d→e (按气流方向用小写字母标号表示)。
②该实验中制备SO 的反应方程式为 。
2
③仪器C 的化学名称为 ,其作用为 。
Ⅱ.探究SO₂的性质
(2) 将收集到的SO₂持续通入如图装置进行实验:
①装置E 中出现 现象时可验证SO 具有氧化性。
2
②装置F 用于验证SO₂的还原性,为实现这一目的,需进一步采取的实验操作是
o
③从硫元素间的相互转化所得的规律判断下列物质中既有氧化性又有还原性的是 (填字母序号)。
a.Na b.Na+ c.Cl₂ d.Cl- e.Fe2+
Ⅲ.葡萄酒中抗氧化剂残留量(以游离SO₂计算的测定)
准确量取100.00mL 葡萄酒样品,加酸蒸馏出抗氧化剂成分,取馏分于锥形瓶中,滴加少量淀粉溶液,
用物质的量浓度为0.0100mol/L 标准溶液滴定至终点,重复操作三次,平均消耗标准溶液22.50mL。 (已
知滴定过程中所发生的反应是I₂+ SO₂+ 2HO = 2HI + HSO₄)。
2 2
(3) 滴定前需排放装有I 溶液的滴定管尖嘴处的气泡,其正确的图示为 (填字母)。
2
6
学科网(北京)股份有限公司(4) 判断达到滴定终点的依据是
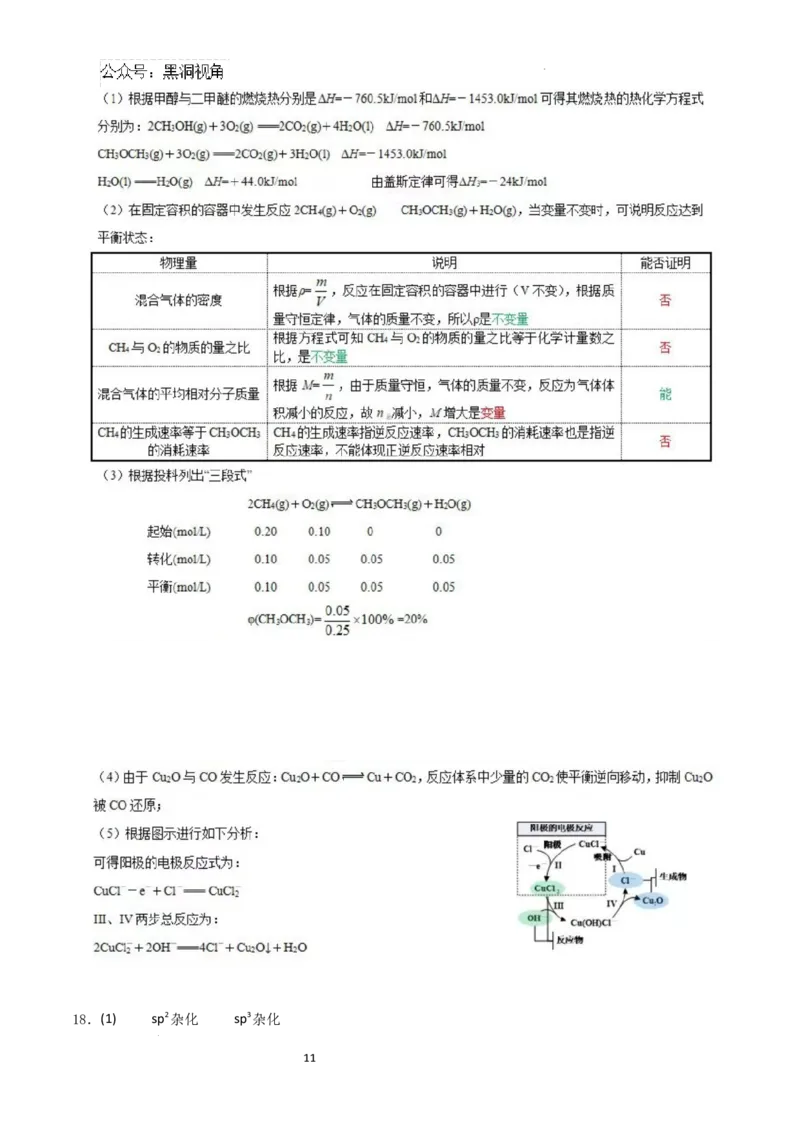
17.(14分)二甲醚又称甲醚,简称DME, 熔点-141.5℃,沸点-24.9℃,与石油液化气相似,被誉为“21世纪
的清洁燃料”。制备原理如下:
(I)由天然气催化制备二甲醚:①2CH(g)+ O(g) CHOCH (g)+ HO(g) △H
4 2 3 3 2 1
(II)由合成气制备二甲醚:②CO(g)+ 2H(g) CHOH(g) △H₂
2 3
③2CH OH(g) CHOCH (g)+ HO(g) △H₃
3 3 3 2
回答下列问题:
(1)若甲醇与二甲醚的燃烧热分别是△H=-760.5kJ/mol和△H=-1453.0kJ/mol;1mol液态水变为气态水要吸
收 44.0kJ的热量。则△H₃= kJ/mol。
(2)一定温度下,在容积固定的密闭容器中按I 制备二甲醚,下列情况能说明反应①达到平衡状态的是
(填序号)。
A.混合气体的密度保持不变
B.CH₄与O₂的物质的量之比保持不变
C.混合气体的平均相对分子质量保持不变
D.CH 的生成速率等于CHOCH₃消耗速率的2倍
4 3
(3)在恒容密闭容器中按原理(I)制备二甲醚,若起始时c(CH₄)=0.20mol/L,c(O₂)=0.10mol/L,平衡时CH 的平
4
衡转化率为50%,则平衡时CHOCH₃的体积分数为 。
3
(4)工业上按原理(II)制备二甲醚时,反应②合成甲醇时常以Cu O作催化剂。研究表明,反应体系中少量
2
CO₂有利于维持催化剂Cu O的量不变,请结合平衡移动原理分析其原因是 _ (写
2
出 相关的化学方程式并辅以必要的文字说明)。
(5)用铜作阳极,钛片作阴极,电解一定浓度的NaCl和 NaOH的混合溶液可得到Cu O,阳极及其溶液中有
2
关转化如图所示。则阳极的电极反应式为 _;溶液中Ⅲ、IV二步总反应的离子方程式
为 。
7
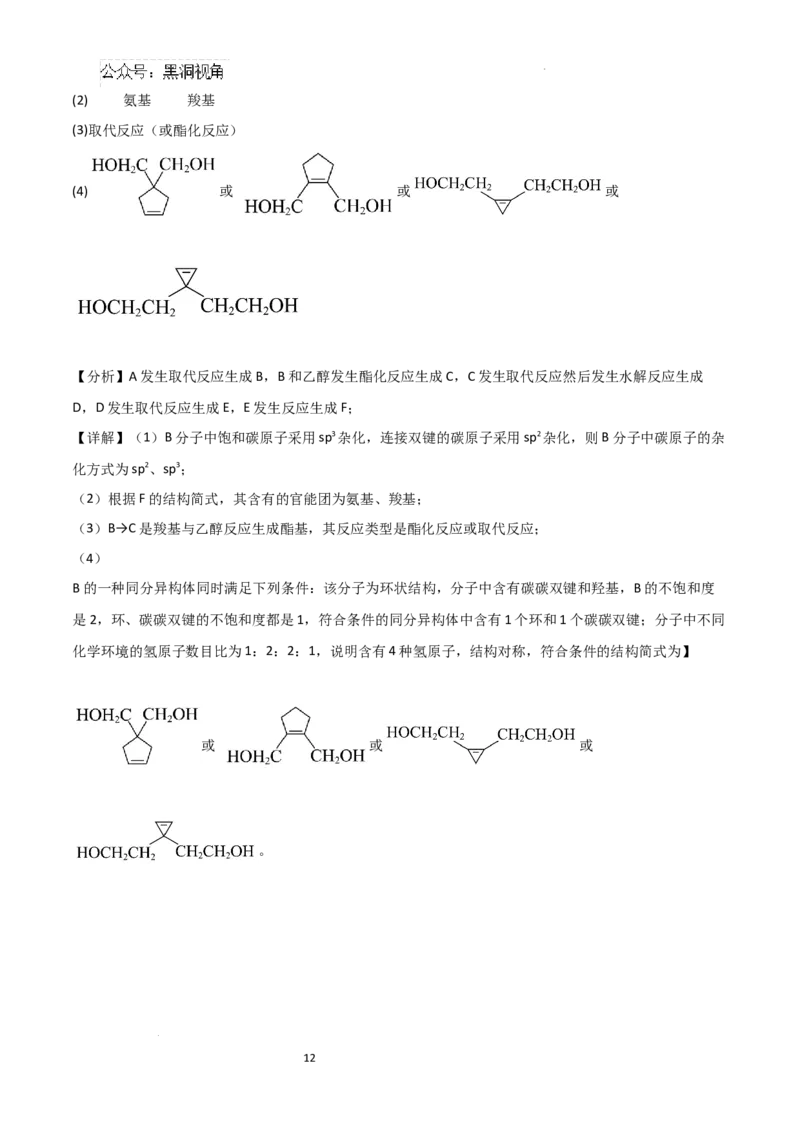
学科网(北京)股份有限公司18.(14分)化合物F(普瑞巴林)是一种治疗神经痛的药物。其合成路线如下:
(1)B分子中碳原子的杂化方式为 、 ;
(2)F中官能团名称是 、 ;
(3)B→C的化学反应类型是 ;B→C的化学反应方程式是
(4)B的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式(只写一种) ;
①该分子为环状结构,分子中含有碳碳双键和羟基;
②分子中不同化学环境的氢原子数目比为1:2:2:1。
区县高中学校25届高三一诊模拟联考
化学参考答案
一、选择题:本题共 14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一
项是符合题目要求的。
题 1 2 3 4 5 6 7
号
答 B A C B D C A
案
题 8 9 10 11 12 13 14
号
答 B A C D B D A
案
15.(除标注外,每空2分,共14分)(1)[Ar]3d5或1s22s22p63s23p63d5(2分)
(2)SiO(2分)
2
8
学科网(北京)股份有限公司(3)取少量溶液于试管中,滴加KSCN溶液,若无明显现象,则无Fe3+(2分);
(4)5:2(2分)
(5) (2分) Fe(OH)(2分)
3
(6) (2分)
16.
9
学科网(北京)股份有限公司17.
10
学科网(北京)股份有限公司18.(1) sp2杂化 sp3杂化
11
学科网(北京)股份有限公司(2) 氨基 羧基
(3)取代反应(或酯化反应)
(4) 或 或 或
【分析】A发生取代反应生成B,B和乙醇发生酯化反应生成C,C发生取代反应然后发生水解反应生成
D,D发生取代反应生成E,E发生反应生成F;
【详解】(1)B分子中饱和碳原子采用sp3杂化,连接双键的碳原子采用sp2杂化,则B分子中碳原子的杂
化方式为sp2、sp3;
(2)根据F的结构简式,其含有的官能团为氨基、羧基;
(3)B→C是羧基与乙醇反应生成酯基,其反应类型是酯化反应或取代反应;
(4)
B的一种同分异构体同时满足下列条件:该分子为环状结构,分子中含有碳碳双键和羟基,B的不饱和度
是2,环、碳碳双键的不饱和度都是1,符合条件的同分异构体中含有1个环和1个碳碳双键;分子中不同
化学环境的氢原子数目比为1:2:2:1,说明含有4种氢原子,结构对称,符合条件的结构简式为】
或 或 或
。
12
学科网(北京)股份有限公司