文档内容
哈三中 2024—2025 学年度上学期
高三学年 10 月月考化学试卷
可能用到的相对原子质量H 1 C 12 N 14 O 16 F 19 Na 23 K 39 Sc 45 Cr 52
Pd 106
I卷(选择题共45分)
一、选择题(每题有一个选项符合题意,1-15题每题3分,共45分)
1.2024年9月20日,华为首款三折叠手机横空出世。以下涉及到的化学知识有错误的是
A.华为公司自主研发的麒麟芯片是业界领先的手机芯片,其基本材料是单晶硅
B.手机屏舍弃前几代使用的无色聚酰亚胺材料,改用超薄柔性玻璃,其中聚酰亚胺属于合成有机高分子材
料
C.使用液晶高分子聚合物(LCP)做天线膜材料,可以提高信号传输速率的同时,降低介电损耗,其中液
晶是介于晶态和液态之间的物质状态
D.内置超冷跨轴石墨烯散热系统,其中12g石墨烯中含有六元环的个数为
2.下列转化中,需要加入氧化剂才能实现的是
A. B. C. D.
3.足量锌和稀硫酸反应,为了加快反应速率又不影响产生氢气的总量,可采用的措施是
A.加硝酸钠固体 B.加醋酸钠固体 C.加硫酸铜固体 D.通入HCl气体
4.下列离子方程式书写正确的是
A.将碳酸氢钙溶液与少量的澄清石灰水混合:
B. 向 硫 酸 铝 钾 溶 液 中 逐 滴 加 入 氢 氧 化 钡 溶 液 , 产 生 沉 淀 的 质 量 最 大 :
C.向次氯酸钠溶液中通入少量 :
D.向酸性KMnO 溶液中加HO 至溶液褪色:
4 2 2
5.设 为阿伏加德罗常数的值,下列说法不正确的是
A.常温常压下 与0.1molHCl充分反应后所得产物含有的分子数为0.1
B.常温常压下, 和 的混合气体中氧原子总数为2
C.100g质量分数为46%的乙醇溶液中,含O-H键的数目为7D.在25℃时,1LpH为2的HSO 溶液中含有H+数目为0.01
2 4
6.已知氰 、硫氰 的化学性质与Cl 类似,被称为“拟卤素”,且阴离子的还原性顺序为
2
。下列说法中不正确的是
A.若 、 发生泄漏,可喷洒石灰水进行处理
B.Cl 与KSCN溶液发生反应的离子方程式为
2
C. 与 溶液能反应,可证明 的还原性大于
D. 加入到NaBr和KSCN的混合溶液中发生反应:
7下列实验操作、现象和解释或结论完全正确的是
选项 实验操作 解释或结论
将含有二氧化硫的气体通入酸性高锰酸钾中,然后加入通过测定白色沉淀的质量,可推算二氧
A
足量氯化钡溶液 化硫的物质的量
pH后者小于前者,C元素的非金属性弱
B 相同温度下,分别测饱和NaHCO 和NaHSO 溶液的pH
3 3 于S元素
实验室用浓硫酸和乙醇制取乙烯,将产生的气体通入溴
C 若溴水褪色,则证明混合气体中有乙烯
水中
向淀粉溶液中加稀硫酸,加热,一段时间后取样,向其若出现砖红色沉淀,则证明淀粉溶液已
D
中加入过量氢氧化钠溶液,再加入新制氢氧化铜,加热 水解
8.下列叙述或数据正确的是
A.室温下用广泛pH试纸测得某氯水的pH=4
B.测定中和反应的反应热时,将碱溶液分批次缓慢倒入酸溶液中
C.酸碱中和滴定测待测液浓度时,装待测液的滴定管水洗后再用待测液润洗2~3次
D.配制溶液时,定容摇匀后,发现液面低于刻度线,再加水至刻度线
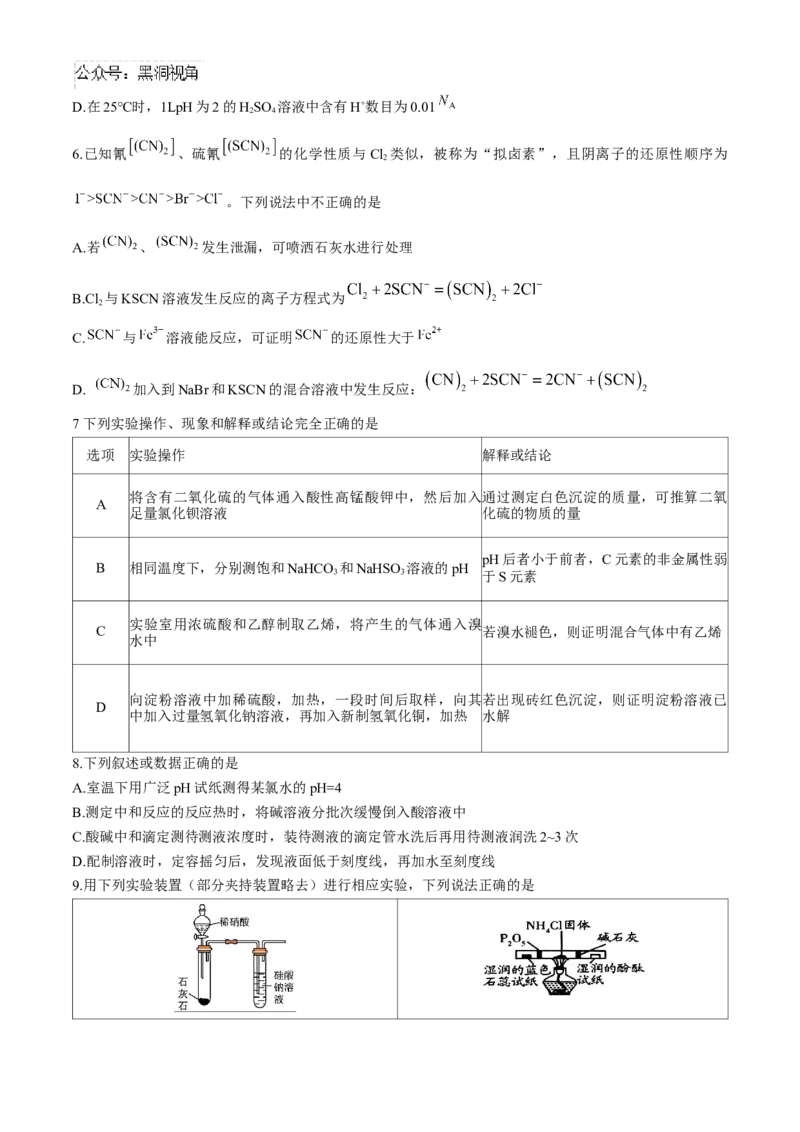
9.用下列实验装置(部分夹持装置略去)进行相应实验,下列说法正确的是A.比较N、C、Si的非金属性强弱 B.利用该装置检验氯化铵受热分解产物
C.Na在空气中加热 D.萃取后从下口放出碘的苯溶液
10.某生物质电池原理如下图所示,充、放电时分别得到高附加值的醇和羧酸。下列说法正确的是
A.放电时,负极电极反应式为:
B.放电时,每当 转化为 ,外电路转移1mol电子
C.充电时,Rh/Cu电极与电源正极相连
D.充电时,K+通过交换膜从右室向左室迁移
11.对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应如下:
,关于该反应下列说法不正确的是
A.X中铜的化合价为+1价,CuSO 仅作氧化剂
4
B. 参加反应时,被CuSO 氧化的P 为3mol
4 4
C.每消耗 时,有12mol电子转移
D.氧化产物和还原产物的物质的量之比为6∶5
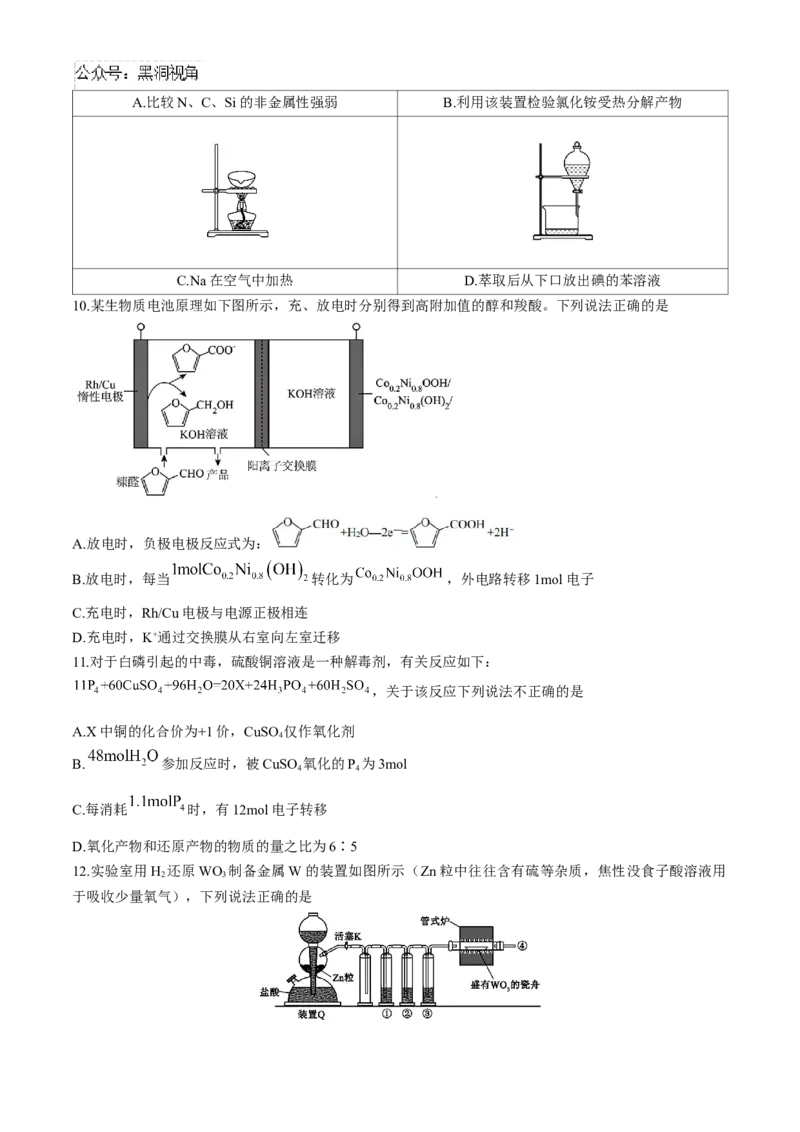
12.实验室用H 还原WO 制备金属W的装置如图所示(Zn粒中往往含有硫等杂质,焦性没食子酸溶液用
2 3
于吸收少量氧气),下列说法正确的是A.管式炉加热前,用试管在④处收集气体并点燃,通过声音判断气体纯度
B.①、②、③中依次盛装KMnO 溶液、浓 、焦性没食子酸溶液
4
C.装置Q(启普发生器)也可用于二氧化锰与浓盐酸反应制备氯气
D.结束反应时,先关闭活塞K,再停止加热
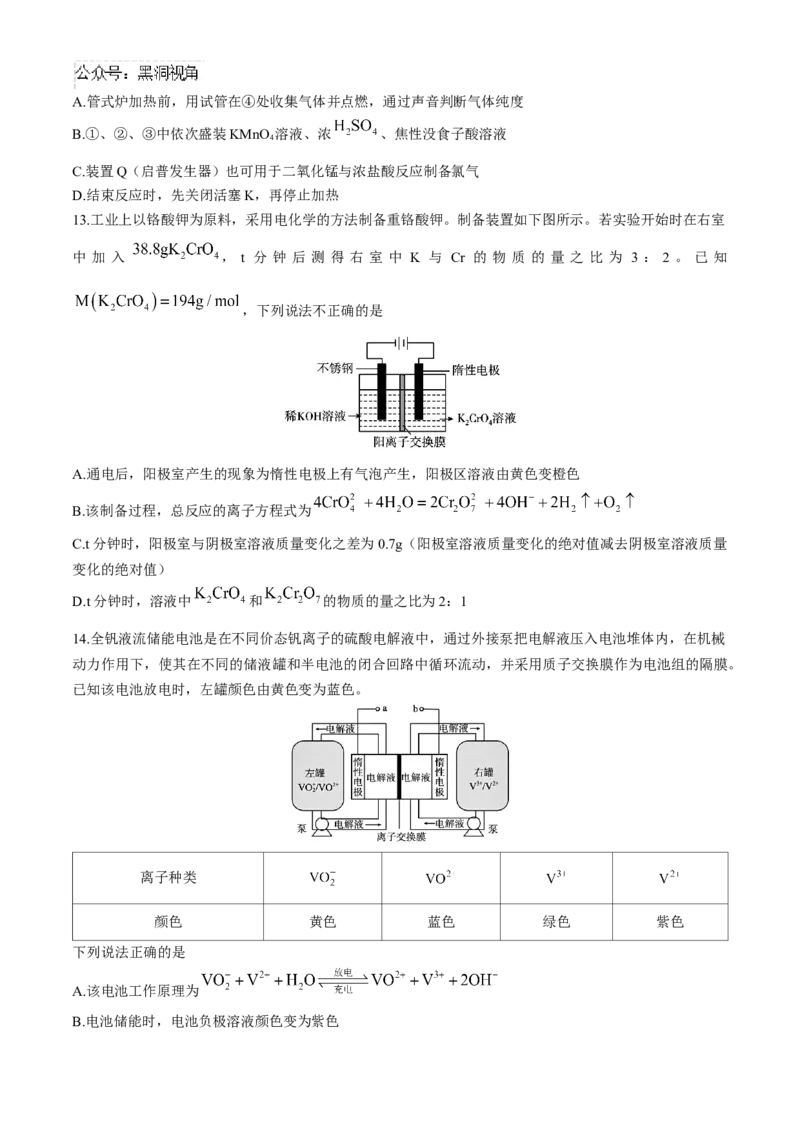
13.工业上以铬酸钾为原料,采用电化学的方法制备重铬酸钾。制备装置如下图所示。若实验开始时在右室
中 加 入 , t 分 钟 后 测 得 右 室 中 K 与 Cr 的 物 质 的 量 之 比 为 3 : 2 。 已 知
,下列说法不正确的是
A.通电后,阳极室产生的现象为惰性电极上有气泡产生,阳极区溶液由黄色变橙色
B.该制备过程,总反应的离子方程式为
C.t分钟时,阳极室与阴极室溶液质量变化之差为0.7g(阳极室溶液质量变化的绝对值减去阴极室溶液质量
变化的绝对值)
D.t分钟时,溶液中 和 的物质的量之比为2:1
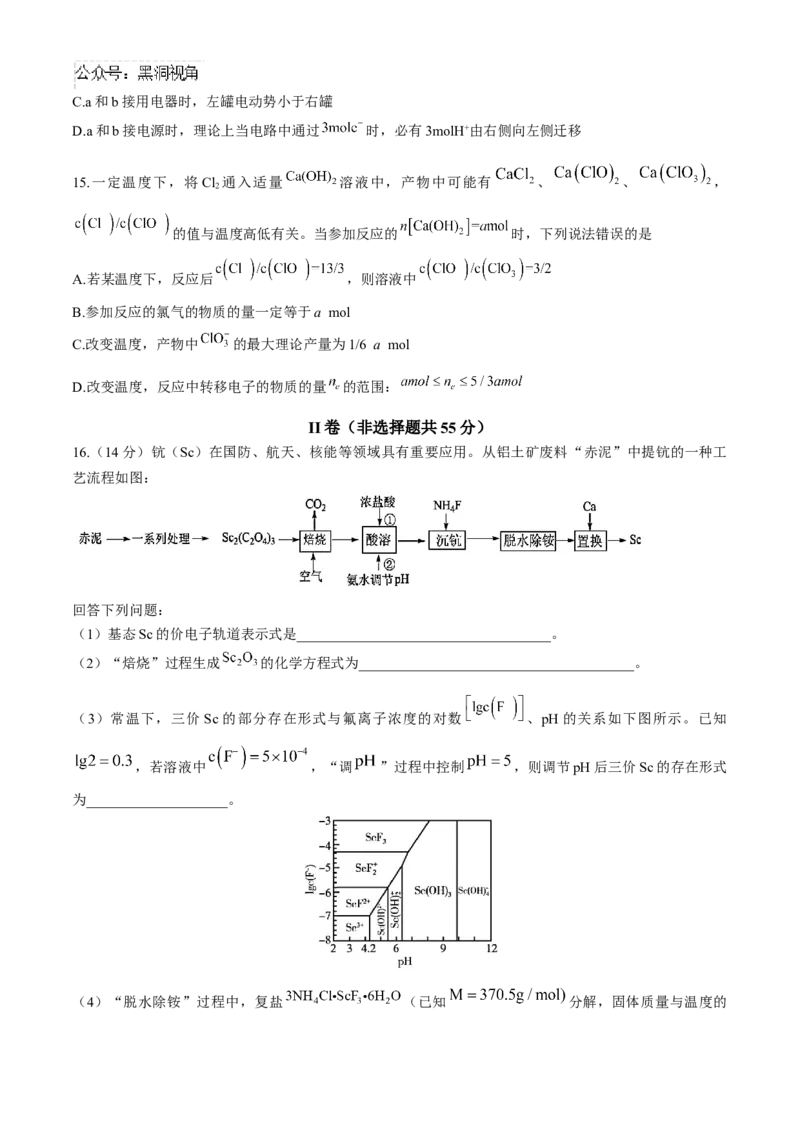
14.全钒液流储能电池是在不同价态钒离子的硫酸电解液中,通过外接泵把电解液压入电池堆体内,在机械
动力作用下,使其在不同的储液罐和半电池的闭合回路中循环流动,并采用质子交换膜作为电池组的隔膜。
已知该电池放电时,左罐颜色由黄色变为蓝色。
离子种类
颜色 黄色 蓝色 绿色 紫色
下列说法正确的是
A.该电池工作原理为
B.电池储能时,电池负极溶液颜色变为紫色C.a和b接用电器时,左罐电动势小于右罐
D.a和b接电源时,理论上当电路中通过 时,必有3molH+由右侧向左侧迁移
15.一定温度下,将 Cl 通入适量 溶液中,产物中可能有 、 、 ,
2
的值与温度高低有关。当参加反应的 时,下列说法错误的是
A.若某温度下,反应后 ,则溶液中
B.参加反应的氯气的物质的量一定等于a mol
C.改变温度,产物中 的最大理论产量为1/6 a mol
D.改变温度,反应中转移电子的物质的量 的范围:
II卷(非选择题共55分)
16.(14分)钪(Sc)在国防、航天、核能等领域具有重要应用。从铝土矿废料“赤泥”中提钪的一种工
艺流程如图:
回答下列问题:
(1)基态Sc的价电子轨道表示式是____________________________________。
(2)“焙烧”过程生成 的化学方程式为_______________________________________。
(3)常温下,三价 Sc的部分存在形式与氟离子浓度的对数 、pH的关系如下图所示。已知
,若溶液中 ,“调 ”过程中控制 ,则调节pH后三价Sc的存在形式
为____________________。
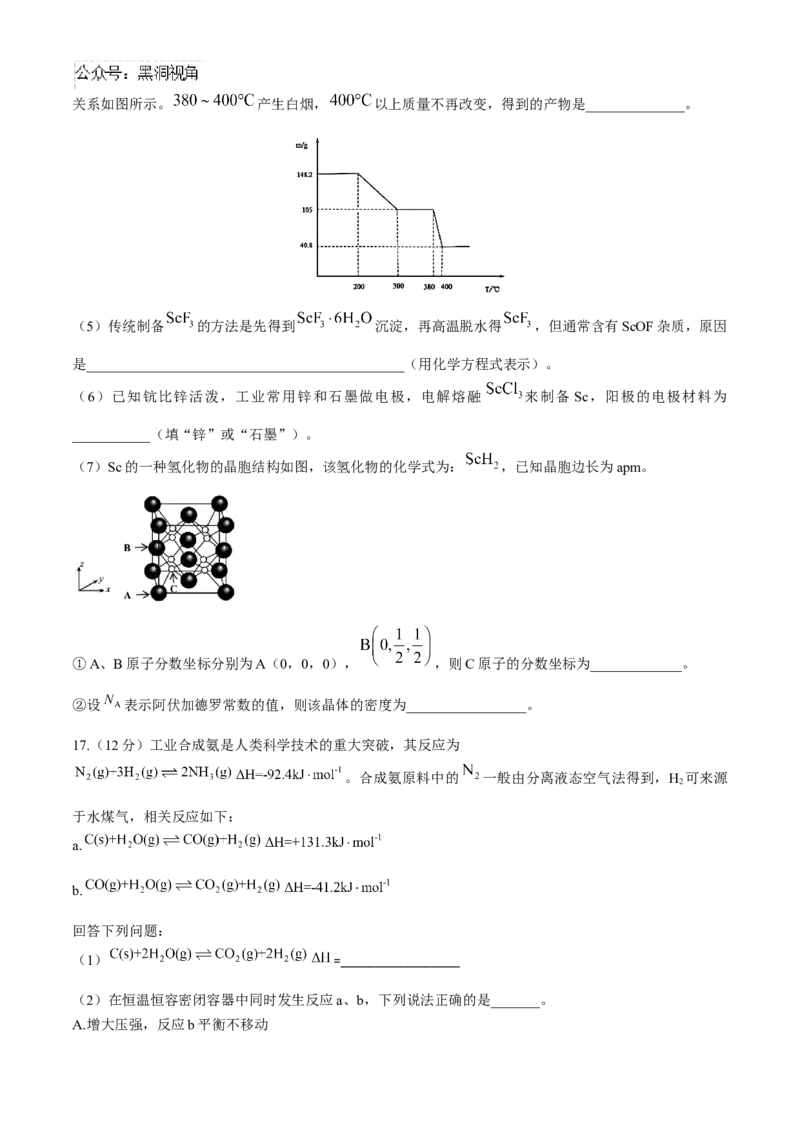
(4)“脱水除铵”过程中,复盐 (已知 分解,固体质量与温度的关系如图所示。 产生白烟, 以上质量不再改变,得到的产物是______________。
(5)传统制备 的方法是先得到 沉淀,再高温脱水得 ,但通常含有ScOF杂质,原因
是_____________________________________________(用化学方程式表示)。
(6)已知钪比锌活泼,工业常用锌和石墨做电极,电解熔融 来制备 Sc,阳极的电极材料为
___________(填“锌”或“石墨”)。
(7)Sc的一种氢化物的晶胞结构如图,该氢化物的化学式为: ,已知晶胞边长为apm。
①A、B原子分数坐标分别为A(0,0,0), ,则C原子的分数坐标为_____________。
②设 表示阿伏加德罗常数的值,则该晶体的密度为_________________。
17.(12分)工业合成氨是人类科学技术的重大突破,其反应为
。合成氨原料中的 一般由分离液态空气法得到,H 可来源
2
于水煤气,相关反应如下:
a.
b.
回答下列问题:
(1) =_________________
(2)在恒温恒容密闭容器中同时发生反应a、b,下列说法正确的是_______。
A.增大压强,反应b平衡不移动B.使用催化剂提高CO平衡转化率
C.混合气体密度保持不变可以认为反应达到平衡状态
D.反应a有非极性键的断裂与形成
(3)实验室模拟合成水煤气,一定温度下在初始压强 p 的恒容密闭容器中加入 2.00molC(s)与
8.00molHO(g)发生反应a、b,在tmin达到平衡时,容器内压强变为1.15p,HO(g)的转化率25.0%,
2 2
平衡时CO的分压为____________,计算反应b的平衡常数 =________( 为用各组分物质的量分数表
示的平衡常数,结果保留2位小数)。
(4)合成氨总反应在起始反应物 时,在不同条件下达到平衡,设体系中 的体积分数为x
( ),在T=400℃下的 、 下的 如图所示,图中对应等压过
程的曲线是______(填“I”或“II”),400℃时 =_______(结果保留2位小数),达到平衡状态后增
大H 投料则H 的平衡转化率______________(填“增大”、“减小”或“不变”)。
2 2
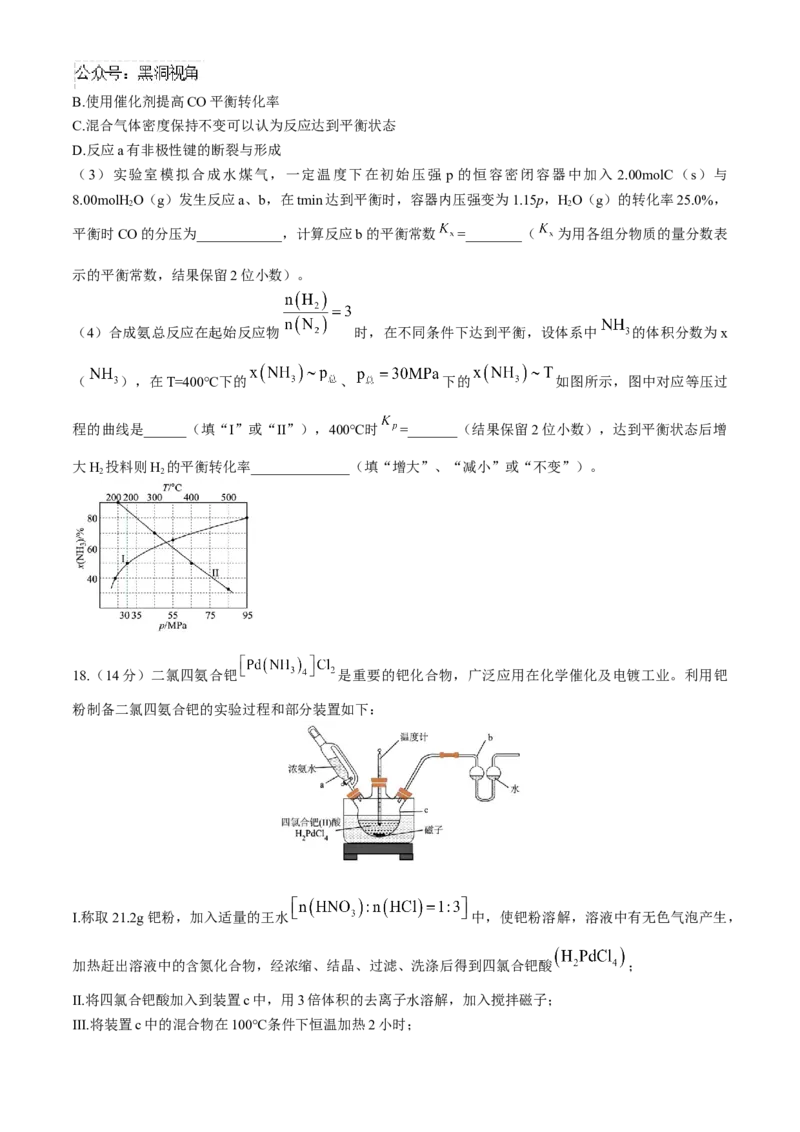
18.(14分)二氯四氨合钯 是重要的钯化合物,广泛应用在化学催化及电镀工业。利用钯
粉制备二氯四氨合钯的实验过程和部分装置如下:
I.称取21.2g钯粉,加入适量的王水 中,使钯粉溶解,溶液中有无色气泡产生,
加热赶出溶液中的含氮化合物,经浓缩、结晶、过滤、洗涤后得到四氯合钯酸 ;
Ⅱ.将四氯合钯酸加入到装置c中,用3倍体积的去离子水溶解,加入搅拌磁子;
Ⅲ.将装置c中的混合物在100℃条件下恒温加热2小时;Ⅳ.在不断搅拌并持续保温下,缓慢加入浓氨水,开始时装置c中产生白烟,溶液内有沉淀产生,继续滴加
浓氨水,溶液逐渐澄清,最后得到浅黄色的 溶液;
V.浅黄色溶液经过一系列操作,得到29.4g纯净的二氯四氨合钯 产品。
已知:二氯四氨合钯 是易溶于水、氨水,不溶于盐酸的淡黄色粉末。室温下
稳定,120℃分解。
回答下列问题:
(1)“步骤I”中溶解钯粉的化学反应方程式为___________________________________。
(2)装置c的仪器名称为__________;装置b的作用为___________。
(3)“步骤Ⅲ”中最佳的加热方式为___________(填选项字母)。
A.酒精灯加热 B.酒精喷灯加热 C.水浴加热 D.油浴加热
(4)装置c中产生的白烟的成分可能为___________。
(5)根据实验分析,比较在题述实验条件下, 、 与钯的配位能力为: _____NH (填“强于”
3
“弱于”或“等于”)。二氯四氨合钯 中配位原子为______。
(6)“步骤V”中的一系列操作为:_________________,过滤、洗涤、50°C真空干燥后得到纯净的二氯
四氨合钯。
(7)本实验中产品产率为___________(保留3位有效数字)。
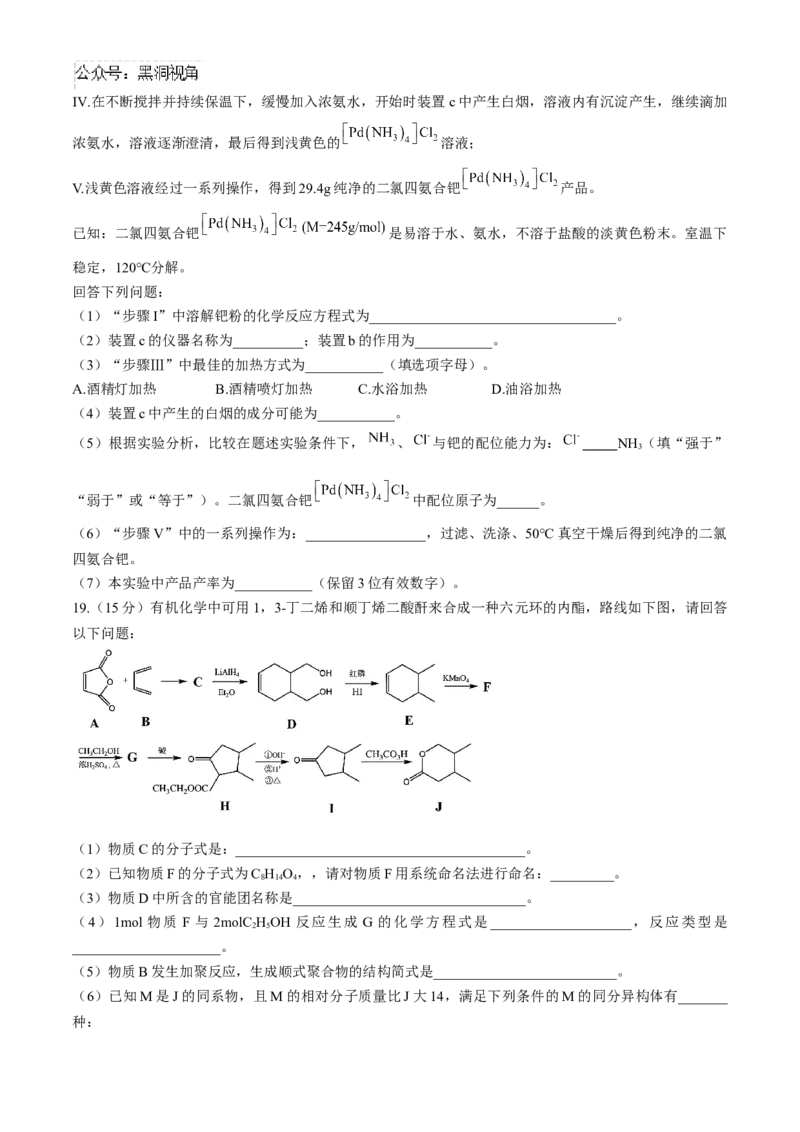
19.(15分)有机化学中可用1,3-丁二烯和顺丁烯二酸酐来合成一种六元环的内酯,路线如下图,请回答
以下问题:
(1)物质C的分子式是:_________________________________________。
(2)已知物质F的分子式为C H O,,请对物质F用系统命名法进行命名:_________。
8 14 4
(3)物质D中所含的官能团名称是_________________________________。
(4)1mol 物质 F 与 2molC HOH 反应生成 G 的化学方程式是____________________,反应类型是
2 5
_____________________。
(5)物质B发生加聚反应,生成顺式聚合物的结构简式是__________________________。
(6)已知M是J的同系物,且M的相对分子质量比J大14,满足下列条件的M的同分异构体有_______
种:①包含六元碳环结构 ②能发生水解反应
其中,六元环上的一氯代物有三种的是:_____________________________。哈三中 2024-2025 学年度上学期
高三学年 10 月月考化学试卷答案
一、选择题(每题有一个选项符合题意,1-15题每题3分,共45分)
1 2 3 4 5 6 7 8 9 10
D D C A A C D C B D
11 12 13 14 15
B A C B C
二、非选择题(除特殊标注外,每空2分,共55分)
16.(14分)(1) (2)
(3)ScF (4)ScF(1分)
3 3
(5)
(6)石墨(1分) (7)① ②
17.(12分)(1)+90.1kJ/mol (2)CD
(3)0.05p或者p/20 0.67 (4)Ⅱ(1分) 减小(1分)
18.(14分)(1)
(2)三颈烧瓶 吸收挥发出来的氨气、氯化氢、HNO(主要)、平衡压强(也给分)
3
(3)D(1分) (4)NH Cl(1分) (5)弱于(1分) N(1分)
4
(6)蒸发浓缩、冷却结晶 (7)60.0%
19.(15分)(1)C HO (2)3,4-二甲基己二酸 (3)碳碳双键,羟基
8 8 3
(4)
取代反应/酯化反应(1分)
(5) (6)7,