文档内容
济宁市实验中学 2022 级高三 10 月月考化学试题
注意事项:
1.本试卷分选择题和非选择题两部分。满分100分,考试时间90分钟。
2.答题前,考生务必将姓名、班级等个人信息填写在答题卡指定位置。
3.考生作答时,请将答案答在答题卡上。选择题每小题选出答案后,用2B铅笔把答题卡上对
应题目的答案标号涂黑;非选择题请用直径0.5毫米黑色墨水签字笔在答题卡上各题的答题
区域内作答。超出答题区域书写的答案无效,在试题卷、草稿纸上作答无效。
可能用到的相对原子质量:H:1 C:12 O:16 Na:23 Cl:35.5 Fe:56
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题目要求。
1. 汉·陈琳《武军赋》:“铠则东胡阙巩,百炼精钢”。下列说法正确的是
A. 钢是合金,合金是指含有两种或两种以上金属的混合物
B. 百炼成钢的过程就是改变生铁中碳含量的过程
C. 铁比铜活泼,铁的发现、大量冶炼和使用均早于铜
的
D. 铁是比较活泼 金属,自然界中不存在游离态的铁
2. 在生活中,化学知识起了重要作用。下列说法正确的是
A. 食品中放入盛有硅胶颗粒的小袋,可以防止食品被氧化
B. “84”消毒液是以NaClO为有效成分的消毒液,与盐酸混合可以提升消毒效果
C. 葡萄酒酿制过程中添加少量 ,起到杀菌抗氧化作用
D. 可以用醋酸和淀粉溶液检验加碘盐中的
3. 镁和铝都是较活泼的金属,下列叙述正确的是
A. 第一电离能:
B. 工业上常通过电解 溶液的方法制取金属
C. 将 溶液蒸干可制得无水
D. 历史上曾用反应: 制铝;现代工业用反应:制铷,所以活动性:
4. 物质的性质决定其用途,下列有关物质性质和应用的关系正确的是
A. SiO 是酸性氧化物,能用氢氟酸(HF)雕刻玻璃
2
B. 碳酸氢铵受热易分解,可用作植物生长的肥料
C. 钠能与水剧烈反应,可用作95%乙醇的强除水剂
D. BeO熔点高,可用作耐火材料
5. 下列反应原理中,不符合工业冶炼金属实际情况的是
A. B.
C. D.
6. 金属及其化合物转化关系是化学学习的重要内容之一。下列各组物质的转化关系中不全部是通过一步反
应完成的是
A. Na→NaOH→Na CO→NaCl B. Al→Al O→Al(OH) →A1Cl
2 3 2 3 3 3
C. Mg→MgCl →Mg(OH) →MgSO D. Fe→Fe(NO )→Fe (OH) →Fe O
2 2 4 3 3 3 2 3
7. “褪色”是高中化学实验中一种常见且重要的现象。以下实验中的“褪色”现象与所得结论相匹配的是
选
实验操作 结论
项
A 向滴有酚酞的 溶液中通入Cl Cl 具有漂白性
2 2
B 向酸性 液中滴入乙醇 乙醇具有还原性
C 向滴有碘水的淀粉溶液中通入SO SO 具有漂白性
2 2
D 向 与 的混合溶液中加入铁粉 比 更易与 配位
A. A B. B C. C D. D
8. 根据海水综合利用的工业流程图,判断下列说法正确的是已知: 受热生成 和HCl气体等。
A. 过程①的除杂试剂先后顺序及操作是 、 、稀盐酸,过滤、蒸发结晶
B. 在过程③中将 灼烧即可制得无水
C. 过程⑤反应后溶液呈强酸性,生产中需解决其对设备的腐蚀问题
D. 在过程④、⑥反应中每氧化0.4mol 需消耗4.48L
9. 下列关于实验室制取SO 的实验,其中叙述正确的是
2
A. 甲图中可利用浓硫酸和铜单质制取SO
2
B. 乙图中干燥SO
2
C. 可用丙图中装置和药品收集二氧化硫并吸收尾气
的
D. 不可用丁图中装置和药品检验铜和浓硫酸反应生成 CuSO
4
10. 侯氏制碱法原理是:NH +H O+CO+NaCl=NaHCO ↓+NHCl,析出碳酸氢钠,下列实验关于实验装置
3 2 2 3 4
及原理设计说法不合理的是
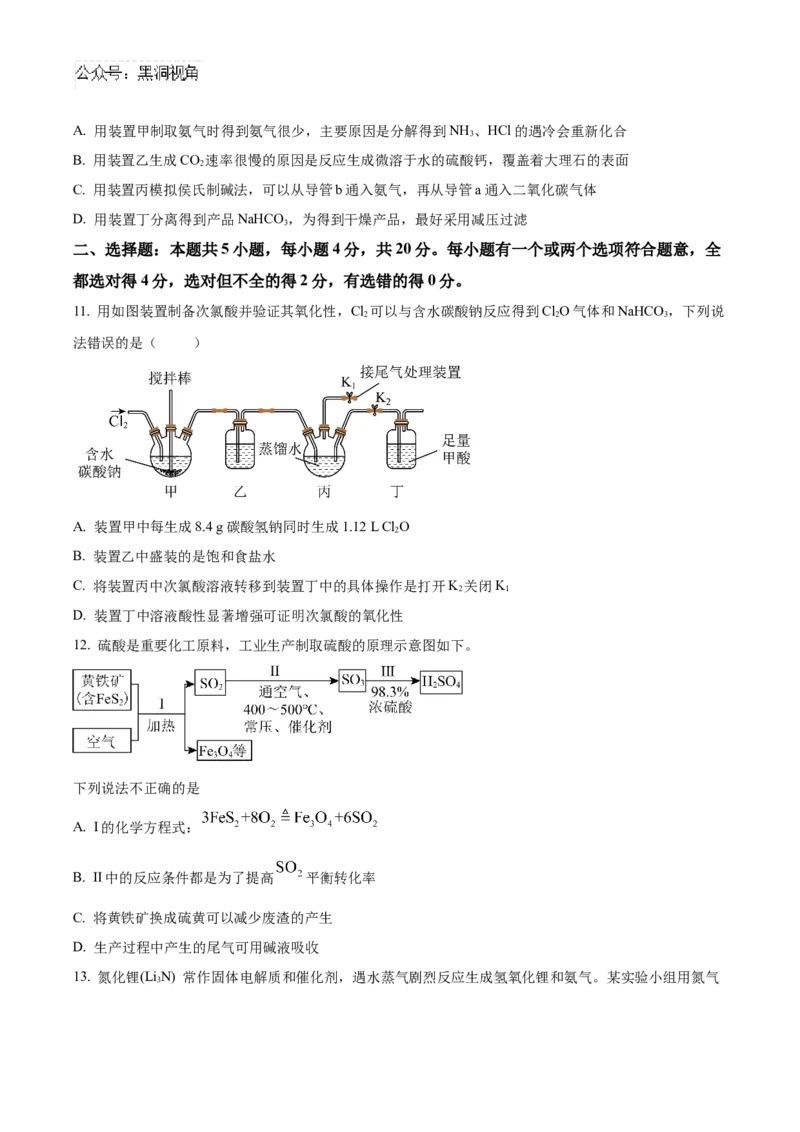
甲 乙 丙 丁A. 用装置甲制取氨气时得到氨气很少,主要原因是分解得到NH 、HCl的遇冷会重新化合
3
B. 用装置乙生成CO 速率很慢的原因是反应生成微溶于水的硫酸钙,覆盖着大理石的表面
2
C. 用装置丙模拟侯氏制碱法,可以从导管b通入氨气,再从导管a通入二氧化碳气体
D. 用装置丁分离得到产品NaHCO ,为得到干燥产品,最好采用减压过滤
3
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全
都选对得4分,选对但不全的得2分,有选错的得0分。
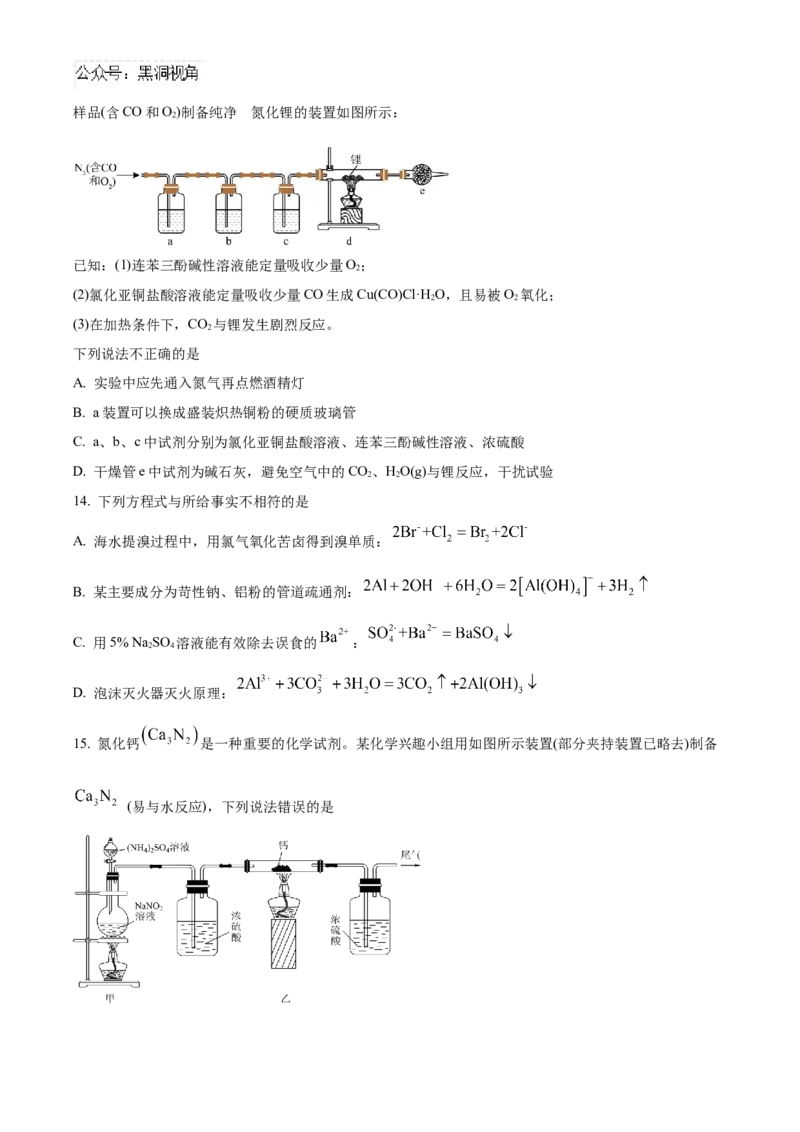
11. 用如图装置制备次氯酸并验证其氧化性,Cl 可以与含水碳酸钠反应得到ClO气体和NaHCO ,下列说
2 2 3
法错误的是( )
A. 装置甲中每生成8.4 g碳酸氢钠同时生成1.12 L Cl O
2
B. 装置乙中盛装的是饱和食盐水
C. 将装置丙中次氯酸溶液转移到装置丁中的具体操作是打开K 关闭K
2 1
D. 装置丁中溶液酸性显著增强可证明次氯酸的氧化性
12. 硫酸是重要化工原料,工业生产制取硫酸的原理示意图如下。
下列说法不正确的是
A. I的化学方程式:
B. Ⅱ中的反应条件都是为了提高 平衡转化率
C. 将黄铁矿换成硫黄可以减少废渣的产生
D. 生产过程中产生的尾气可用碱液吸收
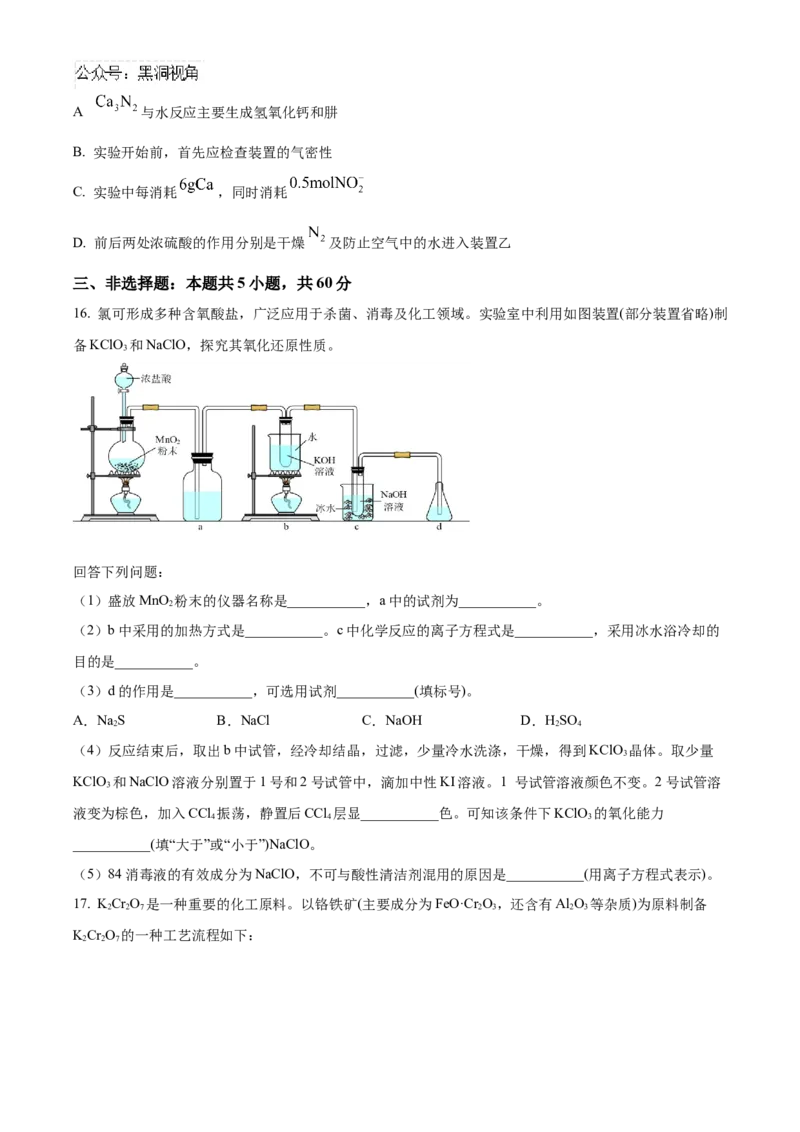
13. 氮化锂(Li N) 常作固体电解质和催化剂,遇水蒸气剧烈反应生成氢氧化锂和氨气。某实验小组用氮气
3的
样品(含CO和O)制备纯净 氮化锂的装置如图所示:
2
已知:(1)连苯三酚碱性溶液能定量吸收少量O;
2
(2)氯化亚铜盐酸溶液能定量吸收少量CO生成Cu(CO)Cl·H O,且易被O 氧化;
2 2
(3)在加热条件下,CO 与锂发生剧烈反应。
2
下列说法不正确的是
A. 实验中应先通入氮气再点燃酒精灯
B. a装置可以换成盛装炽热铜粉的硬质玻璃管
C. a、b、c中试剂分别为氯化亚铜盐酸溶液、连苯三酚碱性溶液、浓硫酸
D. 干燥管e中试剂为碱石灰,避免空气中的CO、HO(g)与锂反应,干扰试验
2 2
14. 下列方程式与所给事实不相符的是
A. 海水提溴过程中,用氯气氧化苦卤得到溴单质:
B. 某主要成分为苛性钠、铝粉的管道疏通剂:
C. 用5% Na SO 溶液能有效除去误食的 :
2 4
D. 泡沫灭火器灭火原理:
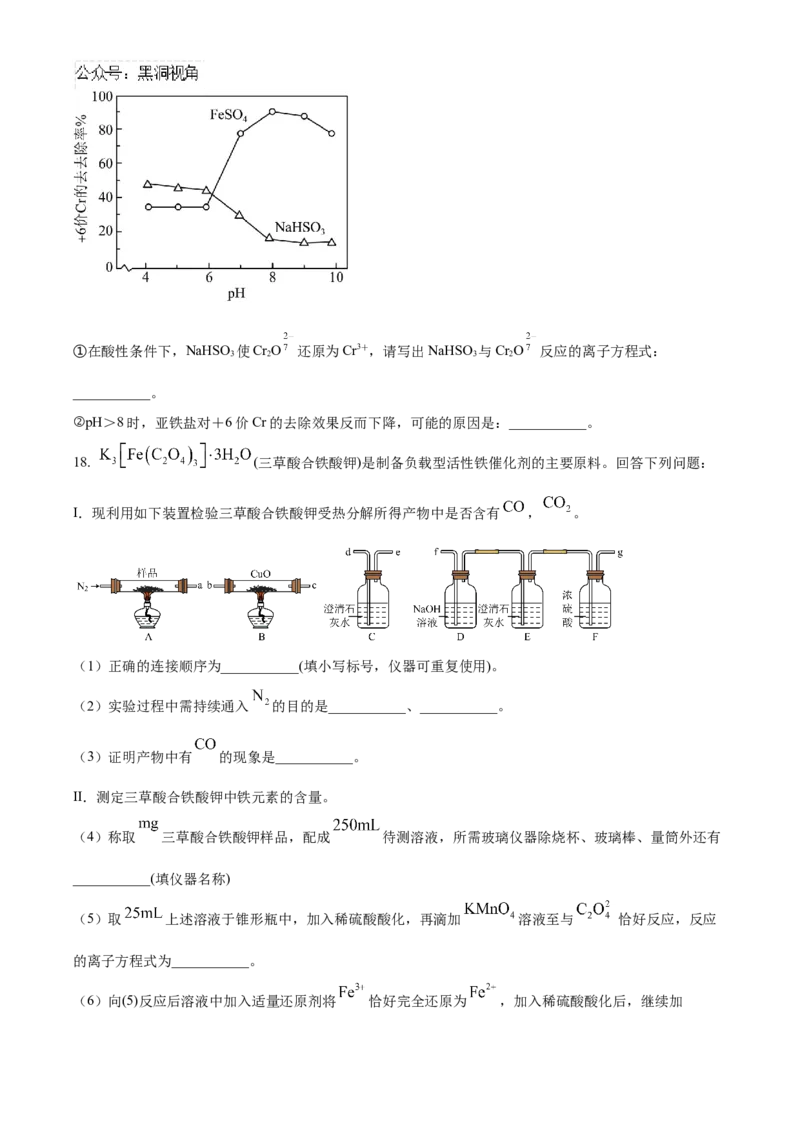
15. 氮化钙 是一种重要的化学试剂。某化学兴趣小组用如图所示装置(部分夹持装置已略去)制备
(易与水反应),下列说法错误的是.
A 与水反应主要生成氢氧化钙和肼
B. 实验开始前,首先应检查装置的气密性
C. 实验中每消耗 ,同时消耗
D. 前后两处浓硫酸的作用分别是干燥 及防止空气中的水进入装置乙
三、非选择题:本题共5小题,共60分
16. 氯可形成多种含氧酸盐,广泛应用于杀菌、消毒及化工领域。实验室中利用如图装置(部分装置省略)制
备KClO 和NaClO,探究其氧化还原性质。
3
回答下列问题:
(1)盛放MnO 粉末的仪器名称是___________,a中的试剂为___________。
2
(2)b中采用的加热方式是___________。c中化学反应的离子方程式是___________,采用冰水浴冷却的
目的是___________。
(3)d的作用是___________,可选用试剂___________(填标号)。
A.NaS B.NaCl C.NaOH D.HSO
2 2 4
(4)反应结束后,取出b中试管,经冷却结晶,过滤,少量冷水洗涤,干燥,得到KClO 晶体。取少量
3
KClO 和NaClO溶液分别置于1号和2号试管中,滴加中性KI溶液。1 号试管溶液颜色不变。2号试管溶
3
液变为棕色,加入CCl 振荡,静置后CCl 层显___________色。可知该条件下KClO 的氧化能力
4 4 3
___________(填“大于”或“小于”)NaClO。
(5)84消毒液的有效成分为NaClO,不可与酸性清洁剂混用的原因是___________(用离子方程式表示)。
17. KCr O 是一种重要的化工原料。以铬铁矿(主要成分为FeO·Cr O,还含有Al O 等杂质)为原料制备
2 2 7 2 3 2 3
KCr O 的一种工艺流程如下:
2 2 7已知:(a)Cr O +HO 2CrO +2H+
2 2
(b)不同温度下各物质的溶解度:
物质 KCl NaCl KCr O NaCr O
2 2 7 2 2 7
溶解度(g/100g H O) 0 ℃ 28 35.7 4.7 163
2
40 ℃ 40.1 36.4 26.3 215
80 ℃ 51.3 38 70 376
(c)步骤①的主要反应为:2FeO·Cr O+4NaCO+7NaNO 4NaCrO+Fe O+4CO↑+7NaNO
2 3 2 3 3 2 4 2 3 2 2。
(1)“滤渣1”和“滤渣2”的主要成分分别是___________、___________(填化学式)。写出步骤③的离子反应
方程式___________;步骤④中调pH,以下试剂可选用___________(填标号)。
a.NH B.KOH C.CHCOOH D.HCl
3 3
(2)在步骤⑤中加入适量KCl,___________,过滤得到KCr O 固体。
2 2 7
(3)某工厂用a kg铬铁矿粉(含Cr O 40%)制KCr O,最终得到产品b kg,产率为___________×100%(列
2 3 2 2 7
计算式)。
(4)化学还原法可除去废水中的Cr O ,取含Cr O 的模拟水样在不同pH条件下,分别向每个水样中
2 2
加一定量的FeSO 、NaHSO,搅拌,充分反应,然后滴加Ca(OH) 悬浊液,静置沉淀,测定+6价Cr的去
4 3 2
除率,实验结果如图所示。①在酸性条件下,NaHSO 使Cr O 还原为Cr3+,请写出NaHSO 与Cr O 反应的离子方程式:
3 2 3 2
___________。
②pH>8时,亚铁盐对+6价Cr的去除效果反而下降,可能的原因是:___________。
18. (三草酸合铁酸钾)是制备负载型活性铁催化剂的主要原料。回答下列问题:
Ⅰ.现利用如下装置检验三草酸合铁酸钾受热分解所得产物中是否含有 , 。
(1)正确的连接顺序为___________(填小写标号,仪器可重复使用)。
(2)实验过程中需持续通入 的目的是___________、___________。
(3)证明产物中有 的现象是___________。
Ⅱ.测定三草酸合铁酸钾中铁元素的含量。
(4)称取 三草酸合铁酸钾样品,配成 待测溶液,所需玻璃仪器除烧杯、玻璃棒、量筒外还有
___________(填仪器名称) 。
(5)取 上述溶液于锥形瓶中,加入稀硫酸酸化,再滴加 溶液至与 恰好反应,反应
的离子方程式为___________。
(6)向(5)反应后溶液中加入适量还原剂将 恰好完全还原为 ,加入稀硫酸酸化后,继续加溶液时恰好与 反应。晶体中铁元素的质量分数表达式为___________。
19. 三星堆出土的金面具等金制品揭示了人类古文明对黄金的使用。
Ⅰ.金的结构与性质
(1)金的价电子排布为 ,它在周期表中的位置为_______。
(2)金面具的制作过程包含了淘金、冶金、铸金、锤鍱等工艺,以下金的性质中,与其金属键有关的是
_______(填字母)
A. 有金属光泽 B. 有较高的熔点 C. 有很好的延展性 D. 有良好的导电性
Ⅱ.金的冶炼
(3)金的化学性质很稳定,单独用浓盐酸或浓硝酸均不能将金溶解,但将浓硝酸与浓盐酸按体积比 配
制成王水,则可以溶解金,发生的反应如下: 。
①王水溶金过程中,硝酸的作用是_______。
②盐酸的作用是:提供 与生成的 配位,降低了 浓度,提高 的还原性。
③ 可被浓硝酸轻易溶解,但王水溶解 的效果却不好,原因可能是_______。
④ 可用 粉还原,完成“沉金”。 被 完全还原时,消耗 的物质的量是
_______ 。
(4)在碱性条件下用 溶液也可溶金。(已知: 是一种易挥发的弱酸。)
①补全 溶液溶金反应的离子方程式:_______。② 中配位原子是C,结合电子式说明C可以作为配位原子的原因:_______。
③已知 的氧化性随溶液酸性的增强而增强。工业上常选 的 溶液进行溶金,不选更低
的原因可能是_______(写出一种即可)。
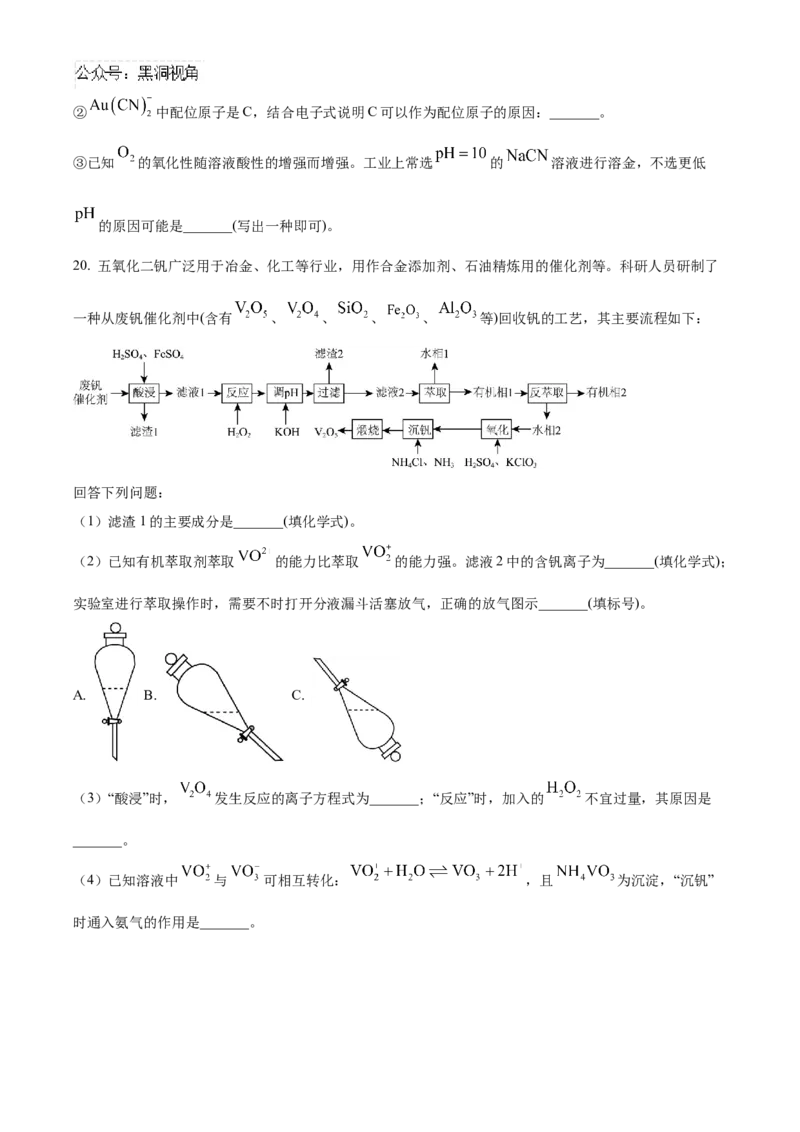
20. 五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、石油精炼用的催化剂等。科研人员研制了
一种从废钒催化剂中(含有 、 、 、 、 等)回收钒的工艺,其主要流程如下:
回答下列问题:
(1)滤渣1的主要成分是_______(填化学式)。
(2)已知有机萃取剂萃取 的能力比萃取 的能力强。滤液2中的含钒离子为_______(填化学式);
实验室进行萃取操作时,需要不时打开分液漏斗活塞放气,正确的放气图示_______(填标号)。
A. B. C.
(3)“酸浸”时, 发生反应的离子方程式为_______;“反应”时,加入的 不宜过量,其原因是
_______。
(4)已知溶液中 与 可相互转化: ,且 为沉淀,“沉钒”
时通入氨气的作用是_______。