文档内容
南昌市三校(一中、十中、铁一中)高三上学期第一次联考
化 学 试 卷
考试时长:75分钟 试卷总分100分
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 P-31 Cl-35.5
Zn-65 Se-79
一、单选题(本大题共15小题,共45.0分)
1.化学与社会发展和人类进步息息相关。下列说法错误的是
A.华为Mate60pro系列“争气机”的芯片材料主要为晶体硅
B. 福尔马林能使蛋白质变性,可用于浸制动物标本
C. 高压钠灯发出的黄光透雾能力强、射程远,可用于道路照明
D. “发现和合成量子点”成为2023年诺贝尔化学奖的主题。碳量子点通常是由无定型和晶态的碳核组
成,在碳核表面含有不同的含氧官能团,它与石墨互为同素异形体。
2.近期,中科大的研究团队发明了一种“同位素指纹”方法,可以用于食品溯源。化学元素锶位于周期
表第ⅡA族,在自然界中有4种稳定的同位素,其中“锶87”和“锶86”在不同地质环境中的相对含
量不同,而这种同位素特征又会通过水和食物传递到生物体内,因此,锶同位素检测可以作为追踪大
闸蟹地理起源的可靠方法。下列有关说法正确的是
A.
87Sr中的中子数为38
38
B. Sr元素位于周期的ds区
C. 同周期中第一电离能比Sr小的元素只有1种
D. 根据元素周期律推测Sr(OH) 是一种强碱
2
3.下列过程涉及的化学反应相应的离子方程式正确的是
A.向碘化亚铁溶液中滴加少量稀硝酸:
B.等浓度等体积的 溶液和HCl溶液混合:
C.硅酸钠溶液中通入足量二氧化碳:
D.向N H Fe(SO ) 溶液中加入过量Ba(OH) 溶液:
4 4 2 2
Fe3++2SO2−+2Ba2++3OH−=Fe(OH) ↓+2BaSO ↓
4 3 4
4. 为阿伏加德罗常数的值,下列说法正确的是
A. 将0.5 mol乙烯通入足量溴的CCl 溶液中充分反应,生成C-Br键的数目为1 N
4 A
B. 标准状况下,22.4LCl 与过量的水充分反应,转移电子数为N
2 A
C. 常温下,pH=2的亚硫酸溶液中含有的H+数目为0.01 NA
高三化学三校联考试卷 第1页,共8页
学科网(北京)股份有限公司D. 等物质的量的 和 , 的质子数比 多
5.使用Zn-Mn双原子电催化剂,可以实现以 、 和水为前驱体制得尿素CO(NH ) ,其中有关
2 2
表述错误的是
A.Mn元素位于周期表的第VIIB族
B. 中的共价键类型: 键和 键
C. 的电子式:
D.尿素的空间填充模型:
6.下列实验操作及现象推出的相应结论正确的是
选项 实验操作 现象 结论
向Na S与Na SO 的混合溶液中加入 Na S 与 Na SO 之间发生
A 2 2 3 溶液变浑浊 2 2 3
硝酸 了氧化还原反应
取二氧化硅与少量焦炭,在高温条件
B 产生灰黑色固体 非金属性:
下反应
取少量某铁的氧化物完全溶于盐酸, 该氧化物中不存在
C 没有出现血红色
再滴加KSCN溶液 三价铁
用大理石和稀盐酸反应制取CO,
D 2 溶液变浑浊 酸性:碳酸>苯酚
气体通入苯酚钠溶液中
7.羟甲香豆素(丙)是一种治疗胆结石的药物,部分合成路线如图所示。下列说法不正确的是
A.甲分子中含有1个手性碳原子
B.过程①为取代反应
C.常温下1mol乙最多与含3molNaOH的水溶液完全反应
D.1mol丙与足量溴水反应时,消耗Br 的物质的量为4mol
2
8.查阅资料得知MnO +NaBr+H SO Na SO +MnSO +Br ↑+H O(未配平)。某兴趣小组的同学利用如图
2 2 4 → 2 4 4 2 2
所示的装置探究苯与液溴的反应类型。下列说法正确的是
高三化学三校联考试卷 第2页,共8页
学科网(北京)股份有限公司A.实验装置的连接顺序为c→a→d→b,b中产生淡黄色沉淀,证明苯与液溴发生的是取代反应
B.装置c中发生反应的还原剂与氧化剂物质的量之比为2∶1
C.装置d中仪器G的名称为直形冷凝管
D.反应后装置d中混合液经碱洗、分液后,上层液体蒸馏得到溴苯
9.利用辉锑矿(主要成分为 ,含Fe O 、MgO、 等杂质)为原料制备SbOCl的工艺流程如图所
2 3
示。已知:还原性: 。
下列说法正确的是
A.“溶浸”中浸出渣的成分只有
B.“还原”加入Sb的目的是将 还原为Fe
C.“水解”时发生的主要反应为:
D.“水解”时可采用边加热、边通空气搅拌的形式促进 的水解
10.前四周期元素X、Y、Z、W、Q的原子序数依次增大,基态X原子核外电子占据两种形状不同的原
子轨道,且两种轨道中电子总数相等,Q与X处于同一主族,Y周期序数与其主族序数相等,Z的第二
电离能远小于第三电离能,W的一种氧化物常用于红色涂料。下列说法正确的是
A.电负性:
B.Y、Z、W工业冶炼的方法相同
C.Z的氯化物是工业漂白粉的有效成分
D.QX 的键角小于QX 的键角
2 3
11.证实证伪是化学学科需要的重要证据推理意识。已知:正高碘 酸(结构
高三化学三校联考试卷 第3页,共8页
学科网(北京)股份有限公司如图所示)是一种五元弱酸,具有强氧化性,脱水可得偏高碘酸( ),下列说法一定正确的是
A. 溶液一定显碱性
B.正高碘酸中心原子的杂化方式为sp3杂化
C.正高碘酸与 反应后溶液呈紫红色,反应如下:
D.正高碘酸隔绝空气加热分解仅生成 、
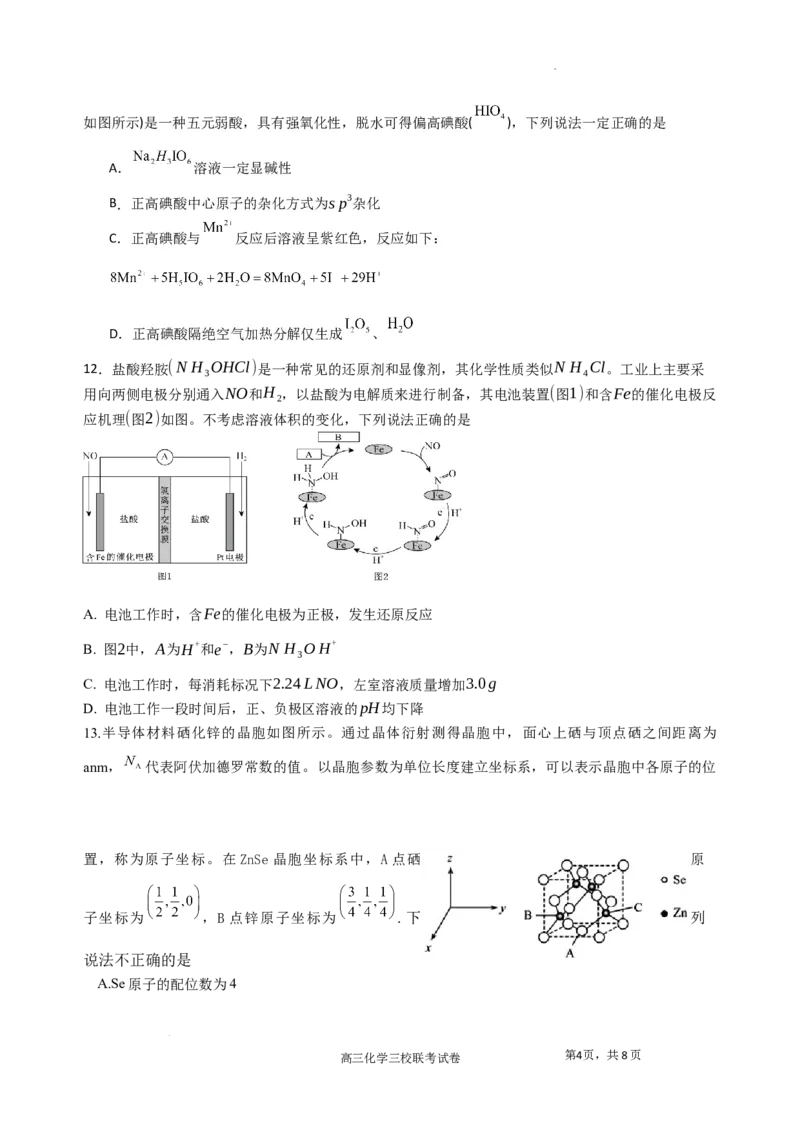
12.盐酸羟胺(N H OHCl)是一种常见的还原剂和显像剂,其化学性质类似N H Cl。工业上主要采
3 4
用向两侧电极分别通入NO和H ,以盐酸为电解质来进行制备,其电池装置(图1)和含Fe的催化电极反
2
应机理(图2)如图。不考虑溶液体积的变化,下列说法正确的是
A. 电池工作时,含Fe的催化电极为正极,发生还原反应
B. 图2中,A为H+和e−,B为N H OH+
3
C. 电池工作时,每消耗标况下2.24LNO,左室溶液质量增加3.0g
D. 电池工作一段时间后,正、负极区溶液的pH均下降
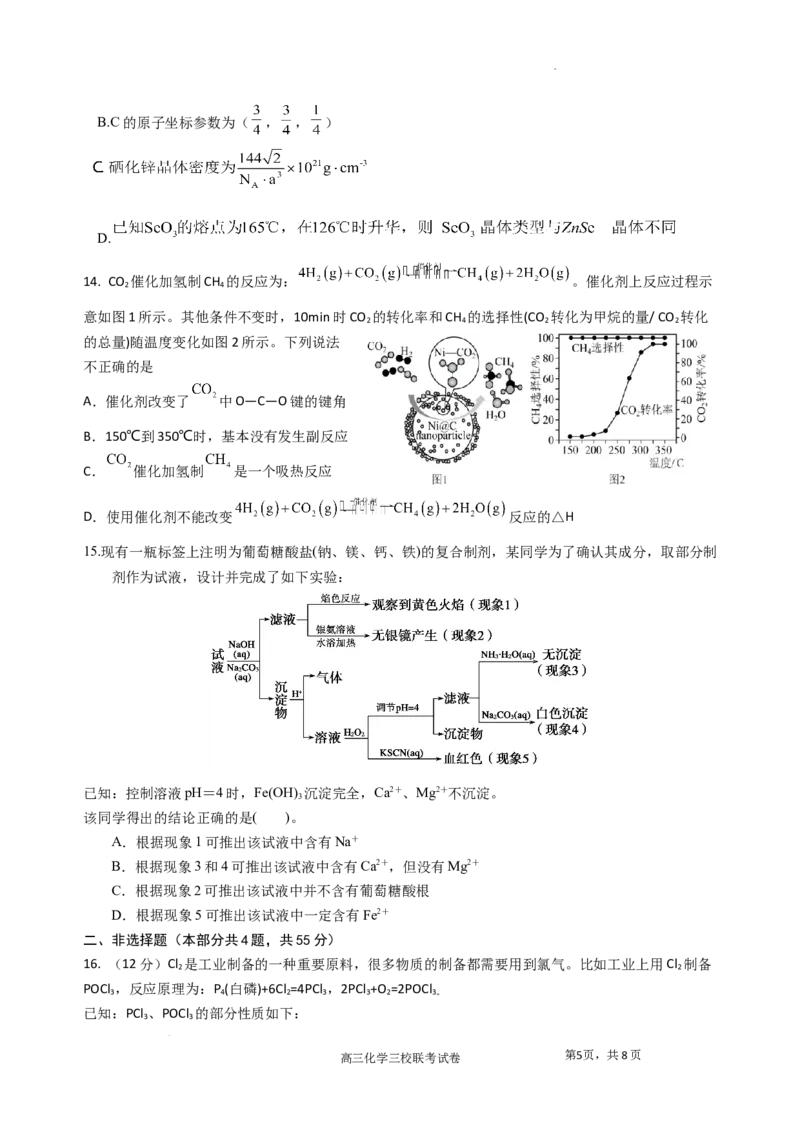
13.半导体材料硒化锌的晶胞如图所示。通过晶体衍射测得晶胞中,面心上硒与顶点硒之间距离为
anm, 代表阿伏加德罗常数的值。以晶胞参数为单位长度建立坐标系,可以表示晶胞中各原子的位
置,称为原子坐标。在 ZnSe 晶胞坐标系中,A 点硒 原
子坐标为 ,B 点锌原子坐标为 .下 列
说法不正确的是
A.Se原子的配位数为4
高三化学三校联考试卷 第4页,共8页
学科网(北京)股份有限公司B.C的原子坐标参数为( , , )
D.
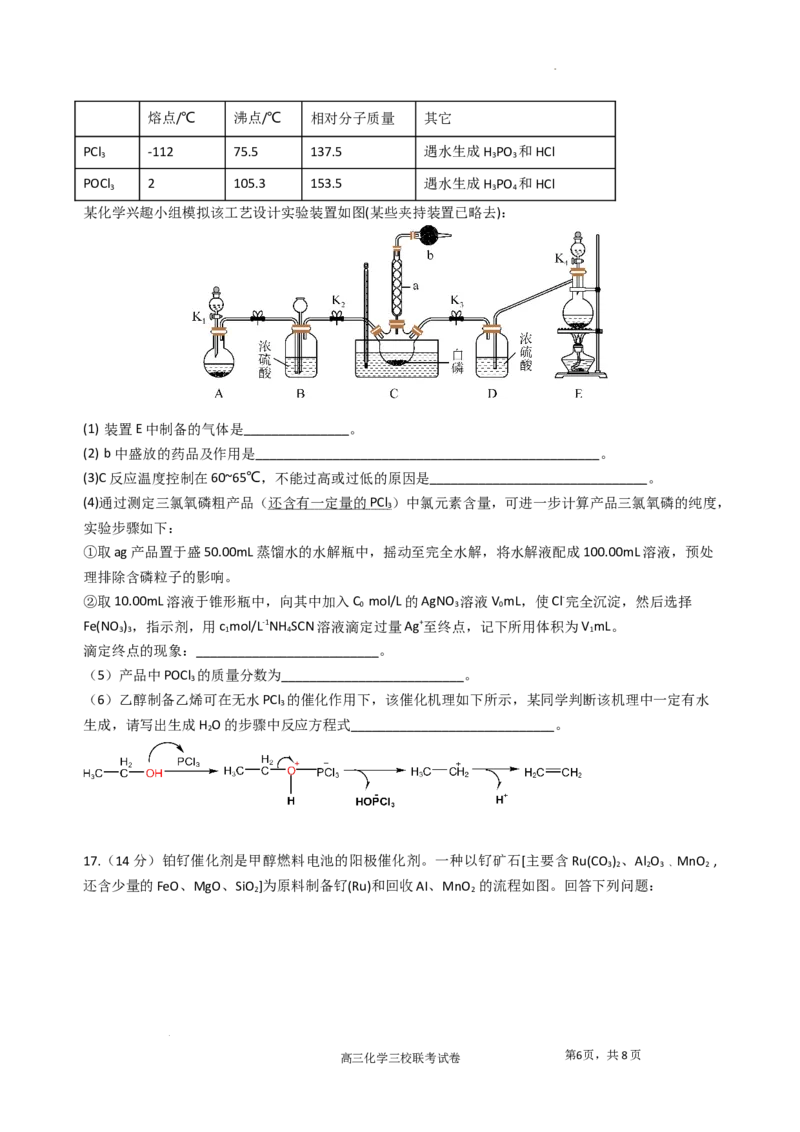
14. CO 催化加氢制CH 的反应为: 。催化剂上反应过程示
2 4
意如图1所示。其他条件不变时,10min时CO 的转化率和CH 的选择性(CO 转化为甲烷的量/ CO 转化
2 4 2 2
的总量)随温度变化如图2所示。下列说法
不正确的是
A.催化剂改变了 中O—C—O键的键角
B.150℃到350℃时,基本没有发生副反应
C. 催化加氢制 是一个吸热反应
D.使用催化剂不能改变 反应的△H
15.现有一瓶标签上注明为葡萄糖酸盐(钠、镁、钙、铁)的复合制剂,某同学为了确认其成分,取部分制
剂作为试液,设计并完成了如下实验:
已知:控制溶液pH=4时,Fe(OH) 沉淀完全,Ca2+、Mg2+不沉淀。
3
该同学得出的结论正确的是( )。
A.根据现象1可推出该试液中含有Na+
B.根据现象3和4可推出该试液中含有Ca2+,但没有Mg2+
C.根据现象2可推出该试液中并不含有葡萄糖酸根
D.根据现象5可推出该试液中一定含有Fe2+
二、非选择题(本部分共4题,共55分)
16. (12分)Cl 是工业制备的一种重要原料,很多物质的制备都需要用到氯气。比如工业上用Cl 制备
2 2
POCl ,反应原理为:P (白磷)+6Cl =4PCl ,2PCl +O =2POCl
3 4 2 3 3 2 3。
已知:PCl 、POCl 的部分性质如下:
3 3
高三化学三校联考试卷 第5页,共8页
学科网(北京)股份有限公司熔点/℃ 沸点/℃ 相对分子质量 其它
PCl -112 75.5 137.5 遇水生成H PO 和HCl
3 3 3
POCl 2 105.3 153.5 遇水生成H PO 和HCl
3 3 4
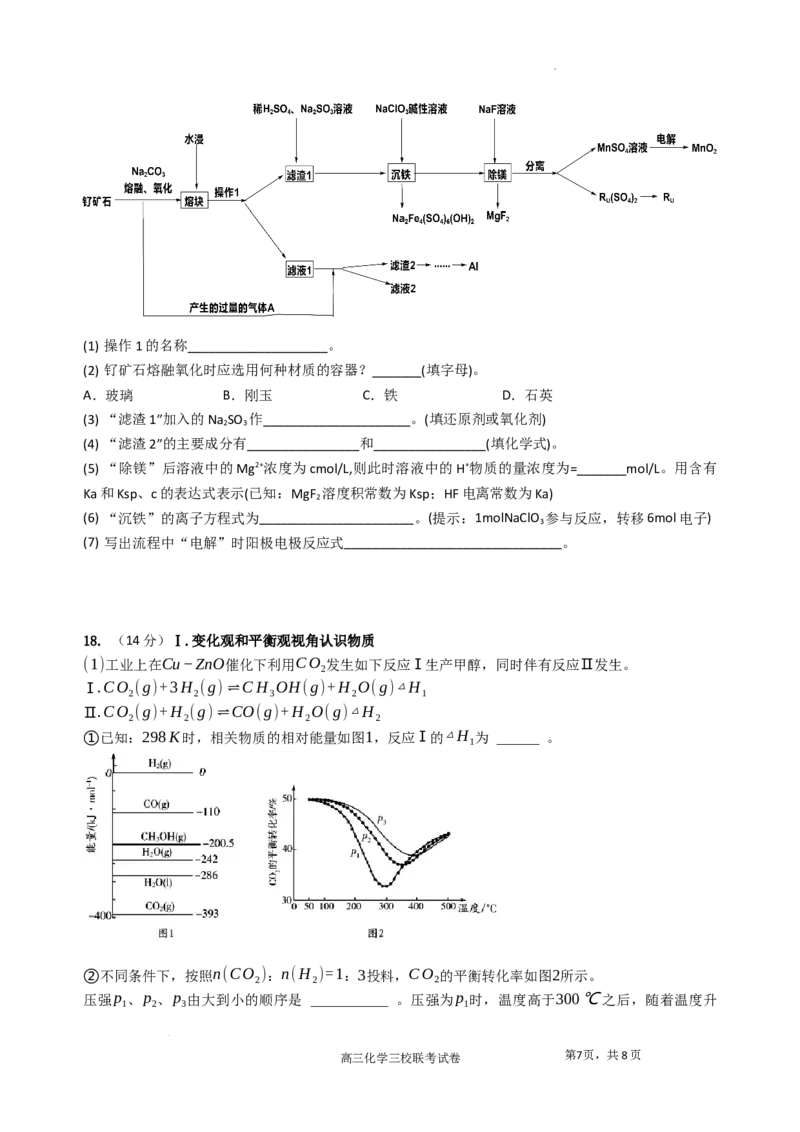
某化学兴趣小组模拟该工艺设计实验装置如图(某些夹持装置已略去):
(1) 装置E中制备的气体是_______________。
(2) b中盛放的药品及作用是_________________________________________________。
(3)C反应温度控制在60~65℃,不能过高或过低的原因是_______________________________。
(4)通过测定三氯氧磷粗产品( 还含有一定量的 PC l )中氯元素含量,可进一步计算产品三氯氧磷的纯度,
3
实验步骤如下:
①取ag产品置于盛50.00mL蒸馏水的水解瓶中,摇动至完全水解,将水解液配成100.00mL溶液,预处
理排除含磷粒子的影响。
②取10.00mL溶液于锥形瓶中,向其中加入C mol/L的AgNO 溶液V mL,使Cl-完全沉淀,然后选择
0 3 0
Fe(NO ) ,指示剂,用c mol/L-1NH SCN溶液滴定过量Ag+至终点,记下所用体积为V mL。
3 3 1 4 1
滴定终点的现象:__________________________。
(5)产品中POCl 的质量分数为__________________________。
3
(6)乙醇制备乙烯可在无水PCl 的催化作用下,该催化机理如下所示,某同学判断该机理中一定有水
3
生成,请写出生成H O的步骤中反应方程式_____________________________。
2
17.(14分)铂钌催化剂是甲醇燃料电池的阳极催化剂。一种以钌矿石[主要含Ru(CO ) 、Al O MnO ,
3 2 2 3 、 2
还含少量的FeO、MgO、SiO ]为原料制备钌(Ru)和回收AI、MnO 的流程如图。回答下列问题:
2 2
高三化学三校联考试卷 第6页,共8页
学科网(北京)股份有限公司(1) 操作1的名称____________________。
(2) 钌矿石熔融氧化时应选用何种材质的容器?_______(填字母)。
A.玻璃 B.刚玉 C.铁 D.石英
(3) “滤渣1”加入的Na SO 作_____________________。(填还原剂或氧化剂)
2 3
(4) “滤渣2”的主要成分有________________和________________(填化学式)。
(5) “除镁”后溶液中的Mg2+浓度为cmol/L,则此时溶液中的H+物质的量浓度为=_______mol/L。用含有
Ka和Ksp、c的表达式表示(已知:MgF 溶度积常数为Ksp;HF电离常数为Ka)
2
(6) “沉铁”的离子方程式为______________________。(提示:1molNaClO 参与反应,转移6mol电子)
3
(7) 写出流程中“电解”时阳极电极反应式_______________________________。
18. (14分)Ⅰ.变化观和平衡观视角认识物质
(1)工业上在Cu−ZnO催化下利用CO 发生如下反应Ⅰ生产甲醇,同时伴有反应Ⅱ发生。
2
Ⅰ.CO (g)+3H (g)⇌CH OH(g)+H O(g)△H
2 2 3 2 1
Ⅱ.CO (g)+H (g)⇌CO(g)+H O(g)△H
2 2 2 2
①已知:298K时,相关物质的相对能量如图1,反应Ⅰ的△H 为 ______ 。
1
②不同条件下,按照n(CO ):n(H )=1:3投料,CO 的平衡转化率如图2所示。
2 2 2
压强p 、p 、p 由大到小的顺序是 ___________ 。压强为p 时,温度高于300℃之后,随着温度升
1 2 3 1
高三化学三校联考试卷 第7页,共8页
学科网(北京)股份有限公司高CO 平衡转化率增大的原因 ____________________________ 。
2
(2)能说明反应CO (g)+3H (g)⇌CH OH(g)+H O(g)△H 已达平衡状态的是 ______(
2 2 3 2 1
填字母)。
A.单位时间内生成1molCH OH(g)的同时消耗了1molCO (g)
3 2
B.在恒温恒容的容器中,混合气体的密度保持不变
C.在绝热恒容的容器中,反应的平衡常数不再变化
D.在恒温恒压的容器中,气体的平均摩尔质量不再变化
Ⅱ.从微粒结构视角认识物质
(3)基态Fe2+的核外电子排布式为 _____________________;第四周期元素中,基态原子未成对电子
数与Co相等的有 _________(填元素符号)。
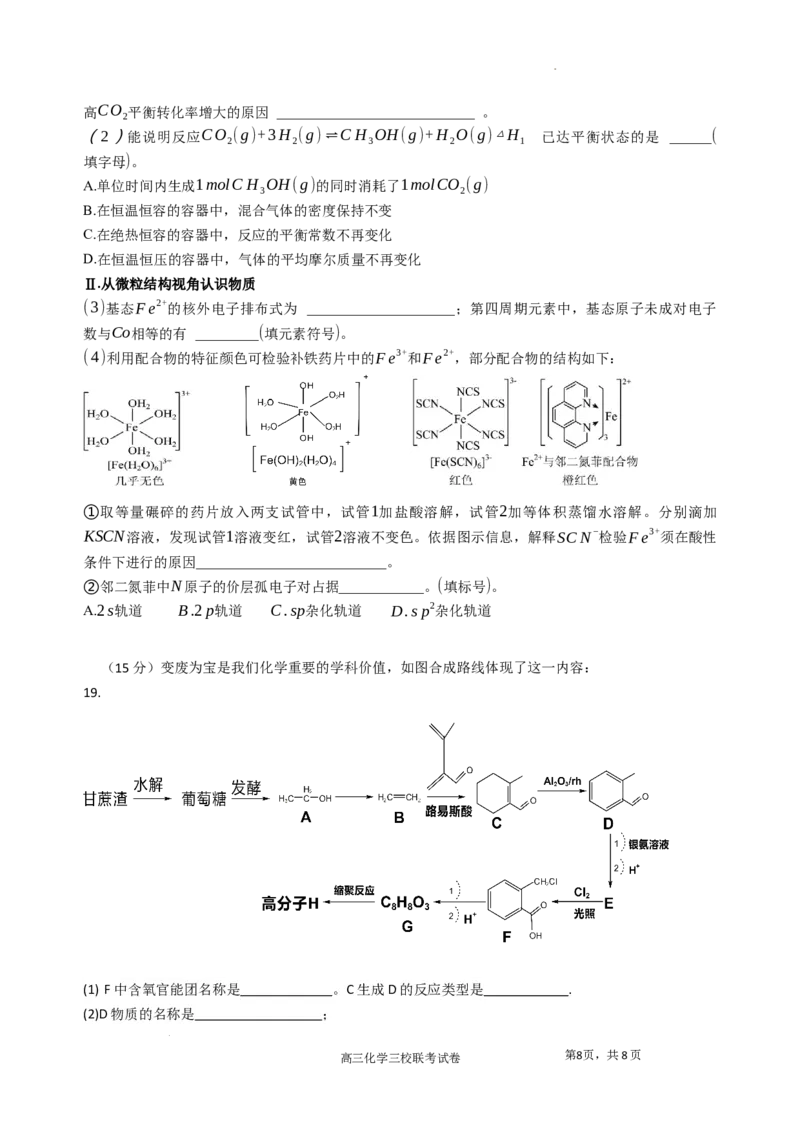
(4)利用配合物的特征颜色可检验补铁药片中的Fe3+和Fe2+,部分配合物的结构如下:
①取等量碾碎的药片放入两支试管中,试管1加盐酸溶解,试管2加等体积蒸馏水溶解。分别滴加
KSCN溶液,发现试管1溶液变红,试管2溶液不变色。依据图示信息,解释SCN−检验Fe3+须在酸性
条件下进行的原因___________________________。
②邻二氮菲中N原子的价层孤电子对占据____________。(填标号)。
A.2s轨道 B.2p轨道 C.sp杂化轨道 D.sp2杂化轨道
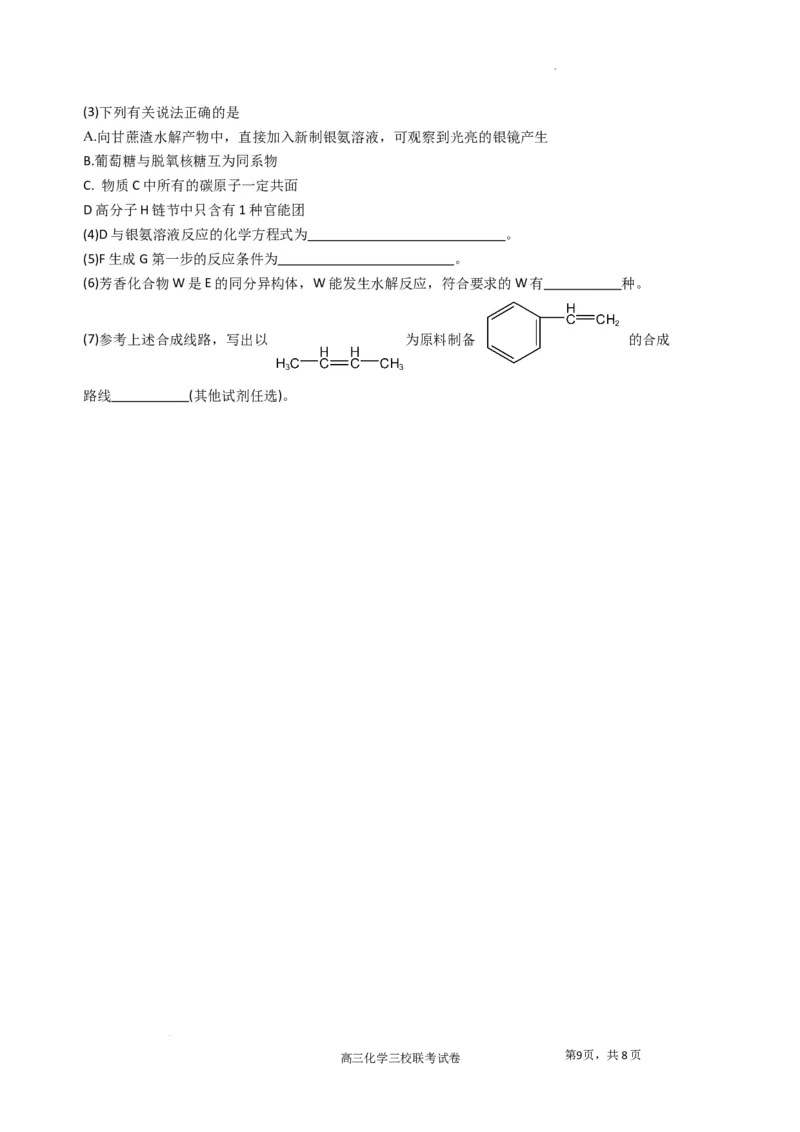
(15分)变废为宝是我们化学重要的学科价值,如图合成路线体现了这一内容:
19.
(1) F中含氧官能团名称是 。C生成D的反应类型是 .
(2)D物质的名称是 ;
高三化学三校联考试卷 第8页,共8页
学科网(北京)股份有限公司(3)下列有关说法正确的是
A.向甘蔗渣水解产物中,直接加入新制银氨溶液,可观察到光亮的银镜产生
B.葡萄糖与脱氧核糖互为同系物
C. 物质C中所有的碳原子一定共面
D高分子H链节中只含有1种官能团
(4)D与银氨溶液反应的化学方程式为 。
(5)F生成G第一步的反应条件为 。
(6)芳香化合物W是E的同分异构体,W能发生水解反应,符合要求的W有 种。
(7)参考上述合成线路,写出以 为原料制备 的合成
路线 (其他试剂任选)。
高三化学三校联考试卷 第9页,共8页
学科网(北京)股份有限公司南昌市三校(一中、十中、铁一中)高三上学期第一次联考
化 学 试 卷答案
1——5 D D C A D 6——10 C D B C D 11——15 C A B C B
16.【答案】共12分,每空2分,2、3小问答对一半给1分
(1) CI 或者氯气 (2)碱石灰,作用是吸收多余的 防止污染空气、防止空气H O进入C装
2 2
置
(3) 由于温度太低,反应速率变慢;温度过高,PCl 易挥发,利用率降低;
3
(4) 最后一滴(或半滴)标准液,溶液变红,30s不变色
[300a−137.5(c V −c V )]
0 0 1 1 ×153.5%
(5)48a
(6)
17.(14分)第4问各1分,其他每空2分
(1)过滤 (2)C
Ka
√ksp
(3)还原剂 (4)H SiO Al(OH) (5) c
2 3 3
(6)6Na++12Fe2++2ClO +18SO +6H O=3Na Fe (SO ) (OH) ↓+2Cl-+6OH-
2 2 4 4 6 2
(7)Mn2+-2e-+2H O=MnO +4H+
2 2
18.(14分) (1)①−49.5kJ/mol
②p >p >p ; (1分)
3 2 1
反应Ⅰ是放热反应,反应Ⅱ是吸热反应,温度高于300℃之后,反应转化率主要由反应Ⅱ决定
(2)CD (3)1s22s22p63s23p63d6; V、As
(4) ①用KSCN检验Fe3+时,SCN−会与OH−竞争结合Fe3+。pH升高,OH−更易与Fe3+结合,
酸性增强,OH−浓度减小,SCN−可以竞争到Fe3+ ②D(1分)
19.【答案】共15分,;第1问各1分;第5问3分,可按步骤酌情给分;其他每空2分
(1)羧基 氧化反应或消去反应
(2)邻甲基苯甲醛 或 2-甲基苯甲醛 (3) D
高三化学三校联考试卷 第10页,共8页
学科网(北京)股份有限公司(4)
(5)NaOH的水溶液,加热(
△
) (6)6
(7)
高三化学三校联考试卷 第11页,共8页
学科网(北京)股份有限公司