文档内容
树德中学高 2022 级高三上学期 11 月半期测试化学试题
时间:75min 满分:100分
命题人:袁玉红 审题人:佘海丽唐建华刘发春
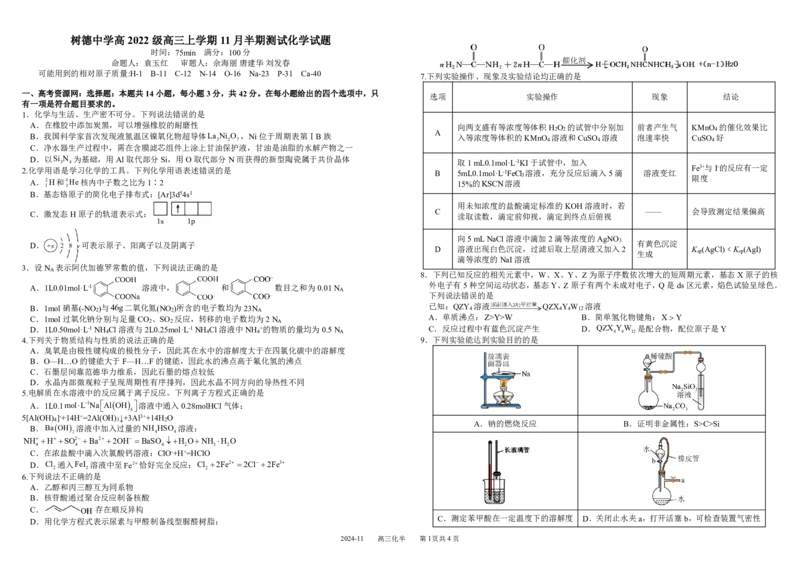
可能用到的相对原子质量:H-1 B-11 C-12 N-14 O-16 Na-23 P-31 Ca-40 7.下列实验操作、现象及实验结论均正确的是
一、高考资源网:选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只
选项 实验操作 现象 结论
有一项是符合题目要求的。
1.化学与生活、生产密不可分。下列说法错误的是
A.在橡胶中添加炭黑,可以增强橡胶的耐磨性 向两支盛有等浓度等体积H O 的试管中分别加 前者产生气 KMnO 的催化效果比
2 2 4
A
B.我国科学家首次发现液氮温区镍氧化物超导体La 3 Ni 2 O 7 ,Ni位于周期表第ⅠB族 入等浓度等体积的KMnO 4 溶液和CuSO 4 溶液 泡速率快 CuSO 4 好
C.净水器生产过程中,需在含膜滤芯组件上涂上甘油保护液,甘油是油脂的水解产物之一
D.以Si
3
N
4
为基础,用Al取代部分Si,用O取代部分N而获得的新型陶瓷属于共价晶体
取1mL0.1mol·L-1KI于试管中,加入
2.化学用语是学习化学的工具。下列化学用语表述错误的是
B 5mL0.1mol·L-1FeCl 溶液,充分反应后滴入5滴 溶液变红
Fe3+与I-的反应有一定
3 限度
A.2H和4He核内中子数之比为1∶2 15%的KSCN溶液
1 2
B.基态铬原子的简化电子排布式:[Ar]3d54s1
用未知浓度的盐酸滴定标准的KOH溶液时,若
C.激发态H原子的轨道表示式: C
读取读数,滴定前仰视,滴定到终点后俯视
—— 会导致测定结果偏高
向5mLNaCl溶液中滴加2滴等浓度的AgNO
D. 可表示原子、阳离子以及阴离子 3 有黄色沉淀
D 溶液出现白色沉淀,过滤后取上层清液又加入2 K (AgCl)﹤K (AgI)
生成 sp sp
滴等浓度的NaI溶液
3.设N 表示阿伏加德罗常数的值,下列说法正确的是
A
8.下列已知反应的相关元素中,W、X、Y、Z为原子序数依次增大的短周期元素,基态X原子的核
A.1L0.01mol·L-1 溶液中, 和 数目之和为0.01N
外电子有5种空间运动状态,基态Y、Z原子有两个未成对电子,Q是ds区元素,焰色试验呈绿色。
A
下列说法错误的是
B.1mol硝基(-NO 2 )与46g二氧化氮(NO 2 )所含的电子数均为23N A 已知:QZY 4 溶液 QZX 4 Y 4 W 12 溶液
C.1mol过氧化钠分别与足量CO 、SO 反应,转移的电子数均为2N A.单质沸点:Z>Y>W B.简单氢化物键角:XY
2 2 A
D.1L0.50mol·L-1NH Cl溶液与2L0.25mol·L-1NH Cl溶液中NH +的物质的量均为0.5N C.反应过程中有蓝色沉淀产生 D.QZX YW 是配合物,配位原子是Y
4 4 4 A 4 4 12
4.下列关于物质结构与性质的说法正确的是 9.下列实验能达到实验目的的是
A.臭氧是由极性键构成的极性分子,因此其在水中的溶解度大于在四氯化碳中的溶解度
B.O—H…O的键能大于F—H…F的键能,因此水的沸点高于氟化氢的沸点
C.石墨层间靠范德华力维系,因此石墨的熔点较低
D.水晶内部微观粒子呈现周期性有序排列,因此水晶不同方向的导热性不同
5.电解质在水溶液中的反应属于离子反应。下列离子方程式正确的是
A.1L0.1molL1Na
AlOH
溶液中通入0.28molHCl气体:
4
5[Al(OH) ]-+14H+=2Al(OH) ↓+3Al3++14H O
B.Ba
4
OH 溶液中加入过
3
量的NH HS
2
O 溶液:
A.钠的燃烧反应 B.证明非金属性:S>C>Si
2 4 4
NH H SO2Ba2 2OH BaSO H ONH H O
4 4 4 2 3 2
C.在浓盐酸中滴入次氯酸钙溶液:ClO-+H+=HClO
D.Cl 通入FeI 溶液中至Fe2恰好完全反应:Cl 2Fe2 2Cl 2Fe3
2 2 2
6.下列说法不正确的是
A.乙醇和丙三醇互为同系物
B.核苷酸通过聚合反应制备核酸
C. 存在顺反异构
D.用化学方程式表示尿素与甲醛制备线型脲醛树脂:
C.测定苯甲酸在一定温度下的溶解度 D.关闭止水夹a,打开活塞b,可检查装置气密性
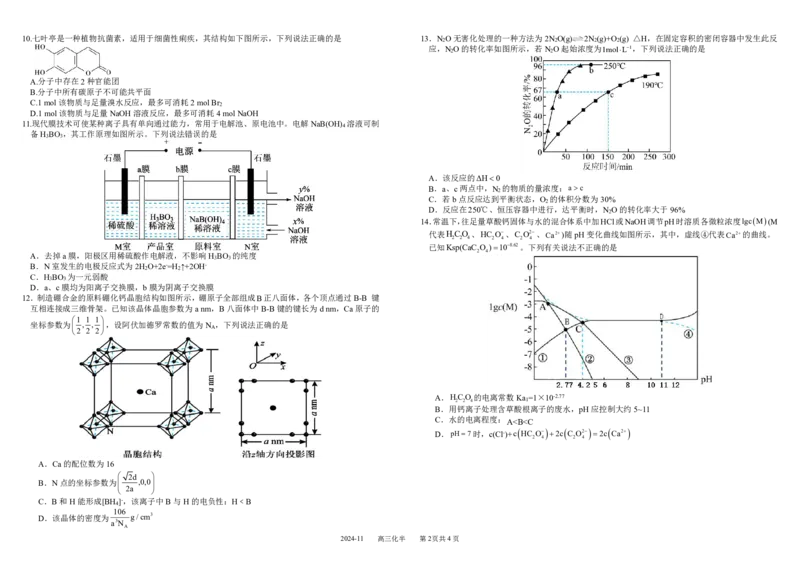
2024-11 高三化半 第1页共4页10.七叶亭是一种植物抗菌素,适用于细菌性痢疾,其结构如下图所示,下列说法正确的是 13.N O无害化处理的一种方法为2N O(g) 2N (g)+O (g) △H,在固定容积的密闭容器中发生此反
2 2 2 2
应,N
2
O的转化率如图所示,若N
2
O起始浓度为1molL1,下列说法正确的是
A.分子中存在2种官能团
B.分子中所有碳原子不可能共平面
C.1mol该物质与足量溴水反应,最多可消耗2molBr
2
D.1mol该物质与足量NaOH溶液反应,最多可消耗4molNaOH
11.现代膜技术可使某种离子具有单向通过能力,常用于电解池、原电池中。电解NaB(OH) 溶液可制
4
备H BO ,其工作原理如图所示。下列说法错误的是
3 3
A.该反应的ΔH0
B.a、c两点中,N 的物质的量浓度:a c
2
C.若b点反应达到平衡状态,O 的体积分数为30%
2
D.反应在250℃、恒压容器中进行,达平衡时,N O的转化率大于96%
2
14.常温下,往足量草酸钙固体与水的混合体系中加HCl或NaOH调节pH时溶质各微粒浓度lgcM
(M
代表HCO 、HC O、C O2、Ca2+)随pH变化曲线如图所示,其中,虚线④代表Ca2的曲线。
2 2 4 2 4 2 4
已知Ksp(CaC O )108.62。下列有关说法不正确的是
2 4
A.去掉a膜,阳极区用稀硫酸作电解液,不影响H BO 的纯度
3 3
B.N室发生的电极反应式为2H O+2e-=H ↑+2OH-
2 2
C.H BO 为一元弱酸
3 3
D.a、c膜均为阳离子交换膜,b膜为阴离子交换膜
12.制造硼合金的原料硼化钙晶胞结构如图所示,硼原子全部组成B正八面体,各个顶点通过B-B 键
互相连接成三维骨架。已知该晶体晶胞参数为anm,B八面体中B-B键的键长为dnm,Ca原子的
1 1 1
坐标参数为 , , ,设阿伏加德罗常数的值为N
A
,下列说法正确的是
2 2 2
A.HCO 的电离常数Ka =1×10-2.77
2 2 4 1
B.用钙离子处理含草酸根离子的废水,pH应控制大约5~11
C.水的电离程度:
A”“<”或“=”)0。
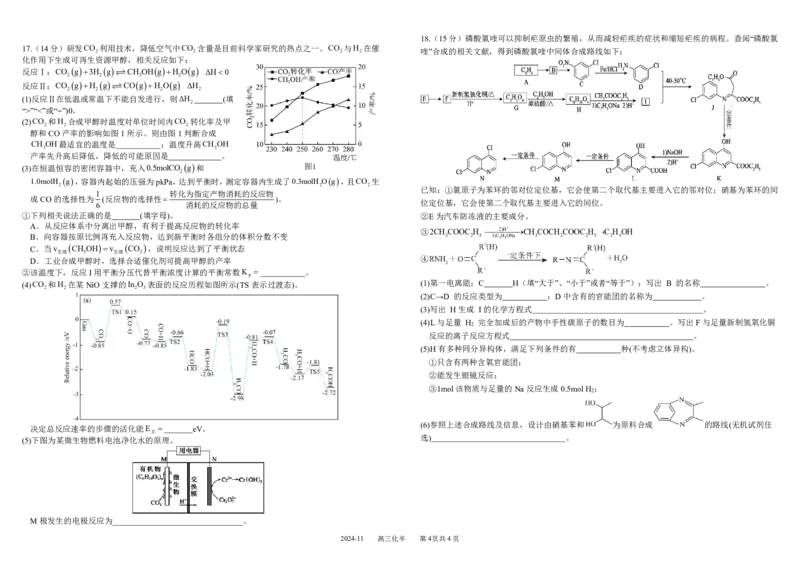
(2)CO 和H 合成甲醇时温度对单位时间内CO 转化率及甲
2 2 2
醇和CO产率的影响如图1所示。则由图1判断合成
CH OH最适宜的温度是 ;温度升高CH OH
3 3
产率先升高后降低,降低的可能原因是 。
(3)在恒温恒容的密闭容器中,充入0.5molCO g和
2
1.0molH g,容器内起始的压强为pkPa,达到平衡时,测定容器内生成了0.3molH Og,且CO 生
2 2 2
已知:①氯原子为苯环的邻对位定位基,它会使第二个取代基主要进入它的邻对位;硝基为苯环的间
1 转化为指定产物消耗的反应物
成CO的选择性为
6
(反应物的选择性
消耗的反应物的总量
)。
位定位基,它会使第二个取代基主要进入它的间位。
①下列相关说法正确的是 (填字母)。 ②E为汽车防冻液的主要成分。
A.从反应体系中分离出甲醇,有利于提高反应物的转化率
③2CH COOC H 2)HCH COCH COOC H C H OH
B.向容器按原比例再充入反应物,达到新平衡时各组分的体积分数不变 3 2 5 1)C2H5ONa 3 2 2 5 2 5
C.当v CH OHv CO ,说明反应达到了平衡状态
生成 3 生成 2
D.工业合成甲醇时,选择合适催化剂可提高甲醇的产率 ④
②该温度下,反应I用平衡分压代替平衡浓度计算的平衡常数K 。
p
(4)CO 和H 在某NiO支撑的In O 表面的反应历程如图所示(TS表示过渡态)。 (1)第一电离能:C H(填“大于”、“小于”或者“等于”);写出 B 的名称 。
2 2 2 3
(2)C→D 的反应类型为 ;D中含有的官能团的名称为 。
(3)写出 H生成 I的化学方程式 。
(4)L与足量 H 完全加成后的产物中手性碳原子的数目为 。写出F与足量新制氢氧化铜
2
反应的离子反应方程式 。
(5)H有多种同分异构体,满足下列条件的有 种(不考虑立体异构)。
①只含有两种含氧官能团;
②能发生银镜反应;
③1mol该物质与足量的Na反应生成0.5molH ;
2
(6)参照上述合成路线及信息,设计由硝基苯和 为原料合成 的路线(无机试剂任
决定总反应速率的步骤的活化能E eV。
主
(5)下图为某微生物燃料电池净化水的原理。
选) 。
M极发生的电极反应为________________________________。
2024-11 高三化半 第4页共4页树德中学高2022级高三上学期11月半期测试化学试题
参考答案
一、选择题:本题共14小题,每小题3分,共42分
1 2 3 4 5 6 7 8 9 10 11 12 13 14
B C B D A A C D B D A B D A
二、非选择题:本题共4小题,共58分。
15.(15分,除指定分数外,每空2分)
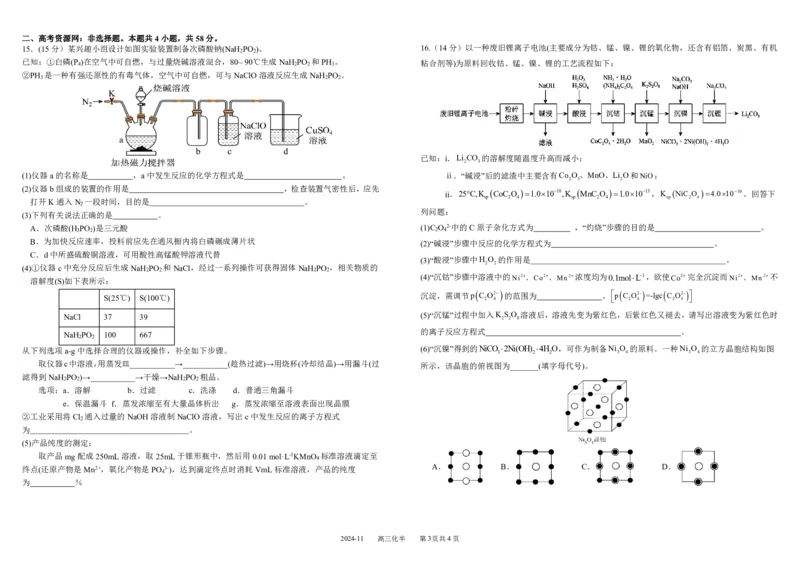
(1)三颈烧瓶(1分) P +3NaOH+3H O 3NaH PO +PH ↑
4 2 2 2 3
安全瓶,防止c中溶液倒吸入a中(写成安全瓶,防倒吸也可以)
排尽装置内的空气,防止反应生成的pH 自燃引起爆炸
3
(3)C(1分)
(4)f(1分)、e(1分)、c(1分) PH +2ClO-+OH-=H PO -+2Cl-+H O
3 2 2 2
(5) (加%不得分)
16.(14分,每空2分)
(1)sp2 除去碳黑和有机粘合剂
(2)Al O +2NaOH=2NaAlO +H O
2 3 2 2
(3)将Co3还原为Co2
(4)12
(2)250℃ 反应Ⅰ的正反应为放热反应,升高温度平衡逆向移动,CH OH产率降低;(或温度升 3 高,催化剂的活性下降,CH OH产率降低或温度升高,反应II占主导,CO产率升高,CH OH产率 3 3 降低) 3375 (3)AD (kPa)1 32P2 (4)2.17 (5)(C H O ) -24ne-+7nH O===6nCO ↑+24nH+ 6 10 5 n 2 2 18.(15分,除指定分数外,每空2分) (1)小于(1分) 硝基苯 (2)还原反应(1分) 氨基、碳氯键或氯原子(全对得1分) (3) ( 条件不写扣1分) (4)5(1分) OHC-CHO+4Cu(OH) +2OH-=C O 2-+2Cu O↓+6H O 2 2 4 2 2 (5)12 (6) (3分) (两步正确得1分,三步正确得2分,全对得3分) 2024-11 高三化半 第5页共4页