文档内容
成都石室中学 2025 届 2024—2025 学年度上期十月考试
化学试卷
试卷说明:满分100分,考试时间75分钟
可能用到的相对原子质量:H 1 C 12 N 14 O 16 F 19 Cl 35.5 Co 59 Ag 108
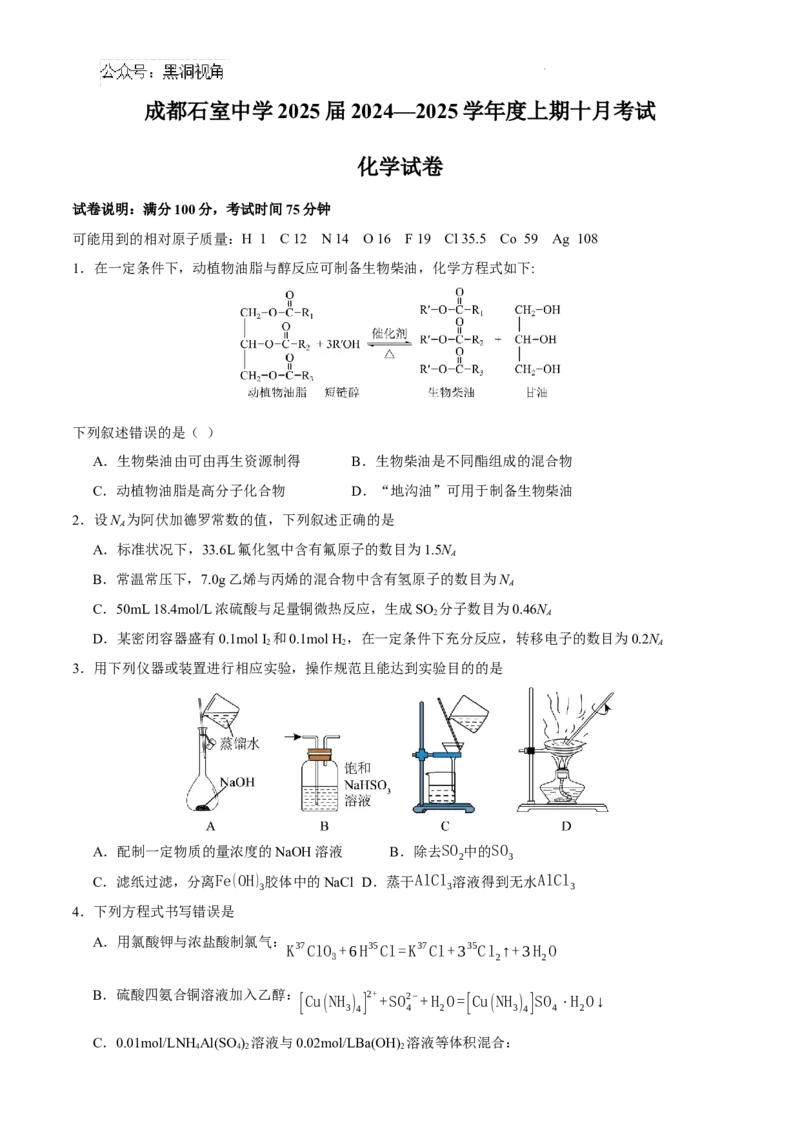
1.在一定条件下,动植物油脂与醇反应可制备生物柴油,化学方程式如下:
下列叙述错误的是( )
A.生物柴油由可由再生资源制得 B.生物柴油是不同酯组成的混合物
C.动植物油脂是高分子化合物 D.“地沟油”可用于制备生物柴油
2.设N 为阿伏加德罗常数的值,下列叙述正确的是
A
A.标准状况下,33.6L氟化氢中含有氟原子的数目为1.5N
A
B.常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为N
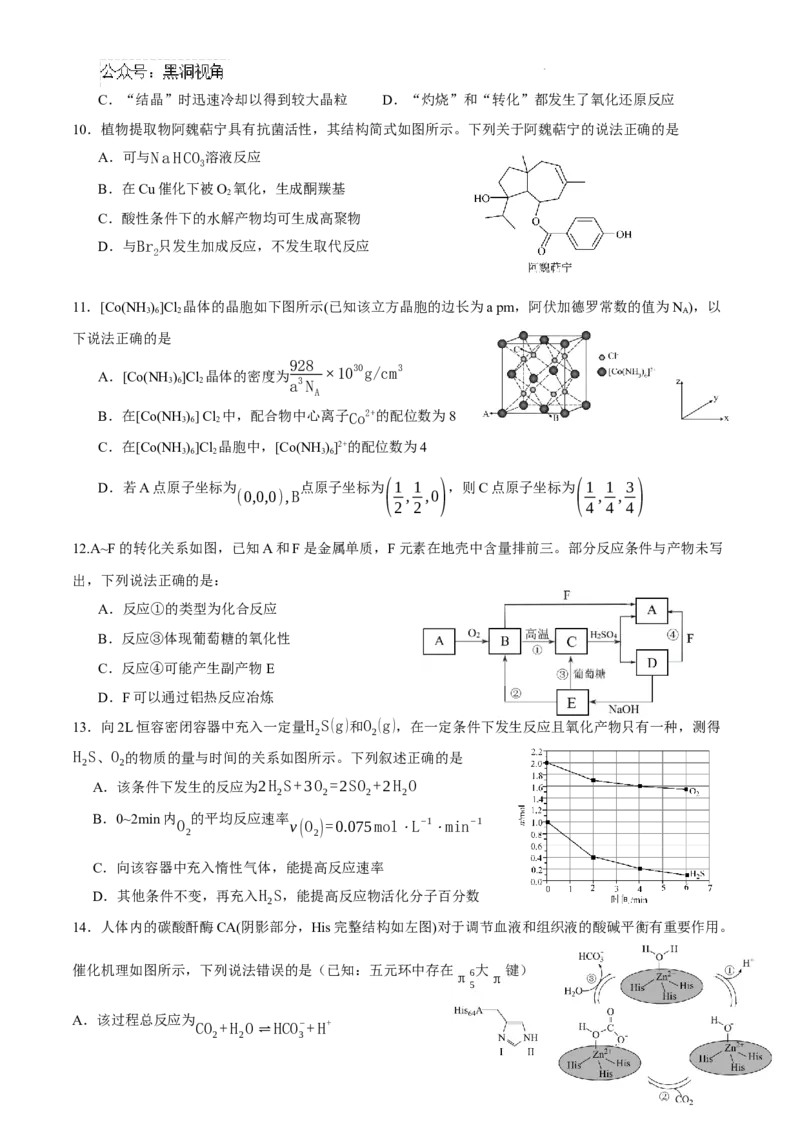
A
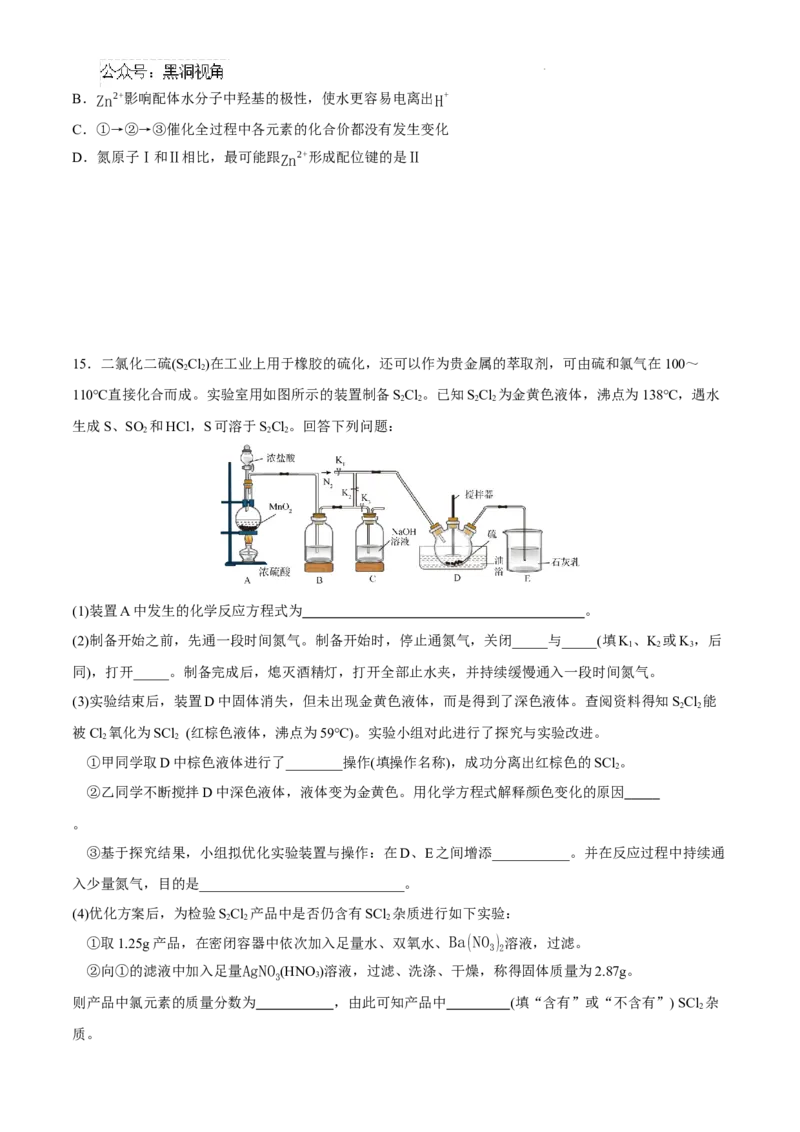
C.50mL 18.4mol/L浓硫酸与足量铜微热反应,生成SO 分子数目为0.46N
2 A
D.某密闭容器盛有0.1mol I 和0.1mol H ,在一定条件下充分反应,转移电子的数目为0.2N
2 2 A
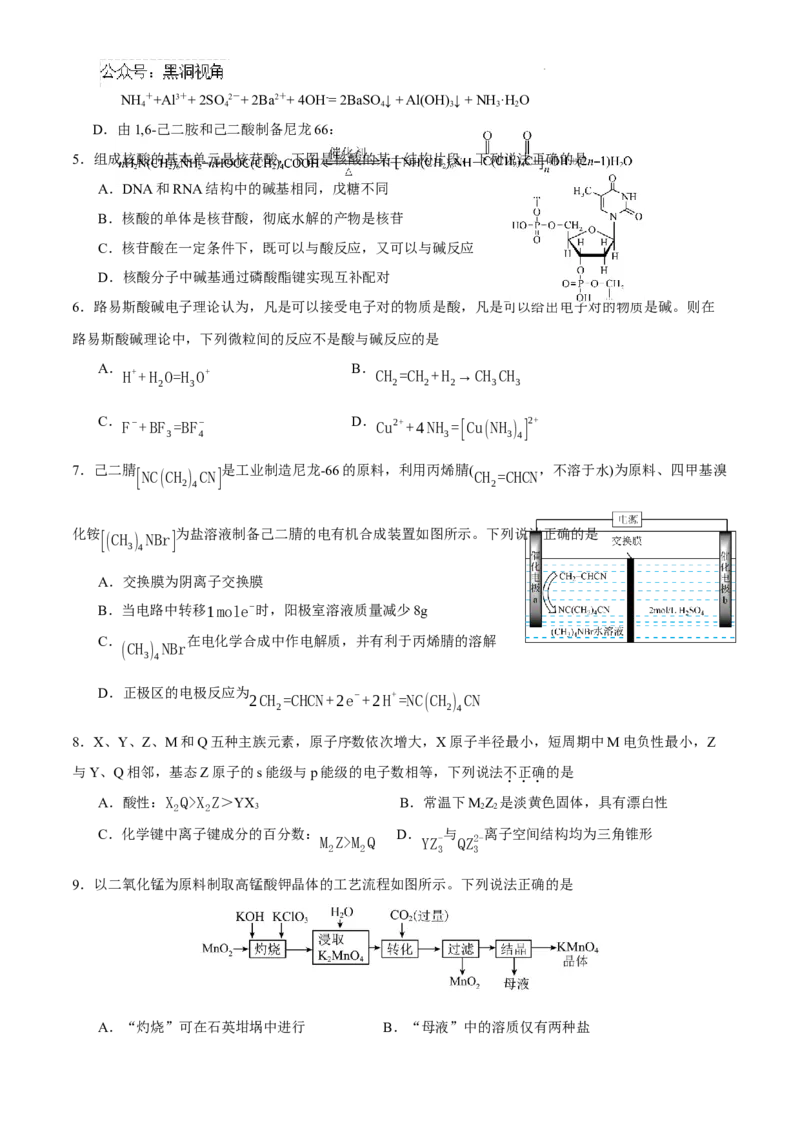
3.用下列仪器或装置进行相应实验,操作规范且能达到实验目的的是
A.配制一定物质的量浓度的NaOH溶液 B.除去SO 中的SO
2 3
C.滤纸过滤,分离Fe(OH) 胶体中的NaCl D.蒸干AlCl 溶液得到无水AlCl
3 3 3
4.下列方程式书写错误是
A.用氯酸钾与浓盐酸制氯气:
K37ClO +6H35Cl=K37Cl+335Cl ↑+3H O
3 2 2
B.硫酸四氨合铜溶液加入乙醇: [Cu(NH ) ] 2+ +SO2−+H O=[Cu(NH ) ]SO ⋅H O↓
3 4 4 2 3 4 4 2
C.0.01mol/LNH Al(SO ) 溶液与0.02mol/LBa(OH) 溶液等体积混合:
4 4 2 2
学科网(北京)股份有限公司NH ++Al3++ 2SO 2-+ 2Ba2++ 4OH-= 2BaSO↓ + Al(OH) ↓ + NH·H O
4 4 4 3 3 2
D.由1,6-己二胺和己二酸制备尼龙66:
5.组成核酸的基本单元是核苷酸,下图是核酸的某一结构片段,下列说法正确的是
A.DNA和RNA结构中的碱基相同,戊糖不同
B.核酸的单体是核苷酸,彻底水解的产物是核苷
C.核苷酸在一定条件下,既可以与酸反应,又可以与碱反应
D.核酸分子中碱基通过磷酸酯键实现互补配对
6.路易斯酸碱电子理论认为,凡是可以接受电子对的物质是酸,凡是可以给出电子对的物质是碱。则在
路易斯酸碱理论中,下列微粒间的反应不是酸与碱反应的是
A. B.
H++H O=H O+ CH =CH +H →CH CH
2 3 2 2 2 3 3
C. F−+BF =BF− D. Cu2++4NH =[Cu(NH ) ] 2+
3 4 3 3 4
7.己二腈 是工业制造尼龙-66的原料,利用丙烯腈( ,不溶于水)为原料、四甲基溴
[NC(CH ) CN] CH =CHCN
2 4 2
化铵 为盐溶液制备己二腈的电有机合成装置如图所示。下列说法正确的是
[(CH ) NBr]
3 4
A.交换膜为阴离子交换膜
B.当电路中转移1mole−时,阳极室溶液质量减少8g
C. 在电化学合成中作电解质,并有利于丙烯腈的溶解
(CH ) NBr
3 4
D.正极区的电极反应为
2CH =CHCN+2e−+2H+=NC(CH ) CN
2 2 4
8.X、Y、Z、M和Q五种主族元素,原子序数依次增大,X原子半径最小,短周期中M电负性最小,Z
与Y、Q相邻,基态Z原子的s能级与p能级的电子数相等,下列说法不正确的是
A.酸性:X Q>X Z>YX B.常温下MZ 是淡黄色固体,具有漂白性
2 2 3 2 2
C.化学键中离子键成分的百分数: D. 与 离子空间结构均为三角锥形
M Z>M Q YZ- QZ2-
2 2 3 3
9.以二氧化锰为原料制取高锰酸钾晶体的工艺流程如图所示。下列说法正确的是
A.“灼烧”可在石英坩埚中进行 B.“母液”中的溶质仅有两种盐
学科网(北京)股份有限公司C.“结晶”时迅速冷却以得到较大晶粒 D.“灼烧”和“转化”都发生了氧化还原反应
10.植物提取物阿魏萜宁具有抗菌活性,其结构简式如图所示。下列关于阿魏萜宁的说法正确的是
A.可与NaHCO 溶液反应
3
B.在Cu催化下被O 氧化,生成酮羰基
2
C.酸性条件下的水解产物均可生成高聚物
D.与Br 只发生加成反应,不发生取代反应
2
11.[Co(NH )]Cl 晶体的晶胞如下图所示(已知该立方晶胞的边长为a pm,阿伏加德罗常数的值为N ),以
3 6 2 A
下说法正确的是
928
A.[Co(NH )]Cl 晶体的密度为
×1030g/cm3
3 6 2 a3N
A
B.在[Co(NH )] Cl 中,配合物中心离子Co2+的配位数为8
3 6 2
C.在[Co(NH )]Cl 晶胞中,[Co(NH )]2+的配位数为4
3 6 2 3 6
D.若A点原子坐标为 点原子坐标为(1 1 ),则C点原子坐标为(1 1 3)
(0,0,0),B , ,0 , ,
2 2 4 4 4
12.A~F的转化关系如图,已知A和F是金属单质,F元素在地壳中含量排前三。部分反应条件与产物未写
出,下列说法正确的是:
A.反应①的类型为化合反应
B.反应③体现葡萄糖的氧化性
C.反应④可能产生副产物E
D.F可以通过铝热反应冶炼
13.向2L恒容密闭容器中充入一定量H S(g)和O (g),在一定条件下发生反应且氧化产物只有一种,测得
2 2
H S、O 的物质的量与时间的关系如图所示。下列叙述正确的是
2 2
A.该条件下发生的反应为2H S+3O =2SO +2H O
2 2 2 2
B.0~2min内
O
的平均反应速率
v(O )=0.075mol⋅L−1 ⋅min−1
2 2
C.向该容器中充入惰性气体,能提高反应速率
D.其他条件不变,再充入H S,能提高反应物活化分子百分数
2
14.人体内的碳酸酐酶CA(阴影部分,His完整结构如左图)对于调节血液和组织液的酸碱平衡有重要作用。
催化机理如图所示,下列说法错误的是(已知:五元环中存在 大 键)
π6 π
5
A.该过程总反应为
CO +H O HCO−+H+
⇌
2 2 3
学科网(北京)股份有限公司B.Zn2+影响配体水分子中羟基的极性,使水更容易电离出H+
C.①→②→③催化全过程中各元素的化合价都没有发生变化
D.氮原子Ⅰ和Ⅱ相比,最可能跟Zn2+形成配位键的是Ⅱ
15.二氯化二硫(S Cl)在工业上用于橡胶的硫化,还可以作为贵金属的萃取剂,可由硫和氯气在100~
2 2
110℃直接化合而成。实验室用如图所示的装置制备SCl。已知SCl 为金黄色液体,沸点为138℃,遇水
2 2 2 2
生成S、SO 和HCl,S可溶于SCl。回答下列问题:
2 2 2
(1)装置A中发生的化学反应方程式为 。
(2)制备开始之前,先通一段时间氮气。制备开始时,停止通氮气,关闭_____与_____(填K、K 或K,后
1 2 3
同),打开_____。制备完成后,熄灭酒精灯,打开全部止水夹,并持续缓慢通入一段时间氮气。
(3)实验结束后,装置D中固体消失,但未出现金黄色液体,而是得到了深色液体。查阅资料得知SCl 能
2 2
被Cl 氧化为SCl (红棕色液体,沸点为59℃)。实验小组对此进行了探究与实验改进。
2 2
①甲同学取D中棕色液体进行了________操作(填操作名称),成功分离出红棕色的SCl 。
2
②乙同学不断搅拌D中深色液体,液体变为金黄色。用化学方程式解释颜色变化的原因
。
③基于探究结果,小组拟优化实验装置与操作:在D、E之间增添___________。并在反应过程中持续通
入少量氮气,目的是_____________________________。
(4)优化方案后,为检验SCl 产品中是否仍含有SCl 杂质进行如下实验:
2 2 2
①取1.25g产品,在密闭容器中依次加入足量水、双氧水、Ba(NO ) 溶液,过滤。
3 2
②向①的滤液中加入足量AgNO (HNO)溶液,过滤、洗涤、干燥,称得固体质量为2.87g。
3 3
则产品中氯元素的质量分数为 ,由此可知产品中 (填“含有”或“不含有”) SCl 杂
2
质。
学科网(北京)股份有限公司(5)从实验安全的角度考虑,上述装置存在的缺陷是_________________________________________。
16. “零碳甲醇”是符合“碳中和”属性的绿色能源。请回答下列问题:
(1)工业上可以利用直接法合成甲醇:
Ⅰ.CO (g)+3H (g)⇌ CH OH(g)+H O(g) ΔH=−akJ⋅mol−1 (a>0)
2 2 3 2
①该反应自发进行的条件是_________(填“高温自发”、“低温自发”或“任意温度自发”)。
但实际生产中,通常需要适当升温,目的是___________________________。
②将体积分数为10%CO 30%H 的进料气(含惰性杂质气体),控制压强为50 bar发生反应Ⅰ,α =
2、 2 CO2(平衡)
90%。计算平衡时p(H )= (保留两位小数)bar,平衡常数K = bar−2(写出计算式)。
2 p
③可利用沸点差异分离产物与反应物。分析甲醇的熔沸点高于CO 的原因__________________。
2
(2)工业上也利用间接法合成甲醇,相关反应如下:
Ⅱ. ;
CO (g)+H (g)⇌ CO(g)+H O(g) ΔH =+41.1kJ⋅mol−1
2 2 2 2
Ⅲ. ;
CO(g)+2H (g)⇌ CH OH(g) ΔH =−90kJ⋅mol−1
2 3 3
①间接工艺法的决速步为反应Ⅱ,则下列简化示意图中能体现上述反应体系能量变化的是 (填字母)。
A. B. C. D.
②在某催化剂下,反应Ⅲ的历程(*表示吸附在催化剂上)如图所示:
ⅱ到ⅵ的四个基元过程,可看作H 不断被催化剂吸附,H原子转
2
变为吸附态后随即与含碳微粒成键。试仿照ⅰ~ⅳ的形式写出ⅴ对
应的物质 (已知ⅴ中只有一种吸附在催化剂表面的物
质)。
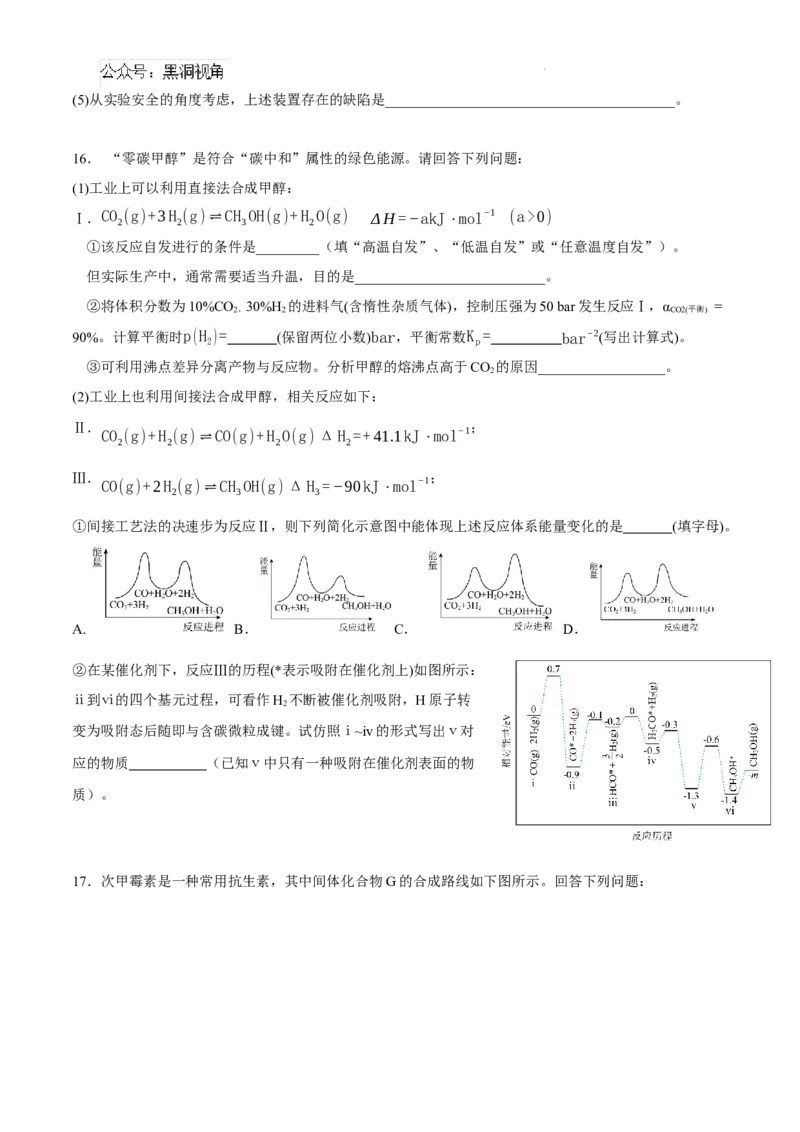
17.次甲霉素是一种常用抗生素,其中间体化合物G的合成路线如下图所示。回答下列问题:
学科网(北京)股份有限公司已知:①: Ph3P、O3 + (R为烃基或H)
→
② R COOR LiAlH4 R CHOH + R OH (R为烃基或H)
1 2 1 2 2
→
(1)B的名称为 。
(2)E中的官能团名称为______________。
(3)D→E的反应方程式为 。
(4)E→F的反应类型为 。
(5)G的结构简式为 。
(6)芳香族化合物I是H的同分异构体,1mol化合物I与Na反应最多生成33.6L H (标准状况下),且化合
2
物I的核磁共振氢谱显示3组峰,其结构简式为 。
(7)参照上述合成路线,以 为原料合成 (上述流程中的试剂及无机
试剂任选)
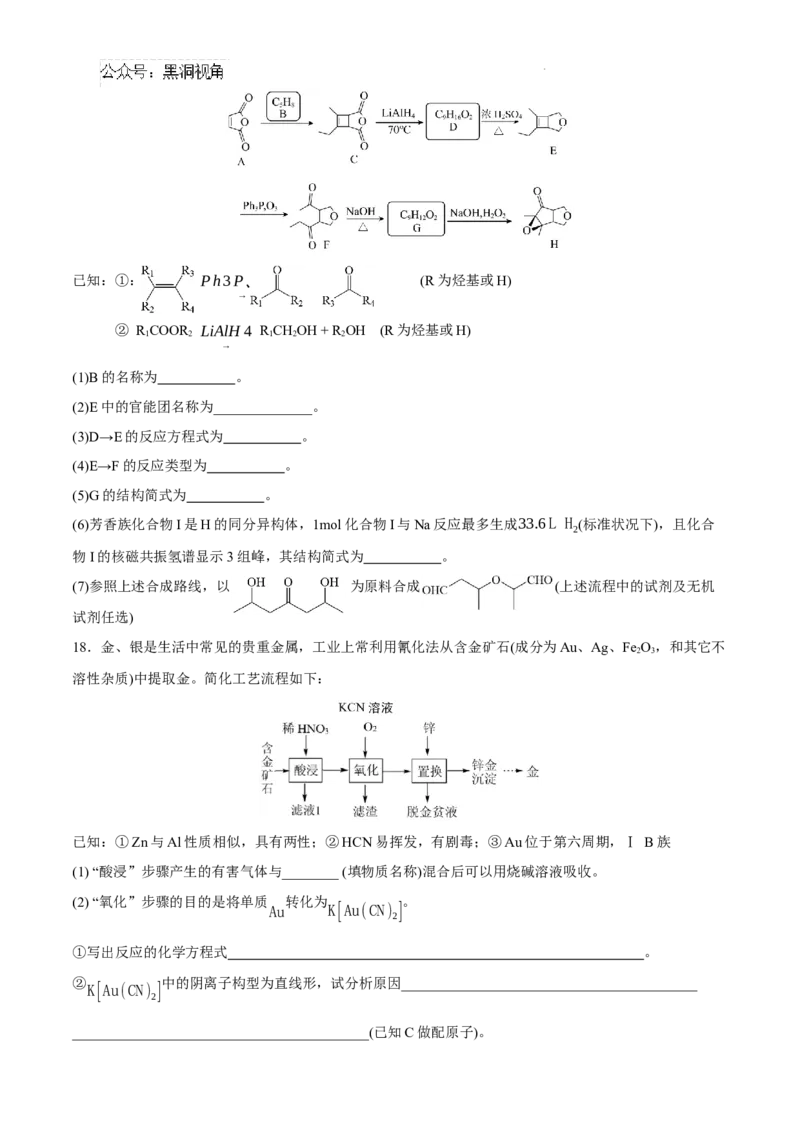
18.金、银是生活中常见的贵重金属,工业上常利用氰化法从含金矿石(成分为Au、Ag、Fe O,和其它不
2 3
溶性杂质)中提取金。简化工艺流程如下:
已知:①Zn与Al性质相似,具有两性;②HCN易挥发,有剧毒;③Au位于第六周期,Ⅰ B族
(1) “酸浸”步骤产生的有害气体与________ (填物质名称)混合后可以用烧碱溶液吸收。
(2) “氧化”步骤的目的是将单质 转化为 。
Au K[Au(CN) ]
2
①写出反应的化学方程式 。
② 中的阴离子构型为直线形,试分析原因__________________________________________
K[Au(CN) ]
2
__________________________________________(已知C做配原子)。
学科网(北京)股份有限公司③为抑制CN-水解,需同时加入KOH,但KOH用量不可过多,原因是:__________________________。
(3)已知,c(Au+)过高时易发生歧化反应,因此需控制溶液中的c(CN-)。欲使浸出液中c(Au+)/c([Au(CN) -])<
2
10-6,试计算说明c(CN-)的最小合理取值(写出计算过程)。
____________________________________________________________________________________________
已知: K (HCN)=5.0×10−10;2H++[Au(CN) ] − ⇌ Au++2HCN , K=4.0×10−20
a 2
(4)某小组设计模拟实验方案,从滤液1中提取银单质:取滤液1蒸干灼烧至恒重,加盐酸充分反应后过滤,
所得滤渣即Ag单质。该方案的不合理处包括:①能耗过高,会产生大量污染性气体。②__________
____________________________(借助方程式表示)。查阅资料得知,常温时NH·H O在碱性条件下能还原
2 4 2
Ag(NH ) + :4 Ag(NH ) ++N 2 H 4 ·H 2 O=4Ag↓+N 2 ↑+4 NH++4NH 3 ↑+H 2 O。请设计从滤液1中获取单质Ag的实
3 2 3 2 4
验方案:
(不必写出具体操作;实验中须使用的试剂有:浓氨水、2 mol·L−1 NH·H O溶液,1 mol·L−1HSO )。
2 4 2 2 4
学科网(北京)股份有限公司