文档内容
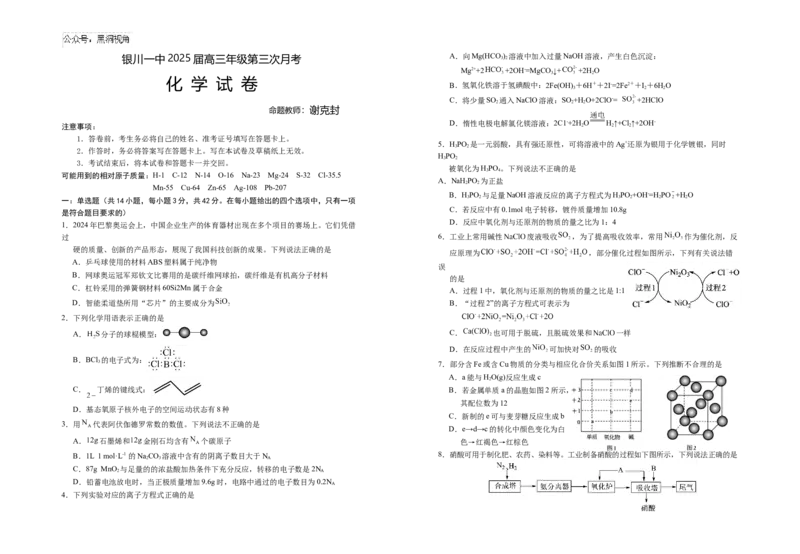
银川一中2025届高三年级第三次月考 A.向Mg(HCO
3
)
2
溶液中加入过量NaOH溶液,产生白色沉淀:
Mg2++2 +2OH-=MgCO↓+ +2H O
3 2
化 学 试 卷
B.氢氧化铁溶于氢碘酸中:2Fe(OH) +6H++2I-=2Fe2++I+6HO
3 2 2
C.将少量SO 通入NaClO溶液:SO +H O+2ClO-= +2HClO
2 2 2
命题教师:谢克封
D.惰性电极电解氯化镁溶液:2C1-+2H O H↑+Cl↑+2OH-
注意事项: 2 2 2
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
5.HPO 是一元弱酸,具有强还原性,可将溶液中的Ag+还原为银用于化学镀银,同时
3 2
2.作答时,务必将答案写在答题卡上。写在本试卷及草稿纸上无效。
HPO
3 2
3.考试结束后,将本试卷和答题卡一并交回。
被氧化为HPO 。下列说法不正确的是
3 4
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 S-32 Cl-35.5
A.NaH PO 为正盐
2 2
Mn-55 Cu-64 Zn-65 Ag-108 Pb-207
B.HPO 与足量NaOH溶液反应的离子方程式为HPO +OH-=H PO +H O
一:单选题(共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项 3 2 3 2 2 2
C.若反应中有0.1mol电子转移,镀件质量增加10.8g
是符合题目要求的)
D.反应中氧化剂与还原剂的物质的量之比为1:4
1.2024年巴黎奥运会上,中国企业生产的体育器材出现在多个项目的赛场上。它们凭借
过 6.工业上常用碱性 废液吸收 ,为了提高吸收效率,常用 作为催化剂,反
硬的质量、创新的产品形态,展现了我国科技创新的成果。下列说法正确的是
应原理为 ,部分催化过程如图所示,下列有关说法错
A.乒乓球使用的材料ABS塑料属于纯净物
误
B.网球奥运冠军郑钦文比赛用的是碳纤维网球拍,碳纤维是有机高分子材料
的是
C.杠铃采用的弹簧钢材料60Si2Mn属于合金
A.过程1中,氧化剂与还原剂的物质的量之比是1:1
D.智能柔道垫所用“芯片”的主要成分为 B.“过程2”的离子方程式可表示为
2.下列化学用语表示正确的是
A. 分子的球棍模型: C. 也可用于脱硫,且脱硫效果和 一样
D.在反应过程中产生的 可加快对 的吸收
B.BCl 的电子式为:
3 7.部分含Fe或含Cu物质的分类与相应化合价关系如图1所示。下列推断不合理的是
A.a能与HO(g)反应生成c
2
C. 丁烯的键线式: B.若金属单质a的晶胞如图2所示,
其配位数为12
D.基态氧原子核外电子的空间运动状态有8种
C.新制的e可与麦芽糖反应生成b
3.用 代表阿伏伽德罗常数的数值。下列说法不正确的是
D.e→d→c的转化中颜色变化为白
A. 石墨烯和 金刚石均含有 个碳原子 色→红褐色→红棕色
B.1L 1 mol·L-1 的NaCO 溶液中含有的阴离子数目大于N 8.硝酸可用于制化肥、农药、染料等。工业制备硝酸的过程如下图所示,下列说法正确的是
2 3 A
C.87g MnO 与足量的的浓盐酸加热条件下充分反应,转移的电子数是2N
2 A
D.铅蓄电池放电时,当正极质量增加9.6g时,电路中通过的电子数目为0.2N
A
4.下列实验对应的离子方程式正确的是A.合成氨塔中采用高温有利于提高反应物的平衡转化率 A.可用“水浸”操作直接提取钾长石中的主要成分
B.图中A和B分别为氧气和水 B.“浸渣Ⅰ”可以作为冶炼金属铝的主要原料
C.常温下,铝与浓硝酸不反应,可用铝罐材料盛装浓硝酸 C.“碱化Ⅱ”发生的主要反应为
D.尾气不需要净化处理,可以直接排放
D.流程中只有 可循环利用
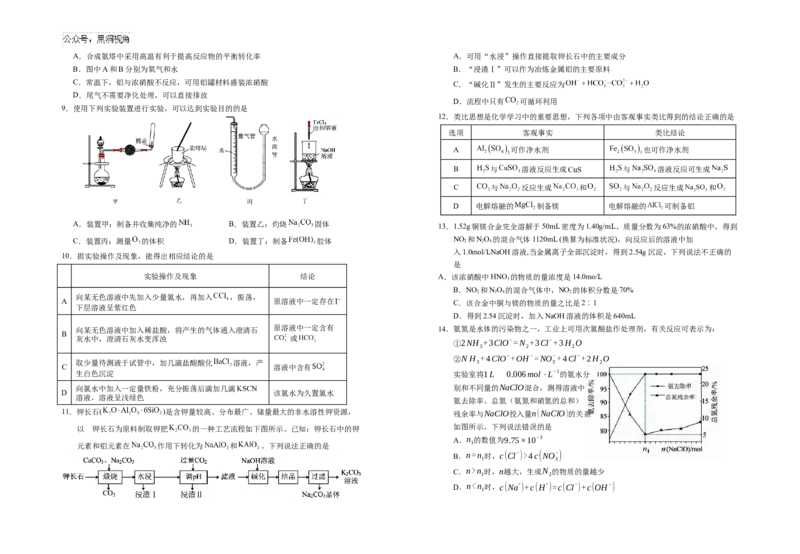
9.使用下列实验装置进行实验,可以达到实验目的的是
12.类比思想是化学学习中的重要思想,下列各项中由客观事实类比得到的结论正确的是
选项 客观事实 类比结论
A 可作净水剂 也可作净水剂
B 与 溶液反应生成 与 溶液反应可生成
C 与 反应生成 和 与 反应生成 和
D 电解熔融的 制备镁 电解熔融的 可制备铝
A.装置甲:制备并收集纯净的 B.装置乙:灼烧 固体
13.1.52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到
C.装置丙:测量 的体积 D.装置丁:制备 胶体 NO 2 和N 2 O 4 的混合气体1120mL (换算为标准状况),向反应后的溶液中加
入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀,下列说法不正确的
10.据实验操作及现象,能得出相应结论的是
是
实验操作及现象 结论 A.该浓硝酸中HNO 的物质的量浓度是14.0mo/L
3
B.NO 和NO 的混合气体中,NO 的体积分数是70%
2 2 4 2
向某无色溶液中先加入少量氯水,再加入 ,振荡,
A 原溶液中一定存在 C.该合金中铜与镁的物质的量之比是2︰1
下层溶液呈紫红色
D.得到2.54沉淀时,加入NaOH溶液的体积是640mL
向某无色溶液中加入稀盐酸,将产生的气体通入澄清石 原溶液中一定含有 14.氨氮是水体的污染物之一,工业上可用次氯酸盐作处理剂,有关反应可表示为:
B
灰水中,澄清石灰水变浑浊 或
①2NH +3ClO−=N +3Cl−+3H O
3 2 2
②N H +4ClO−+OH−=NO−+4Cl−+2H O
取少量待测液于试管中,加几滴盐酸酸化 溶液,产 3 3 2
C 溶液中含有
生白色沉淀 实验室将1L 0.006mol⋅L−1的氨水分
向氯水中加入一定量铁粉,充分振荡后滴加几滴KSCN 别和不同量的NaClO混合,测得溶液中
D 该氯水为久置氯水
溶液,溶液呈浅绿色
氨去除率、总氮(氨氮和硝氮的总和)
11.钾长石( )是含钾量较高、分布最广、储量最大的非水溶性钾资源, 残余率与NaClO投入量n(NaClO)的关系
以 钾长石为原料制取钾肥 的一种工艺流程如下图所示。已知:钾长石中的钾 如图所示。下列说法错误的是
A.n 的数值为9.75×10−3
1
元素和铝元素在 作用下转化为 和 。下列说法正确的是
B.n=n 时,c(Cl−)>4c(NO−)
1 3
C.n>n 时,n越大,生成N 的物质的量越少
1 2
D.n”或
_______。 “<”)。
(5)相对方法1,方法2具有突出优势有 (答一条即可)。
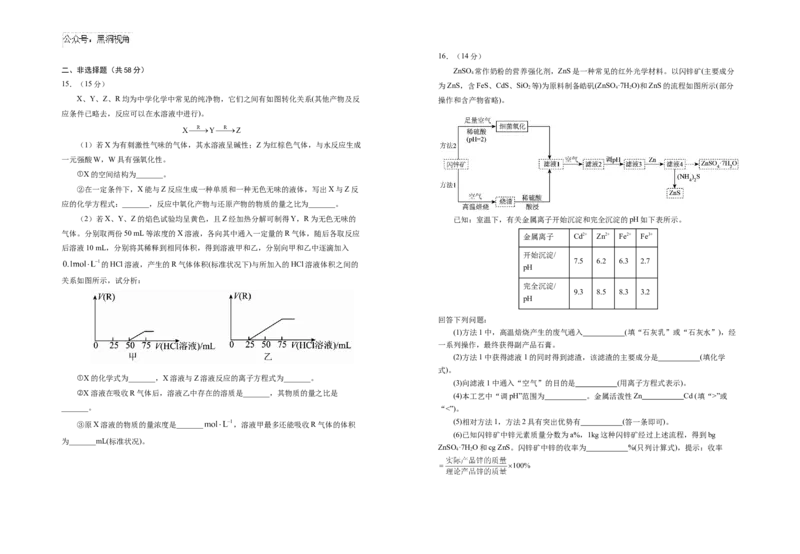
③原X溶液的物质的量浓度是_______ ,溶液甲最多还能吸收R气体的体积
(6)已知闪锌矿中锌元素质量分数为a%,1kg这种闪锌矿经过上述流程,得到bg
为_______mL(标准状况)。
ZnSO·7H O和cg ZnS。闪锌矿中锌的收率为 %(只列计算式),提示:收率
4 217.(14分) 18.(15分)
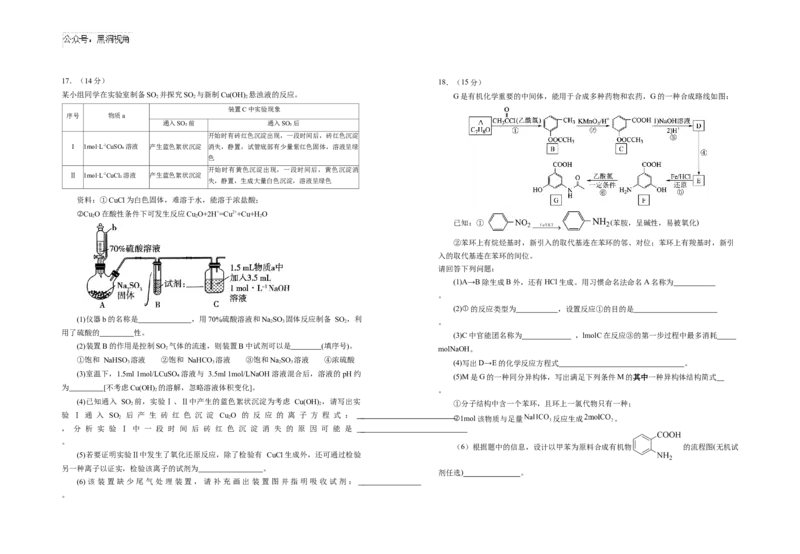
某小组同学在实验室制备SO 2 并探究SO 2 与新制Cu(OH) 2 悬浊液的反应。 G是有机化学重要的中间体,能用于合成多种药物和农药,G的一种合成路线如图:
装置C中实验现象
序号 物质a
通入SO₂前 通入SO₂后
开始时有砖红色沉淀出现,一段时间后,砖红色沉淀
I 1mol·L-1CuSO₄溶液 产生蓝色絮状沉淀 消失,静置,试管底部有少量紫红色固体,溶液呈绿
色
开始时有黄色沉淀出现,一段时间后,黄色沉淀消
Ⅱ 1mol·L-1CuCl₂溶液 产生蓝色絮状沉淀
失,静置,生成大量白色沉淀,溶液呈绿色
资料:①CuCl为白色固体,难溶于水,能溶于浓盐酸;
②Cu O在酸性条件下可发生反应Cu O+2H+=Cu2++Cu+HO
2 2 2
已知:① (苯胺,呈碱性,易被氧化)
②苯环上有烷烃基时,新引入的取代基连在苯环的邻、对位;苯环上有羧基时,新引
入的取代基连在苯环的间位。
请回答下列问题:
(1)A→B除生成B外,还有HCl生成。用习惯命名法命名A名称为
。
(2)①的反应类型为 ,设置反应①的目的是
(1)仪器b的名称是 ,用70%硫酸溶液和NaSO 固体反应制备 SO ,利
2 3 2 。
用了硫酸的 性。
(3)C中官能团名称为 ,lmolC在反应③的第一步过程中最多消耗
(2)装置B的作用是控制SO 气体的流速,则装置B中试剂可以是 (填序号)。
2 molNaOH。
①饱和 NaHSO 溶液 ②饱和 NaHCO 溶液 ③饱和NaSO 溶液 ④浓硫酸
3 3 2 3 (4)写出D→E的化学反应方程式 。
(3)室温下,1.5ml 1mol/LCuSO₄溶液与 3.5ml 1mol/LNaOH溶液混合后,溶液的pH约
(5)M是G的一种同分异构体,写出满足下列条件M的其中一种异构体结构简式
为 [不考虑Cu(OH) 的溶解,忽略溶液体积变化]。
2 。
(4)已知通入 SO 2 前,实验Ⅰ、Ⅱ中产生的蓝色絮状沉淀为考虑 Cu(OH) 2 ,请写出实 ①分子结构中含一个苯环,且环上一氯代物只有一种;
验 Ⅰ 通 入 SO 后 产 生 砖 红 色 沉 淀 Cu O 的 反 应 的 离 子 方 程 式 :
2 2 ②1mol该物质与足量 反应生成 。
, 分 析 实 验 Ⅰ 中 一 段 时 间 后 砖 红 色 沉 淀 消 失 的 原 因 可 能 是
。
(6)根据题中的信息,设计以甲苯为原料合成有机物 的流程图(无机试
(5)若要证明实验Ⅱ中发生了氧化还原反应,除了检验有 CuCl生成外,还可通过检验
另一种离子以证实,检验该离子的试剂为 。
剂任选) 。
(6)该装置缺少尾气处理装置,请补充画出装置图并指明吸收试剂:
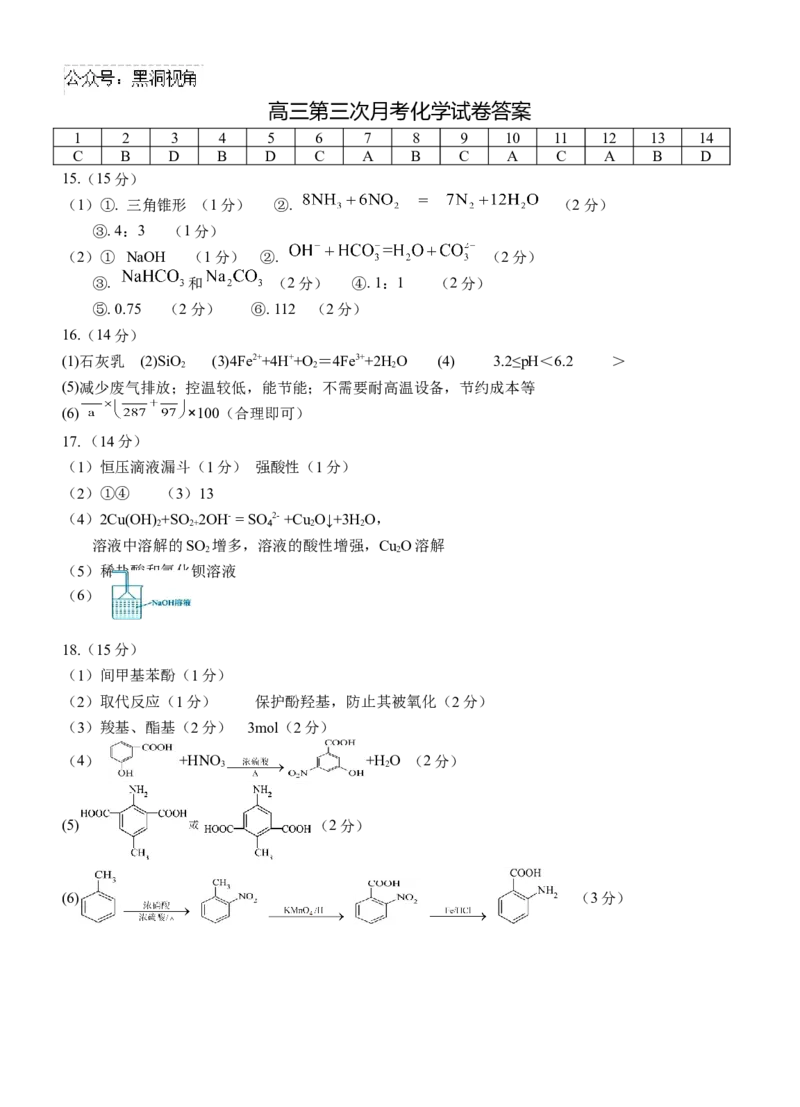
。高三第三次月考化学试卷答案
1 2 3 4 5 6 7 8 9 10 11 12 13 14
C B D B D C A B C A C A B D
15.(15分)
(1)①. 三角锥形 (1分) ②. (2分)
③. 4:3 (1分)
.
(2)① NaOH (1分) ②. (2分)
③. 和 (2分) ④. 1:1 (2分)
⑤. 0.75 (2分) ⑥. 112 (2分)
16.(14分)
(1)石灰乳 (2)SiO (3)4Fe2++4H++O =4Fe3++2H O (4) 3.2≤pH<6.2 >
2 2 2
(5)减少废气排放;控温较低,能节能;不需要耐高温设备,节约成本等
(6) ×100(合理即可)
17.(14分)
(1)恒压滴液漏斗(1分) 强酸性(1分)
(2)①④ (3)13
(4)2Cu(OH) +SO 2OH- = SO₄2- +Cu O↓+3H O,
2 2+ 2 2
溶液中溶解的SO 增多,溶液的酸性增强,Cu O溶解
2 2
(5)稀盐酸和氯化钡溶液
(6)
18.(15分)
(1)间甲基苯酚(1分)
(2)取代反应(1分) 保护酚羟基,防止其被氧化(2分)
(3)羧基、酯基(2分) 3mol(2分)
(4) +HNO +H O (2分)
3 2
(5) (2分)
(6) (3分)