文档内容
2027届高二上学期9月月考
化学试卷
试题满分:100分 考试时间:75分钟
注意事项:
1.本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分。答卷前,考生务必将自己的姓名、准
考证号填写在答题卡上。
2.回答第I卷时,选出每小题答案后,用2B铅笔把答题卡上对应题目的答案标号涂黑。如需改动,
用橡皮擦干净后,再选涂其他答案标号。写在本试卷上无效。
3.回答第Ⅱ卷时,将答案写在答题卡上。写在本试卷上无效。
可能用到的相对原子质量:H-1 B-11 C-12 N-14 O-16 Na-23 Al-27 Si-28 P-31 S-32
Cl-35.5 Fe-56 Cu-64
I卷(选择题)
一、选择题:本题共 15个小题,每小题3分,共45分。在每小题给出的四个选项中,只有
一项是符合题目要求的。
1.下列过程中,化学反应速率的增大对人类生产和生活有益的是( )
A.橡胶老化 B.铁桥生锈 C.食物变质 D.氨的合成
2.在铁粉和过量2mol/L的稀HSO 反应中,下列各措施能加快的速率,但又不影响H 的总量的是(
2 4 2
)
A.加入少量的CuSO 溶液 B.将2mol/L的稀硫酸改成98%的浓硫酸
4
C.将铁粉改为铁片 D.加热
3.反应C(s)十HO(g) CO(g)十H(g) 在一密闭容器中进行,下列条件的改变能使反应速率减小的是
2 2
A.减少C的量 B.容积不变,增加水蒸气的量
C.升温 D.压强不变,充入Ne
4.下列变化过程中∆H<0的是
A.电解Al O 得到Al和O B.碳和水蒸气制备水煤气
2 3 2
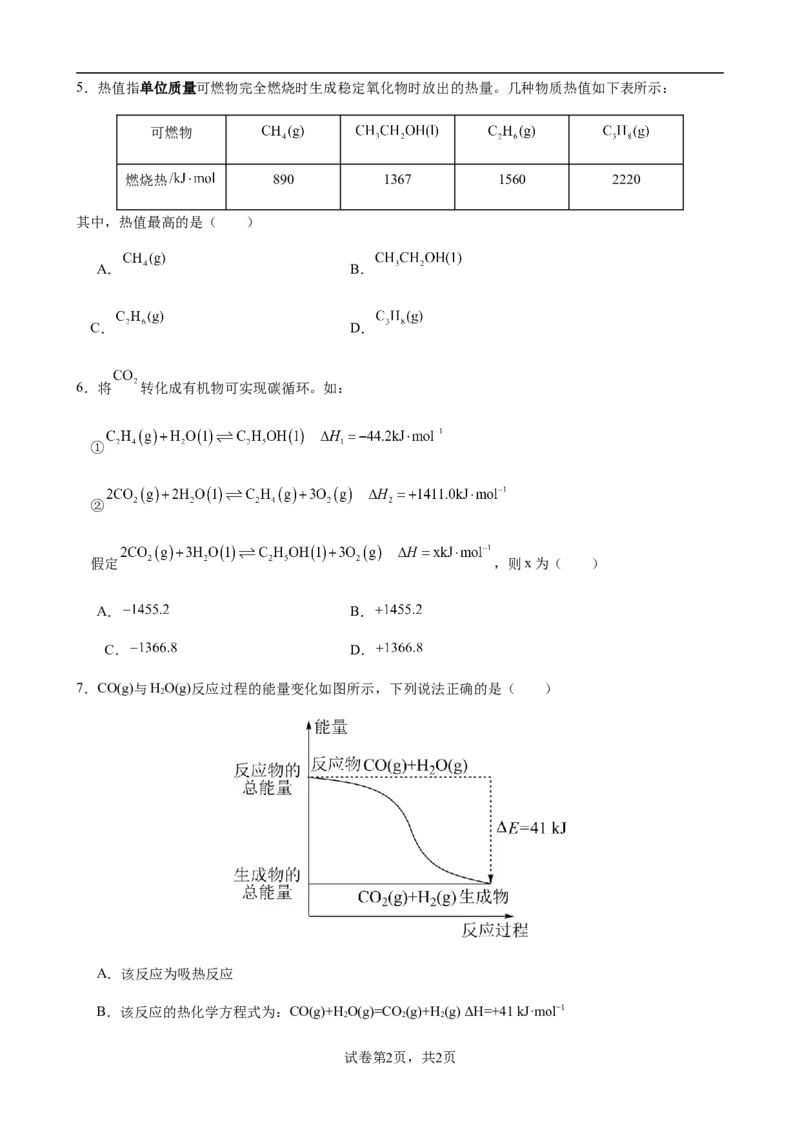
C.镁与稀盐酸反应 D.液体水的汽化5.热值指单位质量可燃物完全燃烧时生成稳定氧化物时放出的热量。几种物质热值如下表所示:
可燃物
燃烧热 890 1367 1560 2220
其中,热值最高的是( )
A. B.
C. D.
6.将 转化成有机物可实现碳循环。如:
①
②
假定 ,则x为( )
A. B.
C. D.
7.CO(g)与HO(g)反应过程的能量变化如图所示,下列说法正确的是( )
2
A.该反应为吸热反应
B.该反应的热化学方程式为:CO(g)+HO(g)=CO(g)+H(g) ΔH=+41 kJ·mol−1
2 2 2
试卷第2页,共2页C.CO(g)和HO(g)的总键能大于CO(g)和H(g)的总键能
2 2 2
D.1 mol CO(g)和HO(l)反应生成1 mol CO (g)和1 mol H (g)放出热量小于41 kJ
2 2 2
8.热化学方程式C(s)+HO(g)=CO(g)+H (g) ΔH=+131.3 kJ·mol-1表示( )
2 2
A.碳和水反应吸收131.3 kJ能量
B.1 mol碳和1 mol水反应生成一氧化碳和氢气并吸收131.3 kJ热量
C.1 mol固态碳和1 mol水蒸气反应生成一氧化碳气体和氢气,并吸热131.3 kJ
D.1个固态碳原子和1分子水蒸气反应吸收131.3 kJ热量
9.反应A(g)+2B(g) C(g)+D(g)+QkJ的能量变化如图所示,有关叙述正确的是( )
A.Q=E
2
B.在反应体系中加入催化剂,反应速率增大,E 减小,E 不变
1 2
C.Q>0,升高温度,正反应速率增大,逆反应速率减小
D.若减小体积,平衡会移动,当反应再次达到平衡时,A的平
衡浓度增大
10.CH 和CO 可以制造价值更高的化学产品。已知:
4 2
CH(g)+2O(g)=CO(g)+2HO(g) △H=a kJ·mol-1
4 2 2 2 1
CO(g)+HO(g)=CO(g)+H(g) △H=b kJ·mol-1
2 2 2 2
2CO(g)+O(g)=2CO(g) △H=c kJ·mol-1
2 2 3
则反应CO(g)+CH(g) 2CO(g)+2H(g)的△H用含a、b、c的代数式表示为
2 4 2
A.a+2b-c B.a+b-2c
C.2a+2b-c D.a+2b-2c
11.对于反应A(g)+3B(g)=2C(g)+2D(g),在不同条件下的化学反应速率如下,其中反应速率最快的是
A.V(A)=0.3mol·L-1s-1
B.v(B)=1.8mol·L-1s-1
C.v(C)=0.7mol·L-1s-1D.v(D)=3.2mol·L-1·min-1
12.一定温度下,向容积为1L的恒容密闭容器中加入2mol 气体和1mol 气体发生反应
,有关数据如表。下列说法正确的是
时间段/min 反应物 的平均消耗速率/( )
0~2 0.40
0~4 0.30
0~6 0.20
A.1min时, 的物质的量浓度为0.8 B.4min时, 的体积分数约为33.3%
C.5min时, 的物质的量为1mol D.6min时,充入氖气,正反应速率增大
13.下列关于化学反应速率和平衡的说法,正确的是
A.升高温度能增大单位体积内活化分子数目,加快反应速率
B.增大反应物浓度,可增大活化分子的百分数,因而反应速率加快
C.催化剂可以降低反应的反应热,进而提高反应速率
D.可逆反应:2NO (g) 2NO(g)+O(g),当n(NO )∶n(NO)∶n(O )=2∶2∶1时,反应达平衡
2 2 2 2
⇌
14.在2L密闭容器中进行反应:N+3H 2NH ,5min内氨的质量增加1.7g,反应速率
2 2 3
( )
A.v(NH )=0.02mol/(L·min)
3
B.v(NH )=0.01mol/(L·min)
3
C.v(N )=0.01mol/(L·min)
2
D.v(H )=0.03mol/(L·min)
2
15.已知CH 气体的燃烧热为802 kJ∙mol-1,1mol CH 不完全燃烧生成CO和HO(l)时放出的热量为519
4 4 2
试卷第4页,共2页kJ。如果1 mol CH 与一定量O 燃烧生成CO、CO、HO,并放出731.25 kJ的热量,则一定量O 的质量
4 2 2 2 2
为
A.40 g B.56 g C.60 g D.无法计算第II卷(非选择题)
二、非选择题(本题共4题,共55分)
16.(每空2分,共12分)化学反应作随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于放热反应的是___________(填字母)。
A.碳与水蒸气反应 B.铝和氧化铁反应 C.CaCO 受热分解 D.锌与盐酸反应
3
(2)获取能量变化的途径 ①已知:
化学键 Si−O Si−Cl H−H H−Cl Si−Si Si−C
键能(kJ/mol) a b c d e f
则:SiCl (g)+2H(g)=Si(s)+4HCl(g) 的反应热ΔH= kJ/mol。(1molSi中含有2molSi−Si)
4 2
②已知在常温常压下:i.2CHOH(l)+3O (g)=2CO (g)+4HO(g) ΔH=−1275.6kJ/mol
3 2 2 2
ii.HO(l)=HO(g) ΔH=+44.0kJ/mol
2 2
写出表示甲醇燃烧热的热化学方程式
。
③利用实验装置测量利用下图装置制定中和热的实验步骤如下:
①用量筒量取0.25mol/L的硫酸50mL倒入小烧杯中,测出硫酸溶液温度;
②用另一量筒量取50mL0.55mol/LNaOH溶液,并用同一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液的最高温度。
Ⅰ.仪器a的名称为 。
Ⅱ.做了四次实验,并将实验数据记录如下:
起始温度t℃ 终止温度t℃
1 2
温度实验次数
HSO NaOH 平均值
2 4
1 26.2 26.0 26.1 29.5
2 27.0 27.4 27.2 32.3
3 25.9 25.9 25.9 29.2
4 26.4 26.2 26.3 29.8
近似认为0.55mol/LNaOH溶液和0.25mol/L硫酸液的密度都是1g/cm3,中和后生成溶液的比热容
试卷第6页,共2页c=4.181J/(g∙°C),通过以上数据计算中和热ΔH= (结果保留少数点后一位)。
结果与−57.3kJ/mol有偏差的原团可能与下列哪些原因有关 。
A.量取硫酸溶液的体积时仰视读数 B.装置的隔热效果差
C.将NaOH溶液快速一次倒入盛硫酸的小烧杯中 D.搅拌不充分
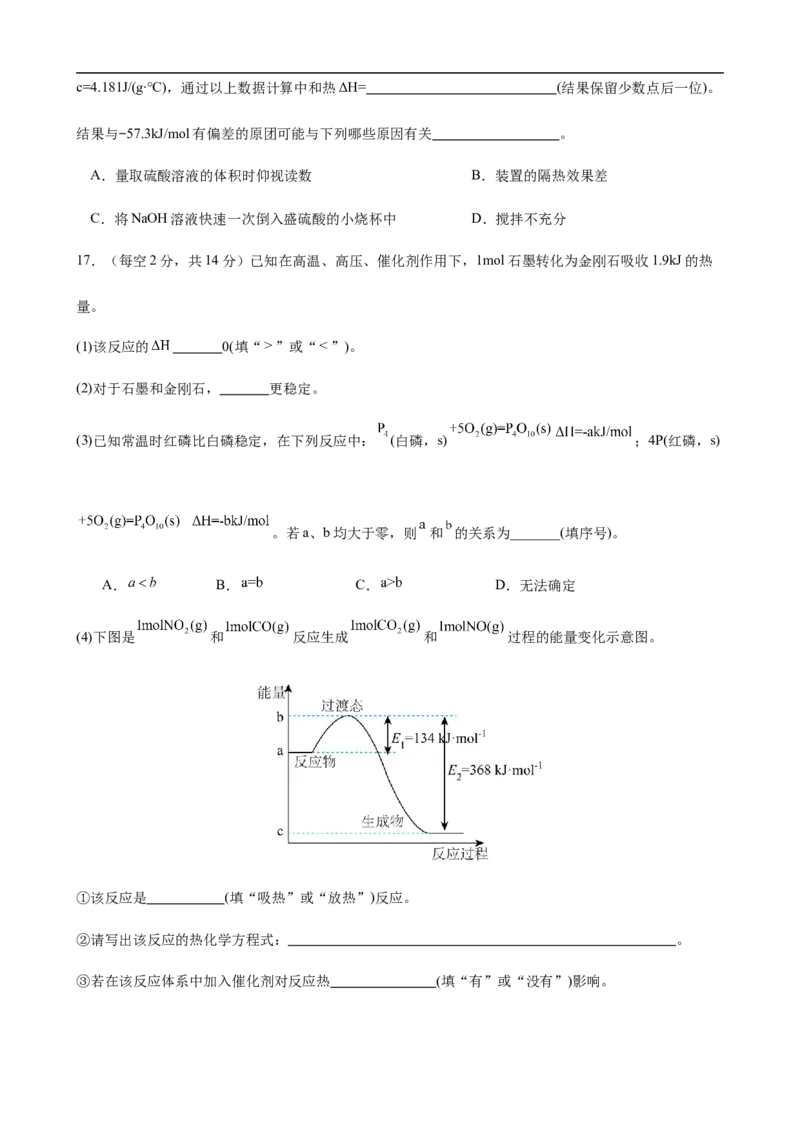
17.(每空2分,共14分)已知在高温、高压、催化剂作用下,1mol石墨转化为金刚石吸收1.9kJ的热
量。
(1)该反应的 0(填“ ”或“ ”)。
(2)对于石墨和金刚石, 更稳定。
(3)已知常温时红磷比白磷稳定,在下列反应中: (白磷,s) ;4P(红磷,s)
。若a、b均大于零,则 和 的关系为_______(填序号)。
A. B. C. D.无法确定
(4)下图是 和 反应生成 和 过程的能量变化示意图。
①该反应是 (填“吸热”或“放热”)反应。
②请写出该反应的热化学方程式: 。
③若在该反应体系中加入催化剂对反应热 (填“有”或“没有”)影响。(5)0.3mol的气态高能燃料乙硼烷 在氧气中氧化生成固态三氧化二硼和液态水时放出649.5kJ热
量,其热化学方程式为
。
试卷第8页,共2页18.(第(1)①第一空1分,其余每空2分,共15分)Ⅰ.天然气既是高效洁净的能源,又是重要的化工
原料,在生产、生活中用途广泛。回答下列问题:
(1)①下图是一个简易测量某反应是放热反应还是吸热反应的实验装
置。将镁片加入小试管内,然后注入足量的盐酸, 形管中液面A
填“上升”或“下降” ,说明此反应是 填“放热”或“吸
热” 反应。
若换为下列反应,则与 中 形管中现象不同的有 填字母 。
A.
B.
C.
D.
(2)甲烷可以消除氮氧化物污染。如: 。下列措施不能使该
反应速率加快的是 填字母 。
A.使用合适的催化剂 B.升高温度
C.及时分离 D.把容器的体积缩小一倍
E.恒容条件下充入 F.恒容条件下充入 惰性气体
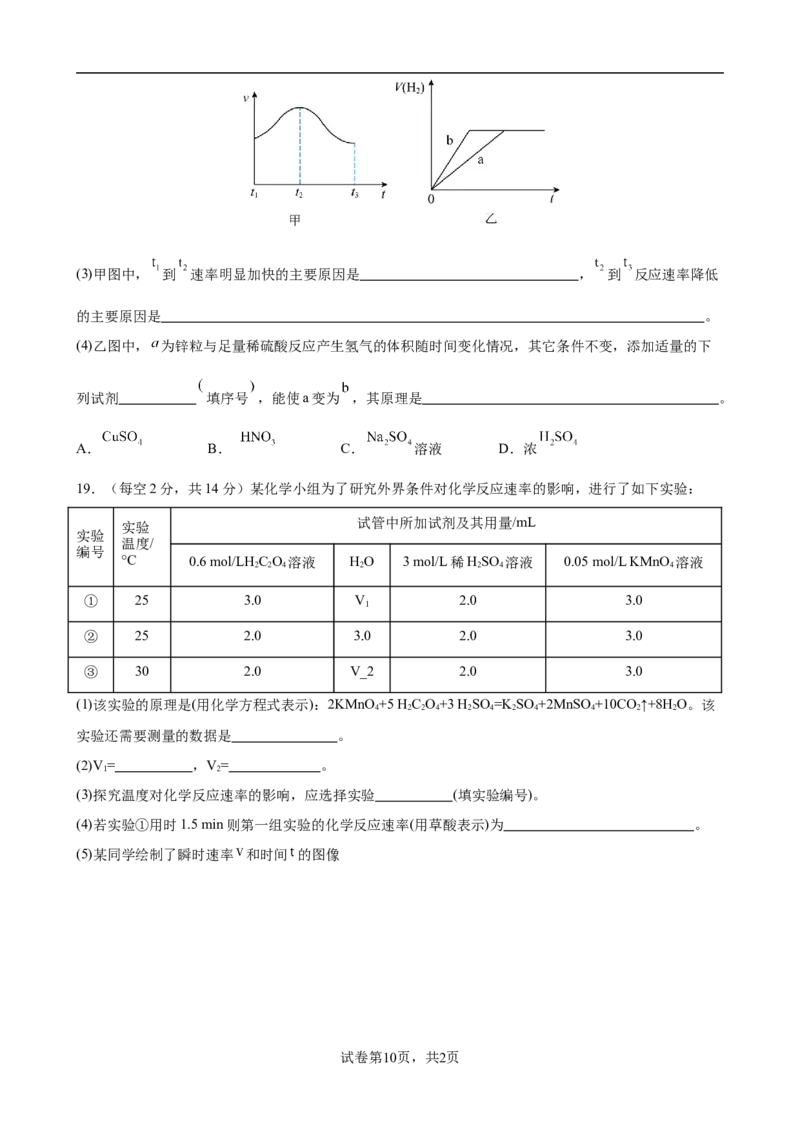
Ⅱ.某实验小组通过锌粒与稀硫酸反应的实验,研究影响反应速率的因素,并绘制出甲、乙两种图象。(3)甲图中, 到 速率明显加快的主要原因是 , 到 反应速率降低
的主要原因是 。
(4)乙图中, 为锌粒与足量稀硫酸反应产生氢气的体积随时间变化情况,其它条件不变,添加适量的下
列试剂 填序号 ,能使a变为 ,其原理是 。
A. B. C. 溶液 D.浓
19.(每空2分,共14分)某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
试管中所加试剂及其用量/mL
实验
实验
温度/
编号
°C 0.6 mol/LHC O 溶液 HO 3 mol/L稀HSO 溶液 0.05 mol/L KMnO 溶液
2 2 4 2 2 4 4
① 25 3.0 V 2.0 3.0
1
② 25 2.0 3.0 2.0 3.0
③ 30 2.0 V_2 2.0 3.0
(1)该实验的原理是(用化学方程式表示):2KMnO +5 H C O+3 H SO =K SO +2MnSO +10CO ↑+8H O。该
4 2 2 4 2 4 2 4 4 2 2
实验还需要测量的数据是 。
(2)V = ,V= 。
1 2
(3)探究温度对化学反应速率的影响,应选择实验 (填实验编号)。
(4)若实验①用时1.5 min则第一组实验的化学反应速率(用草酸表示)为 。
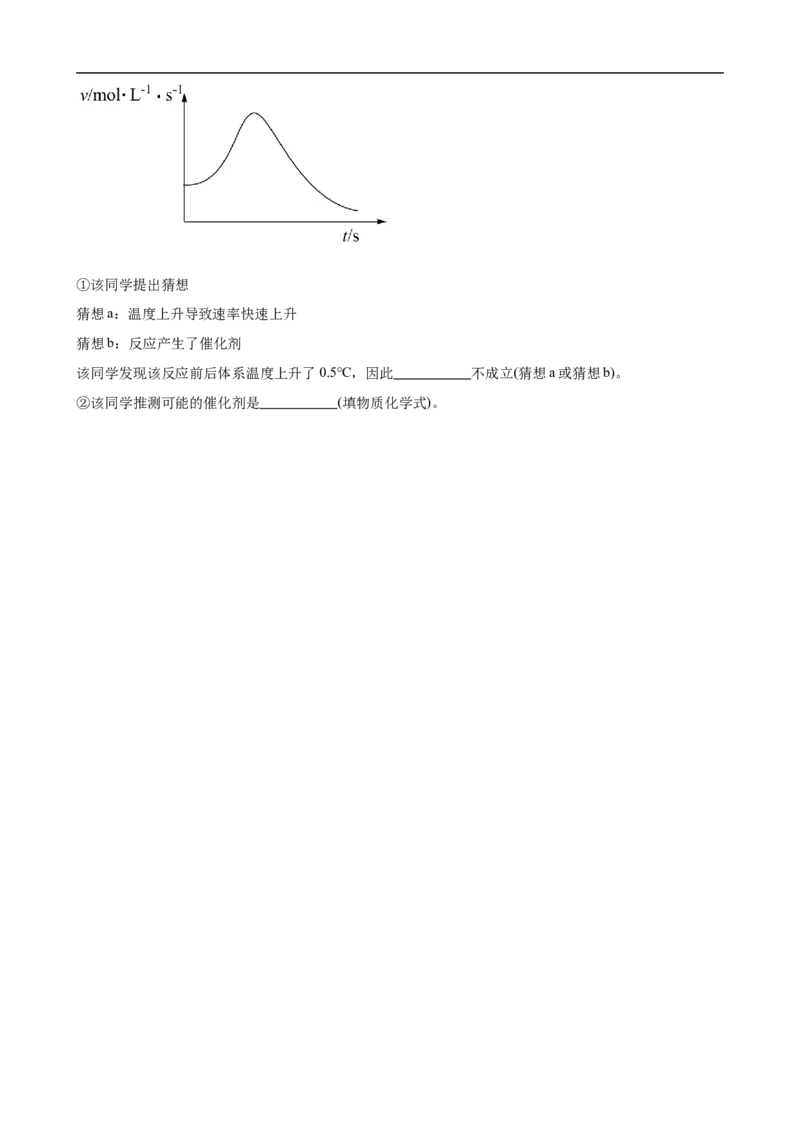
(5)某同学绘制了瞬时速率 和时间 的图像
试卷第10页,共2页①该同学提出猜想
猜想a:温度上升导致速率快速上升
猜想b:反应产生了催化剂
该同学发现该反应前后体系温度上升了0.5℃,因此 不成立(猜想a或猜想b)。
②该同学推测可能的催化剂是 (填物质化学式)。