文档内容
南京市 2024-2025 学年度第二学期五校联盟期中学情调
研 高二化学试卷
本卷: 共 100分 考试时间:75分钟
可能用到的相对原子质量:H-1 C-12 O-16 Ti-48 Fe-56 Co-59 Ba-137
一、单项选择题:共 13 题,每题 3 分,共 39 分。每题只有一个选项最符合题
意。
1. 自主创新是我国成为世界科技强国的关键支点。通过持续不断的科技创新,我国已在科
技领域取得了显著成就。下列说法不正确的是
A “鸿蒙”操作系统——载体芯片的主体材料属于金属晶体
B .自主研发的大型飞机 C919 用到的氮化硅陶瓷是新型无机非金属材料
C .量子科技“墨子号”使用光纤作为地面传输材料,其主要成分为二氧化硅
D .我国首次获得公斤级丰度99% 的 产品, 与"MO 互为同位
素
2. 下列化学用语表示正确的
A .s,的电子式: B .sO, 分子的 VSEPR 模型为:
C .邻羟基苯甲醛分子内氢键示意图:
D .NH;是极性键构成的非极性分子
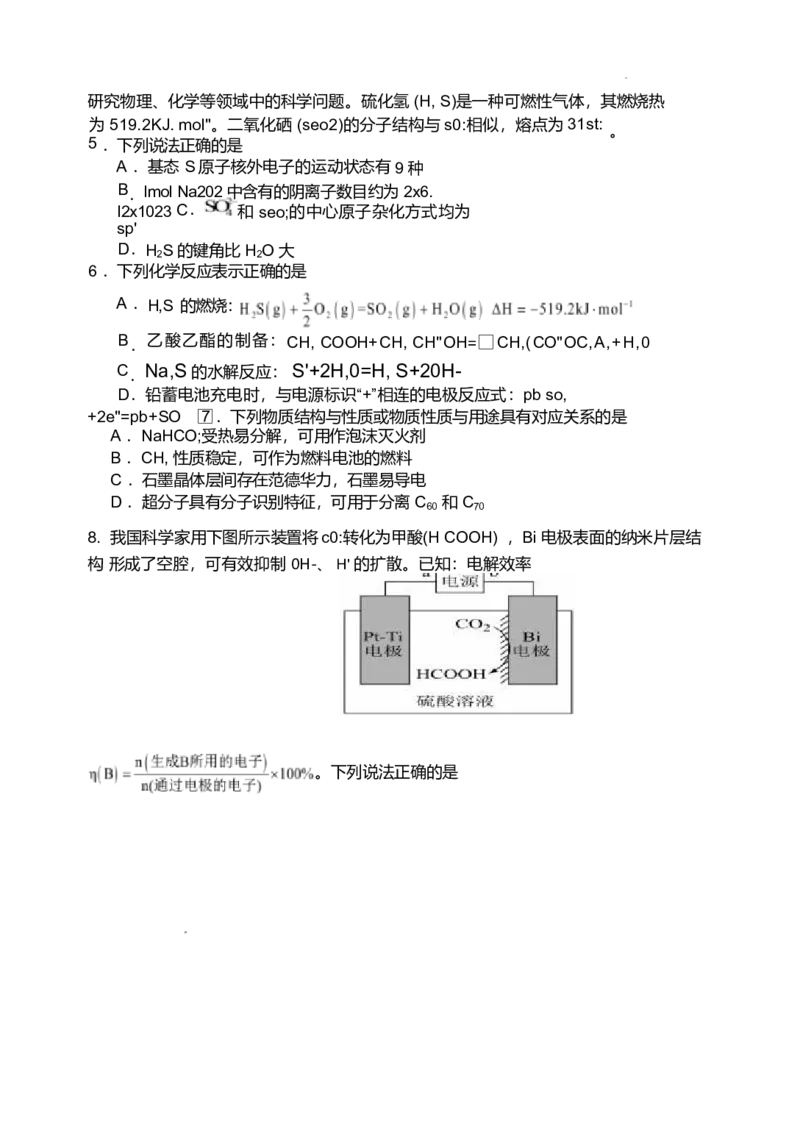
3. 用下列仪器或装置进行相应实验,操作规范且能达到实验目的的是
A .配制一定物质的量浓度的 NaOH 溶液 B .除去S0: 中的 S0;
C .分离 Fe(OH);胶体中的 NaCl D .蒸干 溶液得到无水
4. 臭氧(Q)在 [re1n,o, I"催化下能将烟气中的so2、NOY分别氧化为 sa和 。
下 列关于 N、0、 S、 Fe 元素及其化合物的说法正确的是
A 原子半径: B 沸点: H, S>H2O>N HY
. .
C 第一电离能: I,(N)>I,(0)>I,(S) D 电负性:x(Fe)0
热水中 加深
向I mL0.I mol-L"KI 溶液中加入
C
5mL0.1mol-L'Fecl I
溶液,萃
溶
色
液变成红
反
Fe
应
" 与 I-所发生的反应为可逆
取 分液后,向水层滴入 KSCN
溶液
向锌粒和稀硫酸反应的试管中, 气体生成速 CU SO4是锌和稀硫酸反应的
D
滴加几滴CU SO4溶液 率加快 催 化剂
12. 室温下,通过下列实验探究 NaClO 的性质。已知:K (HClO)=3×10-8 ,K (H CO )=4×
a a1 2 3
10-7 ,K (H CO )=5×10-11。
a2 2 3
实验 1 :测定 0.1mol·L-1NaClO 溶液的 pH。
实验 2 :向 0.1mol·L-1NaClO 溶液中加入稀硫酸至 pH=7。
实验 3 :向 0.1mol·L-1NaClO 溶液中通入少量 CO 2。
实验 4 :向 0.1mol·L-1NaClO 溶液中通入少量 SO ,再加入 BaCl 溶液,产生白色沉淀。
2 2
下列说法正确的是
A .实验 1 所测 NaClO 溶液的 pH>11
B .实验 2 所得的溶液中:c(HClO)=2c(SO
) C .实验 3 所得溶液中:c(CO )>c(HCO )
D .实验 4 所得的溶液中:c(Ba2+)·c(SO )=K (BaSO )
sp 313. 由 CO 催化加氢制 CH OH 的反应体系中,发生的主要反应如
2 3
下。 反应 I :CO (g)+H (g)==CO(g)+H O(g) ;ΔH=+41.1kJ•mol-1。
2 2 2
反应 II :CO (g)+3H (g)==CH OH(g)+H O(g) ;ΔH=-49.0kJ•mol-1。
2 2 3 2
在其他条件相同的情况下,按 n(CO ): n(H )=1: 3(总量一定)投料于恒容密闭容器中进行反
2 2
应,CO2 的平衡转化率和甲醇的选择性[甲醇的选择性 : ]随温度的变化
趋势如图所示。
下列说法不正确的是
A .若反应 2CH OH(g)==CH OCH (g)+H O(g) ΔH=-24.5kJ•mol-1 ,则由 H 和 CO 制
3 3 3 2 2
备 二甲醚的热化学方程式:2CO(g)+4H (g)==CH OCH (g)+H O(g)
2 3 3 2
ΔH=-204.7kJ•mol-1
B .根据图中数据,温度选择 553K ,达到平衡时,反应体系内甲醇的产量最高
C .随着温度的升高,CO 的平衡转化率增加但甲醇的选择性降低,其原因可能
2
是 反应 II 平衡逆向移动幅度弱于反应 I 正向移动幅度
D .473~513K 范围内,温度升高,平衡时的 逐渐增大
二、非选择题:共 4 题,共 61 分。
14. (17 分) 三氯化六氨合钴 是一种橙黄色、微溶于水的配合物,常用于合成
其他含钴的配合物。利用含钴废料(含少量 Fe、Al 等杂质)制取[coiN a,. Jey,的工艺流程
如 图所示:已知:
①浸出液中含有的金属离子主要有co'- 、 、 Fe* 、 A1 。
②氧化性H,O,>CO">C Ilo;>Fe"
。
③ 、 、 、
K,[A(0H),]-1x10"。溶液中金属离子物质的量浓度低于 mol/L 时,可认为
沉淀完全。
(1)①co* 的价层电子轨道表示式是 ▲ ; [COIN m,. JC1中心离子配位数为 ▲ 。
②写出除杂过程中Nacl0;参与反应的离子方程式 ▲ 。
③调 pH 过程中加Na, c0,调节后会生成两种沉淀,同时得到的滤液中c(co")-0.1 mol/L
, 调节 pH 的范围为 ▲ 。
(2)滤液中加入NH, cl溶液有利于后续 与 NH; 的配合反应,其原因是 ▲ 。
生成的[COIN a,. J]coi:需隔绝空气保存,否则会很快转化为 。写出转化
为 [CON a,. JC,的化学反应方程式 ▲ 。
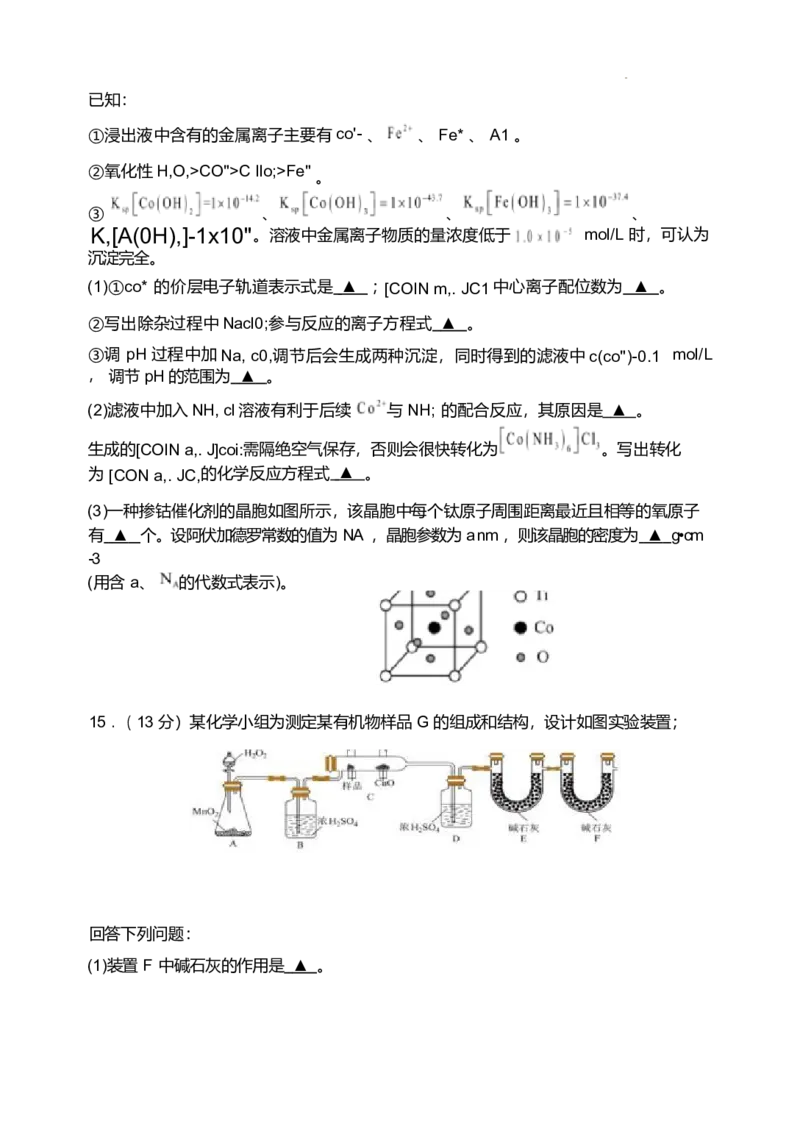
(3)一种掺钴催化剂的晶胞如图所示,该晶胞中每个钛原子周围距离最近且相等的氧原子
有 ▲ 个。设阿伏加德罗常数的值为 NA ,晶胞参数为 a nm ,则该晶胞的密度为 ▲ g•cm
-3
(用含 a、 的代数式表示)。
15 .( 13 分)某化学小组为测定某有机物样品 G 的组成和结构,设计如图实验装置;
回答下列问题:
(1)装置 F 中碱石灰的作用是 ▲ 。(2)若准确称取2.2g 样品 G(只含C、H、 0 三种元素) ,经充分燃烧后(CuO 的作用是确保
有 机物充分氧化,最终生成 C0:和 HO) ,装置 D 质量增加 1.8g ,U 形管 E 质量增加
4.4g。 G 的实验式为 ▲ 。
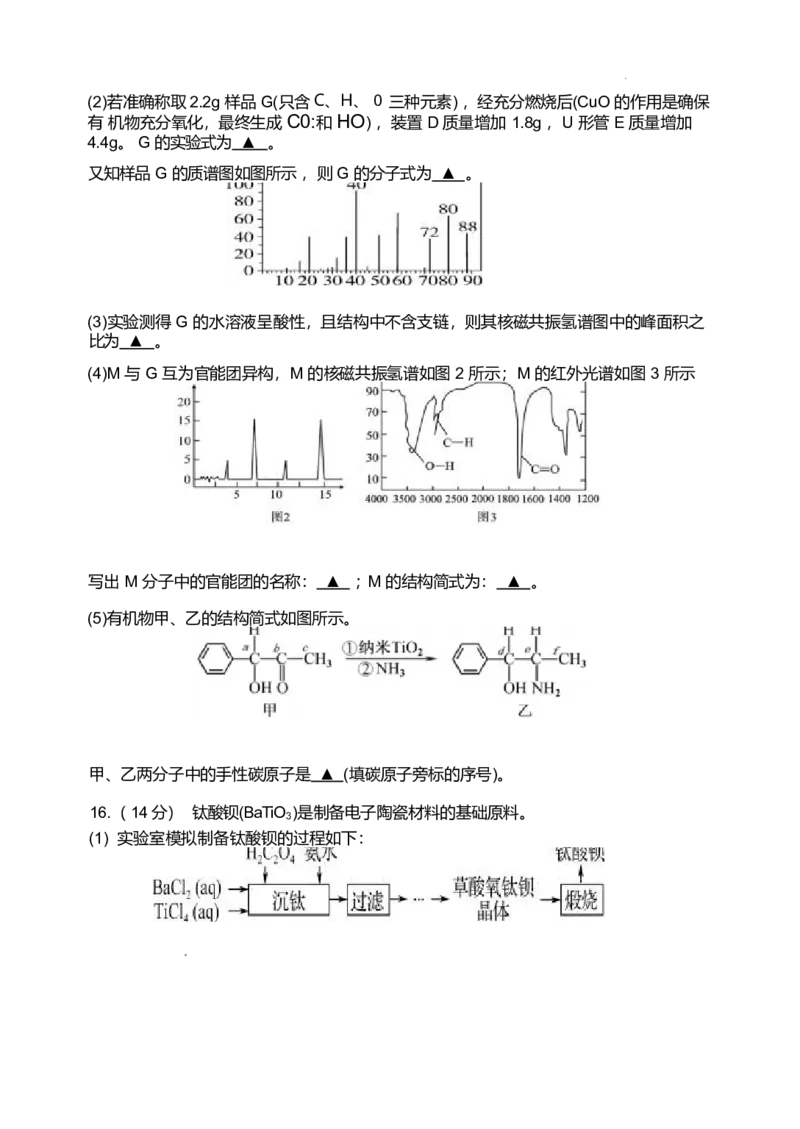
又知样品 G 的质谱图如图所示 ,则 G 的分子式为 ▲ 。
(3)实验测得 G 的水溶液呈酸性,且结构中不含支链,则其核磁共振氢谱图中的峰面积之
比为 ▲ 。
(4)M 与 G 互为官能团异构,M 的核磁共振氢谱如图 2 所示;M 的红外光谱如图 3 所示
写出 M 分子中的官能团的名称: ▲ ; M 的结构简式为: ▲ 。
(5)有机物甲、乙的结构简式如图所示。
甲、乙两分子中的手性碳原子是 ▲ (填碳原子旁标的序号)。
16.( 14 分) 钛酸钡(BaTiO )是制备电子陶瓷材料的基础原料。
3
(1) 实验室模拟制备钛酸钡的过程如下:已知:TiCl 能水解生成 TiO2+ ,TiO2 +能进一步水解生成 TiO ;钛酸钡 BaTiO 能与浓
4 2 3
硫 酸反应生成 TiO2+ ;草酸氧钛钡晶体的化学式为 BaTiO(C O ) ·4H O。
2 4 2 2
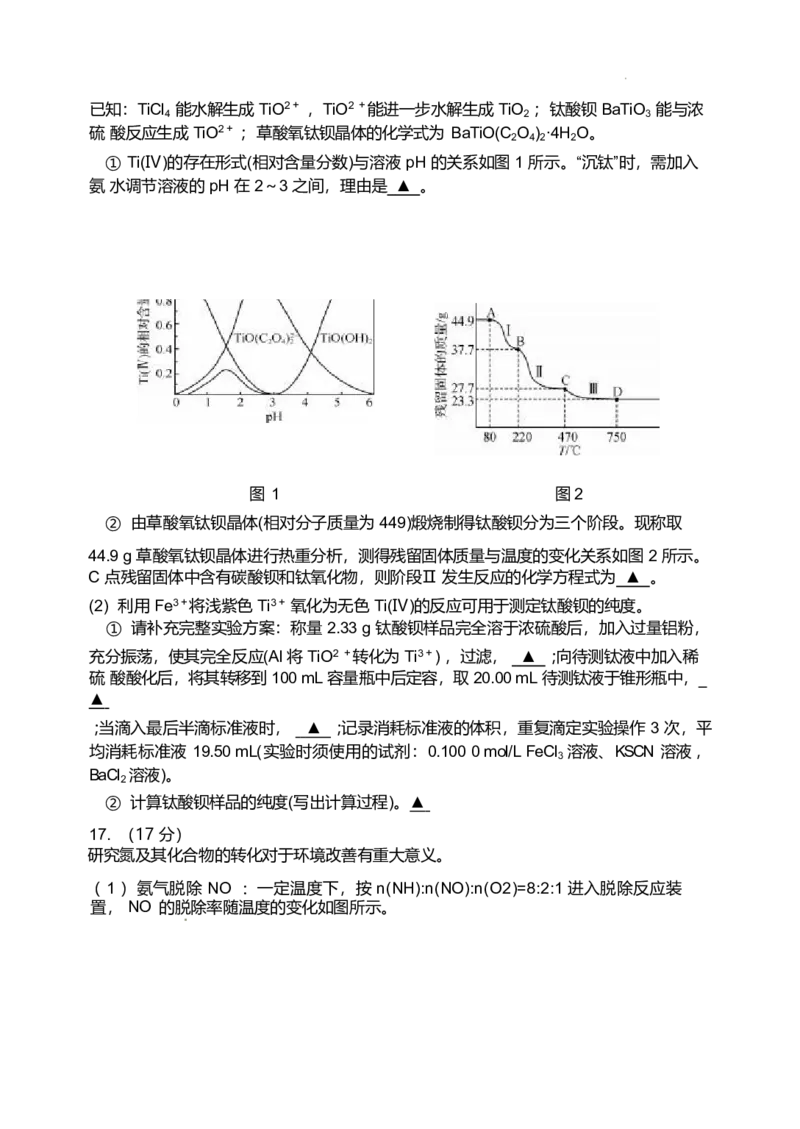
① Ti(Ⅳ)的存在形式(相对含量分数)与溶液 pH 的关系如图 1 所示。“沉钛”时,需加入
氨 水调节溶液的 pH 在 2~3 之间,理由是 ▲ 。
图 1 图 2
② 由草酸氧钛钡晶体(相对分子质量为 449)煅烧制得钛酸钡分为三个阶段。现称取
44.9 g 草酸氧钛钡晶体进行热重分析,测得残留固体质量与温度的变化关系如图 2 所示。
C 点残留固体中含有碳酸钡和钛氧化物,则阶段Ⅱ 发生反应的化学方程式为 ▲ 。
(2) 利用 Fe3+将浅紫色 Ti3+ 氧化为无色 Ti(Ⅳ)的反应可用于测定钛酸钡的纯度。
① 请补充完整实验方案:称量 2.33 g 钛酸钡样品完全溶于浓硫酸后,加入过量铝粉,
充分振荡,使其完全反应(Al 将 TiO2 +转化为 Ti3+) ,过滤, ▲ ;向待测钛液中加入稀
硫 酸酸化后,将其转移到 100 mL 容量瓶中后定容,取 20.00 mL 待测钛液于锥形瓶中,
▲
;当滴入最后半滴标准液时, ▲ ;记录消耗标准液的体积,重复滴定实验操作 3 次,平
均消耗标准液 19.50 mL(实验时须使用的试剂:0.100 0 mol/L FeCl 溶液、KSCN 溶液 ,
3
BaCl 溶液)。
2
② 计算钛酸钡样品的纯度(写出计算过程)。▲
17. (17 分)
研究氮及其化合物的转化对于环境改善有重大意义。
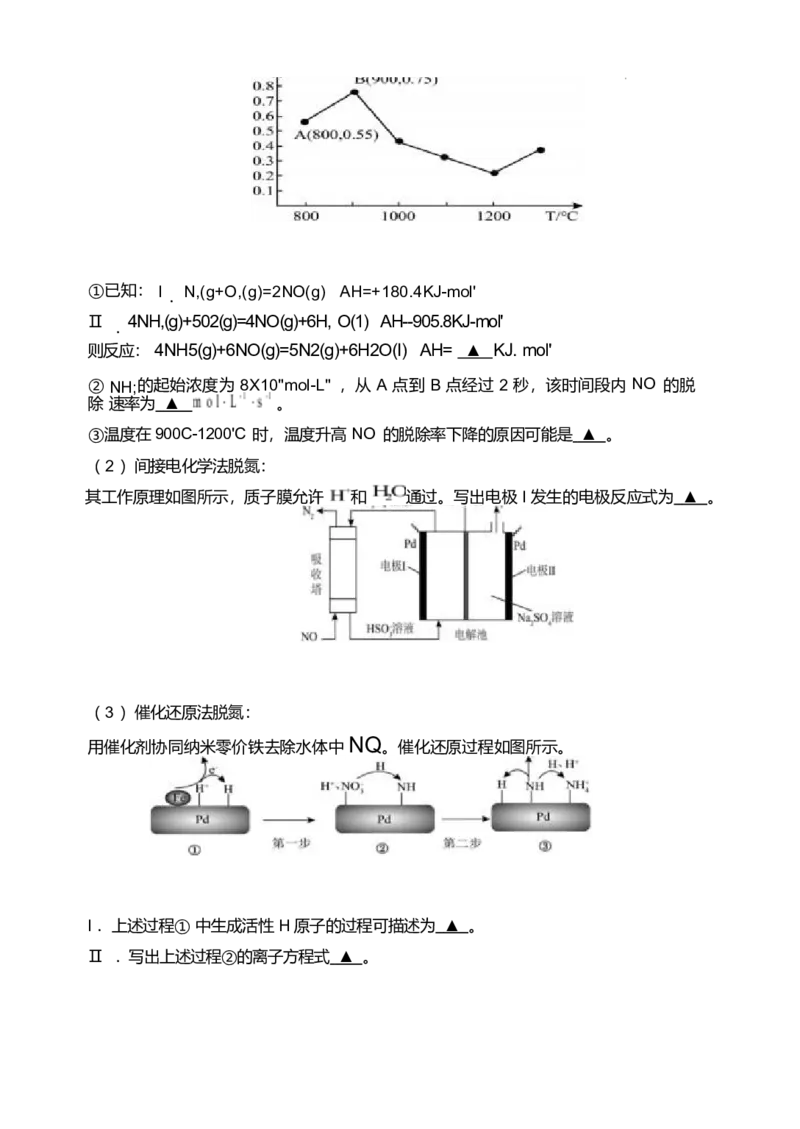
( 1 )氨气脱除 NO :一定温度下,按 n(NH):n(NO):n(O2)=8:2:1进入脱除反应装
置, NO 的脱除率随温度的变化如图所示。①已知: I N,(g+O,(g)=2NO(g) AH=+180.4KJ-mol'
.
Ⅱ 4NH,(g)+502(g)=4NO(g)+6H, O(1) AH--905.8KJ-mol'
.
则反应: 4NH5(g)+6NO(g)=5N2(g)+6H2O(I) AH= ▲ KJ. mol'
② NH;的起始浓度为 8X10"mol-L" ,从 A 点到 B 点经过 2 秒,该时间段内 NO 的脱
除 速率为 ▲ 。
③温度在900C-1200'C 时,温度升高 NO 的脱除率下降的原因可能是 ▲ 。
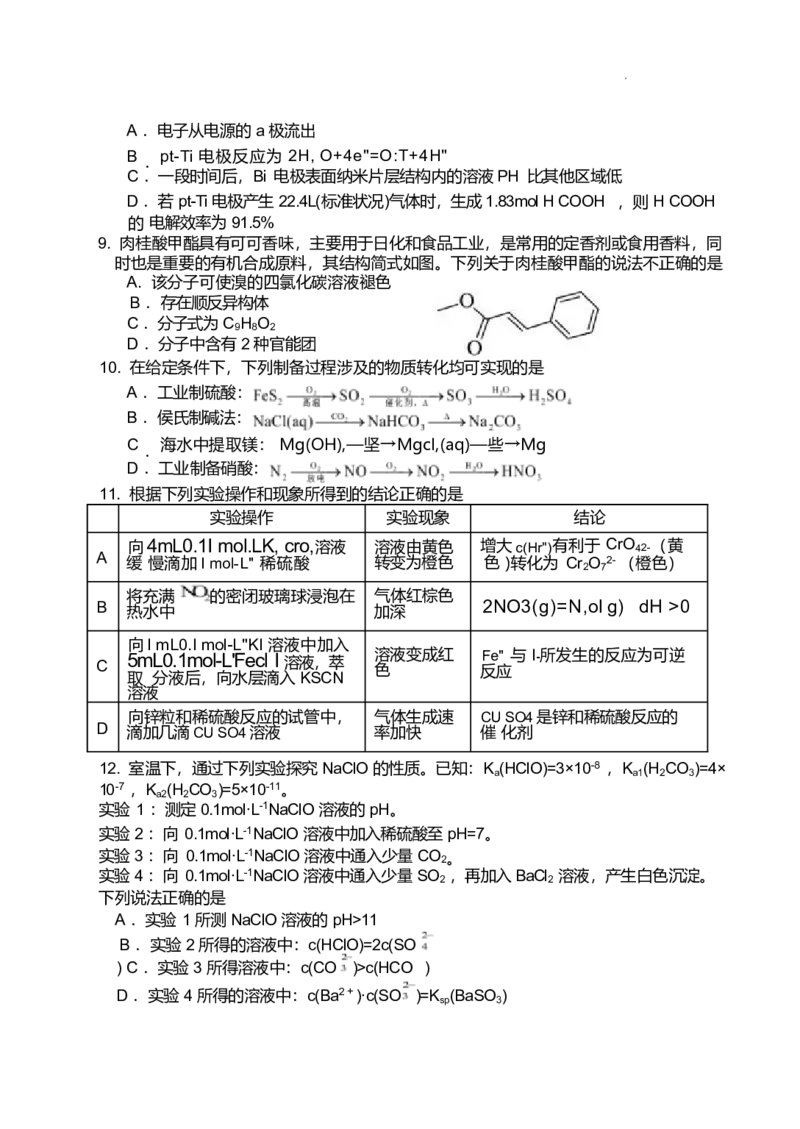
( 2 )间接电化学法脱氮:
其工作原理如图所示,质子膜允许 和 通过。写出电极 I 发生的电极反应式为 ▲ 。
( 3 )催化还原法脱氮:
NQ
用催化剂协同纳米零价铁去除水体中 。催化还原过程如图所示。
I .上述过程① 中生成活性 H 原子的过程可描述为 ▲ 。
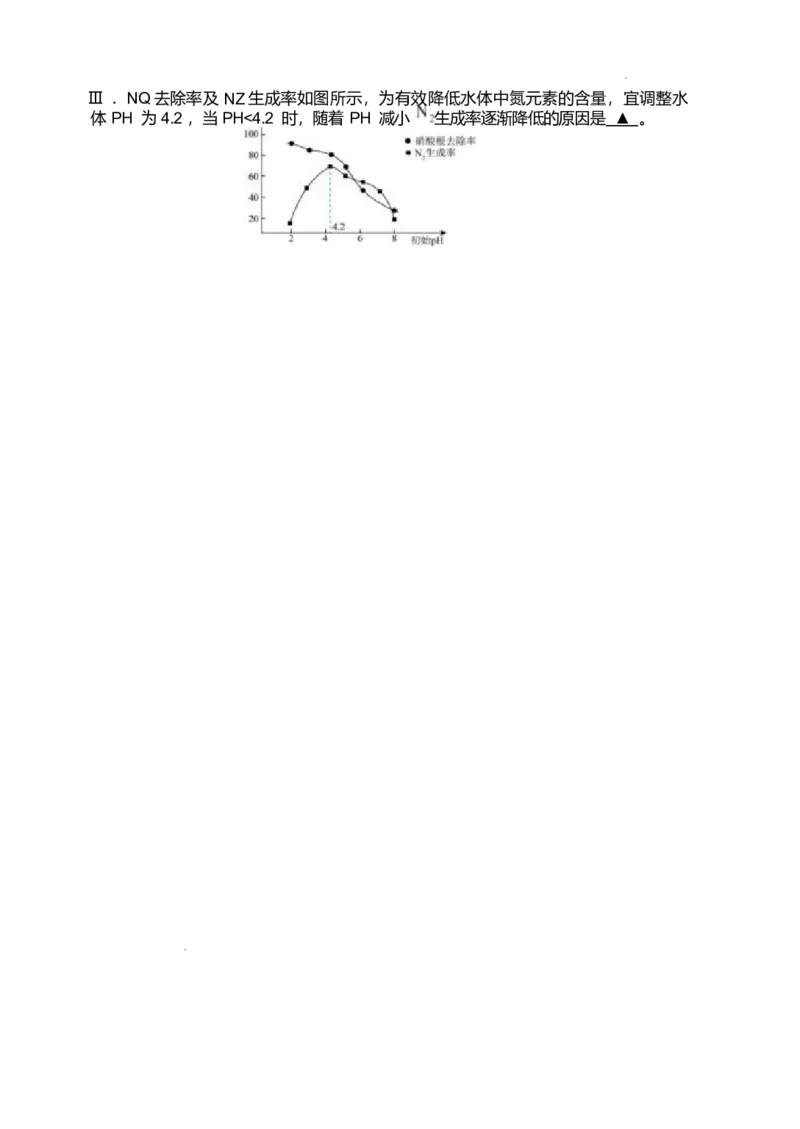
Ⅱ . 写出上述过程②的离子方程式 ▲ 。Ⅲ . NQ去除率及 NZ生成率如图所示,为有效降低水体中氮元素的含量,宜调整水
体 PH 为 4.2 ,当 PH<4.2 时,随着 PH 减小 生成率逐渐降低的原因是 ▲ 。南京市 2024-2025 学年度第二学期五校联盟期中学情调
研 高二化学试卷 答案
题 1 2 3 4 5 6 7 8 9 10
号
答 A B B C C B D D C A
案
题 11 12 13
号
答 A B D
案
14. (17 分)
(1) (8 分) ① ( 2 分,每空 1分) 6
② (3 分) ClO - +6Fe2+ +6H+ =Cl- + 6Fe3+ +3H O
3 2
③ (3 分) 4.7~7.4
(2) (5 分) ( 2 分)NH, cl电离出的 NH抑制氨水的电离,更有利于 与 NH;
的
配合反应
(3 分)4[Co(NH ) ]Cl +O +4NH Cl+2H O=4[Co(NH ) ]Cl +4NH .
3 6 2 2 4 2 3 6 3 3
H O (或者 4[Co(NH ) ]Cl +O +4NH Cl=4[Co(NH ) ]Cl +4NH +2H O)
2 3 6 2 2 4 3 6 3 3 2
;
(3) (4 分) 12
15.(13 分)
(1)( 1 分)吸收空气中的HO和C0:
(2) (4 分) C H O
2 4
(3) ( 2 分)3 :2 :2 :1(合理答案均可)
(4)(4 分) 羟基 、羰基;
(5)(2 分)a、d、e16.( 14 分)
( 1 )①( 2 分)pH 在 2~3 之间时,Ti(Ⅳ)主要以 TiO(C O )2-2 的形式存在,可直接
2 4
与 Ba2 +反应,有利于草酸氧钛钡晶体的生成。
220~470 ℃
②( 3 分)BaTiO(C O ) BaCO +TiO +2CO↑ + CO ↑
2 4 2 3 2 2
( 2 )( 6 分)① 洗涤滤渣 2~3 次,至取最后一次洗涤液少许于试管中,滴加 BaCl 溶
2
液, 无白色沉淀生成;将洗涤液与原滤液合并,
向锥形瓶中滴加 2~3 滴 KSCN 溶液,用 0.100 0 mol/L FeCl 溶液滴定,
3
溶液由浅紫色变成红色,且半分钟内红色不褪去
②( 3 分)
根据反应:Ti3++Fe3 + ℵ→ Ti(Ⅳ)+Fe2 +可知,
20 mL 待测钛液中,
n(Ti3+)=n(Fe3+)=0.019 5 L×0.100 0 mol/L=0.001 95 mol
钛酸钡样品的纯度=0.001 95 mol×5×233 g/mol2.33 g×100%=97.5%
18. (17 分)
(1)(6 分) ① .( 2 分) -I807.8 ② . ( 2 分)2x10-b
③ . ( 2 分)该反应正向为放热反应,升高温度,有利于反应逆向进行, NO 的脱除率降
低
(2)(3 分)2HSO;+2e-+2H'=S, O⃞O⃞(cid:2)+2H, O
(3)(7 分) I .( 2 分)Fe 在催化剂表面失去电子,转化为 Fe2+,H+得到电子生成活
性 H 原子
Ⅱ . (3 分) NQ +H++6H=NH+3H 2 O