文档内容
公众号:云儿和花
江苏省启东中学 2024~2025 学年度第一学期第一次月考
高二化学
注意事项:
1.本试卷分为选择题和非选择题两部分,共100分,考试时间75分钟。
2.将选择题答案涂在答题卡的对应位置上,非选择题的答案卡的指定栏目内。
可能用到的相对原子质量:H:1 C:12 O:16 Cu:64 Zn:65 Ag:108
一、单项选择题:共16题,每题3分,共48分。每题只有一个选项最符合题意。
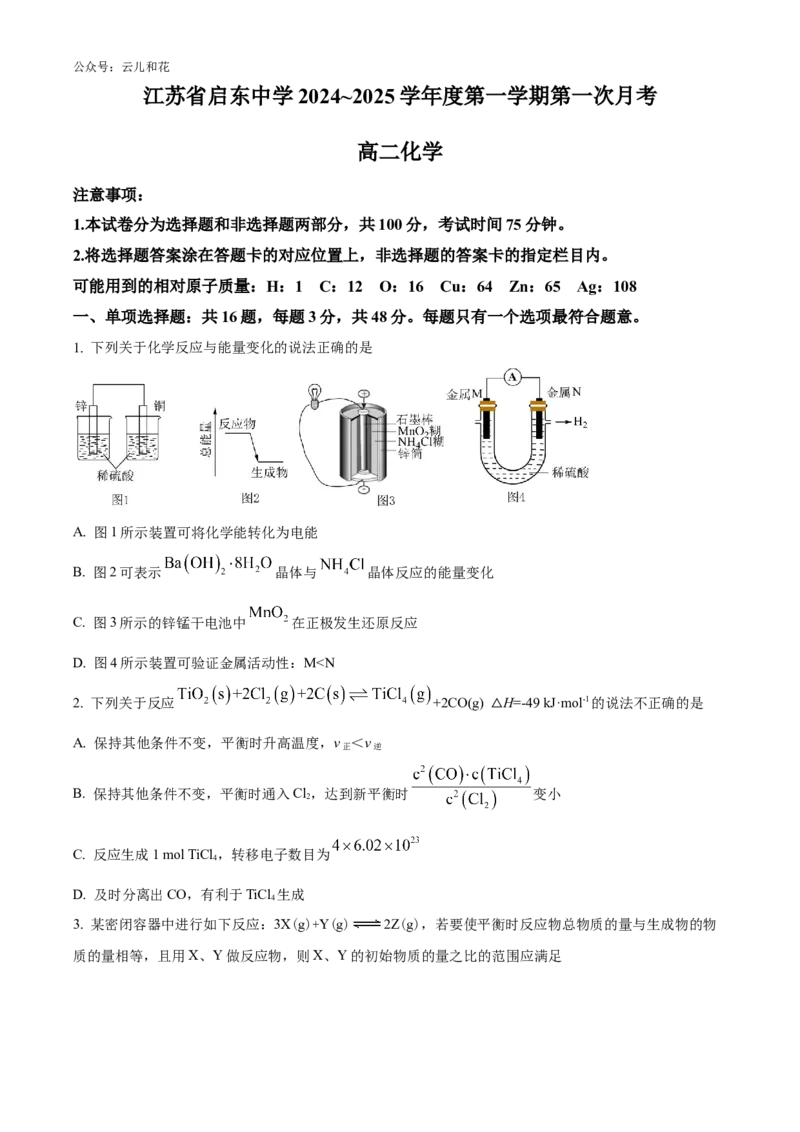
1. 下列关于化学反应与能量变化的说法正确的是
A. 图1所示装置可将化学能转化为电能
B. 图2可表示 晶体与 晶体反应的能量变化
C. 图3所示的锌锰干电池中 在正极发生还原反应
D. 图4所示装置可验证金属活动性:Mc+d
B. 平衡向右移动
C. 重新达平衡时,A气体浓度增大
D. 重新达平衡时,B的体积分数减小
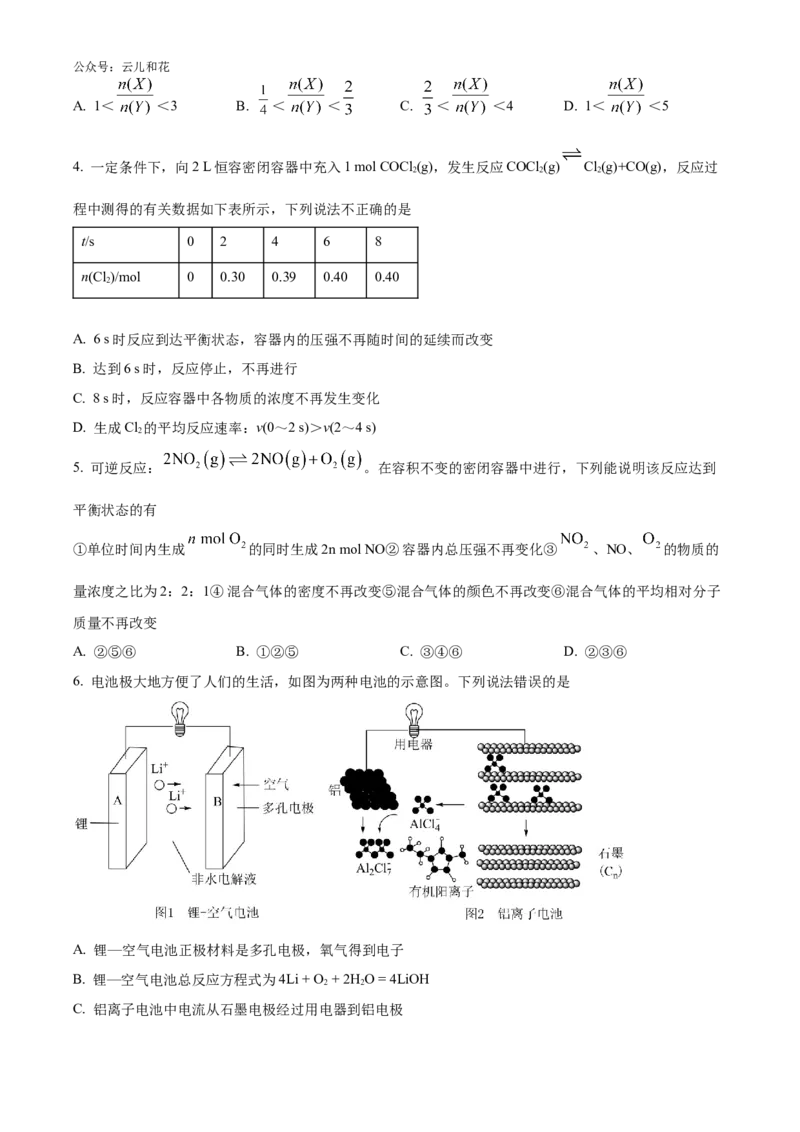
11. 分析如下操作对 2NO NO 平衡影响的实验,说法正确的是
2 2 4
步骤1:活塞从Ⅰ处→拉至Ⅱ处公众号:云儿和花
步骤2:活塞从Ⅱ处一推向Ⅰ处
A. 步骤1,减小压强,平衡右移
B. 步骤1,混合气颜色变浅,平衡右移
C. 步骤2,浓度商Q<平衡常数K,平衡右移
D. 步骤2,混合气颜色先变深后变浅,变深的原因是生成了更多NO
2
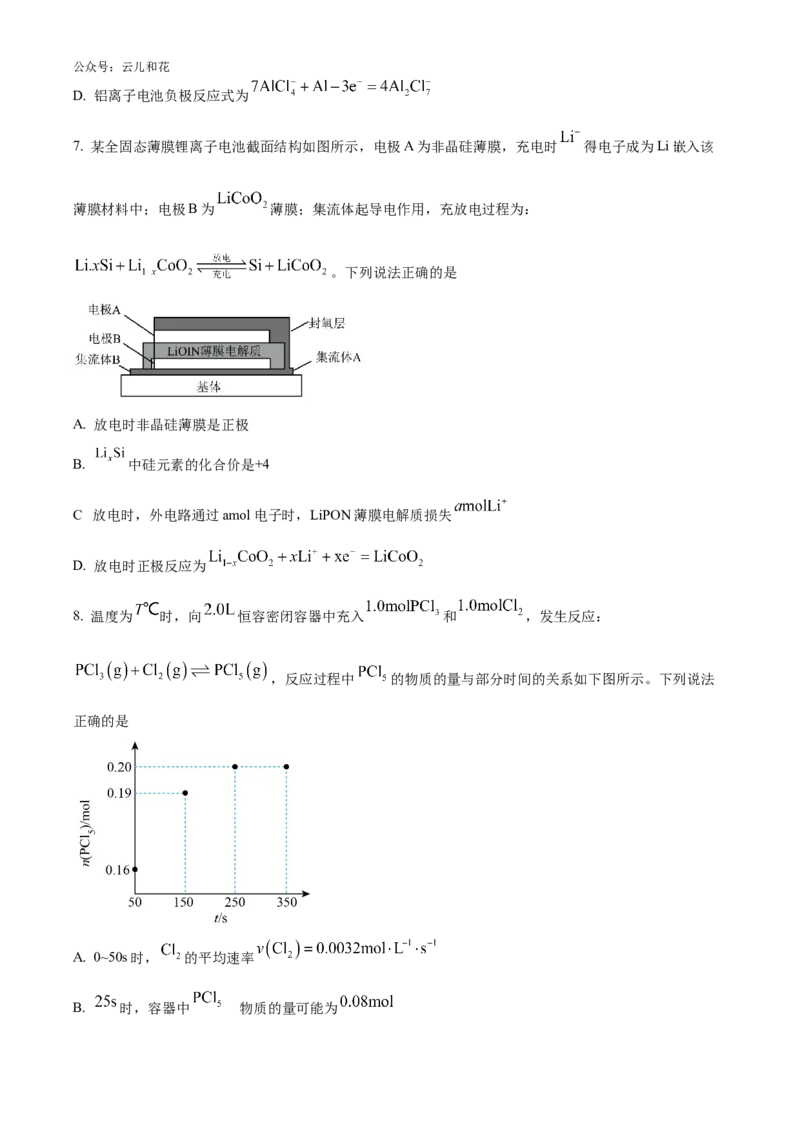
12. 甲酸甲酯是重要有机化工原料,制备反应为CHOH(g)+CO(g) HCOOCH(g) ΔH<0;相同时间内,
3 3
在容积固定的密闭容器中,使反应在不同温度下进行(起始投料比均 为1),相同时间内测得
CO的转化率随温度变化的曲线如下图。下列说法中不正确的是
A. 70~80℃,CO转化率随温度升高而增大,其原因是升高温度反应速率增大
B. 85~90℃,CO转化率随温度升高而降低,其原因可能是升高温度平衡逆向移动
C. d点和e点的平衡常数:K < K
d e
的
D. a点对应 CO的转化率与CHOH的转化率相同
3
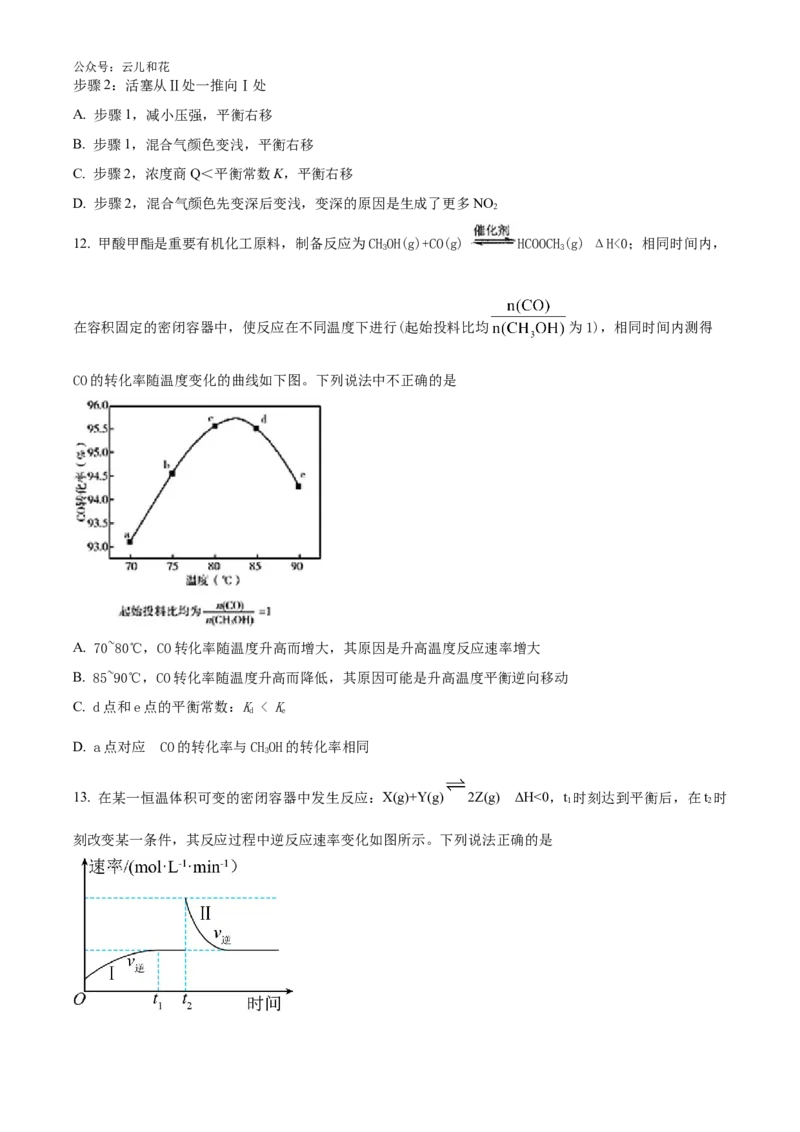
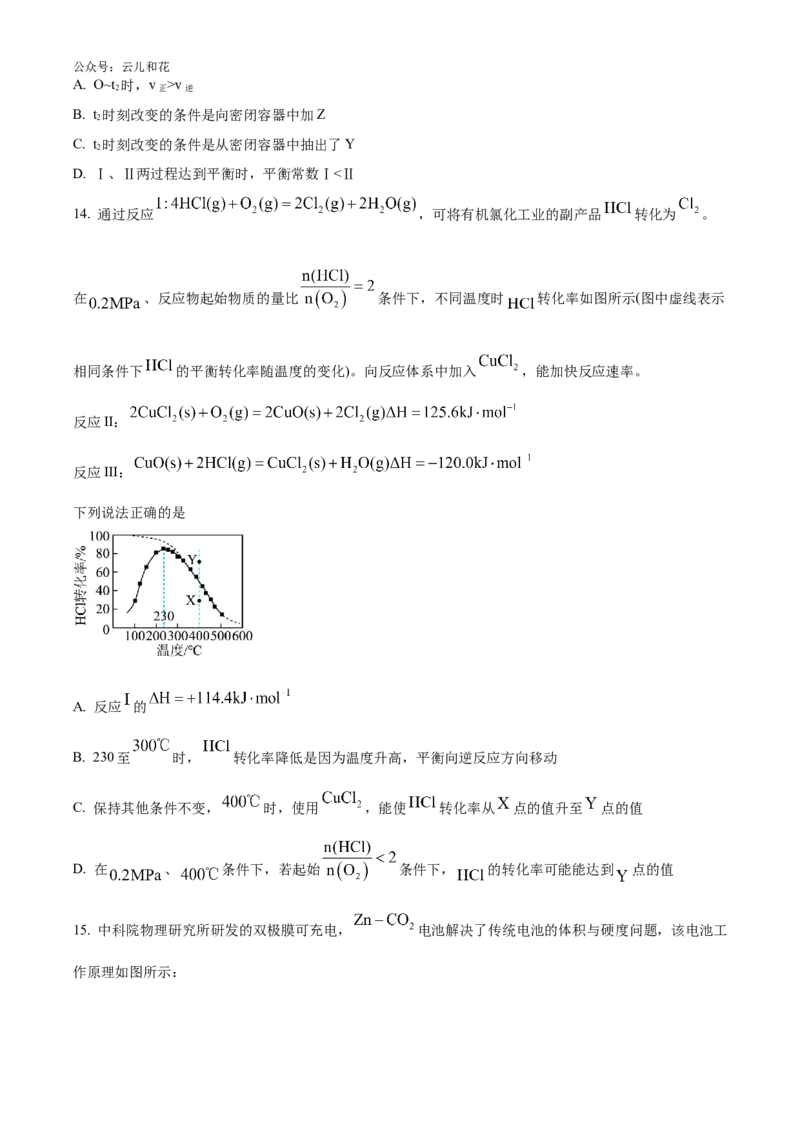
13. 在某一恒温体积可变的密闭容器中发生反应:X(g)+Y(g) 2Z(g) ΔH<0,t 时刻达到平衡后,在t 时
1 2
刻改变某一条件,其反应过程中逆反应速率变化如图所示。下列说法正确的是公众号:云儿和花
A. O~t 时,v >v
2 正 逆
B. t 时刻改变的条件是向密闭容器中加Z
2
C. t 时刻改变的条件是从密闭容器中抽出了Y
2
D. Ⅰ、Ⅱ两过程达到平衡时,平衡常数Ⅰ<Ⅱ
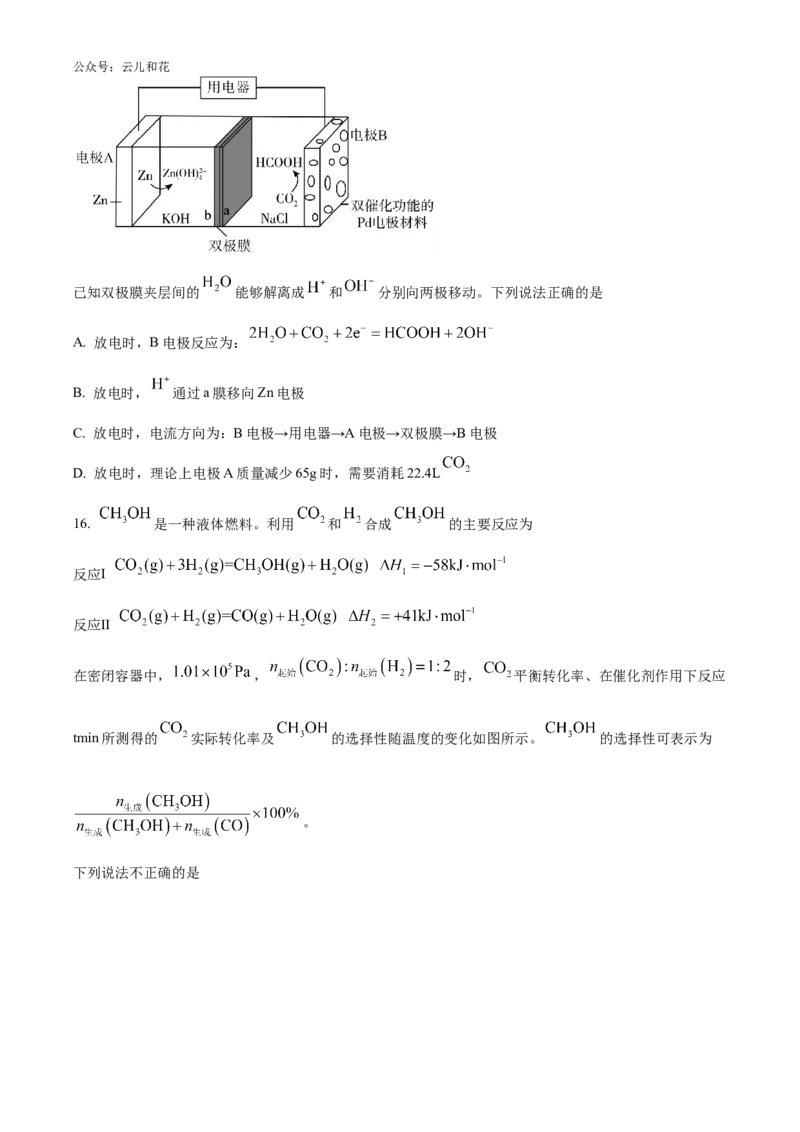
14. 通过反应 ,可将有机氯化工业的副产品 转化为 。
在 、反应物起始物质的量比 条件下,不同温度时 转化率如图所示(图中虚线表示
相同条件下 的平衡转化率随温度的变化)。向反应体系中加入 ,能加快反应速率。
反应II:
反应III:
下列说法正确的是
A. 反应 的
B. 230至 时, 转化率降低是因为温度升高,平衡向逆反应方向移动
C. 保持其他条件不变, 时,使用 ,能使 转化率从 点的值升至 点的值
D. 在 、 条件下,若起始 条件下, 的转化率可能能达到 点的值
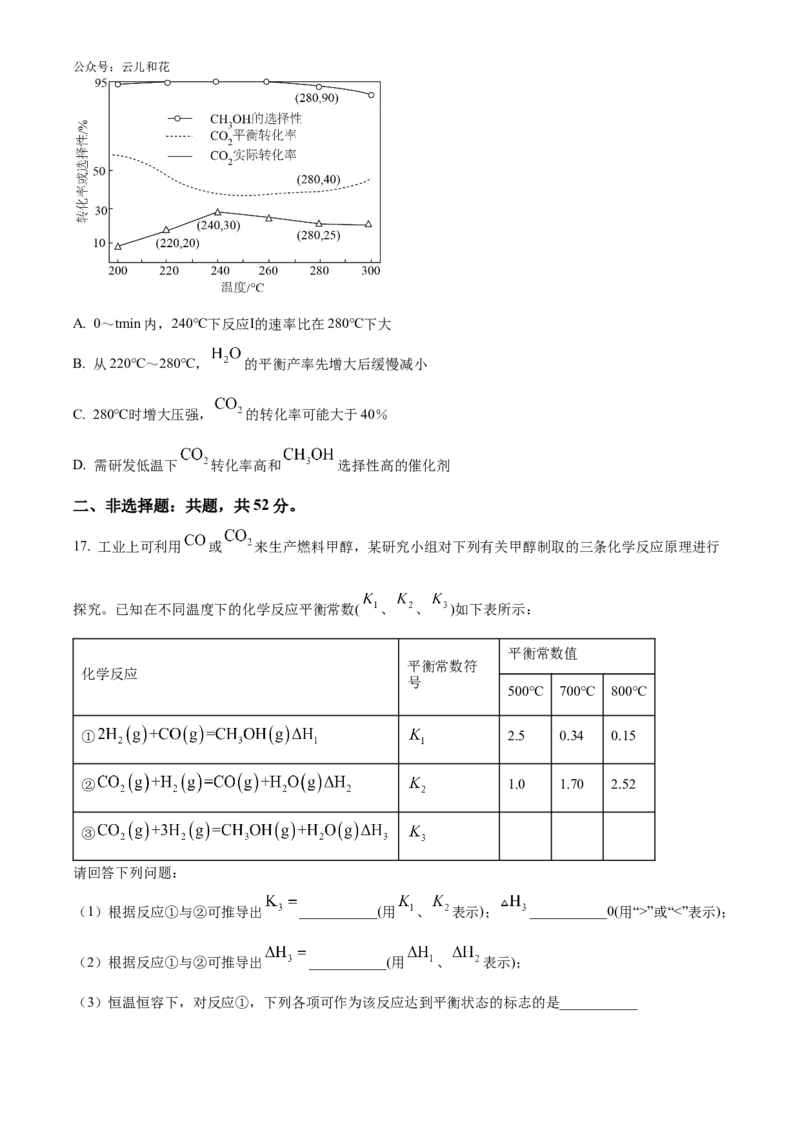
15. 中科院物理研究所研发的双极膜可充电, 电池解决了传统电池的体积与硬度问题,该电池工
作原理如图所示:公众号:云儿和花
已知双极膜夹层间的 能够解离成 和 分别向两极移动。下列说法正确的是
A. 放电时,B电极反应为:
B. 放电时, 通过a膜移向Zn电极
C. 放电时,电流方向为:B电极→用电器→A电极→双极膜→B电极
D. 放电时,理论上电极A质量减少65g时,需要消耗22.4L
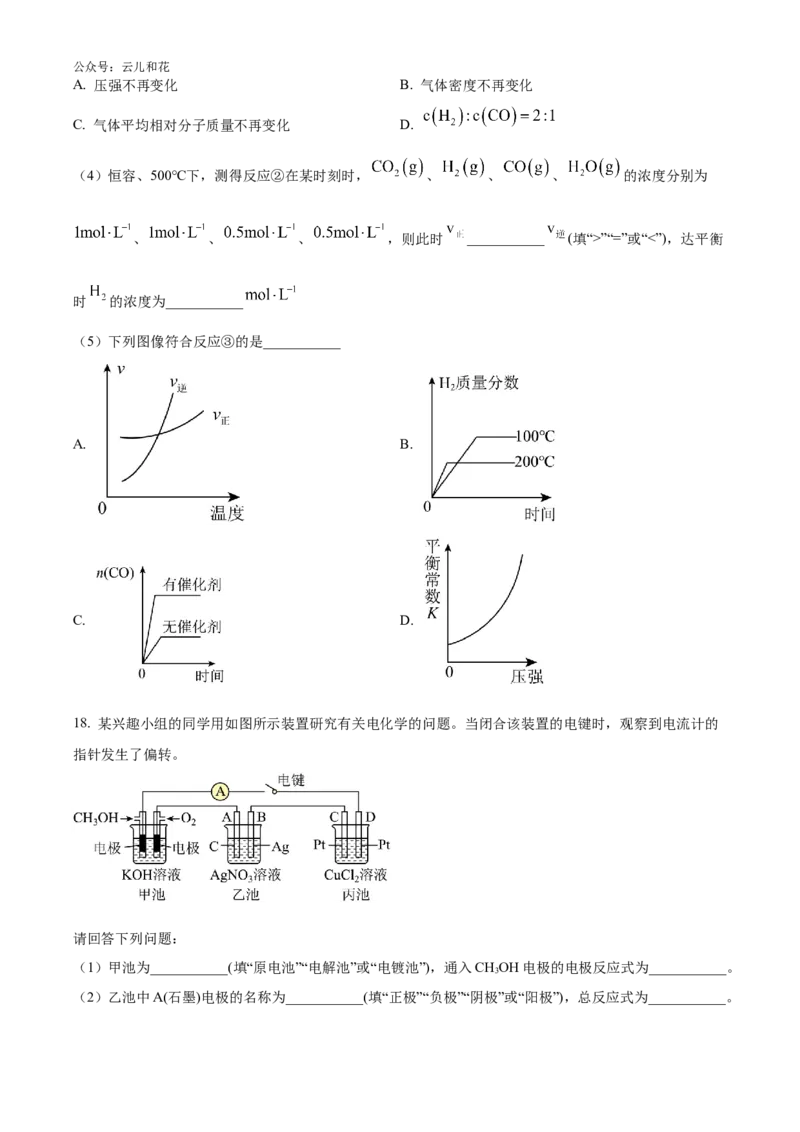
16. 是一种液体燃料。利用 和 合成 的主要反应为
反应Ⅰ
反应Ⅱ
在密闭容器中, , 时, 平衡转化率、在催化剂作用下反应
tmin所测得的 实际转化率及 的选择性随温度的变化如图所示。 的选择性可表示为
。
下列说法不正确的是公众号:云儿和花
A. 0~tmin内,240℃下反应Ⅰ的速率比在280℃下大
B. 从220℃~280℃, 的平衡产率先增大后缓慢减小
C. 280℃时增大压强, 的转化率可能大于40%
D. 需研发低温下 转化率高和 选择性高的催化剂
二、非选择题:共题,共52分。
17. 工业上可利用 或 来生产燃料甲醇,某研究小组对下列有关甲醇制取的三条化学反应原理进行
探究。已知在不同温度下的化学反应平衡常数( 、 、 )如下表所示:
平衡常数值
平衡常数符
化学反应
号
500℃ 700℃ 800℃
① 2.5 0.34 0.15
② 1.0 1.70 2.52
③
请回答下列问题:
(1)根据反应①与②可推导出 ___________(用 、 表示); ___________0(用“>”或“<”表示);
(2)根据反应①与②可推导出 ___________(用 、 表示);
(3)恒温恒容下,对反应①,下列各项可作为该反应达到平衡状态的标志的是___________公众号:云儿和花
A. 压强不再变化 B. 气体密度不再变化
C. 气体平均相对分子质量不再变化 D.
(4)恒容、500℃下,测得反应②在某时刻时, 、 、 、 的浓度分别为
、 、 、 ,则此时 ___________ (填“>”“=”或“<”),达平衡
时 的浓度为___________
(5)下列图像符合反应③的是___________
A. B.
C. D.
18. 某兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装置的电键时,观察到电流计的
指针发生了偏转。
请回答下列问题:
(1)甲池为___________(填“原电池”“电解池”或“电镀池”),通入CHOH电极的电极反应式为___________。
3
(2)乙池中A(石墨)电极的名称为___________(填“正极”“负极”“阴极”或“阳极”),总反应式为___________。公众号:云儿和花
(3)当乙池中B极质量增加5.40 g时,甲池中理论上消耗O 的体积为___________mL(标准状况),丙池中
2
___________极析出___________g铜。
(4)若丙池中电极不变,将其溶液换成NaCl溶液,电键闭合一段时间后,甲中溶液的pH将
___________(填“增大”“减小”或“不变”);丙中溶液的pH将___________(填“增大”“减小”或“不变”),若将丙
中溶液复原,需加入___________。
19. 将 转化为高附加值化学品是目前研究的热点之一,甲醇是重要的化工原料和优良的替代燃料,因
此 加氢制甲醇被广泛关注。 与 在催化剂作用下主要发生以下反应:
ⅰ.
ⅱ.
ⅲ.
(1) ___________ ,反应ⅲ在___________ (填“高温”“低温”或“任意温度”)下能自发进行。
在恒容绝热条件下,起始投料按 充入容器中,若只发生反应ⅲ,则下列可作为该条
件下反应ⅲ达到平衡的判断依据的是___________ (填标号)。
A. 与 的比值不变 B. 不变 C.容器内气体压强不变
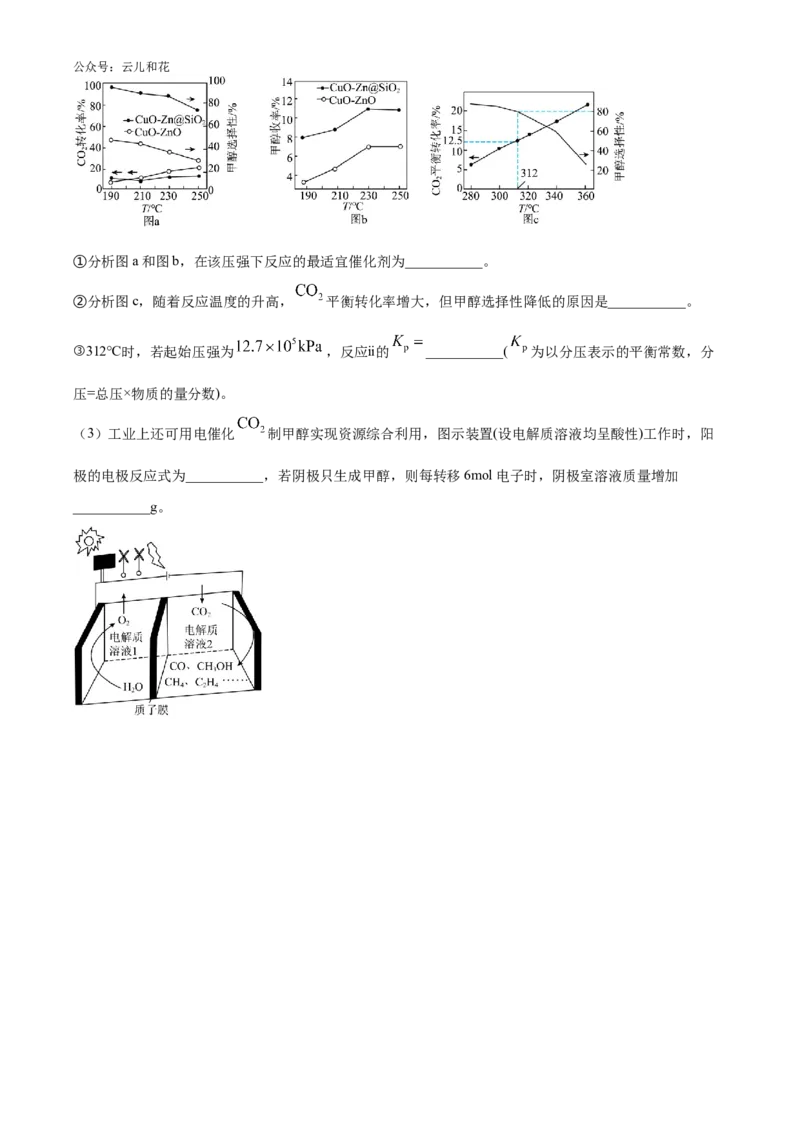
(2)将1mol 和3mol 充入体积为2L的密闭容器中,只发生反应ⅰ和ⅱ。在190~250℃、8MPa下,
以CuO-ZnO、CuO-Zn@ 作催化剂,研究反应相同时间在不同催化剂的作用下, 转化率、
选择性、 收率与温度的关系如图a、图b;280~360℃下,在某催化剂作用下探究 的
平衡转化率及 的选择性随温度变化的关系如图c.已知:选择性=(生成目标产物所消耗的反应物
的物质的量÷参与反应的反应物的物质的量)×100%。公众号:云儿和花
①分析图a和图b,在该压强下反应的最适宜催化剂为___________。
②分析图c,随着反应温度的升高, 平衡转化率增大,但甲醇选择性降低的原因是___________。
③312℃时,若起始压强为 ,反应ⅱ的 ___________( 为以分压表示的平衡常数,分
压=总压×物质的量分数)。
(3)工业上还可用电催化 制甲醇实现资源综合利用,图示装置(设电解质溶液均呈酸性)工作时,阳
极的电极反应式为___________,若阴极只生成甲醇,则每转移6mol电子时,阴极室溶液质量增加
___________g。公众号:云儿和花
江苏省启东中学 2024~2025 学年度第一学期第一次月考
高二化学
注意事项:
1.本试卷分为选择题和非选择题两部分,共100分,考试时间75分钟。
2.将选择题答案涂在答题卡的对应位置上,非选择题的答案卡的指定栏目内。
可能用到的相对原子质量:H:1 C:12 O:16 Cu:64 Zn:65 Ag:108
一、单项选择题:共16题,每题3分,共48分。每题只有一个选项最符合题意。
【1题答案】
【答案】C
【2题答案】
【答案】B
【3题答案】
【答案】D
【4题答案】
【答案】B
【5题答案】
【答案】A
【6题答案】
【答案】B
【7题答案】
【答案】D
【8题答案】
【答案】C
【9题答案】
【答案】A
【10题答案】
【答案】A
【11题答案】
【答案】C
【12题答案】公众号:云儿和花
【答案】C
【13题答案】
【答案】B
【14题答案】
【答案】D
【15题答案】
【答案】C
【16题答案】
【答案】B
二、非选择题:共题,共52分。
【17题答案】
【答案】(1) ①. ②. <
(2) (3)AC
(4) ①. > ②. 0.75 (5)A
【18题答案】
【答案】(1) ①. 原电池 ②.
(2) ①. 阳极 ②.
(3) ①. 280 ②. D ③. 1.6
(4) ①. 减小 ②. 增大 ③. HCl
【19题答案】
【答案】(1) ①. -90.4kJ·mol−1 ②. 低温 ③. BC
(2) ①. Cu-ZnO@ SiO ②. 温度升高,反应Ⅱ(吸热反应)平衡正向移动程度大于反应I(放热反应)
2
平衡逆向移动的程度,使CO 的转化率增大;温度升高反应I平衡逆向移动,使甲醇的选择性降低 ③.
2
(3) ①. 2HO-4e-=O ↑+4H+ ②. 50
2 2