文档内容
高三化学
本试卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分。考试结束,将答题卡交回。
第Ⅰ卷(选择题 共40分)
注意事项:
1.答卷前,考生务必将自己的姓名、考生号等填写在答题卡指定位置。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。
如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题
卡上。写在本试卷上无效。
相对原子质量:H 1 Li 7 Be 9 C 12 N 14 O 16 Na 23 S 32 Cl 35.5 Ni 59
一、 选择题:本题共10小题,每小题2分,共20分。每小题只有一
个选项符合题目要求。
1.化学与生活、社会、环境息息相关,下列说法正确的是
A.亚硝酸钠具有一定毒性,不能用作食品防腐剂
B.清洗铁锅后及时擦干,能减缓铁锅因发生吸氧腐蚀而生锈
C.铁磁流体液态机器人中,驱动机器人运动的磁铁的主要成分是FeO
D.燃料的脱硫、NO的催化转化都是减少温室效应的措施
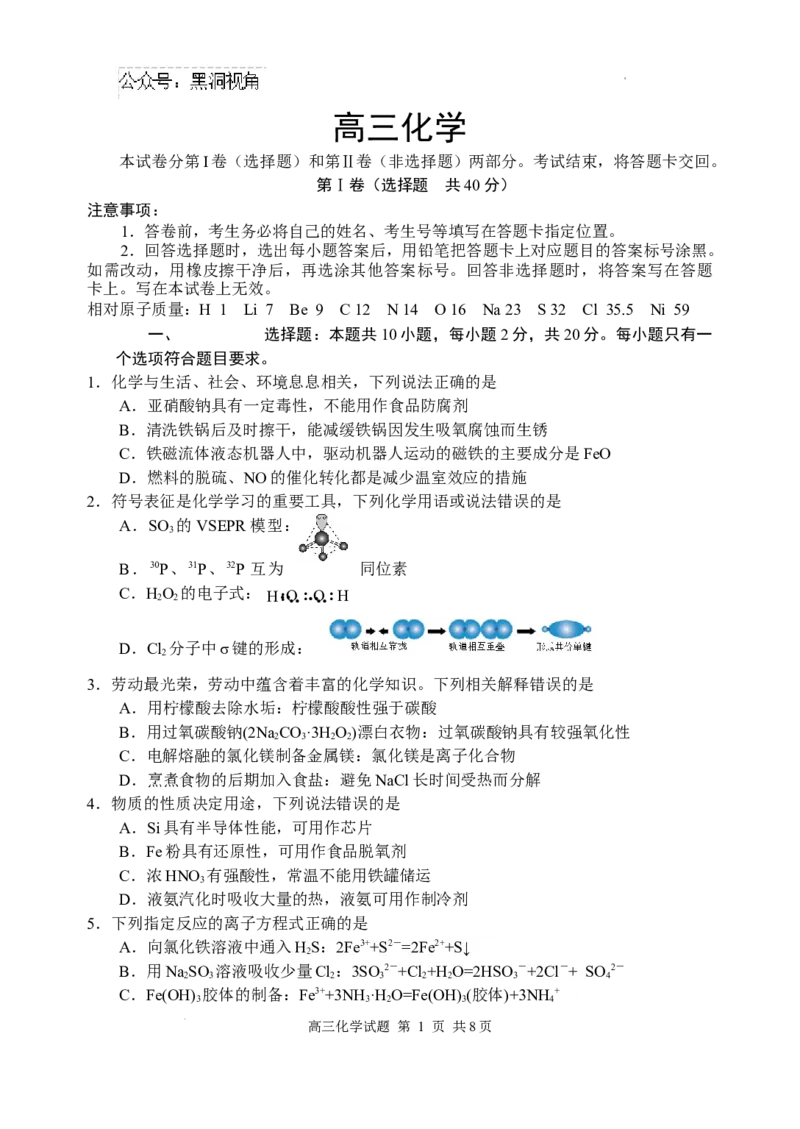
2.符号表征是化学学习的重要工具,下列化学用语或说法错误的是
A.SO 的VSEPR模型:
3
B.30P、31P、32P 互为 同位素
C.H 2 O 2 的电子式: H‥ : O‥ :‥ O ‥ : H
D.Cl 分子中σ键的形成:
2
3.劳动最光荣,劳动中蕴含着丰富的化学知识。下列相关解释错误的是
A.用柠檬酸去除水垢:柠檬酸酸性强于碳酸
B.用过氧碳酸钠(2NaCO·3H O)漂白衣物:过氧碳酸钠具有较强氧化性
2 3 2 2
C.电解熔融的氯化镁制备金属镁:氯化镁是离子化合物
D.烹煮食物的后期加入食盐:避免NaCl长时间受热而分解
4.物质的性质决定用途,下列说法错误的是
A.Si具有半导体性能,可用作芯片
B.Fe粉具有还原性,可用作食品脱氧剂
C.浓HNO 有强酸性,常温不能用铁罐储运
3
D.液氨汽化时吸收大量的热,液氨可用作制冷剂
5.下列指定反应的离子方程式正确的是
A.向氯化铁溶液中通入HS:2Fe3++S2-=2Fe2++S↓
2
B.用NaSO 溶液吸收少量Cl:3SO 2-+Cl+H O=2HSO -+2Cl-+ SO 2-
2 3 2 3 2 2 3 4
C.Fe(OH) 胶体的制备:Fe3++3NH·HO=Fe(OH) (胶体)+3NH+
3 3 2 3 4
高三化学试题 第 1 页 共8页
学科网(北京)股份有限公司D.向Mg(HCO ) 溶液中加入足量的NaOH溶液:
3 2
Mg2++2HCO -+2OH-=MgCO ↓+CO 2-+2H O
3 3 3 2
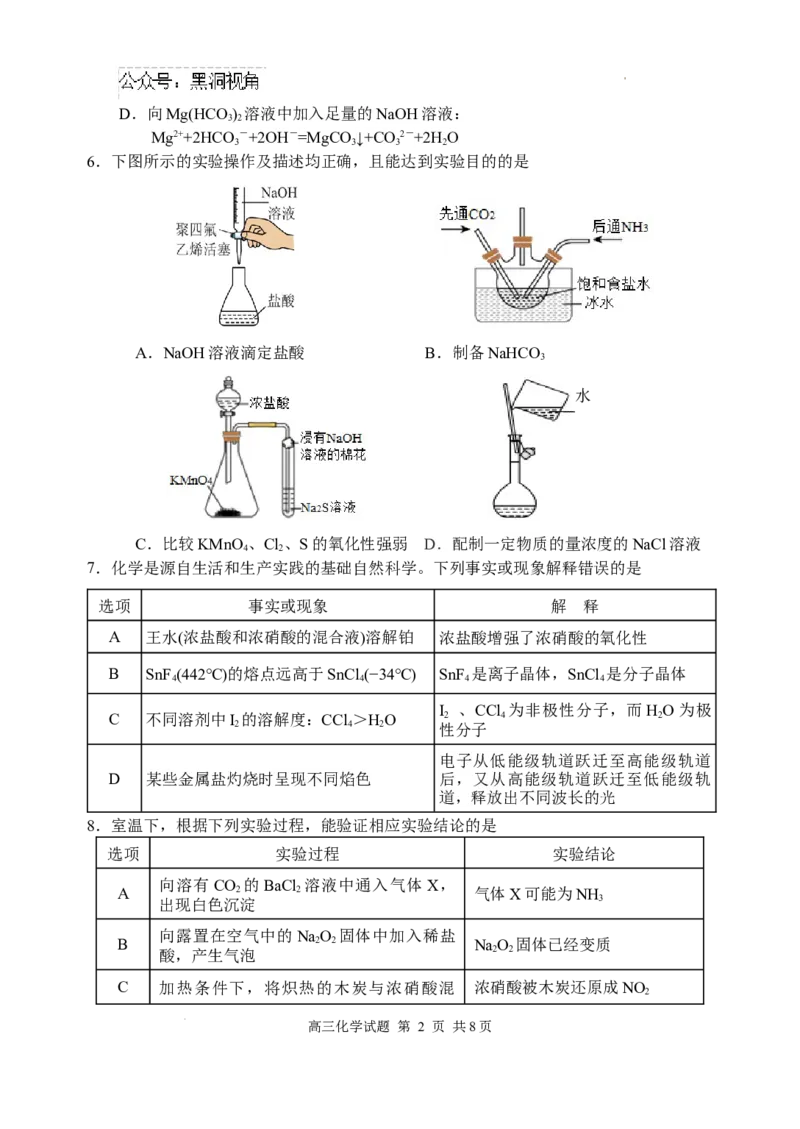
6.下图所示的实验操作及描述均正确,且能达到实验目的的是
A.NaOH溶液滴定盐酸 B.制备NaHCO
3
水
C.比较KMnO 、Cl、S的氧化性强弱 D.配制一定物质的量浓度的NaCl溶液
4 2
7.化学是源自生活和生产实践的基础自然科学。下列事实或现象解释错误的是
选项 事实或现象 解 释
A 王水(浓盐酸和浓硝酸的混合液)溶解铂 浓盐酸增强了浓硝酸的氧化性
B SnF (442℃)的熔点远高于SnCl (−34℃) SnF 是离子晶体,SnCl 是分子晶体
4 4 4 4
I 、CCl 为非极性分子,而HO为极
C 不同溶剂中I 的溶解度:CCl >HO 2 4 2
2 4 2 性分子
电子从低能级轨道跃迁至高能级轨道
D 某些金属盐灼烧时呈现不同焰色 后,又从高能级轨道跃迁至低能级轨
道,释放出不同波长的光
8.室温下,根据下列实验过程,能验证相应实验结论的是
选项 实验过程 实验结论
向溶有CO 的BaCl 溶液中通入气体X,
A 2 2 气体X可能为NH
出现白色沉淀 3
向露置在空气中的NaO 固体中加入稀盐
B 2 2 NaO 固体已经变质
酸,产生气泡 2 2
C 加热条件下,将炽热的木炭与浓硝酸混 浓硝酸被木炭还原成NO
2
高三化学试题 第 2 页 共8页
学科网(北京)股份有限公司合,产生红棕色气体
用硫酸酸化的HO 滴入Fe(NO ) 溶液中,
D 2 2 3 2 氧化性:HO>Fe3+
溶液变黄色 2 2
9.某种电解质的组成如图所示,已知该化合物的五元环上的5个原子共平面,且X、
Y、Z、Q、W为原子序数依次增大的短周期元素, 下列说法
错误的是
A.该化合物中含有配位键、σ键、大π
键
B.Z、X形成的二元化合物与W、X形
成的二元化合物间可发生化合反应
C.简单离子半径:Z>Q
D.该化合物中Z有两种杂化方式
10.为探究化学平衡移动的影响因素,设计方案并进行实验,观察到相关现象。其中方
案设计和结论都正确的是
选 影响
方案设计 现象 结论
项 因素
向1mol·L−1FeCl 溶液中滴加 溶液先变红,
3 减小反应物浓度,平衡向
A 浓度 KSCN 溶液,反应达平衡 加水后颜色变
逆反应方向移动
后,向溶液中继续加水 浅
对于反应前后气体总体积
向恒温恒容密闭玻璃容器中
不变的可逆反应,增大压
B 压强 充入100mLHI气体,反应达 气体颜色不变
强,平衡不移动,物质浓
到平衡后再充入100mLAr
度保持不变
将封装有 NO 和 NO 混合 升高温度,平衡向吸热反
C 温度 2 2 4 气体颜色变深
气体的烧瓶浸泡在热水中 应方向移动
催化 向Zn和稀硫酸正在反应的 单位时间内产 使用催化剂可加快反应速
D
剂 溶液中滴加少量CuSO 溶液 生的气体增多 率,使平衡正向移动
4
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题目
要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.部分含Mg或Al或Fe物质的分类与相应化合价关系如图。下列推断合理的是
化
A.若a在沸水中可生成e,则a→f的反应一定是置换反应 合 +3 b c d
价
B.若含d的分散系有净水作用,则a+c一定可以生成f +2 g f e
C.若c为阴离子且含组成a的元素,则b为两性物质
D.若存在g→f→e→d转化过程,则组成a的元素位于 0 a
周期表d区 单质 氧化物 盐 碱
高三化学试题 第 3 页 共8页
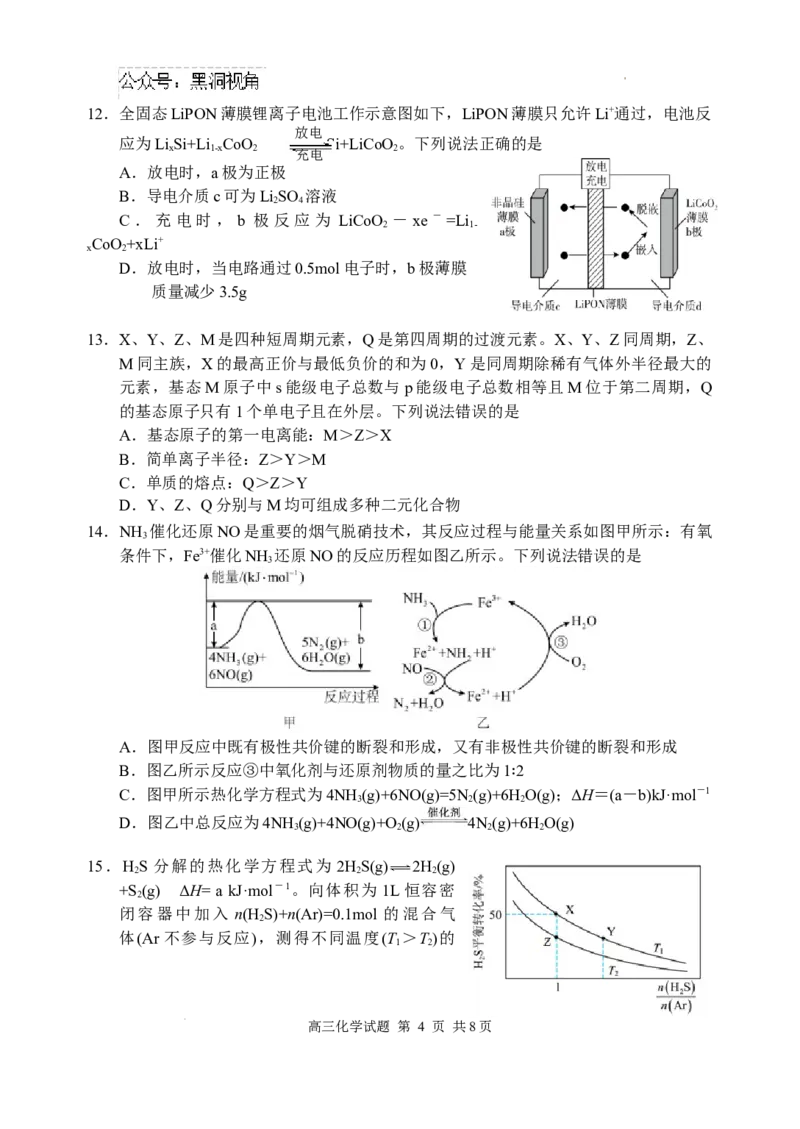
学科网(北京)股份有限公司12.全固态LiPON薄膜锂离子电池工作示意图如下,LiPON薄膜只允许Li+通过,电池反
放电
应为LiSi+Li CoO Si+LiCoO。下列说法正确的是
x 1-x 2 充电 2
A.放电时,a极为正极
B.导电介质c可为LiSO 溶液
2 4
C.充电时, b 极反应为 LiCoO -xe-=Li
2 1-
CoO+xLi+
x 2
D.放电时,当电路通过0.5mol电子时,b极薄膜
质量减少3.5g
13.X、Y、Z、M是四种短周期元素,Q是第四周期的过渡元素。X、Y、Z同周期,Z、
M同主族,X的最高正价与最低负价的和为0,Y是同周期除稀有气体外半径最大的
元素,基态M原子中s能级电子总数与p能级电子总数相等且M位于第二周期,Q
的基态原子只有1个单电子且在外层。下列说法错误的是
A.基态原子的第一电离能:M>Z>X
B.简单离子半径:Z>Y>M
C.单质的熔点:Q>Z>Y
D.Y、Z、Q分别与M均可组成多种二元化合物
14.NH 催化还原NO是重要的烟气脱硝技术,其反应过程与能量关系如图甲所示:有氧
3
条件下,Fe3+催化NH 还原NO的反应历程如图乙所示。下列说法错误的是
3
A.图甲反应中既有极性共价键的断裂和形成,又有非极性共价键的断裂和形成
B.图乙所示反应③中氧化剂与还原剂物质的量之比为1 2
C.图甲所示热化学方程式为4NH (g)+6NO(g)=5N (g)+6HO(g);ΔH=(a-b)kJ·mol-1
3 2 2
∶
D.图乙中总反应为4NH (g)+4NO(g)+O (g) 4N(g)+6HO(g)
3 2 2 2
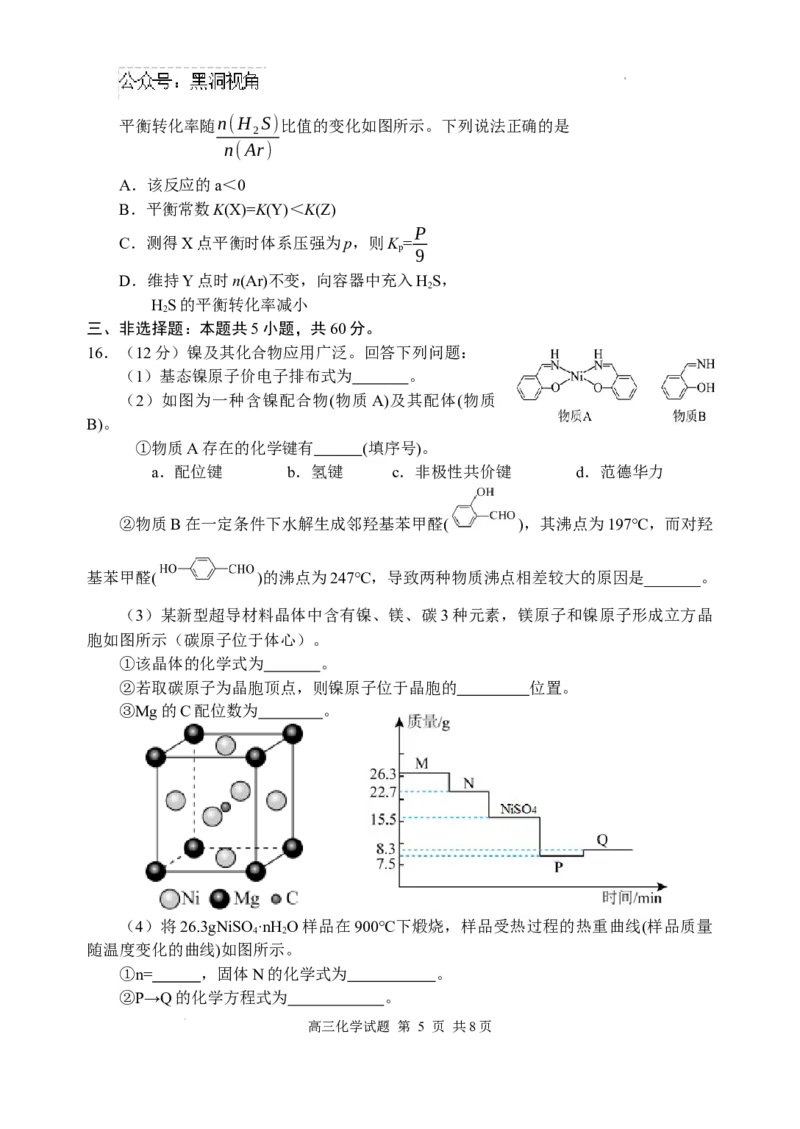
15.HS 分解的热化学方程式为 2HS(g) 2H(g)
2 2 2
+S (g) ΔH= a kJ·mol-1。向体积为 1L恒容密
2
闭容器中加入 n(H S)+n(Ar)=0.1mol 的混合气
2
体(Ar 不参与反应),测得不同温度(T >T)的
1 2
高三化学试题 第 4 页 共8页
学科网(北京)股份有限公司平衡转化率随n(H S)比值的变化如图所示。下列说法正确的是
2
n(Ar)
A.该反应的a<0
B.平衡常数K(X)=K(Y)<K(Z)
P
C.测得X点平衡时体系压强为p,则K =
p
9
D.维持Y点时n(Ar)不变,向容器中充入HS,
2
HS的平衡转化率减小
2
三、非选择题:本题共5小题,共60分。
16.(12分)镍及其化合物应用广泛。回答下列问题:
(1)基态镍原子价电子排布式为 。
(2)如图为一种含镍配合物(物质A)及其配体(物质
B)。
①物质A存在的化学键有 (填序号)。
a.配位键 b.氢键 c.非极性共价键 d.范德华力
②物质B在一定条件下水解生成邻羟基苯甲醛( ),其沸点为197℃,而对羟
基苯甲醛( )的沸点为247℃,导致两种物质沸点相差较大的原因是_______。
(3)某新型超导材料晶体中含有镍、镁、碳3种元素,镁原子和镍原子形成立方晶
胞如图所示(碳原子位于体心)。
①该晶体的化学式为 。
②若取碳原子为晶胞顶点,则镍原子位于晶胞的 位置。
③Mg的C配位数为 。
(4)将26.3gNiSO·nHO样品在900℃下煅烧,样品受热过程的热重曲线(样品质量
4 2
随温度变化的曲线)如图所示。
①n= ,固体N的化学式为 。
②P→Q的化学方程式为 。
高三化学试题 第 5 页 共8页
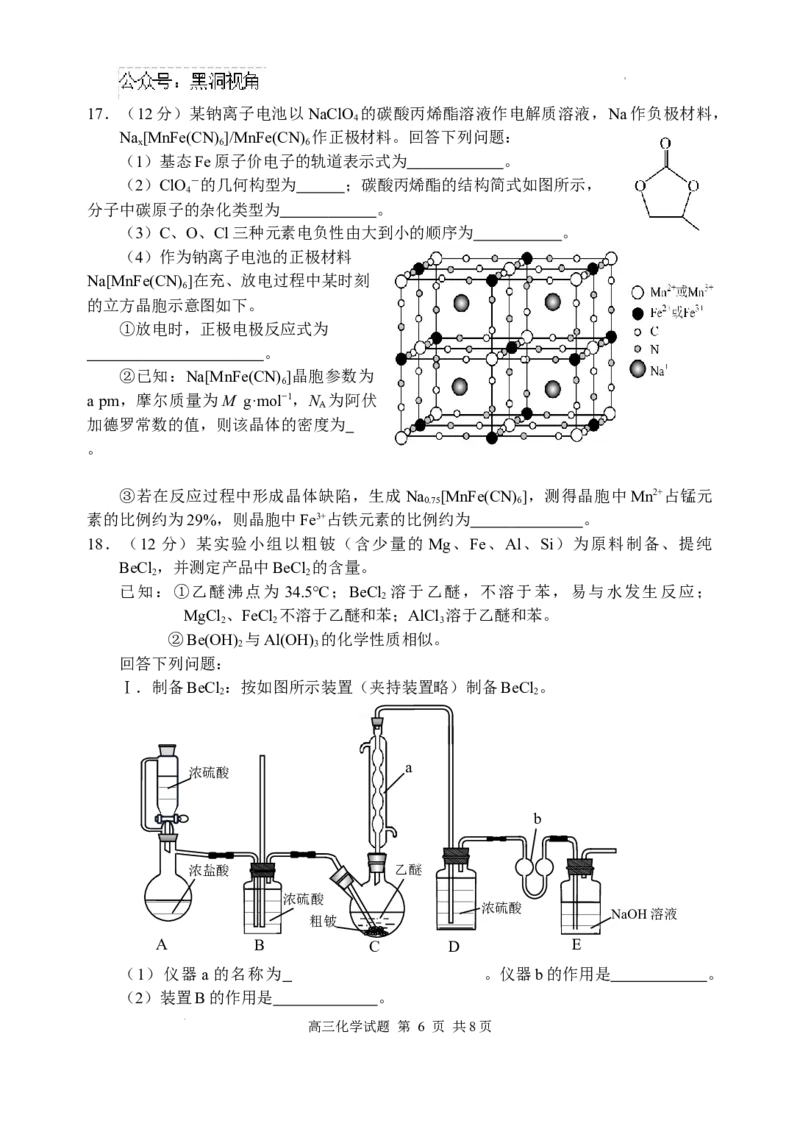
学科网(北京)股份有限公司17.(12分)某钠离子电池以NaClO 的碳酸丙烯酯溶液作电解质溶液,Na作负极材料,
4
Na[MnFe(CN) ]/MnFe(CN) 作正极材料。回答下列问题:
x 6 6
(1)基态Fe原子价电子的轨道表示式为 。
(2)ClO -的几何构型为 ;碳酸丙烯酯的结构简式如图所示,
4
分子中碳原子的杂化类型为 。
(3)C、O、Cl三种元素电负性由大到小的顺序为 。
(4)作为钠离子电池的正极材料
Na[MnFe(CN) ]在充、放电过程中某时刻
6
的立方晶胞示意图如下。
①放电时,正极电极反应式为
。
②已知:Na[MnFe(CN) ]晶胞参数为
6
a pm,摩尔质量为M g·mol−1,N 为阿伏
A
加德罗常数的值,则该晶体的密度为
。
③若在反应过程中形成晶体缺陷,生成Na [MnFe(CN) ],测得晶胞中Mn2+占锰元
0.75 6
素的比例约为29%,则晶胞中Fe3+占铁元素的比例约为 。
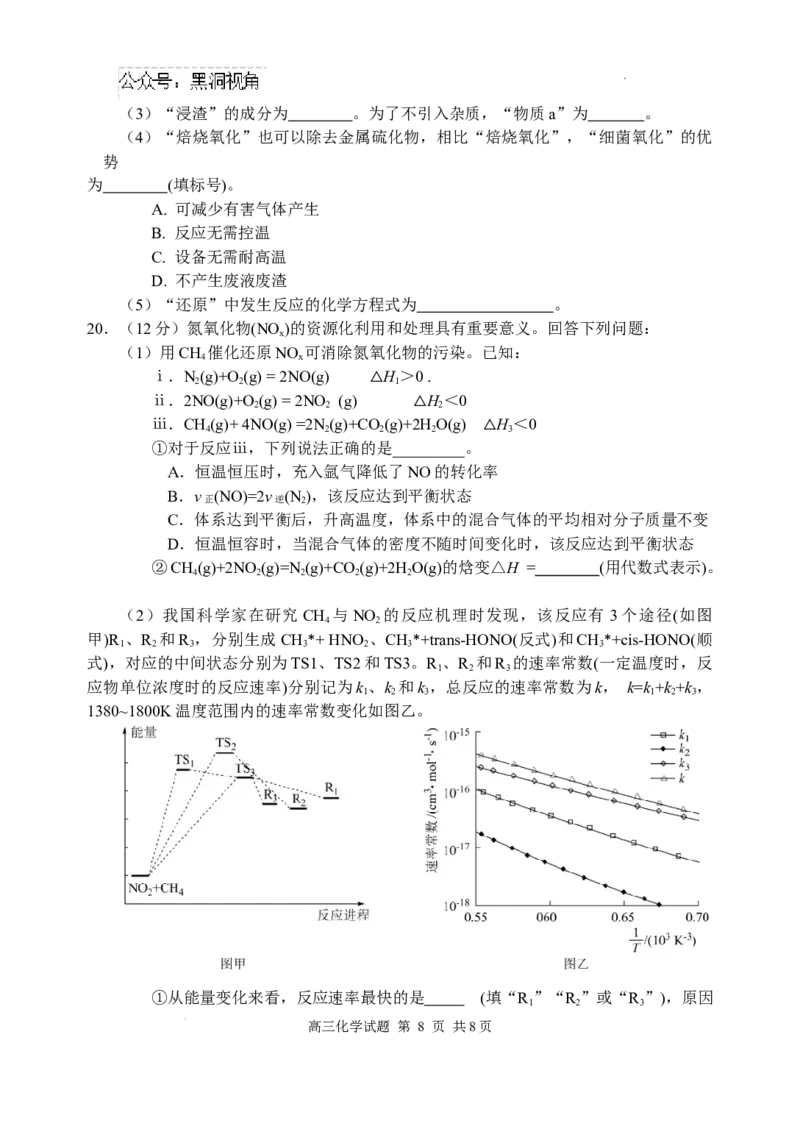
18.(12 分)某实验小组以粗铍(含少量的 Mg、Fe、Al、Si)为原料制备、提纯
BeCl ,并测定产品中BeCl 的含量。
2 2
已知:①乙醚沸点为 34.5℃;BeCl 溶于乙醚,不溶于苯,易与水发生反应;
2
MgCl 、FeCl 不溶于乙醚和苯;AlCl 溶于乙醚和苯。
2 2 3
②Be(OH) 与Al(OH) 的化学性质相似。
2 3
回答下列问题:
Ⅰ.制备BeCl :按如图所示装置(夹持装置略)制备BeCl 。
2 2
a
浓硫酸
b
浓盐酸 乙醚
浓硫酸
浓硫酸
NaOH溶液
粗铍
A B C D E
(1)仪器a的名称为 。仪器b的作用是 。
(2)装置B的作用是 。
高三化学试题 第 6 页 共8页
学科网(北京)股份有限公司(3)实验中装置C需置于温度15℃左右的水浴中,其主要目的是 。
(4)该实验装置中存在的缺陷是 。
Ⅱ.BeCl 的提纯
2
充分反应后,装置C中乙醚溶液经过滤、蒸馏出乙醚得到固体,再用苯溶解固体,
充分搅拌后过滤、洗涤、干燥得BeCl 产品。
2
(5)用苯溶解固体,充分搅拌后过滤,目的是 。
Ⅲ.BeCl 的纯度测定
2
取m g上述产品溶于盐酸配成250mL溶液;取25.00mL溶液,加入EDTA掩蔽杂质
离子,用NaOH溶液调节pH,过滤、洗涤,得Be(OH) 固体;加入KF溶液至固体恰好
2
完全溶解,滴加酚酞作指示剂,用a mol·L−1盐酸滴定其中的KOH,消耗盐酸b mL。
(已知:4KF+ Be(OH) = K BeF +2KOH;滴定过程中KBeF 不与盐酸反应)
2 2 4 2 4
(6)滴定终点的现象是 。
(7)BeCl 的纯度为 (用含m、a、b的式子表示)。
2
(8)下列情况会导致所测BeCl 的纯度偏小的是 (填标号)。
2
A.滴定前尖嘴部分有一气泡,滴定终点时消失
B.滴定过程中,往锥形瓶内加入少量蒸馏水
C.滴定时,不慎将锥形瓶内溶液溅出少许
D.滴定前仰视读数,滴定后俯视读数
19. (12分)中国是世界上最早利用细菌冶金的国家。某工厂用细菌冶金技术处理含金硫
化矿(含有Au、CuFeS、Cu S、SiO)以回收Au和Cu,工艺流程如下:
2 2 2
盐酸 HO NH
2 2 2 4
滤渣 浸取液
空气 HSO 浸取 还原 Au
2 4
含金硫 粉碎 含金硫 细菌氧化 浸渣 N 2
化矿 化矿粉 pH=2
物质a
Fe
滤液① 滤液②
调节pH 沉铁 沉铜 Cu
Fe(OH)
3
已知:
①金属硫化物在“细菌氧化”时转化为硫酸盐。
②“浸取液”中Au以HAuCl 形式存在。
4
回答下列问题:
(1)“粉碎”的目的是 。
(2)“细菌氧化”中,若有0.1mol CuFeS 参加反应,该反应转移 mole-。
2
Cu S发生反应的离子方程式为 。
2
高三化学试题 第 7 页 共8页
学科网(北京)股份有限公司(3)“浸渣”的成分为 。为了不引入杂质,“物质a”为 。
(4)“焙烧氧化”也可以除去金属硫化物,相比“焙烧氧化”,“细菌氧化”的优
势
为 (填标号)。
A. 可减少有害气体产生
B. 反应无需控温
C. 设备无需耐高温
D. 不产生废液废渣
(5)“还原”中发生反应的化学方程式为 。
20.(12分)氮氧化物(NO )的资源化利用和处理具有重要意义。回答下列问题:
x
(1)用CH 催化还原NO 可消除氮氧化物的污染。已知:
4 x
ⅰ.N(g)+O(g) = 2NO(g) H>0 .
2 2 1
ⅱ.2NO(g)+O (g) = 2NO (g) H<0
2 2 2
△
ⅲ.CH(g)+ 4NO(g) =2N (g)+CO (g)+2HO(g) H<0
4 2 2 2 3
△
①对于反应ⅲ,下列说法正确的是_________。
△
A.恒温恒压时,充入氩气降低了NO的转化率
B.v (NO)=2v (N),该反应达到平衡状态
正 逆 2
C.体系达到平衡后,升高温度,体系中的混合气体的平均相对分子质量不变
D.恒温恒容时,当混合气体的密度不随时间变化时,该反应达到平衡状态
②CH(g)+2NO (g)=N(g)+CO (g)+2HO(g)的焓变△H = (用代数式表示)。
4 2 2 2 2
(2)我国科学家在研究 CH 与NO 的反应机理时发现,该反应有 3个途径(如图
4 2
甲)R 、R 和R ,分别生成CH*+ HNO 、CH*+trans-HONO(反式)和CH*+cis-HONO(顺
1 2 3 3 2 3 3
式),对应的中间状态分别为TS1、TS2和TS3。R 、R 和R 的速率常数(一定温度时,反
1 2 3
应物单位浓度时的反应速率)分别记为k 、k 和k ,总反应的速率常数为k, k=k+k+k ,
1 2 3 1 2 3
1380~1800K温度范围内的速率常数变化如图乙。
①从能量变化来看,反应速率最快的是 (填“R ”“R ”或“R ”),原因
1 2 3
高三化学试题 第 8 页 共8页
学科网(北京)股份有限公司是 。
②下列有关说法错误的是 (填正确答案标号)。
A.trans-HONO比HNO 和cis-HONO都稳定
2
B.在高温时,R 和R 会相互竞争
1 3
C.温度升高,3个反应的速率常数都减小
D.CH 与NO 存在多种反应机理,R 是主要反应
4 2 1
(3)用 NH 催化还原 NO 也可以消除氮氧化物的污染,其反应原理为:NO(g)
3 x
+NO (g)+2NH (g) 2N(g) + 3HO(g)。一定温度下,在某恒定压强为p的密闭容器中充入
2 3 2 2
物质的量相等的NO、NO 和NH ,达到平衡状态后,N 的摩尔分数为0.2。
2 3 2
①NO 的转化率为 。
2
②该温度下此反应的平衡常数K = (用含p的式子表示)。
p
高三化学参考答案及评分标准
选择题
1. B 2.A 3.D 4.C 5.B 6.C 7.A 8.A 9.D 10.C
11.CD 12.C 13.B 14.AB 15.CD
16.(12分,除标明分值外,其余每空均为2分)
(1)3d84s2(1分)
(2)①ac ② 易形成分子内氢键, 易形成分子间氢键,
故前者沸点低于后者
(3)①MgNiC(1分) ②棱心(1分) ③8(1分)
3
(4)①6(1分) NiSO ·4HO(1分) ②4NiO+O 2Ni O
4 2 2 2 3
17.(12分,除标明分值外,其余每空均为2分)
3d 4s
(1) (1分)
(2)正四面体形(1分) sp2、sp3
高三化学试题 第 9 页 共8页
学科网(北京)股份有限公司(3)O>Cl>C
(4)① MnFe(CN) +Na++e-= Na[MnFe(CN) ] ②
4M×1030
③54%或0.54
6 6
N a3
A
18.(12分,除标明分值外,其余每空均为2分)
(1)球形冷凝管(1分) 防止倒吸(1分)
(2)除去HCl中带出的水蒸气,防止BeCl 水解;平衡体系压强,防止体系压强过
2
大
(3)防止溶液温度过高,致使乙醚和HCl挥发过快(1分)
(4)最后缺少收集H 的装置(1分)
2
(5)除去AlCl 杂质(1分)
3
(6)当滴入最后一滴盐酸,溶液由浅红色褪为无色,且半分钟不恢复原色(1分)
40ab
(7) % (8)CD
m
19.(12分,除标明分值外,其余每空均为2分)
(1)增大接触面积,提高反应速率,使反应更充分
(2)1.7 2Cu S+5O+4H+ 4Cu2++2SO 2-+2H O
2 2 4 2
(3)SiO (1分) CuO或Cu(OH) 或CuCO 或Cu (OH) CO(1分)
2 2 3 2 2 3
(4)AC (5)4HAuCl +3N H 3N+4Au+16HCl
4 2 4 2
20.(12分,除标明分值外,其余每空均为2分)
( )①BC ②△H- H+ H
1 2 3
( )①R3(1分) TS3的活化能最低或R3的过渡态能量最低(1分) ②CD
1 △ △
(3)①0.33 或1/3 ②2.7p
2
高三化学试题 第 10 页 共8页
学科网(北京)股份有限公司